JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
가시광선 조명 아래 플라스모닉 촉매용 실버 팔라듐 합금 나노 입자 의 준비
요약
여기에 제시된 은 팔라듐(Ag-Pd) 합금 나노입자(NPs)의 합성을 위한 프로토콜이 ZrO 2(Ag-Pd/ZrO2)에서지원된다. 이 시스템은 가시광선 조사에서 에너지를 수확하여 분자 변환을 가속화하고 제어할 수 있도록 합니다. 이것은 Ag-Pd/ZrO2 NPs에 의해 촉매화된 빛 조사에서 니트로벤젠 감소에 의해 삽화됩니다.
초록
플라스모닉 나노입자(NPs)의 국소화된 표면 플라스몬 공명(LSPR)은 다양한 분자 변형의 선택성을 가속화하고 조절할 수 있다. 이는 이러한 범위에서 LSPR 흥분을 지원하는 플라스모닉 나노 입자가 촉매로 사용될 때 반응을 구동하고 제어하는 지속 가능한 입력으로 가시적이거나 가까운 IR 광을 사용할 가능성을 열어줍니다. 불행히도, 이것은 팔라듐 (PD)과 같은 여러 촉매 금속의 경우는 아닙니다. 이러한 한계를 극복하기 위한 한 가지 전략은 플라스모닉 및 촉매 금속을 함유한 바이메탈 EP를 사용하는 것입니다. 이 경우 플라스모닉 금속의 LSPR 여기는 촉매 성분에 의해 구동되는 변환을 가속화하고 제어하는 데 기여할 수 있다. 본 명세서에서 보고된 방법은 플라스모닉 촉매 제역할을 하는 ZrO 2(Ag-Pd/ZrO2)에서지원되는 바이메탈 실버 팔라듐(Ag-Pd) NPs의 합성에 초점을 맞추고 있다. NPs는 ZrO2 지지대에서 해당 금속 전구체의 공동 함침에 의해 제조되었고, 이어서 ZrO2 지지대에서 직접 바이메탈 EP의 형성으로 이어지는 동시 감소에 의해 제조되었다. Ag-Pd/ZrO2 NPs는 LED 램프에 의한 425 nm 조명 하에서 니트로벤젠을 감소시켜 플라스모닉 촉매로 사용되었다. 가스 크로마토그래피(GC)를 사용하여, 어둡고 가벼운 조사 조건 하에서 환원 반응의 변환 및 선택성을 모니터링할 수 있으며, 플라스모닉 메탈 Ag로 비플라스모닉 PD를 합금한 후 LSPR 흥분하에서 선택성을 향상된 촉매 성능과 제어할 수 있다. 이 기술은 광범위한 분자 변환 및 NPs 조성에 적응할 수 있으므로 변환 및 선택성 측면에서 다양한 유형의 촉매의 플라스모닉 촉매 활성의 특성화에 유용합니다.
서문
금속 나노 입자 (NP)의 여러 응용 프로그램 중 촉매는 특별한주의를 기울일 자격이 있습니다. 촉매는 지속 가능한 미래에 중심적인 역할을 하여 에너지 소비 감소, 원료 의 활용 도성 및 더 깨끗한 반응 조건1,2,3,4를가능하게 합니다. 따라서 촉매의 진전은 화학 공정의 원자 효율을 향상시키고 더 깨끗하고 경제적으로 가능하며 환경 친화적으로 만드는 도구를 제공 할 수 있습니다. 은(Ag), 금(Au) 또는 구리(Cu)를 포괄하는 금속 은(Ag), 금(Au) 또는 구리(Cu)는 이러한 시스템이 국소화된 표면 플라스몬 공명(LSPR) 여기5,6,7,8을통해 나노스케일에서 빛과 상호 작용하는 독특한 방식으로 발생하는 가시적 범위에서 흥미로운 광학 적 특성을 표시할 수 있다. 플라스모닉 NPs라고불리는 이들 NPs에서 LSPR은 전자5,6,7,8의집단 운동과 함께 사건 광자(들어오는 전자파로부터)간의 공명 상호작용을 포함한다. 이러한 현상은 환경9,10,11의크기, 모양, 조성 및 유전체 상수에 의존하는 특징적인 주파수에서 일어난다. 예를 들어, Ag, Au 및 Cu의 경우 이러한 주파수는 눈에 보이는 것에서 가까운 IR까지 다양할 수 있으며, LSPR5,6,7,8,12,13을자극하기 위해 태양 에너지를 활용할 수 있는 가능성을 열어줍니다.
최근에는 플라스모닉 NPs에서 LSPR 암분이 분자변환5,14,15,16,17,18,19의선택성을 가속화하고 조절하는 데 기여할 수 있음을 입증하였다. 이것은 점서 촉매라는 필드를 낳았다, 가속에 빛에서 에너지를 사용하는 데 초점을 맞추고, 드라이브, 및 제어 화학 변환5,14,15, 16,17,18,19. 이러한 맥락에서, 플라스모닉 폰의 LSPR 여기가 LSPR 흥분 핫 캐리어라고 불리는 에너지 핫 전자와 구멍의 형성으로 이어질 수 있다는 것이 확립되었습니다. 이들 운반대는 전자 또는 진동활성화(15,16)를통해 흡착된 종과 상호 작용할 수 있다. 반응속도 증가 외에도, 이 과정은 또한 기존의 열화학적 중심 공정을 통해 접근할 수 없는 대체 반응 경로를 제공할 수 있으며, 반응 선택성20,21,22, 23,24,25에대한 제어를 위한 새로운 길을 열어줄 수있다. 중요한 것은, 플라스몬 붕괴가 열 방출로 이어질 수 있다는 점에 주목할 필요가 있으며, 이는 또한 반응 속도 속도 속도에 기여할 수 있는 NPs 부근의 온도 상승으로 이끌어 내는15,16.
이러한 흥미로운 기능으로 인해, 플라스모닉 촉매는 성공적으로 다양한 분자 변환을 향해 사용되었습니다18. 그럼에도 불구하고 중요한 과제는 여전히 남아 있습니다. Ag 및 Au와 같은 플라스모닉 NP는 가시및 거의 IR 범위에 우수한 광학 특성을 표시하지만, 촉매 특성은 변환 범위측면에서 제한됩니다. 즉, 몇 가지 변환에 대해 좋은 촉매 특성을 표시하지 않습니다. 또한 팔라듐(Pd) 및 백금(Pt)과 같은 촉매에 중요한 금속은 가시또는 거의 IR 범위에서 LSPR 흥분을 지원하지 않습니다. 이러한 격차를 해소하기 위해, 플라스모닉 및 촉매 금속을 포함하는 바이메탈 NP는 효과적인전략(20,26,27,28, 29)을나타낸다. 이러한 시스템에서 플라스모닉 금속은 LSPR을 통해 광 여기로부터 에너지를 수확하기 위해 안테나로 사용될 수 있으며, 이 금속은 촉매 금속에서 분자 변환을 구동, 가속 및 제어하는 데 사용됩니다. 따라서,이 전략은 우리가 기존의 플라스모닉 금속 NPs 를 넘어 플라스몬 촉매를 확장 할 수있습니다 20,26,27,28,29.
이 프로토콜은 ZrO2 (Ag-Pd/ZrO2)에서지원되는 바이메탈 실버 팔라듐 (Ag-Pd) 합금 NPs의 촉진 합성을 설명하며, 이는 플라스모닉 촉매를 위한 플라스모닉 촉매 시스템으로 작용할 수 있습니다. Ag-Pd/ZrO2 NPs는 ZrO2 지지대에서 해당 금속 전구체의 공동 함침에 의해 제조되었으며, 그 다음으로 동시 감소30이되었다. 이러한 접근법은 ZrO2 지지체의 표면에서 직접 크기(직경)의 약 10nm 정도의 바이메탈 NPs를 형성하게 되었다. NP는 Pd의 1mol%로 구성되어 촉매 금속의 활용도를 최소화하면서 결과 Ag-Pd NP의 광학 적 특성을 극대화하였다. 플라스모닉 촉매에서 Ag-Pd/ZrO2 NPs의 적용을 위한 프로토콜이 니트로벤젠의 감소를 위해 입증되었다. 우리는 LSPR 흥분을 위해 425 nm LED 조명을 고용했습니다. 가스 크로마토그래피는 어둡고 가벼운 조사 조건 하에서 환감 반응의 변환 및 선택성을 모니터링하기 위해 수행되었다. LSPR 흥분은 순전히 열 구동 조건에 비해 Ag-Pd/ZrO2 NPs에서 선택성을 제어하여 촉매 성능을 향상시켰습니다. 이 프로토콜에 기재된 방법은 가스 크로마토그래피와 결합된 간단한 광촉매 반응 설정을 기반으로 하며 광범위한 분자 변환 및 NPs 조성에 적응할 수 있다. 따라서,이 방법은 변환 및 반응 선택성, 다른 NP및 무수한 액체 상 변환의 관점에서, 광촉매 활성의 특성화를 가능하게한다. 우리는이 문서가 현장에서 이민자와 경험이 풍부한 과학자 모두에게 중요한 지침과 통찰력을 제공 할 것이라고 믿습니다.
프로토콜
1. Ag-Pd/ZrO2 NPs 합성
참고: 이 절차에서 Ag-Pd의 Pd mol%는 1%에 해당했으며 ZrO2의 Ag-PD 로딩은 3wt.%에 해당했습니다.
- 250mL 비커에 ZrO2 분말 1 g을 놓습니다.
- AgNO 3(aq) (0.0059 mol/L) 및 K2PdCl 4(aq)의 9.71mL(0.00031 mol/L) 용액의 50mL를 실온에서 격렬한 자기 교반(500rpm)에서 비커에 추가합니다.
- 용해액 10mL(0.53M)를 추가합니다.
- 혼합물을 20분 동안 격렬한 교반(500rpm) 아래에 보관하십시오.
- 20분 후, 파이펫을 사용하여 1mL/분 의 속도로 새로 준비된 NaBH 4(aq) (0.035 M) 용액의 서스펜션 10mL에 추가합니다. 현탁액을 과정 전반에 걸쳐 교반 (500 rpm) 아래에 보관하십시오.
- 혼합물을 실온에서 30 분 동안 저어 주세요.
2. 촉매의 분리 및 정화
- 서스펜션을 원심분리튜브로 옮기고 10분 동안 3,260 x g에서 원심분리로 고체를 혼합물로부터 분리한다.
- 파이펫으로 액체 상을 조심스럽게 제거하고 튜브에 15mL 의 산화물을 추가합니다.
- 고체의 분산이 얻어지을 때까지 힘차게 흔들어 주세요. 좋은 분산이 이루어지지 않으면 튜브를 초음파 욕조에 5 분 동안 놓습니다.
- 10 분 동안 3,260 x g에서 분산을 원심 분리합니다.
- 세정 단계(2.2. ~ 2.2.2.2.) 탈온화된 물을 사용하여 두 번 더 반복한 다음 물 대신 에탄올을 사용합니다.
- 에탄올을 제거하고 오븐에서 12시간 동안 60°C에서 고체를 건조시다.
- 다양한 현미경, 원소 및 분광 기술에 의해 준비된 Ag-Pd/ZrO2 NP를 특성화합니다.
3. Ag /ZrO2 NPs의 합성
참고: 이 절차에서 ZrO2의 Ag 로딩은 3wt.%에 해당합니다.
- 250mL 비커에 ZrO2 분말 1 g을 놓습니다.
- 실온에서 격렬한 자기 교반(500rpm)의 비커에 AgNO 3(aq) (0.0059 mol/L) 용액의 50mL를 추가합니다.
- 용해액 10mL(0.53M)를 추가합니다.
- 혼합물을 20분 동안 격렬한 교반(500rpm) 아래에 보관하십시오.
- 20분 후, 파이펫을 사용하여 1mL/분 의 속도로 새로 준비된 NaBH 4(aq) (0.035 M) 용액의 서스펜션 10mL에 추가합니다. 현탁액을 과정 전반에 걸쳐 교반 (500 rpm) 아래에 보관하십시오.
- 혼합물을 실온에서 30 분 동안 저어 주세요.
4. 촉매의 분리 및 정화
- 서스펜션을 원심분리튜브로 옮기고 10분 동안 3,260 x g에서 원심분리로 고체를 혼합물로부터 분리한다.
- 파이펫으로 액체 상을 조심스럽게 제거하고 튜브에 15mL 의 산화물을 추가합니다.
- 고체의 분산이 관찰될 때까지 힘차게 흔들어 주세요. 좋은 분산이 이루어지지 않으면 튜브를 초음파 욕조에 5 분 동안 놓습니다.
- 10 분 동안 3,260 x g에서 분산을 원심 분리합니다.
- 탈온화된 물을 사용하여 세척 단계(4.2.~ 4.2.2.) 두 번 더 반복한 다음, 물 대신 에탄올을 사용한 다음 두 번 더 반복합니다.
- 에탄올을 제거하고 오븐에서 12시간 동안 60°C에서 고체를 건조시다.
- 준비된 Ag/ZrO2 NPs는 다양한 현미경, 원소 및 분광 기술을 특징으로 할 수 있습니다.
5. LSPR 여기의 니트로벤젠 감소를 향한 플라스모닉 촉매 성능 조사(빛 조명)
- 마그네틱 교반 바와 함께 25mL 라운드 하단 플라스크에 촉매 30 mg을 놓습니다.
- 이소프로필 알코올(IPA)에 니트로벤젠(0.03 mol/L)의 용액5mL을 원자로에 넣습니다.
- 이어서 11.22 mg의 KOH 파우더(0.0002 mol)를 추가합니다.
- 1 분 동안 아르곤 흐름으로 현탁액을 버블링하여 원자로를 제거합니다. 정화 직후 플라스크를 밀봉합니다.
- 반응기를 온도 조절 자기 교반기(500rpm) 위에 70°C로 가열하는 오일 욕조에 놓습니다.
- 광원으로 425 nm의 파장을 가진 4 개의 LED 램프를 사용하여 튜브를 방사하고, 0.5 W / cm2의광 강도를 갖는다. 램프에서 반응 플라스크까지의 거리는 7cm여야 합니다.
- 격렬한 자기 교반 (500 rpm)에서 70 °C에서 2.5 h의 반응을 진행하게하십시오.
- 그런 다음, 빛을 끄고, 반응기를 열고 주사기와 바늘을 사용하여 1mL 샘플을 수집한다. 0.45 μm 필터를 통해 걸러내고 촉매 미립자를 제거하고 가스 크로마토그래피 바이알로 제거합니다.
6. LSPR 흥분의 부재에 대한 반응 (어두운 조건)
- 5에 설명된 것과 동일한 단계를 따르지만 가벼운 조사없이 수행하십시오. 반응 튜브를 알루미늄 호일로 감싸서 빛 노출을 방지합니다.
7. 가스 크로마토그래피 (GC) 분석 준비
- 약 30mmol/L 니트로벤젠(NB), 30mmol/L의 안일린(AN), 아조벤젠(AB)의 30mmol/L이 포함된 IPA 용액을 준비한다.
- 적합한 방법을 사용하여 솔루션의 GC 분석을 실행합니다. 열 온도 및 가스 흐름 프로그램을 변경하여 다양한 방법을 테스트할 수 있습니다. 선택한 메서드는 최소 보존 기간 동안 IPA, NB, AN 및 AB에 해당하는 피크를 분리할 수 있어야 합니다.
- 이 방법을 선택하면 IPA에서 50mMM, 25mM, 10mM, 5mM 및 2.5mMM NB의 솔루션 세트와 동일한 농도의 IPA에서 AN 및 AB의 또 다른 솔루션 세트를 준비하십시오.
- 준비된 솔루션에 대한 GC 분석을 실행합니다. 각 크로마토그램은 2개의 피크를 제시해야 합니다: 더 높은 것은 IPA에 해당하고 낮은 것은 NB, AN 또는 AB에 해당합니다. 각 크로마토그램에 대해 모든 피크의 보존 시간과 피크 영역을 기록합니다.
- 각 샘플의 농도 대 피크 영역을 플로팅하여 NB, AN 및 AB의 교정 곡선을 추적합니다.
8. GC 분석
- 5단계에서 수집된 샘플에 대한 GC 분석을 실행합니다. 및 6. 7.2 단계에 사용되는 동일한 메서드를 사용합니다. 및 7.4.
- 각 크로마토그램에 대해 보존 시간과 피크 영역을 기록하고 이전에 플롯된 교정 곡선을 사용하여 샘플에서 NB, AN 및 AB의 농도를 결정합니다.
- 방정식을 사용하여 니트로 벤젠 변환뿐만 아니라 애니라인과 아조벤젠 선택도를 계산합니다.
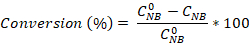
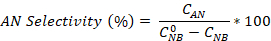
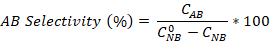
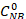 초기 NB 농도(0.03 mol/L), C NB, CAN,C AB는 각각 GC 분석에 의한 2.5시간 반응 후 NB, AN 및 AB 농도에 대응한다.
초기 NB 농도(0.03 mol/L), C NB, CAN,C AB는 각각 GC 분석에 의한 2.5시간 반응 후 NB, AN 및 AB 농도에 대응한다.
결과
도 1A는 순수 ZrO2 산화물(왼쪽)과 Ag-Pd/ZrO2 NPs(오른쪽)를 포함하는 고체 시료의 디지털 사진을 나타낸다. 이러한 색상 변경은 흰색(ZrO2)에서갈색(Ag-Pd/ZrO2)으로ZrO2 표면에서 Ag-Pd NPs의 증착에 대한 초기 질적 증거를 제공한다. 도 1B는 Ag-Pd/ZrO2 NPs(파란색 추적) 뿐만 아니라 ZrO2(블랙 트레이스) 및 Ag/ZrO
토론
이 방법에 기술된 연구 결과는 Pd의 본질적인 촉매 활성(또는 다른 촉매학적이지만 플라스모닉 금속이 아님)가 바이메탈 합금NPs(35)에서가시광선 조사를 통해 LSPR 여기를 통해 현저하게 향상될 수 있음을 보여준다. 이 경우 Ag(또는 다른 플라스모닉 금속)는 LSPR 여기를 통해 가시광선 조사로부터 에너지를 수확할 수 있습니다. LSPR 여기는 핫 충전 캐리어 (뜨거운 전자 및 구멍)와 국?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 헬싱키 대학과 제인과 아토스 에르코 재단에 의해 지원되었다. S.H. 펠로우십을 위한 에라스무스+ EU 기금 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-Propanol (anhydrous, 99.5%) | Sigma-Aldrich | 278475 | CAS Number 67-63-0 |
| Aniline (for synthesis) | Sigma-Aldrich | 8.22256 | CAS Number 62-53-3 |
| Azobenzene (98%) | Sigma-Aldrich | 424633 | CAS Number 103-33-3 |
| Ethanol | Honeywell | 32221 | CAS Number 64-17-5 |
| Hydrochloric acid (37%) | VWR | PRLSMC310066 | CAS Number 7647-01-0 |
| L-Lysine (crystallized, ≥98.0% (NT)) | Sigma-Aldrich | 62840 | CAS Number 56-87-1 |
| Nitric acid (65%) | Merck | 100456 | CAS Number 7697-37-2 |
| Nitrobenzene | Sigma-Aldrich | 8.06770 | CAS Number 98-95-3 |
| Potassium hydroxide | Fisher | 10448990 | CAS Number 1310-58-3 |
| Potassium tetrachloropalladate (II) (98%) | Sigma-Aldrich | 205796 | CAS Number 10025-98-6 |
| Silver nitrate (ACS reagent, ≥99.0%) | Sigma-Aldrich | 209139 | CAS Number 7761-88-8 |
| Sodium borohydride (fine granular for synthesis) | Sigma-Aldrich | 8.06373 | CAS Number 16940-66-2 |
| Zirconium (IV) oxide (nanopowder, <100 nm particle size (TEM)) | Sigma-Aldrich | 544760 | CAS Number 1314-23-4 |
참고문헌
- Dunn, P. J., Hii, K. K., Krische, M. J., Williams, M. T. . Sustainable Catalysis: Challenges and Pratices for the Pharmaceutical and Fine Chemical Industries. , (2013).
- Tzouras, N. V., Stamatopoulos, I. K., Papastavrou, A. T., Liori, A. A., Vougioukalakis, G. C. Sustainable metal catalysis in C-H activation. Coordination Chemistry Reviews. 343, 25 (2017).
- Polshettiwar, V., Varma, R. S. Green chemistry by nano-catalysis. Green Chemistry. 12 (5), 743 (2010).
- Rodrigues, T. S., da Silva, A. G. M., Camargo, P. H. C. Nanocatalysis by noble metal nanoparticles: controlled synthesis for the optimization and understanding of activities. Journal of Materials Chemistry A. 7 (11), 5857-5874 (2019).
- Linic, S., Christopher, P., Ingram, D. B. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy. Nature Materials. 10 (12), 911-921 (2011).
- Nam, J. M., Liz-Marzán, L., Halas, N. Chemical Nanoplasmonics: Emerging Interdisciplinary Research Field at Crossroads between Nanoscale Chemistry and Plasmonics. Accounts of Chemical Research. 52 (11), 2995-2996 (2019).
- Brongersma, M. L., Halas, N. J., Nordlander, P. Plasmon-induced hot carrier science and technology. Nature Nanotechnology. 10 (1), 25-34 (2015).
- Smith, J. G., Faucheaux, J. A., Jain, P. K. Plasmon resonances for solar energy harvesting: A mechanistic outlook. Nano Today. 10 (1), 67-80 (2015).
- Hartland, G. V. Optical studies of dynamics in noble metal nanostructures. Chemical Reviews. 111 (6), 3858-3887 (2011).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment. Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Hermoso, W., et al. Triangular metal nanoprisms of Ag, Au, and Cu: Modeling the influence of size, composition, and excitation wavelength on the optical properties. Chemical Physics. 423, 142-150 (2013).
- Kumar, A., et al. Rational Design and Development of Lanthanide-Doped NaYF4@CdS-Au-RGO as Quaternary Plasmonic Photocatalysts for Harnessing Visible-Near-Infrared Broadband Spectrum. ACS Applied Materials and Interfaces. 10 (18), 15565-15581 (2018).
- Reddy, K. L., Kumar, S., Kumar, A., Krishnan, V. Wide spectrum photocatalytic activity in lanthanide-doped upconversion nanophosphors coated with porous TiO2 and Ag-Cu bimetallic nanoparticles. Journal of Hazardous Materials. 367, 694-705 (2019).
- Ingram, D. B., Linic, S. Water splitting on composite plasmonic-metal/semiconductor photoelectrodes: Evidence for selective plasmon-induced formation of charge carriers near the semiconductor surface. Journal of the American Chemical Society. 133 (14), 5202-5205 (2011).
- Linic, S., Aslam, U., Boerigter, C., Morabito, M. Photochemical transformations on plasmonic metal nanoparticles. Nature Materials. 14 (6), 567-576 (2015).
- Aslam, U., Rao, V. G., Chavez, S., Linic, S. Catalytic conversion of solar to chemical energy on plasmonic metal nanostructures. Nature Catalyst. 1, 656-665 (2018).
- Araujo, T. P., Quiroz, J., Barbosa, E. C. M., Camargo, P. H. C. Understanding plasmonic catalysis with controlled nanomaterials based on catalytic and plasmonic metals. Current Opinion in Colloid and Interface Science. 39, 110-122 (2019).
- Gellé, A., et al. Applications of plasmon-enhanced nanocatalysis to organic transformations. Chemical Reviews. , 986-1041 (2020).
- Shaik, F., Peer, I., Jain, P. K., Amirav, L. Plasmon-Enhanced Multicarrier Photocatalysis. Nano Letters. 18 (7), 4370-4376 (2018).
- Quiroz, J., et al. Controlling Reaction Selectivity over Hybrid Plasmonic Nanocatalysts. Nano Letters. 18, 7289-7297 (2018).
- Peiris, E., et al. Plasmonic Switching of the Reaction Pathway: Visible-Light Irradiation Varies the Reactant Concentration at the Solid-Solution Interface of a Gold-Cobalt Catalyst. Angewandte Chemie - International Edition. 58 (35), 12032-12036 (2019).
- Yu, S., Wilson, A. J., Heo, J., Jain, P. K. Plasmonic Control of Multi-Electron Transfer and C-C Coupling in Visible-Light-Driven CO2 Reduction on Au Nanoparticles. Nano Letters. 18 (4), 2189-2194 (2018).
- Yu, S., Jain, P. K. Plasmonic photosynthesis of C 1 -C 3 hydrocarbons from carbon dioxide assisted by an ionic liquid. Nature Communications. 10, 2022 (2019).
- Zhang, X., et al. Product selectivity in plasmonic photocatalysis for carbon dioxide hydrogenation. Nature Communications. 8, 1-9 (2017).
- Cortés, E. Efficiency and Bond Selectivity in Plasmon-Induced Photochemistry. Advanced Optical Materials. 5 (15), 1700191 (2017).
- de Freitas, I. C., et al. Design-controlled synthesis of IrO 2 sub-monolayers on Au nanoflowers: marrying plasmonic and electrocatalytic properties. Nanoscale. , 23-27 (2020).
- Zhang, C., et al. Al-Pd Nanodisk Heterodimers as Antenna-Reactor Photocatalysts. Nano Letters. 16 (10), 6677-6682 (2016).
- Zhou, L., et al. Light-driven methane dry reforming with single atomic site antenna-reactor plasmonic photocatalysts. Nature Energy. 5, 61-70 (2020).
- Swearer, D. F., et al. Heterometallic antenna-reactor complexes for photocatalysis. Proceedings of the National Academy of Sciences. 113 (32), 8916-8920 (2016).
- Peiris, S., Sarina, S., Han, C., Xiao, Q., Zhu, H. -. Y. Silver and palladium alloy nanoparticle catalysts: reductive coupling of nitrobenzene through light irradiation. Dalton Transactions. 46 (32), 10665-10672 (2017).
- Rahm, J. M., et al. A Library of Late Transition Metal Alloy Dielectric Functions for Nanophotonic Applications. Advanced Functional Materials. 2002122, 02122 (2020).
- Zhang, C., Chen, B. Q., Li, Z. Y., Xia, Y., Chen, Y. G. Surface Plasmon Resonance in Bimetallic Core-Shell Nanoparticles. Journal of Physical Chemistry C. 119 (29), 16836-16845 (2015).
- Liu, Z., Huang, Y., Xiao, Q., Zhu, H. Selective reduction of nitroaromatics to azoxy compounds on supported Ag-Cu alloy nanoparticles through visible light irradiation. Green Chemistry. 18 (3), 817-825 (2016).
- Chaiseeda, K., Nishimura, S., Ebitani, K. Gold nanoparticles supported on alumina as a catalyst for surface plasmon-enhanced selective reductions of nitrobenzene. ACS Omega. 2 (10), 7066-7070 (2017).
- Peiris, S., et al. Metal nanoparticle photocatalysts: emerging processes for green organic synthesis. Catalysis Science and Technology. 6 (2), 320-338 (2016).
- García-García, I., et al. Silver-Based Plasmonic Catalysts for Carbon Dioxide Reduction. ACS Sustainable Chemistry and Engineering. 8 (4), 1879-1887 (2020).
- Agrawal, A., Johns, R. W., Milliron, D. J. Control of Localized Surface Plasmon Resonances in Metal Oxide Nanocrystals. Annual Review of Materials Research. 47 (1), 1-31 (2017).
- Lounis, S. D., Runnerstrom, E. L., Llordés, A., Milliron, D. J. Defect chemistry and Plasmon physics of colloidal metal oxide Nanocrystals. Journal of Physical Chemistry Letters. 5 (9), 1564-1574 (2014).
- Rej, S., et al. Determining Plasmonic Hot Electrons and Photothermal Effects during H2 Evolution with TiN-Pt Nanohybrids. ACS Catalysis. 10 (9), 5261-5271 (2020).
- Barragan, A. A., et al. Photochemistry of Plasmonic Titanium Nitride Nanocrystals. The Journal of Physical Chemistry C. 123 (35), 21796-21804 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유