17.7 : Efeitos da Temperatura na Energia Livre
A espontaneidade de um processo depende da temperatura do sistema. As transições de fase, por exemplo, irão prosseguir espontaneamente em uma direção ou na outra, dependendo da temperatura da substância em questão. Da mesma forma, algumas reações químicas também podem apresentar espontaneidades dependentes da temperatura. Para ilustrar este conceito, considera-se a equação relativa à mudança da energia livre para as alterações da entalpia e entropia para o processo:
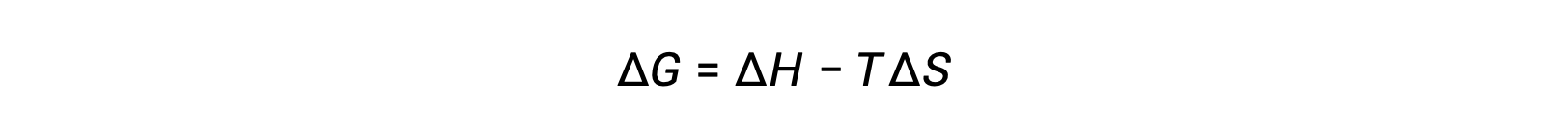
A espontaneidade de um processo, como refletido no sinal aritmético da sua alteração de energia livre, é então determinada pelos sinais das alterações da entalpia e entropia e, em alguns casos, pela temperatura absoluta. Uma vez que T é a temperatura absoluta (kelvin), só pode ter valores positivos. Existem, portanto, quatro possibilidades em relação aos sinais da entalpia e da entropia:
- Tanto ΔH como ΔS são positivas. Esta condição descreve um processo endotérmico que envolve um aumento da entropia do sistema. Neste caso, ΔG será negativo se a magnitude do termo TΔS for maior que ΔH. Se o termo TΔS for inferior a ΔH, a alteração de energia livre será positiva. Tal processo é espontâneo a altas temperaturas e não espontâneo a baixas temperaturas.
- Tanto ΔH como ΔS são negativas. Esta condição descreve um processo exotérmico que envolve uma diminuição da entropia do sistema. Neste caso, ΔG será negativa se a magnitude do termo TΔS for inferior a ΔH. Se a magnitude do termo TΔS for superior a ΔH, a alteração de energia livre será positiva. Tal processo é espontâneo a baixas temperaturas e não espontâneo a altas temperaturas.
- ΔH é positiva, e ΔS é negativa. Esta condição descreve um processo endotérmico que envolve uma diminuição da entropia do sistema. Neste caso, ΔG será positivo independentemente da temperatura. Tal processo é não espontâneo a todas as temperaturas.
- ΔH é negativa, e ΔS é positiva. Esta condição descreve um processo exotérmico que envolve um aumento na entropia do sistema. Neste caso, ΔG será negativa, independentemente da temperatura. Tal processo é espontâneo a todas as temperaturas.
Este texto é adaptado de Openstax, Chemistry 2e, Section 16.4: Free Energy.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
