Method Article
Detecção de Sinalização de Efeitos Complexos Downstream de BMP4 Usando In situ PLA, um Ensaio Ligadura Proximidade
Neste Artigo
Resumo
Aqui nós mostramos como usar Assay Proximidade Ligadura (PLA), com uma combinação de anticorpos para visualizar proteínas morfogenéticas ósseas (BMP) de sinalização em células fixas. Esta técnica permitiu-nos a seguir o acúmulo nuclear de BMP activada endógena efetoras complexos e quantificar os seus níveis ao longo do tempo sob BMP4 estimulação.
Resumo
BMPs são responsáveis por uma grande variedade de efeitos no desenvolvimento e biológicas. Receptores de BMP ativar (fosforilar) o Smad1/5/8 efetores, que então, formam um complexo com Smad4 e translocar para o núcleo onde funcionam como fatores de transcrição para iniciar BMP efeitos específicos a jusante 1. Tradicionais imuno-fluorescência técnicas com anticorpos contra fosfo Smad-peptídeos apresentam baixa sensibilidade fundo, alta e oferecer quantificação bruta como eles dependem da intensidade do sinal de anticorpos particularmente se este é fotossensível fluorescente. Além disso, fosfo-Smads não podem ser todos em um complexo com Smad4 e engajados na transcrição ativa.
In situ PLA é uma tecnologia capaz de detectar as interações de proteínas com alta especificidade e sensibilidade 2-4. Esta nova tecnologia de reconhecimento de casais de anticorpos com a amplificação de DNA substituto da proteína. Ele gera um sinal, localizada em uma discreta forma de spots revelando a posição exata do evento de reconhecimento. O número de sinais podem ser contados e comparados proporcionando uma medição. Nós aplicamos em PLA situ, utilizando o kit Duolink, com uma combinação de anticorpos que permite a detecção do effectors BMP e sinalização phospho-Smad1/5/8 Smad4 apenas quando estes estão em proximidade ou seja, em um complexo, que ocorre apenas com a sinalização ativação. Isto permitiu, pela primeira vez, a visualização e medição de BMP endógenos de sinalização com alta especificidade e sensibilidade em um experimento de curso de tempo sob estímulo BMP4.
Protocolo
1. Chapeamento de Células e Tratamento com BMP
- Células de cultura em Neuro2a GMEM suplementado com 10% FBS, 1x Non-aminoácidos essenciais (NEAM), 1x piruvato de sódio e 1x L-glutamina. Dividir as células usando tripsina (0,05%-EDTA) e placa de 15,000-20,000 células por poço em um slide de câmara de 16 também.
Cultura HEK293T ou Cos7 células em DMEM suplementado com 10% FBS, 1x L-glutamina e penicilina 1x / estreptomicina. Esterilizar slides polysine por imersão em etanol 70% e usando caneta Immedge empate 1 cm 2 poços. Dividir as células usando tripsina (0,05%-EDTA) e placa de 20,000-25,000 células por poço em 50 mL médio. - Incubar as células a 37 ° C em um umidificado, 5% CO 2 incubadora.
- Após 24 h substituir o meio com soro livre GMEM (suplementado com 0,1% de albumina, NEAM 1x, 1x piruvato de sódio e 1x L-glutamina) para Neuro2a ou com soro livre DMEM (suplementada com L-Glutamina e penicilina 1x / estreptomicina) para HEK293T / Cos7 e incubar as células por 2-3 h. Manter três poços com células em condições de cultura normal (ou seja, 10% FBS) para uso como controles.
- Tratar as células com dorsomorphin (inibidor da via BMP, 2 mM) ou BMP4 (25 ng / ml) para o tempo desejado (por exemplo, para h 10 min-1) 5.
2. Fixação e permeabilização
- Prepare o fixador, PFA 4%. Pesar 4 g de PFA para preparar uma solução de 4% em 100 ml PBS. Aquecer a solução a 50 ° C até que fique claro. Filtrar a solução através de um filtro 0,22 mm e armazenar a 4 ° C até o uso. Use fixador fresco (não armazenados por mais de 2 dias).
- Aspirar o meio dos poços e lavar com 1xPBS. Não pipete as soluções diretamente sobre as células, pois isso pode resultar em descolamento das células. Antes de ir para a próxima etapa, se slides câmara são usados remover as câmaras, mas deixar o silicone em torno dos poços.
- Adicionar 50 ul PFA 4% e incubar por 10 minutos, à temperatura ambiente, sem agitação.
- Lavar as células com PBS por 3 x 5 min em um frasco Coplin com agitação à temperatura ambiente.
- Tratar as células com 0,5% Triton X-100 em PBS por 10 min, sem agitação à temperatura ambiente.
- Lavar as células com Tween 0,05% 20 em TBS (TBS-T) por 3 x 5 min em um frasco Coplin com agitação à temperatura ambiente.
3. Bloqueio
- Torneira da TBS-T. Adicione uma gota de solução de bloqueio Duolink II (1x) por poço.
- Incubar as lâminas em câmara úmida pré-aquecido por 1 hora a 37 ° C.
4. Anticorpos primários
- Misturar e diluir aP-Smad1/5/8 (coelho policlonal) em 1:100 e a-Smad4 (mouse monoclonal) a 1:100 na II anticorpos Duolink Diluente (1x). Prepare também aP-Smad1/5/8 e-Smad4 sozinho nas mesmas concentrações para ser usado para controles.
- Torneira a solução de bloqueio dos slides. Remover o bloqueio solução muito possível, mas tomar cuidado extra para não deixar que as células secas antes de adicionar o anticorpo. Adicionar 40 mL das soluções de anticorpos aos poços. Em um poço adicionar Diluente de anticorpos apenas como um controle negativo adicional.
5. Sondas PLA
- Diluir as duas sondas PLA (Duolink II anti-Mouse MINUS e Duolink II anti-coelho PLUS) 1:05 em diluente de anticorpo.
- Torneira a solução anticorpo primário do slides. Lavar as lâminas duas vezes 5 min cada um com 1x Duolink tampão de lavagem II A em um frasco Coplin com agitação à temperatura ambiente.
- Toque fora do tampão de lavagem A partir dos slides e adicionar a solução PLA sonda (40 mL / poço).
Incubar as lâminas em câmara úmida pré-aquecido por 1 hora a 37 ° C.
6. Ligadura
- Vortex da Duolink estoque Ligadura II (5x) e diluir 1:5 em água de alta pureza e misturar. Ao calcular o volume de água, levar em conta o volume da Ligase que será adicionado a uma diluição final de 1:40, pouco antes da adição da mistura aos poços.
- Torneira a solução sonda PLA do slides. Lavar as lâminas em tampão de lavagem 1x A por 2 vezes 5 minutos cada um em uma jarra de Coplin com agitação à temperatura ambiente.
- Retire o Ligase do congelador usando um bloco de congelamento (-20 ° C). Adicione o Ligase à solução Ligadura (elaborado em 6.1), com uma diluição de 1:40 e vortex.
- Toque fora do tampão de lavagem A partir dos slides e adicionar a solução Ligadura Ligase-a cada poço (40 mL / poço). Incubar as lâminas em câmara úmida pré-aquecido por 30 min a 37 ° C.
7. Amplificação
Nota: Light reagentes sensíveis. Manter os slides protegido da luz.
- Diluir o Duolink estoque Amplificação II (5x) 1:5 em água de alta pureza e misturar. Ao calcular o volume de água ter em conta o volume do Polymerase que será adicionado a uma diluição final de 1:80, pouco antes da adição da mistura para poe poços.
- Torneira a solução Ligadura Ligase a partir do slides. Lavar as lâminas em tampão de lavagem 1x A por 2 vezes com 2 min cada um em uma jarra de Coplin com agitação à temperatura ambiente.
- Retire a polimerase do freezer usando um bloco de congelamento (-20 ° C). Adicione o Polimerase para a solução de amplificação (elaborado em 7.1) na diluição de 1:80 e vortex.
- Toque fora do tampão de lavagem A partir dos slides e adicionar a solução de amplificação da Polimerase para cada poço (40 mL / poço). Incubar as lâminas em câmara úmida pré-aquecido para 100 min a 37 ° C.
8. Preparação para a imagem
Nota: Light reagentes sensíveis. Manter os slides protegido da luz.
- Torneira a solução de amplificação da Polimerase a partir do slides e lavar por 2 vezes a cada 10min em 1x Duolink II Wash Buffer B em um frasco Coplin com agitação à temperatura ambiente.
- Mergulhar as lâminas em 0,1 x Wash Buffer B.
- Remover o silicone a partir do slide 16 bem completo. Adicionar ~ 40μl da II Duolink Meio de Montagem com DAPI na lamela e gentilmente coloque-o sobre as amostras pressionando-o ligeiramente de modo que não há bolhas de ar sob a lamínula. Fix e selar a lamela no slide utilizando unha polonês. Esperar pelo menos 15min antes de proceder à imagem.
- Analisar as amostras com um microscópio confocal ou fluorescência. Obtenção de imagens digitais.
9. Quantificação
Nota: Light reagentes sensíveis. Manter os slides protegido da luz.
- Use Duolink ImageTool para contar os sinais nas imagens para obter uma medição do nível de sinalização.
- Compare as medidas e fazer um gráfico.
10. Resultados representante
O resultado de um experimento em PLA situ mostra como discretos pontos fluorescentes. A localização do sinal depende das proteínas específicas estudadas.
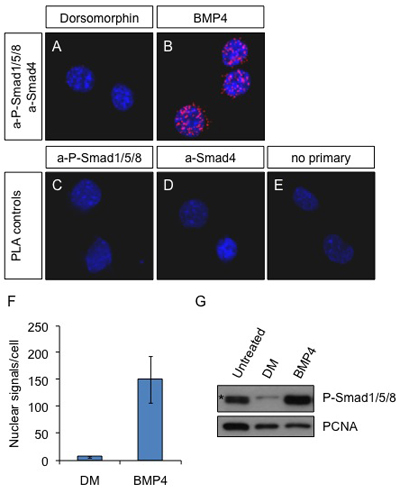
Figura 1. PLA situ em células Neuro2a após a estimulação BMP4. Células foram tratadas com 2 mM dorsomorphin (inibidor da via BMP) (A) ou 25 ng / ml BMP4 (B) por 60 min ou não tratada (CE). Anticorpos contra P-Smad1/5/8 e Smad4 foram usados para detectar os complexos ativos em A e B. Os anticorpos primários aP-Smad1/5/8 sozinho (C) e a-Smad4 sozinho (D) ou omissão do primário anticorpos (E) foram utilizados como controle. Azul: DAPI; Vermelho: sinal de PLA. Imagens foram obtidas com um microscópio confocal Leica SP5.
(F) Os sinais de PLA foram contados com o software ImageTool Duolink eo número médio de manchas no núcleo por célula é apresentado no gráfico. (G) células Neuro2a foram deixados sem tratamento ou tratados com Dorsomorphin (2 mM) ou BMP4 (25 ng / ml) por 60 min. As células foram lisadas e as proteínas foram submetidas a SDS-PAGE e analisadas por immunoblotting com aP-Smad1/5/8 e PCNA-como o carregamento de controle. (*) Banda não específico. Note que o anticorpo aP-Smad1/5/8 não pode distinguir entre os 3 diferentes proteínas presentes no complexo com Smad4.
Discussão
A visualização de complexos de proteínas in situ está em grande demanda, especialmente para estudos na sinalização onde a interação de proteínas e modificação de proteínas são os meios que as células usam para o envio de um sinal de sua superfície para o núcleo. Não foi possível visualizar e quantificar complexos entre duas proteínas endógenas in situ por imunofluorescência antes. Co-localização de anticorpos apresenta baixa resolução e não pode ser usado para visualizar verdadeira interação. PLA é uma nova técnica que os pesquisadores começaram a usar em diferentes sistemas com grande sucesso 6, 7. Aqui, demonstramos como usar PLA não só de visualizar, mas também para quantificar complexos endógenos entre effectors Smad ativada a jusante de estimulação BMP ao longo do tempo. Nós usamos células do tecido diferente de cultura, incluindo Neuro2a e contou com anticorpos comerciais levantadas em diferentes espécies (rato e coelho-Smad4 aP-Smad1/5/8) para alcançar este (fig. 1). Este método permitiu, pela primeira vez, para ver a ativação de BMP-efetoras complexos ao longo do tempo e não apenas a presença do Smad1/5/8 fosforilada, que não podem ser todos envolvidos em complexos ativos com Smad4. Nós contamos os sinais (fig. 1F) e comparou a medida com a quantificação obtida immunoblot das mesmas células 8 (figura 1G). Concluiu-se que o número de pontos fornecem uma medida exata comparativa dos níveis de sinalização ao longo do tempo. A técnica também foi aplicado em linhas de outra célula (HEK293T e Cos7) com resultados semelhantes (dados não mostrados).
O princípio da tecnologia é baseada em duas sondas exclusivas fornecidas com o kit Duolink. Cada sonda PLA consiste de um anticorpo secundário ligado a um oligonucleotídeo sintético única, que atua como repórter. A proximidade das sondas de DNA permite a ligadura no local exato onde essas sondas encontram-se em proximidade. A distância do oligonucleotides, que permite a hibridização de DNA e ligadura é pequeno (40nm <) e, portanto, apenas as proteínas que interagem pode permitir ligadura. O DNA ligado pode então ser amplificado e detectado com hibridização de oligonucleotídeos rotulado da seqüência amplificada. A amplificação é específico, uma vez que depende de princípios hibridização DNA-DNA e também fornece alta sensibilidade como o DNA é amplificado ligado várias vezes, resultando em melhoria do evento ligadura inicial. O DNA amplificado é detectado por hibridização com oligonucleotídeos marcados e produz um local visível e bastante grande. Como as manchas podem ser contados, o sinal PLA fornece não só a informação exata espacial (o local dos eventos de interação), mas também uma forma objetiva de quantificar esses eventos 2-4.
Outras técnicas que são empregadas para a detecção de interações proteína incluem co-imunoprecipitação, imunofluorescência e transferência de energia fluorescente ressonância (FRET). Co-imunoprecipitação ensaios são amplamente utilizados permitindo o isolamento de complexos de proteínas. O método é acompanhado por immunoblotting o que significa que as proteínas devem ser expressas em níveis relativamente elevados, a fim de ser detectado. Problemas de fundo elevado ou ligação não específica de algumas proteínas que as contas são por vezes difíceis de superar, em co-imunoprecipitação. Além disso, co-imunoprecipitação ensaios permitem a detecção de proteínas que pode ser parte de um complexo de proteínas, mas não pode distinguir aqueles que estão muito próximas fisicamente interagindo uns com os outros. Além disso, co-immunoprecipitations não pode fornecer quantificação na resolução única célula ou informações sobre a localização dos complexos de proteína na célula. Detecção de co-existência de complexos de proteínas em uma célula ou um compartimento celular por imunofluorescência é baseado na sobreposição de sinais difusos e, portanto, tem baixa resolução espacial e não pode fornecer informações precisas sobre as interações proteína. Quantificação do sinal de imunofluorescência pode ser feito por estimativa visual apenas se a diferença é várias vezes, e não pode ser exato ou mensuráveis como os pontos PLA. FRET permite a visualização de complexos de proteínas em células vivas e supera a necessidade de anticorpos e da exposição do epítopo. No entanto, FRET geralmente depende da superexpressão de proteínas fundidas artificial, que pode não refletir a complexos de proteína endógena como no PLA.
Condições de bloqueio no protocolo de PLA são críticos como agregação de anticorpos pode ocorrer e aumentar o fundo. Alternativas condições de bloqueio pode ser encontrado em folhas de produtos de anticorpos. Controles apropriados com omissão do anticorpo primário e secundário fornecer informações sobre o que pode ter dado errado e eles precisam ser sempre incluído. É importante para a tela anticorpos diferentes que vai dar o mínimo de fundo quando eles são usados sozinhos e o melhor sinal quando estão juntos. Fixação de cells é crítica como sobre a fixação de complexos de proteínas pode causar a total desnaturar e degradar, enquanto que a fixação insuficiente pode levar à perda de complexos de proteínas durante as etapas do procedimento. Isto pode ser controlado através da redução da concentração do fixador a 3% ou limitando o tempo de fixação. No entanto, a fixação depende também se os anticorpos primários reconhecer proteínas desnaturadas ou não. Como a técnica de PLA é muito sensível, cuidados especiais são necessários para manter os tempos de incubação e as condições micro iguais entre diferentes amostras.
As amostras não devem ser deixadas para secar em qualquer caso, antes da etapa final. A secagem das amostras pode levar a aumento de fundo. A remoção completa da solução de bloqueio também é fundamental para evitar a fundo. Os buffers de lavagem deve sempre estar à temperatura ambiente antes do uso, como baixa temperatura retarda as reações enzimáticas. Para solucionar o problema, consulte o manual do Kit.
É útil usar manchas para determinar a localização sub-celular do sinal de PLA (por exemplo, DAPI, actina etc). Aqui nós temos utilizado DAPI (no meio de montagem) para manchar os núcleos. PLA é compatível com o uso de imunofluorescência com anticorpos para determinar o tipo de célula ou compartimento celular (não mostrado aqui). Quantificação exata pode ser feito através da contagem de sinais eo uso de software específico (Image Tool Duolink, Olink Biosience).
Em conclusão, demonstramos como usar no PLA situ, utilizando o kit para detectar Duolink BMP sinalização em células fixas e apresentou as suas vantagens: fácil de usar, altamente sensível, sem fundo, e uma capacidade única para quantificar ativos de sinalização BMP in situ.
A limitação da aplicação desta técnica para estudar as interações proteína diferente depende da disponibilidade e qualidade dos anticorpos primários que reconhecem as proteínas sob investigação.
Divulgações
Agradecimentos
Esta pesquisa é financiada pelo MRC e as subvenções BBSRC. Agradecemos a Agata Zieba e Katerina Pardalis no laboratório de Ulf Landegren, Uppsala University para ajudar com a criação da técnica e conselhos úteis. Olink Biosience para ajuda técnica e apresentação.
Materiais
| Name | Company | Catalog Number | Comments |
| GMEM | Invitrogen | 21710025 | |
| DMEM | Invitrogen | 21063029 | |
| FBS | AutogenBioclear | 7.01 | |
| Non-essential Amino Acids | Invitrogen | 11149068 | |
| Sodium Pyruvate | Invitrogen | 11360070 | |
| Penicillin / Streptomycin | Invitrogen | 15140122 | |
| L-glutamine | Invitrogen | 25030-054 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | |
| 16-well chamber slides | Lab-Tek | 178599 | |
| Polysine | VWR international | 631-0107 | |
| Cover glass | VWR international | 631-0138 | |
| a-pSmad1/5/8 | Cell Signaling Technology | 9511 | |
| a-Smad4 (B8) | Santa Cruz Biotechnology, Inc. | sc-7966 | |
| Dorsomorphin | Merck & Co., Inc. | 171260-10MG | |
| Recombinant Mouse BMP-4 | R&D Systems | 5020-BP-010 | |
| PFA | Sigma-Aldrich | P6148 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Promega Corp. | H5151 | |
| Duolink II Detection Reagents (Orange) | Olink Bioscience | 92007-0100 | |
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | |
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | |
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | |
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
Referências
- Miyazono, K., Kamiya, Y., Morikawa, M. B. one morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 Forthcoming.
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados