Method Article
Обнаружение сигнализации эффектор-Комплексы Вниз по течению от BMP4 Использование На месте НОАК, Пробирной Расстояние Лигирование
В этой статье
Резюме
Здесь мы показываем, как использовать Расстояние Лигирование анализ (НОАК), при этом сочетание антител к себе костные морфогенетические белки (BMP) сигнализации в фиксированных клетках. Эта техника позволила нам следовать ядерной накопления эндогенных BMP активированный эффекторных комплексов и количественной оценки их уровня в течение долгого времени под BMP4 стимуляции.
Аннотация
БМП отвечают за широкий спектр развития и биологических эффектов. BMP рецепторы активировать (фосфорилировать) Smad1/5/8 эффекторы, которые затем образуют комплекс с Smad4 и транслокации в ядро, где они функционируют как факторы транскрипции инициировать BMP конкретных вниз по течению 1. Традиционные иммунофлуоресценции методы с антителами против фосфо-Smad пептиды проявляют низкую чувствительность, высокий фон и предлагают валового количественного поскольку они полагаются на интенсивность сигнала антител особенно если это светочувствительный флуоресцентные. Кроме того, фосфо-Smads не могут все быть в комплексе с Smad4 и занимается активной транскрипции.
В месте НОАК технология способна обнаруживать белковых взаимодействий с высокой специфичностью и чувствительностью 2-4. Эта новая технология пары антител признание с амплификации ДНК суррогат белка. Он генерирует локализован, дискретный сигнал в виде пятен выявления точного положения признании события. Количество сигналов, можно подсчитать и по сравнению обеспечение измерений. Мы обратились на месте НОАК, используя комплект Duolink, с комбинацией антитела, которые позволяет обнаружить BMP эффекторов сигнализации phospho-Smad1/5/8 и Smad4 только тогда, когда они находятся в непосредственной близости т.е. в комплекс, который происходит только с сигнализацией активации. Это позволило впервые, визуализации и измерения эндогенных BMP сигнализации с высокой специфичностью и чувствительностью в эксперименте время курс под BMP4 стимуляции.
протокол
1. Покрытие клеток и лечение БМП
- Культуры клеток в Neuro2a GMEM с добавлением 10% FBS, 1x Номера для Незаменимые аминокислоты (СВАСМ), 1x пируват натрия и 1 L-глутамина. Разделение клеток с использованием трипсина (0,05%-ЭДТА) и пластины 15.000-20.000 клеток на лунку в 16-и камера слайд.
Культура HEK293T или Cos7 клеток в DMEM с добавлением 10% FBS, 1x L-глютамин и 1x Пенициллин / стрептомицин. Стерилизовать polysine слайдов, погрузив их в 70% этанола и использования Immedge пера привлечь 1 см 2 скважины. Разделение клеток с использованием трипсина (0,05%-ЭДТА) и пластины 20.000-25.000 клеток на лунку в 50 мкл среды. - Инкубируйте клетки при 37 ° С в увлажненной, 5% СО 2 инкубатора.
- Через 24 ч заменить среде с сывороткой свободной GMEM (дополнено с 0,1% альбумин, 1x СВАСМ, 1x пируват натрия и 1 L-глютамин) для Neuro2a или с бессывороточной DMEM (дополнено L-глютамин и 1x Пенициллин / стрептомицин) для HEK293T / Cos7 и инкубировать клетки в течение 2-3 ч. Держите три скважины с клетками при нормальных условиях культивирования (т.е. 10% ЭТС), чтобы использовать в качестве контроля.
- Лечить клеток с dorsomorphin (ингибитор BMP пути, 2 мкМ) или BMP4 (25 нг / мл) в течение интервала времени (например, в течение 10 мин-1 ч) 5.
2. Фиксация и пермеабилизации
- Подготовка фиксатором, 4% PFA. Взвесьте 4 г PFA подготовить 4% раствора в 100 мл PBS. Теплый раствор при 50 ° С, пока не ясно. Фильтр решение через 0,22 мкм фильтр и хранить при 4 ° С до использования. Используйте свежие фиксатором (не хранить в течение более 2-х дней).
- Аспирируйте среды из скважины и промыть 1xPBS. Не пипетки решения непосредственно на клетки, как это может привести к отряду клеток. Прежде чем перейти к следующему шагу, если камера слайды используются удалить камер, но оставить кремния вокруг скважин.
- Добавить 50 мкл 4% PFA и инкубировать в течение 10 минут, при комнатной температуре без перемешивания.
- Вымойте клеток с PBS в течение 3 х 5 мин в банке Коплин от волнения при комнатной температуре.
- Лечить клеток с 0,5% Тритон Х-100 в PBS в течение 10 минут без перемешивания при комнатной температуре.
- Вымойте клеток с 0,05% Твин-20 в TBS (TBS-T) в течение 3 х 5 мин в банке Коплин от волнения при комнатной температуре.
3. Блокирование
- Кран TBS-T. Добавьте одну каплю Duolink II Блокировка Решение (1x) в каждую лунку.
- Инкубируйте слайдов в предварительно нагретой камере влажности в течение 1 часа при температуре 37 ° C.
4. Первичные антитела
- Смешайте и разбавьте aP-Smad1/5/8 (кролик поликлональных) на 1:100 и-Smad4 (мышиных моноклональных) в 1:100 в Duolink II антител Разбавитель (1х). Подготовка также aP-Smad1/5/8 и-Smad4 только в тех же концентрациях, которые будут использоваться для контроля.
- Нажмите выключения блокировки решения из слайдов. Удалить столько блокирование решения, как это возможно, но проявлять особую осторожность, чтобы не позволить клетки перед добавлением сухого антител. Добавить 40 мкл антител решения скважин. В одном хорошо добавить только Разбавитель антител в качестве дополнительного отрицательного контроля.
5. НОАК зондов
- Развести два НОАК зондов (Duolink II анти-Mouse МИНУС и Duolink II анти-кролик PLUS) 1:5 в антител разбавителя.
- Нажмите от первичного решение антитела из слайдов. Вымойте слайды 2 раза 5 минут каждая с 1x Duolink буфера II вымойте в банке Коплин от волнения при комнатной температуре.
- Нажмите от промывочного буфера из слайдов и добавить решение НОАК зонд (40 мкл / лунку).
Инкубируйте слайдов в предварительно нагретой камере влажности в течение 1 часа при температуре 37 ° C.
6. Перевязка
- Vortex Лигирование Duolink II акций (5x) и разбавить 1:5 в высокочистой воды и перемешайте. При расчете объема воды, принимать во внимание объемы лигазы, которые будут добавлены в окончательном разведении 1:40 перед добавлением смеси для скважин.
- Кран решение НОАК зонда от слайдов. Вымойте слайдов в 1x промывочного буфера в 2 раза 5 минут в каждом из банки Коплин от волнения при комнатной температуре.
- Выньте лигазы из морозильника использованием замораживания блока (-20 ° С). Добавить лигазы к Лигирование решение (подготовлен в 6,1) на 1:40 разбавления и вихря.
- Нажмите от промывочного буфера из слайдов и добавить Лигирование-лигазы раствора в каждую лунку (40 мкл / лунку). Инкубируйте слайдов в предварительно нагретой камере влажности в течение 30 мин при 37 ° C.
7. Усиление
Примечание: светочувствительных реагентов. Хранить слайды защищенном от света месте.
- Развести Усиление Duolink II акций (5x) 1:5 в высокочистой воды и перемешайте. При расчете объема воды учитывают объемы полимераза, которая будет добавлена в окончательном разведении 1:80 перед добавлением смеси к-йэлектронной скважин.
- Кран Лигирование-лигазы решение от слайдов. Вымойте слайдов в 1x промывочного буфера с по 2 раза по 2 мин каждый в банке Коплин от волнения при комнатной температуре.
- Выньте полимераза из морозильника использованием замораживания блока (-20 ° С). Добавить к Полимеразная Усиление решение (подготовлен в 7,1) на 1:80 разбавления и вихря.
- Нажмите от промывочного буфера из слайдов и добавить Усиление-полимераза раствора в каждую лунку (40 мкл / лунку). Инкубируйте слайдов в предварительно нагретой камере влажности в течение 100 мин при 37 ° C.
8. Подготовка для работы с изображениями
Примечание: светочувствительных реагентов. Хранить слайды защищенном от света месте.
- Кран-амплификации полимеразной решение от слайдов и мыть 2 раза в 10 минут каждого 1x Duolink II Промывочный буфер B во фляге Коплин при перемешивании при комнатной температуре.
- Dip слайдов в 0,1 х промывочного буфера B.
- Удалить из силиконового 16-и слайд полностью. Добавить ~ 40μl из Duolink II Монтаж среде с DAPI на покровное и осторожно поместите его на образцы нажатия на нее немного, так что Есть нет пузырьков воздуха под покровное стекло. Fix и печать покровное на слайд с помощью лака для ногтей. Подождите, по крайней мере 15 минут прежде чем приступить к визуализации.
- Анализ образцов с конфокальной или флуоресцентного микроскопа. Получить цифровых изображений.
9. Квантификация
Примечание: светочувствительных реагентов. Хранить слайды защищенном от света месте.
- Используйте Duolink ImageTool рассчитывать сигналы на изображения, чтобы получить измерение сигнализации уровня.
- Сравните измерения и сделать график.
10. Представитель Результаты
В результате на месте эксперимента НОАК показывает, как дискретные флуоресцентные пятна. Расположение сигнала зависит от специфических белков изучена.
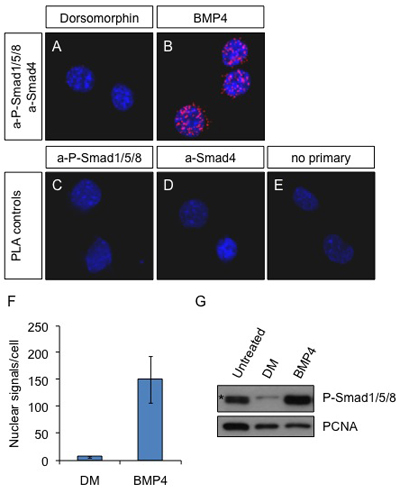
Рисунок 1. Натурные НОАК на клетки Neuro2a после BMP4 стимуляции. Клетки обрабатывали 2 мкМ dorsomorphin (ингибитор пути BMP) () или 25 нг / мл BMP4 (В) в течение 60 минут или не лечить (СЕ). Антитела против P-Smad1/5/8 и Smad4 были использованы для обнаружения активных комплексов в А и В. первичных антител aP-Smad1/5/8 в одиночку (С), а-Smad4 в одиночку (D) или бездействия первичные антитела (E) были использованы в качестве контроля. Синий: DAPI; Красный: PLA сигнала. Картинки были получены с помощью микроскопа Leica SP5 конфокальной.
(F) НОАК сигналы были подсчитаны с программным обеспечением Duolink ImageTool и среднее число мест в ядро в клетке представлена на графике. (G) Neuro2a клетки не лечить или лечить с Dorsomorphin (2 мкМ) или BMP4 (25 нг / мл) в течение 60 мин. Клетки лизировали и белки подвергались SDS-PAGE и проанализированы с помощью метода иммуноблоттинга с aP-Smad1/5/8 и PCNA-как загрузка контроля. (*) Неспецифические группы. Обратите внимание, что aP-Smad1/5/8 антител не в состоянии отличить три различных белков, присутствующих в комплексе с Smad4.
Обсуждение
Визуализации белковых комплексов в местах пользуется большим спросом, особенно для исследований в сигнализации, где взаимодействие белков и модификации, означает, что клетки используют для отправки сигнала с их поверхности к ядру. Это не удалось визуализировать и количественно комплексов между двумя эндогенных белков в месте с иммунофлюоресценции раньше. Сотрудничество локализации антител экспонатов низкого разрешения и не может использоваться для визуализации истинное взаимодействие. НОАК новую технику, что исследователи начали использовать в различных системах с большим успехом 6, 7. Здесь мы показываем, как использовать НОАК не только визуализировать, но и количественно эндогенных комплексами между Smad эффекторов активирован ниже по течению от стимуляции BMP с течением времени. Мы использовали различные ткани культуре клеток, включая Neuro2a и полагались на коммерческие антитела поднял у разных видов (мышь-Smad4 и кролика aP-Smad1/5/8) для достижения этой цели (рис. 1). Этот метод позволил нам, в первый раз, чтобы увидеть активации эффекторных БМП-комплексы с течением времени, а не просто наличие фосфорилированных Smad1/5/8, которые не все могут заниматься активными комплексами с Smad4. Мы насчитали сигналов (рис. 1F) и по сравнению измерение с количественной получена из иммуноблота из тех же клеток 8 (рисунок 1С). Мы пришли к выводу, что число пятен обеспечивают точных сравнительных измерений уровней сигнализации с течением времени. Техника была применена на других линиях клеток (HEK293T и Cos7) с аналогичными результатами (данные не приведены).
Принцип технологии основан на две уникальные зонды поставляемые в наборе Duolink. Каждый зонд НОАК состоит из вторичного антитела придает уникальный синтетический олигонуклеотид, который выступает в качестве репортера. Близость зондов позволяет ДНК перевязки на точное место, где эти зонды крепятся в непосредственной близости. Расстояние олигонуклеотидов, которая позволяет гибридизации ДНК и перевязки мала (<40 нм) и, следовательно, только белки, взаимодействующие может позволить труб. Лигируют ДНК затем может быть усилен и обнаружены с гибридизации меченых олигонуклеотидов усиливается последовательности. Усиление конкретных поскольку оно зависит от ДНК-ДНК гибридизации принципы, а также обеспечивает высокую чувствительность, как лигируют ДНК усиливается в несколько раз приводит к повышению исходное событие труб. Амплифицированной ДНК обнаружено путем гибридизации с мечеными олигонуклеотидов и производит видимый и довольно большое место. Как пятна можно пересчитать, сигнал НОАК обеспечивает не только точное пространственной информации (расположение событий взаимодействия), но и цель способом количественной оценки этих событий 2-4.
Другие методы, которые используются для обнаружения белковых взаимодействий включают в себя совместное иммунопреципитации, immunofluoresence и флуоресцентный резонансный перенос энергии (FRET). Сотрудничество иммунопреципитации тесты широко используются позволяет изоляции белковых комплексов. Метод сопровождается иммуноблоттинга что означает, что белки должны быть выражены на относительно высоком уровне для того, чтобы быть обнаружены. Проблемы высокого фона или неспецифическое связывание некоторых белков в бисер иногда трудно преодолеть в сотрудничестве иммунопреципитации. Кроме того, совместно иммунопреципитации анализов позволяющие выявлять белки, которые могут быть частью белкового комплекса, но не может выделить те, которые находятся в непосредственной близости взаимодействующих физически друг с другом. Кроме того, совместно immunoprecipitations не может обеспечить количественный в одной резолюции ячейки или информацию о локализации белковых комплексов в клетку. Обнаружение совместного существования белковых комплексов в клетку или ячейки отсека immunofluoresence основана на перекрытие рассеянного сигнала и, следовательно, имеет низкое пространственное разрешение и не может дать точной информации о белковых взаимодействий. Количественная оценка immunofluoresence сигнал может быть сделано путем визуальной оценки, только если разница в несколько раз, и не могут быть точными и измеримыми, как пятна НОАК. FRET позволяет визуализации белковых комплексов в живых клетках и преодолевает необходимость антител и воздействия эпитоп. Тем не менее, FRET обычно зависит от гиперэкспрессия искусственного плавленого белков, которые могут не отражать эндогенных белковых комплексов, как в НОАК.
Блокировка условия в НОАК протокола являются критическими, как антитела агрегации может произойти и увеличение фона. Альтернативные блокирование условия можно найти в листах антител продукта. Соответствующие управления с первичными и вторичными антителами упущение предоставить информацию о том, что, возможно, пошли не так, и они должны быть всегда включены. Важно, чтобы показать на экране различные антитела, которые дадут мере фоновом режиме, когда они используются одни и лучший сигнал, когда они вместе. Фиксация челLs имеет решающее значение как чрезмерная фиксация может привести к белковых комплексов, чтобы полностью денатурировать и деградировать, в то время как недостаточная фиксация может привести к потере белковых комплексов во время шагов процедуры. Это можно контролировать за счет снижения концентрации фиксатором до 3%, или на ограничение времени фиксации. Тем не менее, фиксация зависит также от того, первичные антитела распознают денатурированные белки или нет. Как техника НОАК очень чувствительна, особое внимание необходимо для поддержания времени инкубации и микро условиях равного среди разных образцов.
Образцы не должны быть оставлены на сухой в любом случае до последнего шага. Сушка образцов может привести к повышению фона. Полное удаление блокирующий раствор также имеет важное значение для того, чтобы избежать фона. Мыть буферы всегда должны быть доведены до комнатной температуры перед использованием, как низкая температура замедляет ферментативных реакций. Для дальнейшего поиска неисправностей обратитесь к руководству Kit.
Полезно использовать пятна установить субклеточном локализации НОАК сигнала (например DAPI, актин и т.д.). Здесь мы использовали DAPI (в монтажной средой) для окрашивания ядер. PLA совместима с использованием иммунофлюоресценции с антителами для определения типа клеток или клеточного отсека (не показана здесь). Точная количественная может быть сделано путем подсчета сигналов и использование специального программного обеспечения (Duolink Image Tool, OLink Biosience).
В заключение мы продемонстрировали, как использовать на месте НОАК, используя комплект Duolink обнаружить BMP сигнализации в фиксированных клеток и представила свои преимущества: проста в использовании, высокой чувствительностью, не фон, а уникальная способность количественно активных BMP сигнализации на месте.
Ограничение применения этого метода для изучения различных взаимодействий белков зависит от доступности и качества первичных антител, которые признают белков под следствием.
Раскрытие информации
Благодарности
Это исследование финансируется за счет MRC и СИББН грантов. Мы благодарим Агата Zieba и Катерина Pardalis в Лаборатории Ульф Landegren, в университете Упсалы за помощь в создании техники и полезные советы. OLink Biosience технической помощи и презентации.
Материалы
| Name | Company | Catalog Number | Comments |
| GMEM | Invitrogen | 21710025 | |
| DMEM | Invitrogen | 21063029 | |
| FBS | AutogenBioclear | 7.01 | |
| Non-essential Amino Acids | Invitrogen | 11149068 | |
| Sodium Pyruvate | Invitrogen | 11360070 | |
| Penicillin / Streptomycin | Invitrogen | 15140122 | |
| L-glutamine | Invitrogen | 25030-054 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | |
| 16-well chamber slides | Lab-Tek | 178599 | |
| Polysine | VWR international | 631-0107 | |
| Cover glass | VWR international | 631-0138 | |
| a-pSmad1/5/8 | Cell Signaling Technology | 9511 | |
| a-Smad4 (B8) | Santa Cruz Biotechnology, Inc. | sc-7966 | |
| Dorsomorphin | Merck & Co., Inc. | 171260-10MG | |
| Recombinant Mouse BMP-4 | R&D Systems | 5020-BP-010 | |
| PFA | Sigma-Aldrich | P6148 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Promega Corp. | H5151 | |
| Duolink II Detection Reagents (Orange) | Olink Bioscience | 92007-0100 | |
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | |
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | |
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | |
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
Ссылки
- Miyazono, K., Kamiya, Y., Morikawa, M. B. one morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 Forthcoming.
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены