Method Article
효과기 - 단지에게 사용 BMP4의 다운 스트림 신호의 감지 현장에서 괞찮아, 근접 내고 분석
요약
여기 우리는 뼈 Morphogenetic의 단백질 (BMP) 고정 세포에 신호를 시각화하는 항체의 조합과 근접 내고 분석 (괞찮아)를 사용하는 방법을 보여줍니다. 이 기술은 우리가 BMP4 자극을 아래에 효과기 - 단지를 활성화 내생 BMP의 핵 축적에 따라 자신의 수준 시간이 지남에를 정할 수있었습니다.
초록
BMPs는 발달 및 생물 학적 효과의 광범위한 책임이 있습니다. BMP 수용체 다음, Smad4와 복잡한을 형성하고 그들이 BMP 특정 다운 스트림 효과 1 시작 전사 요소로 기능을 핵으로 이동시키다 (phosphorylate) Smad1/5/8 effectors를 활성화해야합니다. phospho - Smad의 펩티드에 대한 항체와 함께 전통적인 단백질 형광 기법은 낮은 감도, 높은 배경을 전시하고이 형광 감광성의 경우 그들이 특히 항체 신호의 강도에 의존하는 등 총 부량을 제공합니다. 또한, phospho - Smads 모든 Smad4 복잡한으로되지 않을 수 있으며 적극적인 녹음에 참여.
현장에서 플레은 높은 특이성과 민감도 2-4과 단백질 상호 작용을 검출 수있는 기술입니다. 단백질의 DNA를 대리의 증폭과 함께이 새로운 기술 커플 항체 인식. 그것은 인식 행사의 정확한 위치를 공개 장소의 형태로 지역화된, 이산 신호를 생성합니다. 신호의 수를 계산하고 측정을 제공 비교할 수 있습니다. 우리는이 신호만을 발생하는 복잡한에 근접 즉,에있는 경우에만 BMP 신호 effectors phospho-Smad1/5/8 및 Smad4의 감지를 허용 항체의 조합으로 Duolink 키트를 사용하여 현장 플레 적용 활성화. 이것은 처음 BMP4 자극 아래 시간 코스 실험에서 높은 특이성과 민감도와 신호 내생 BMP의 시각화 및 측정에 대한 허용.
프로토콜
1. 전지 도금 및 BMP 치료
- GMEM 문화 Neuro2a 세포 10 % FBS와 보충, 1X 비 필수 아미노산 (NEAM), 1X 나트륨 pyruvate과 L - 글루타민 1X. 16 잘 챔버 슬라이드에 트립신 (0.05 % - EDTA (에틸렌 다이아 민 테트라 초산))과 잘 따라 플레이트 15.000-20.000 세포를 사용하여 세포를 분리.
DMEM 문화 HEK293T 또는 Cos7 세포 10 % FBS, 1X L - 글루타민과 1X 페니실린 / 스트렙토 마이신과 보완. 70 % 에탄올에서 그들을 immersing 및 Immedge 펜은 1cm이 우물을 그릴 사용하여 polysine 슬라이드를 소독. 50 μl 매체 트립신 (0.05 % - EDTA (에틸렌 다이아 민 테트라 초산))과 잘 따라 플레이트 20.000-25.000 세포를 사용하여 세포를 분리. - 37 세포를 품어 ° humidified 5 % CO 2 배양기에서 C.
- 24 후 H는 Neuro2a에 대한 혈청 무료 GMEM (알부민 0.1 %, 1X NEAM, 1X 나트륨 pyruvate 및 1X L - 글루타민과 보충) 또는 HEK293T에 대한 혈청 무료 DMEM (L - 글루타민과 1X 페니실린 / 스트렙토 마이신과 보충)로 매체를 교체 / Cos7 후 2-3 H. 위해 전지를 품어 컨트롤로 사용하는 일반 culturing 조건 하에서 세포 (즉, 10% FBS) 세 우물 보관하십시오.
- 원하는 시간 dorsomorphin (BMP 경로, 2 μm의의 억제제) 또는 BMP4 (25 NG / ML)와 세포 (10 분 - 1 H에 대한 예) 5를 처리합니다.
2. 고정 및 Permeabilization
- 정착액, 4퍼센트 PFA를 준비합니다. 100 ML PBS에 4 %의 솔루션을 준비하는 PFA의 4g의 무게를. 50 솔루션을 따뜻한 ° 그것이 명확 C까지. 사용까지 4 0.22 μm의 필터와 매장 ° C를 통해 솔루션을 필터링합니다. 신선한 정착액을 (이상 2 일간 저장되지 않습니다)를 사용합니다.
- 우물에서 매체를 기음과 1xPBS로 씻으십시오. 이것은 세포의 분리의 결과 수 있으므로 직접 세포에 솔루션을 피펫하지 마십시오. 챔버 슬라이드를 사용하는 경우 다음 단계로 진행하기 전에, 회의소를 제거하지만, 우물 주변의 실리콘을 두십시오.
- 동요하지 않고, RT에서 10 분 50 μl 4퍼센트 PFA과 부화를 추가합니다.
- RT에서 교반과 코플린 병 3 X 5 분 PBS로 세포를 씻으십시오.
- 0,5 % 트리톤 PBS에서 X - 100 10 분에 대한 RT에 동요하지 않고있는 세포를 처리합니다.
- RT에서 교반과 코플린 병 3 X 5 분 TBS의 0,05 % 트윈 20 (TBS - T)으로 세포를 씻으십시오.
3. 블로킹
- TBS - T를 누릅니다. 물론 당 Duolink II 차단 솔루션 (1X) 중 하나 드롭을 추가합니다.
- 37 1 H를위한 사전 가열 습도 챔버 ° C.에있는 슬라이드를 품어
4. 프라이 머리 항체
- 믹스와 1:100에서 aP-Smad1/5/8을 (토끼 polyclonal) 희석과 Duolink II 항체 희석액 (1X)에 1:100에서 - Smad4 (마우스 단클론). 컨트롤에 사용되는 동일한 농도에서도 aP-Smad1/5/8 준비하고 A - Smad4 혼자.
- 슬라이드에서 차단 솔루션을 누릅니다. 최대한 차단 솔루션을 제거하지만 항체를 추가하기 전에 세포가 건조하게하지 여분의 처리. 우물에 항체 솔루션 40 μl를 추가합니다. 하나에 잘 추가 대조군에 불과 항체 희석액을 추가합니다.
5. 플레 프로브
- 항체 희석액에 두 플레 프로브 (Duolink II 안티 마우스 빼기와 Duolink II 안티 래빗 플러스) 1:5 희석.
- 슬라이드의 기본 항체 솔루션을 누릅니다. 1X Duolink II 씻으 버퍼 각 슬라이드에게 2 번 5 분 씻어 RT에서 교반과 코플린있는 항아리에.
- 슬라이드에서 씻으 버퍼를 누르하고 (물론 40 μl /) 괞찮아 프로브 솔루션을 추가합니다.
37 1 H를위한 사전 가열 습도 챔버 ° C.에있는 슬라이드를 품어
6. 내고
- 소용돌이 Duolink II의 결합 주식 (5 배)와 고순도 물 혼합에 1:5 희석. 물의 볼륨을 계산할 때, 계정으로 바로 우물에 혼합을 추가하기 전에 1시 40분의 최종 희석에 추가됩니다 Ligase의 볼륨을.
- 슬라이드에서 플레 프로브 솔루션을 누릅니다. 1X 와시 버퍼에있는 슬라이드 RT에서 교반과 코플린 병 2 번 5 분 각각 씻으십시오.
- 냉동 블록 (-20 ° C)를 사용하여 냉동고에서 Ligase를 가져가라. 1시 40분 희석과 와동의 결합 솔루션 (6.1에서 준비)에 Ligase를 추가합니다.
- 슬라이드에서 씻으 버퍼를 누르하고 내고 - Ligase 솔루션을 추가하는 것은 각 웰 (물론 40 μl /). 37 30 분 미리 가열 습도 챔버 ° C.에있는 슬라이드를 품어
7. 확대
참고 : 라이트 민감한 시약. 조명으로부터 보호 슬라이드 보관하십시오.
- 고순도 물 혼합에 Duolink II의 증폭 주식 (5 배) 1:5 희석. 물 볼륨이 계정으로 단지 일까지 혼합을 추가하기 전에 1:80의 최종 희석에 추가됩니다 효소의 볼륨을 계산할 때E 웰스.
- 슬라이드에서 내고 - Ligase 솔루션을 누릅니다. 1X 와시 버퍼에있는 슬라이드를 씻어 RT에서 교반과 코플린있는 항아리에 A 2 번 2 분 각.
- 냉동 블록 (-20 ° C)를 사용하여 냉동고에서 효소를 가져가라. 1:80 희석과 와동의 증폭 솔루션 (7.1에서 준비)에 효소를 추가합니다.
- 슬라이드에서 씻으 버퍼를 누르하고 증폭 - 효소 솔루션을 추가하는 것은 각 웰 (물론 40 μl /). 37 100 분 미리 가열 습도 챔버 ° C.에있는 슬라이드를 품어
8. 이미징을위한 준비
참고 : 라이트 민감한 시약. 조명으로부터 보호 슬라이드 보관하십시오.
- 슬라이드에서 증폭 - 효소 솔루션을 누르고 RT에서 교반과 코플린있는 항아리에 1X Duolink II 워시 버퍼 B에 각 2 회 10 분에 대한 세척.
- 0.1 X 와시 버퍼 B.에있는 슬라이드를 찍어
- 완전히 16 잘 슬라이드에서 실리콘을 제거합니다. coverslip에 DAPI와 매체를 장착 Duolink II의 ~ 40μl를 추가하고 부드럽게 약간하므로 커버 슬립 아래에서 기포가가 없다는 것을 그것을 눌러 샘플을 통해 그것을 놓으십시오. 수정 및 매니큐어를 사용하여 슬라이드에 coverslip을 봉쇄. 영상을 계속하기 전에 적어도 15 분 기다립니다.
- 공촛점 또는 형광 현미경으로 샘플을 분석할 수 있습니다. 디지털 이미지를 얻을 수 있습니다.
9. 부량
참고 : 라이트 민감한 시약. 조명으로부터 보호 슬라이드 보관하십시오.
- 신호 레벨의 측정을 얻기 위해 이미지에 신호를 계산하는 Duolink ImageTool을 사용합니다.
- 측정을 비교하고 그래프를 확인합니다.
10. 대표 결과
현장 플레 실험의에서 결과는 개별 형광 명소를 보여줍니다. 신호의 위치는 공부의 특정 단백질에 따라 달라집니다.
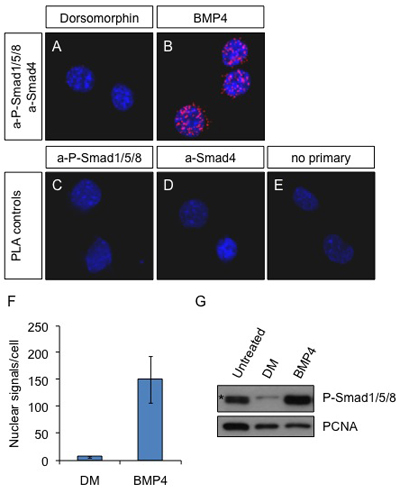
그림 1. 원위치 괞찮아에서 BMP4 자극 후 Neuro2a 세포에. 셀 2 μm의 dorsomorphin (BMP 경로의 억제제) (A) 또는 25 NG / ML BMP4 취급했다 (B)에 대한 치료 60 분 또는 왼쪽 (CE). P-Smad1/5/8 및 Smad4에 대한 항체는 A와 B. 혼자 aP-Smad1/5/8 (C) 기본 항체와 A - Smad4 혼자 (D) 또는 기본 태만에의 적극적인 단지를 검색하는 데 사용되었다 항체 (E)는 컨트롤로 사용되었습니다. 블루 : DAPI, 빨간색 : 괞찮아 신호. 사진은 Leica SP5 공촛점 현미경과 함께 획득했다.
(F) 괞찮아 신호는 Duolink ImageTool 소프트웨어로 간주되었으며 세포 당 핵에있는 명소의 평균 개수는 그래프에 표시됩니다. (G) Neuro2a 세포는 치료 왼쪽 또는 Dorsomorphin (2 μm의) 또는 60 분 BMP4 (25 NG / ML)로 처리되었습니다. 세포 lysed되었으며 단백질은 SDS - PAGE의 대상 및 제어를 로딩으로 aP-Smad1/5/8과 - PCNA와 immunoblotting에 의해 분석되었다. (*)가 아닌 특정 밴드. aP-Smad1/5/8 항체는 3 가지 단백질을 구별 수 없습니다이 Smad4 복잡한에 존재.
토론
현장에서 단백질 단지의 시각은 특히 단백질 상호 작용과 단백질 수정은 세포들은 표면에서 핵으로 신호를 보내기를 위해 사용하는 수단입니다 어디 신호의 연구, 큰 수요에있다. 그것은 전에 immunofluorescence과 함께 현장에서 두 내생 단백질 사이의 단지를 시각화하고 계량 가능한되지 않았습니다. 항체의 공동 지방화는 낮은 해상도를 전시하고 진정한 상호 작용을 시각화하는 데 사용할 수 없습니다. 플레은 연구자가 성공 6, 7과 다른 시스템에서 사용하기 시작한다는 새로운 기술입니다. 여기, 우리는 시간이 지남에 BMP의 자극의 하류 활성화 Smad effectors 사이의 내생 단지를 시각적으로뿐만 아니라 수치뿐만 아니라 괞찮아를 사용하는 방법을 보여줍니다. 우리는 Neuro2a이 (그림 1) 달성 종 (마우스 - Smad4와 토끼 aP-Smad1/5/8)에서 제기된 상업 항체에 의존을 포함한 다른 조직 문화 전지를 사용했습니다. 이 방법은 모든 Smad4와 활성화 단지에 종사하지 않을 수 있습니다 phosphorylated Smad1/5/8의 단지 존재가 아니라 시간이 지남에 따라 BMP 효과기 - 단지의 활성화를 참조하고, 처음으로 우리를 허용했다. 우리는 신호 (그림 1 층)을 계산하고 같은 세포 8 (그림 1G)의 immunoblot에서 얻은 부량로 측정을 비교했다. 우리는 반점의 수가 시간이 지남에 따라 레벨을 신호의 정확한 비교 측정을 제공 결론을 내렸다. 이 기술은 또한 유사한 결과를 다른 세포 라인 (HEK293T 및 Cos7) (데이터가 표시되지 않음)에 적용되었습니다.
기술의 원리는 Duolink 키트와 함께 제공되는 두 개의 정점이 프로브에 따라 달라집니다. 각 플레 프로브는 기자 역할을 독특한 합성 oligonucleotide에 연결된 보조 항체로 구성되어 있습니다. 프로브의 근접이 탐사선이 근접에 부착되는 정확한 위치에서 DNA의 결합을 허용합니다. DNA의 하이브리드화 및 내고 작은 (<40nm) 및 그러므로 수있는 oligonucleotides의 거리, 상호 작용에만 단백질이 결합을 허용할 수 있습니다. 출혈도 잡았 DNA는 다음 증폭 및 증폭 순서 분류 oligonucleotides의 하이브리드화로 검색하실 수 있습니다. 증폭은 DNA - DNA의 하이브리드화 원칙에 따라 같은 특정되고 출혈도 잡았 DNA가 초기 내고 이벤트의 향상의 결과로 몇 배 증폭이므로 또한 고감도를 제공합니다. 증폭된 DNA는 레이블 oligonucleotides와 하이브리드화하여 검색하고 볼 수와 약간 큰 자리를 생산합니다. 반점이 계산 수 있듯이, 플레 신호의 정확한 공간 정보 (상호 작용 이벤트의 위치)뿐만 아니라, 이러한 이벤트를 2-4 quantifying의 객관적인 방법뿐만 아니라를 제공합니다.
단백질 상호 작용의 검출을 위해 고용하는 다른 기술은 공동 immunoprecipitation, immunofluoresence와 형광 공명 에너지 전송을 (무서워)가 있습니다. 공동 immunoprecipitation의 assays 널리 단백질 단지의 절연을 활성화하는 데 사용됩니다. 방법은 단백질을 감지하기 위해 상대적으로 높은 수준의 표현이어야합니다 즉 immunoblotting 함께합니다. 높은 배경이나 비즈 일부 단백질이 아닌 특정 바인딩의 문제는 종종 공동 immunoprecipitation에서 극복하기 어렵습니다. 또한, 공동 immunoprecipitation의 assays는 단백질 복합의 일부가 될 수있는 단백질의 검출을 허용하지만, 서로 물리적으로 상호 작용하는 매우 가까이에있는 이들을 구분할 수 없습니다. 또한, 공동 immunoprecipitations은 세포에서 단백질 단지의 지방화에 대한 단세포 해상도 또는 정보에 quantitation를 제공할 수 없습니다. immunofluoresence하여 셀 또는 셀 구획에 단백질 단지의 공동 존재의 감지 따라서 확산 신호의 중복에 기초하고있다, 낮은 공간 해상도를 가지고 있으며 단백질의 상호 작용에 대한 정확한 정보를 제공할 수 없습니다. 차이가 몇 배 이상이며, 정확한 또는 괞찮아 명소로 측정 수없는 경우에만 immunofluoresence 신호의 양을 정함은 Visual 추정하여이 작업을 수행할 수 있습니다. 안달 라이브 세포에 단백질 단지의 시각화를 허용하고 항체의 필요성과 에피토프의 노출을 극복. 그러나, 걱정은 보통 플레 같이 내생 단백질 단지를 반영하지 않을 수 있습니다 인공 융합 단백질의 overexpression에 따라 달라집니다.
플레 프로토콜 차단 조건 항체 집합이 발생하고 배경을 증가 수 있으므로 중요합니다. 대체 차단 조건은 항체 제품 시트에서 찾을 수 있습니다. 기본 및 보조 항체 누락과 함께 적절한 컨트롤이 잘못 됐을 수도 있습니다 어떤 정보를 제공하고 그들은 항상 포함해야합니다. 그들이 만날 때 그들이 단독으로 사용하는 이상의 배경과 최상의 신호를 제공합니다 다른 항체를 스크린하는 것이 중요합니다. 셀의 고정부족한 고정이 절차의 단계 동안 단백질 단지의 손실로 이어질 수 있습니다 반면,여 - 고정이 단백질 단지 완전히 변성 및 저하를 일으킬 수로인가가 중요합니다. 이것은 3 % 정착액의 농도를 낮추거나 고정 시간을 제한하여 제어할 수 있습니다. 그러나, 고정은 기본 항체가 변성 단백질 여부를 인식하는지 여부에도 달려 있습니다. 플레 기술은 매우 민감한이기 때문에, 특별한주의는 배양 시간 및 다른 샘플간에 동등한 마이크로 조건을 유지하기 위해 필요합니다.
샘플은 최종 단계 이전에 어떤 경우에 건조 왼쪽해서는 안됩니다. 샘플의 건조하면 증가 배경으로 이어질 수 있습니다. 차단 솔루션의 완전한 제거는 배경을 방지하기 위해 중요합니다. 낮은 온도가 효소 반응을 느리게으로 세척 버퍼는 항상 사용하기 전에 실온에 회부해야합니다. 추가 문제 해결을위한 키트의 설명서를 참조하십시오.
그것은 괞찮아 신호 (예 : DAPI, 굴지 등)의 하위 세포 현지화을 확인할 얼룩을 사용하는 데 유용합니다. 여기서 우리는 핵을 얼룩이 DAPI을 (장착 매체) 사용하고 있습니다. 플레은 셀 형식이나 세포 구획을 (여기에 표시되지 않음)를 확인하는 항체와 immunofluorescence의 사용과 호환됩니다. 정확한 양을 정함은 신호와 특정 소프트웨어 (Duolink 이미지 도구 Olink Biosience)의 사용을 계산하여이 작업을 수행할 수 있습니다.
고감도 사용하기 쉽고, 노 배경, 그리고 현장에서 신호 활성 BMP를 정할 수있는 독특한 능력 : 결론적으로 우리는 BMP가 고정된 세포의 신호 전달과 그 이점을 제시 감지 Duolink 키트를 사용하여 현장 괞찮아에 사용하는 방법을 증명하고있다.
다른 단백질 상호 작용을 연구하기 위해이 기술을 적용의 제한은 조사에 따라 단백질을 인식 차 항체의 가용성과 품질에 따라 달라집니다.
공개
감사의 말
이 연구는 MRC와 BBSRC의 기금에 의해 후원됩니다. 우리는 기술과 유용한 조언을 설정 도와 줘서 Ulf Landegren의 실험실에있는 웁살라 대학을 아가타 Zieba와 카테 리나 Pardalis 감사드립니다. 기술 지원 및 프레 젠 테이션에 대한 Olink의 Biosience.
자료
| Name | Company | Catalog Number | Comments |
| GMEM | Invitrogen | 21710025 | |
| DMEM | Invitrogen | 21063029 | |
| FBS | AutogenBioclear | 7.01 | |
| Non-essential Amino Acids | Invitrogen | 11149068 | |
| Sodium Pyruvate | Invitrogen | 11360070 | |
| Penicillin / Streptomycin | Invitrogen | 15140122 | |
| L-glutamine | Invitrogen | 25030-054 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300-054 | |
| 16-well chamber slides | Lab-Tek | 178599 | |
| Polysine | VWR international | 631-0107 | |
| Cover glass | VWR international | 631-0138 | |
| a-pSmad1/5/8 | Cell Signaling Technology | 9511 | |
| a-Smad4 (B8) | Santa Cruz Biotechnology, Inc. | sc-7966 | |
| Dorsomorphin | Merck & Co., Inc. | 171260-10MG | |
| Recombinant Mouse BMP-4 | R&D Systems | 5020-BP-010 | |
| PFA | Sigma-Aldrich | P6148 | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Promega Corp. | H5151 | |
| Duolink II Detection Reagents (Orange) | Olink Bioscience | 92007-0100 | |
| Duolink II PLA probe anti-Mouse MINUS | Olink Bioscience | 92004-0100 | |
| Duolink II PLA probe anti-Rabbit PLUS | Olink Bioscience | 92002-0100 | |
| Duolink II Mounting Medium with DAPI | Olink Bioscience | 82040-0005 | |
| Duolink II Wash Buffers Fluorescence | Olink Bioscience | 82049 |
참고문헌
- Miyazono, K., Kamiya, Y., Morikawa, M. B. one morphogenetic protein receptors and signal transduction. J Biochem. 147, 35-51 (2010).
- Gustafsdottir, S. M. Proximity ligation assays for sensitive and specific protein analyses. Anal Biochem. 345, 2-9 (2005).
- Soderberg, O. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3, 995-1000 (2006).
- Soderberg, O. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Yu, P. B. Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nat Chem Biol. 4, 33-41 (2008).
- Baan, B. In situ proximity ligation detection of c-Jun/AP-1 dimers reveals increased levels of c-Jun/Fra1 complexes in aggressive breast cancer cell lines in vitro and in vivo. Mol Cell Proteomics. 9, 1982-1990 Forthcoming.
- Massinen, S. Functional interaction of DYX1C1 with estrogen receptors suggests involvement of hormonal pathways in dyslexia. Hum Mol Genet. 18, 2802-2812 (2009).
- Thymiakou, E., Zannis, V. I., Kardassis, D. Physical and functional interactions between liver X receptor/retinoid X receptor and Sp1 modulate the transcriptional induction of the human ATP binding cassette transporter A1 gene by oxysterols and retinoids. Biochemistry. 46, 11473-11483 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유