Method Article
High-Throughput medição e classificação de P orgânico em amostras ambientais
Neste Artigo
Resumo
Este protocolo descreve um método de alto rendimento da hidrólise enzimática que utiliza um leitor de microplacas para medir e classificar o fósforo do solo como P monoésteres, diésteres de P inorgânico e P. Até 96 amostras podem ser medidos de uma só vez em um laboratório padrão.
Resumo
Muitos tipos de compostos orgânicos de fósforo (P) moléculas existem em amostras ambientais 1. P medições tradicionais não detectam estes compostos orgânicos P, uma vez que não reagem com reagentes colorimétricos 2,3. Hidrólise enzimática (EH) é um método emergente para caracterizar com precisão formas de P orgânico em amostras ambientais 4,5. Este método só é superado em precisão por Espectroscopia de fósforo-31 de Ressonância Magnética Nuclear (31 P-NMR), um método que é caro e requer especializados training6 técnica. Nós adaptamos um método de hidrólise enzimática capaz de medir a três classes de fósforo (P monoéster, P diéster e P inorgânico) para um sistema de leitor de microplacas 7. Este método fornece aos pesquisadores um meio rápido, preciso, acessível e de fácil utilização para medir espécies P nos solos, sedimentos, adubos e, se concentrou, amostras aquáticas. Este é o único método de alto rendimento para medir as formas e enzima labilidade de P orgânico que pode ser realizado em um laboratório padrão. Os dados resultantes fornece insights para os cientistas que estudam o conteúdo do sistema de nutrientes e potencial de eutrofização.
Protocolo
1. Extração de fósforo
- Prepare uma solução de 1L de 0,25 M de hidróxido de sódio (NaOH, 40,00 g / mol) + 0,05 M de ácido etilenodiaminotetracético (EDTA, 292,24 g / mol).
- Adicionar 30 mL da solução de NaOH + EDTA a 2 g de solo úmido ou seco / amostra em um tubo cônico de 50 mL.
- Incube com agitação por 16 h à temperatura ambiente.
- Centrifugar a 3000 xg por 3 minutos.
2. Ajuste de pH da amostra Extract
- Transferência de uma alíquota de 0,1 mL para um tubo de 1,5 mL micro centrífuga.
- Adicionar 0,017 mL de ácido acético 2,5 M, 0,144 mL de 0,4 M tampão acetato (70,5% de acetato de sódio [CH 3 COONa, 82,03 g / mol] e 29,5% de ácido acético, pH 5,0) e 0,739 mL de água deionizada.
- O volume final do extrato ajustado será de 1 mL eo pH final será 5,0.
3. Enzima Preparação Solução stock
- Prepare 1 L de 0,1 M de acetato de sódio (CH 3 COONa, 82,03 g / mol) solução, pH 5.0.
- Prepare 2 x 10 mL de ácido soluções estoque fosfatase no buffer de acetato de sódio preparada na etapa 3,1 tal que as concentrações finais são cada 0,5 Unidades / mL.
Fosfatase ácida Tipo I de Triticum aestivum (gérmen de trigo; GP, geralmente 0,5 mg sólida U-1, EC 3.1.3.2)
Fosfatase ácida Tipo IV-S de Solanum tuberosum (batata; PP, geralmente 4,6 mg U-1 sólido, EC 3.1.3.2)
* Unidades de actividade são especificados pelo fornecedor, onde uma unidade é definida como a libertação de um micromole de ortofosfato para a solução por hora a 37 ° C. - Reconstituir liofilizado nuclease P1 (CE 3.1.30.1) de Penicillium citrinum (fungos; NP1, geralmente 500 U mg -1 sólido) em um mL de água deionizada, isso agora pode ser armazenado a 4 ° C para uso futuro.
- Pipeta NP1 em um dos 10 tubos mL preparada no passo 3,2 tais que a concentração final é de 2,5 Unidades / mL NP1; misture suavemente por inversão várias vezes.
- Centrifugar as duas soluções enzimáticas 10 mL 3000 xg por 30 minutos.
4. P curva de calibração e controles
- Prepare 1 L de 1 mM fosfato de potássio (K2HPO4, 174,18 g / mol) solução estoque.
- Adicionar 1 mL da solução estoque 1 mM fosfato de potássio a um tubo de centrífuga de 1,5 mL e 0,5 mL realizar sete diluições em série.
- Descartar o primeiro tubo para que você tenha sete diluições variando de 20 nmol-0.625 nmol P.
- Transferência de 80 mL de cada tubo em duplicado para linhas B - H de um padrão em placas de 96 poços.
- Adicionar 80 mL de tampão acetato de sódio (ponto 3.1) com a linha A de colunas 11 e 12 este é o ponto de calibração 0 nmol P.
- Cada coluna 11 e 12 agora contém oito amostras de referência de 0 a 20 nmol de fosfato inorgânico nmol.
- Coluna 10 conterá os seguintes controles:
- Adicionar 40μL PP + solução enzimática GP + 40 mL de tampão de acetato de sódio (ponto 3.1) para os três primeiros poços na coluna 10.
- Adicionar 40 mL PP + GP + solução enzimática NP1 + 40 mL de tampão de acetato de sódio para os próximos três poços.
- Adicionar 40 mL de acetato de sódio contendo 10 glicose-6-fosfato nmol (C 6 H 11 O 9 Na 2 P 2 O • xH, 304,1 g / mol) + 40 mL PP + solução enzimática para um GP bem e para o bem-finais em solução Coluna 10 acetato de sódio em vez de adicionar solução enzimática.
5. Amostra Enzima + Incubação
- Cada amostra que está sendo testado vai ocupar os primeiros 9 poços em uma linha de uma placa padrão de 96 poços.
- Distribuir 40 mL de extratos com pH ajustado amostra da Seção 2 para poços 09/01 em até 8 linhas.
- Depois de todas as amostras foram distribuídas * use uma pipeta multicanal para distribuir PP + solução enzimática GP às colunas 1-3, PP + GP + NP1 às colunas 4-6 e tampão acetato de sódio (preparado na seção 3.1) para colunas 7-9.
* Esta etapa deve ser realizada rapidamente para assegurar todas as amostras de obter tempo de incubação equivalente. - Cobrir a placa de 96 poços com uma tampa e incubar amostras + soluções enzimáticas, controles e curva de calibração exatamente 1 hr a 37 ° C.
6. Medida colorimétrica de Lançamentos e P inorgânicos Background
- Prepare 50 mL de cada uma das seguintes soluções em água deionizada:
Solução A *: 0,1 M de ácido ascórbico (C6H8O6, 176,12 g / mol) + ácido tricloroacético 0,5 M (Cl3CCOOH, 163,39 g / mol)
Solução B: 0,01 M molibdato de amônio ((NH4) 2MoO4, 196,01 g / mol)
Solução C: 0,1 M citrato de sódio (HOC (COONa) (CH2COONa) 2 2H2O, 294,10 g / mol) + 0,2 arseniato de sódio M (NaAsO2, 129,91 g / mol) + 5% de ácido acético glacial
(CH3CO2H, 60,05 g / mol) * A solução deve ser preparado diariamente. - Adicionar 25 ml de solução SDS, 100 ml de solução A, 20 mL de solução B e 50 mL de C e solução para todos os poços na pl de 96 poçoscomeu. Fazer isso rapidamente com uma pipeta multicanal.
- Cobrir a placa e incubar 30 minutos à temperatura ambiente.
- Medir a absorvância a 850 nm em qualquer leitor de micro-placa ajustável.
7. Classificação de Compostos P
- Importação de dados brutos em um aplicativo de planilha (por exemplo, Microsoft Excel).
- Traçar a curva de calibração de fósforo inorgânico: 0-40 nmol P sobre o eixo-x ea média de medições de absorbância duplicada no eixo-y.
- Executar uma regressão linear e encontrar a equação da linha de melhor ajuste.
- Colunas 1-3: Diretamente aplicar a curva de calibração, isto é fundo P. inorgânicos
- Colunas 4-6: Média de valores da amostra triplicado e subtrair controles (solução enzimática + P inorgânico de fundo) do bruto absorbância-P este é derivado de mono-ésteres hidrolisáveis P.
- Colunas 7-9: O mesmo que 7,5, exceto os valores de absorbância subtrair colunas 4-6 - este é P de diésteres hidrolisável P.
- Converter os dados de absorvância em nmol P liberado pela aplicação da equação de calibração.
- nmol P liberado pode ser relacionado para mg P / kg de solo original. Alternativamente, avaliando as proporções de cada classe P também pode ser uma abordagem útil para a análise de dados.
8. Resultados representativos:
Uma rápida inspeção visual da placa de 96 poços após a química colorimétrico vai oferecer pistas sobre se ou não o procedimento foi realizado corretamente. A primeira coisa a verificar é o nível de líquido em cada poço, verificando o perfil lado do prato. Deve haver exatamente 275 mL de reagentes em todos os poços. Em seguida, inspecionar visualmente a cor dos poços de amostras duplicadas triplicado e poços de calibração. Estas técnicas devem ser replicar o mesmo tom de azul. Em seguida aplicar a curva de calibração para os dois poços contendo glicose-6-fosfato e verificar que eles lançaram todos os nmol 10 de P. Após inorgânicos P total extraído foi medido utilizando ICP-OES ou um método alternativo, verifique se o P total valores calculados utilizando este protocolo não excedam a quantidade de P que foi extraído.
Nota: o gerenciamento de dados cuidadosa na planilha vai ajudar a proteger contra erros quantitativos. Você estará lidando com um monte de números de uma vez, criando assim um modelo será tempo bem gasto.
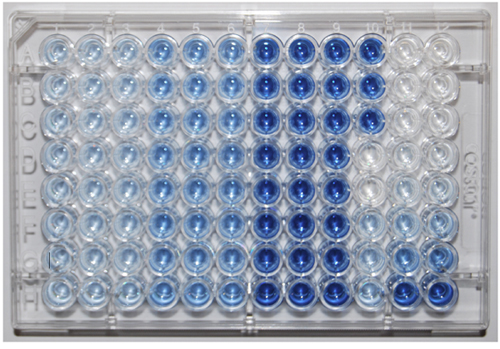
Figura 1. A placa de 96 poços mostrando resultados para 8 amostras (linhas AH) e uma curva de calibração (colunas 11 e 12). Controles estão na coluna 10. Aumentar a intensidade de cor entre as colunas 1-3 e 4-6 é devido ao hidrolisado compostos monoester P, entre as colunas 4-6 e 7-9 é devido a compostos de P diéster hidrolisada.
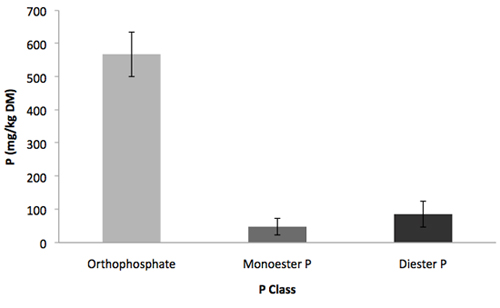
Figura 2. Distribuição das classes P em NaOH 0,05 M-0,25 M EDTA extrato de uma amostra de solo Vermont usando alto rendimento de hidrólise enzimática. Barras de erro indicam o desvio padrão, n = 3.
Discussão
Por sua própria natureza, um método rápido utilizando pequenos volumes requer muito cuidado. Portanto, os passos mais críticos são aqueles que envolvem soluções de pipetagem para a placa. Precisas e, mais importante, a técnica da pipeta consistentes são essenciais para o sucesso deste ensaio.
A extração NaOH-EDTA permitirá que a maior parte do P em amostras de muitos para ser caracterizada em três classes: ortofosfato, P monoéster e solos diéster P., adubos, sedimentos ou qualquer outra amostra do ambiente que contém NaOH-EDTA-extraível P pode ser caracterizada . Formas de P em amostras ambientais não são necessariamente estáveis e esta técnica vai garantir amostras são caracterizadas antes de amostras são comprometidos sem a necessidade de empregar um exército de pesquisadores.
Este ensaio é especialmente adequado quando um grande número de amostras a serem processadas. As necessidades de reagentes e requisitos de espaço foram reduzidas a um nível administrável (por exemplo, tubos de 1,5 mL de microcentrífuga em vez de 50 frascos de vidro mL). Esta adaptação também limita a produção de resíduos.
Divulgações
Agradecimentos
Agradecemos ao USGS e dos Recursos Hídricos e Vermont Lake Centro de Estudos para a concessão de financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| NaOH | Sigma-Aldrich | S8045 | |
| EDTA | Sigma-Aldrich | EDS | |
| Ácido acético glacial | Sigma-Aldrich | 242853 | |
| Acetato de sódio | Sigma-Aldrich | S2889 | |
| Trigo fosfatase ácida | Sigma-Aldrich | P3627 | |
| Fosfatase ácida de batata | Sigma-Aldrich | P1146 | |
| Nuclease P1 | Sigma-Aldrich | N8630 | |
| Fosfato de potássio | Sigma-Aldrich | P2222 | |
| Sigma-Aldrich | |||
| Sigma-Aldrich | |||
| Glicose-6-fosfato | Sigma-Aldrich | G7250 | |
| SDS | Sigma-Aldrich | L4390 | |
| Ácido ascórbico | Sigma-Aldrich | A5960 | |
| TCA | Sigma-Aldrich | T9159 | |
| Molibdato de amônio | Sigma-Aldrich | A1343 | |
| Citrato de sódio | Sigma-Aldrich | S1804 | |
| Arseniato de sódio | Sigma-Aldrich | S9663 |
Referências
- Turner, B. L., Frossard, E., Baldwin, D. S. . Organic phosphorus in the environment. , (2005).
- Murphy, J., Riley, J. P. A modified single solution method for determination of phosphate in natural waters. Anal. Chim. Acta. 27, 31-36 (1962).
- Dick, W. A., Tabatabai, M. A. Determination of orthophosphate in aqueous solutions containing labile organic and inorganic phosphorus compounds. J. Environ. Qual. 6, 82-85 (1977).
- He, Z., Toor, G. S., Honeycutt, C. W., Sims, J. T. An enzymatic hydrolysis approach for characterizing labile phosphorus forms in dairy manure under mild assay conditions. Bioresour. Technol. 97, 1660-1668 (2006).
- He, Z., Honeycutt, C. W. A modified molybdenum blue method for orthophosphate determination suitable for investigating enzymatic hydrolysis of organic phosphates. Commun. Soil Sci. Plant Anal. 36, 1373-1383 (2005).
- Cade-Menun, B. J. Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy. Talanta. 66, 359-371 (2005).
- Johnson, N. R., Hill, J. E. Phosphorus species composition of poultry manure-amended soil using high-throughput enzymatic hydrolysis. Soil Sci. Soc. Am. J. 74, 1786-1791 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados