É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese assistida por microondas, um pote de N-Succinimidyl-4-[ 18 F] fluorobenzoate ([ 18 F] SFB)
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A fácil, um pot-síntese da N-succinimidyl-4-[ 18 F] fluorobenzoate ([ 18 F] SFB) foi desenvolvido com base em um processo não aquoso radioquímica, em três etapas. Utilizando aquecimento por microondas, todo o procedimento pode ser concluído em menos de 30 min, ou 60 min, com posterior purificação por HPLC preparativa. A decadência corrigida rendimentos radioquímica (RCYs) foram 35-5% (n> 30).
Resumo
Biomoléculas, incluindo peptídeos, proteínas 09/01, 10,11 e anticorpos e seus fragmentos de engenharia, 12-14 estão ganhando importância tanto como terapêutica em potencial e agentes de imagem molecular. Nomeadamente, quando marcadas com radioisótopos emissores de pósitrons, (por exemplo, Cu-64, Ga-68 ou F-18), eles podem ser usados como sondas para a imagem latente alvo de muitos processos fisiológicos e patológicos. 15-18 Portanto, esforço significativo tem dedicada à síntese e exploração de 18 F-rotulados biomoléculas. Embora haja exemplos elegante dos 18 F-rotulagem direta de peptídeos, 19-22 condições de reação dura (ou seja, orgânica pH, solvente extrema, alta temperatura) associado com radiofluorination diretos são geralmente incompatíveis com amostras de proteínas frágil. Até o momento, portanto, a incorporação do fármaco grupos prostéticos em biomoléculas continua sendo o método de escolha 23,24.
N-Succinimidyl-4-[18 F] fluorobenzoate ([18 F] SFB), 25-37 um reagente tipo Bolton-Hunter que reage com os grupos amino primários de biomoléculas, é um muito versátil grupo prostético para os 18 F-rotulagem de um amplo espectro de entidades biológicas, em termos de sua evidente estabilidade in vivo e rendimento de radiomarcação alta. Após a marcação com [18 F] SFB, o que resulta [18 F] biomoléculas fluorobenzoylated poderiam ser exploradas como marcadores PET potencial para estudos in vivo de imagens. Most 1 [18 F] radiosyntheses SFB descrito nas literaturas atuais requerem dois ou até três reatores e purificações múltiplas usando extração em fase sólida (SPE) ou cromatografia líquida (HPLC). Tais processos longos dificultam a sua produção de rotina e aplicações difundidas na marcação radioactiva de biomoléculas. Apesar de vários módulo assistida [18 F] sínteses SFB foram relatados, 29-32, 41-42 são baseados principalmente em procedimentos complicados e demorados utilizando caro caixas disponíveis comercialmente radioquímica (Tabela 1). Portanto, uma maior simplificação do radiosynthesis de [18 F] SFB utilizando uma configuração de baixo custo seria muito benéfico para a sua adaptação a um processo automatizado.
Relata-se uma preparação concisa de [18 F] SFB, com base em uma versão simplificada um pot-síntese assistida por microondas, (Figura 1). A nossa abordagem não exige purificação entre as etapas ou qualquer reagentes aquosos. Além disso, a irradiação de microondas, que tem sido usado na síntese de vários marcadores PET, 38-41 pode dá RCYs maior e melhor seletividade do que as reações correspondentes térmica ou eles fornecem rendimentos semelhantes em tempos de reação mais curtos. 38 Mais importante, quando rotulagem biomoléculas , o tempo economizado poderia ser desviado para bioconjugation subseqüente ou passo de imagem PET 28,43 novidade de nosso melhor [18 F] síntese SFB é duplo: (1). estratégia desproteção anidro não requer purificação dos intermediários (s) entre cada etapa e (2) o forno de microondas, transformações radioquímica permitir a produção rápida e confiável de [18 F] SFB.
Protocolo
1. Preparativos iniciais
- Um frasco de V-(5-mL) RV1 (com agitação bar) é usado como vaso de reação principal para a realização de síntese de microondas. Ele é conectado a um adaptador de PEEK com sete entrada / saída portas conecta e colocado dentro da cavidade de microondas (ver figura 2). RV2 está ligado ao cartucho de SPE (I) para recolher o crude [18 F] SFB. RV3 está ligado ao cartucho de SPE (II) para coletar o final [18 F] solução SFB. Ele pode ser colocado em um banho de água quente (40 ° C) para concentrar a solução correspondente antes de reconstituir em tampão PBS, especialmente para a radiomarcação a jusante de biomoléculas.
- Configuração para a recolha de crude [18 F] SFB: Encha MeCN / H 2 O [6 mL; 1:4 (v: v)] solução, 5% ácido acético aquoso (8 mL), MeCN (2 mL) para reservatório A, B e C, respectivamente. Em seguida, ativar um cartucho de SPE (I) (poliestireno, Merck LiCholut PT) com etanol (10 mL), seguido por 5% ácido acético aquoso de lavar (10 mL).
- Configuração para a coleta purificada [18 F] SFB: Prepare reservatório D e E preenchida com 10 ml de H 2 O e 3 ml de éter etílico, respectivamente. O segundo cartucho de SPE (II) (poliestireno, Merck LiCholut PT) é ativado pelo mesmo procedimento mencionado acima.
- Iniciar o HPLC (eluição buffer: MeCN / H 2 O, 1:1 (v / v) contendo 0,2% TFA; taxa de fluxo: 3 ml / min) para o condicionamento pré-coluna HPLC [a coluna em fase reversa semi-prep (Luna, 5 mm C18 (2) 100 A, 250 x 10 mm), Phenomenex, Torrance, CA, EUA].
2. Preparação de secas [isto é, não portadora agregado, (NCA)] [18 F] flúor
- [18 F] flúor na solução [18 O] H 2 O (100 mL) foi adicionado a uma mistura de Kryptofix 222 (20 mg), 1M aquoso K 2 CO 3 (26 mL) e MeCN (0,8 mL) em um Eppendorf tubo. Toda a solução é então misturado bem antes de transferir para a via de entrada de linha RV1 1. [18 F] flúor solução também pode ser passado através de um cartucho de troca aniônica (por exemplo, QMA-light Sep-Pak de Águas) para prender o flúor-18 e, em seguida eluído com uma mistura de K 2 CO 3 e Kryptofix em MeCN.
- Executar a seqüência de secagem (20W, 3 min), sob o programa de controle de microondas para remover a água residual em RV1 [no vácuo]. Após o resfriamento a temperatura do sistema está abaixo de 50 ° C, MeCN adicionais (1,0 mL) foi introduzido no reator ea seqüência é repetida uma vez.
3. Síntese de etil 4 - [18 F] fluorobenzoate
- Para uma solução de DMSO (0,4 mL) contendo etil 4 - (N, N, N-trimetilamônio) benzoato triflate (1,5 mg) foi adicionado em RV1 via linha de entrada 2.
- Execute a seqüência de Etiquetagem (50W, 1 min) no âmbito do programa de controle de microondas com refrigeração navio mexendo, e todas as válvulas fechadas para pagar etílico 4 - [18 F] fluorobenzoate ([18 F] 2).
4. Síntese de 4 de potássio - [18 F] fluorobenzoate
- Para uma solução de DMSO (0,5 mL) contendo KOtBu (13 mg) foi adicionado em RV1 via linha de entrada 3.
- Executar o programa desproteger (40 W, 1 min) no âmbito do programa de controle de microondas com refrigeração navio mexendo, e todas as válvulas fechadas para arcar com o 4 - [18 F] fluorobenzoate sal ([18 F] 3).
5. Síntese de crude [18 F] SFB
- Para uma solução de acetonitrila (2,5 mL) contendo TSTU (30 mg) foi adicionado em RV1 via linha de entrada 6. TSTU é a umidade e sensível à luz. Deve ser aliquotado em pequeno frasco e armazenados a 4 ° C em um recipiente fechado, cobertas por folhas de alumínio.
- Execute seqüência de acoplamento (30W, 2 min), sob o programa de controle de Microondas com refrigeração navio mexendo, e todas as válvulas fechadas para pagar o crude [18 F] SFB.
6. A Preparação do SPE-purificada [18 F] SFB
- 5% ácido acético aquoso (1,0 mL) foi adicionado em RV1 via linha de entrada 7 para neutralizar a mistura de reação. A solução foi então transferida para B frasco contendo 8 ml de ácido acético 5% aquoso (Figura 2).
- Passe a mistura de reação diluída através de cartucho de SPE (I) para prender crude [18 F] SFB utilizando nitrogênio (10 psi).
- WASH SPE cartucho (I) com uma mistura de MeCN e H 2 O [10 mL, 1:4 (v: v)] do reservatório A.
- [18 F] SFB foi eluída fora em RV2 usando MeCN (2 mL) do reservatório C.
7. Purificação do bruto [18 F] SFB com a Rádio-HPLC
- Diluir ou crude [18 F] SFB ou SPE-purificada [18 F] SFB com H 2 O (2 mL) em RV2 e transferir a mistura para o loop HPLC (5 mL). A solução foi injetado o rádio-HPLC [MeCN / H 2 O, 1:1 (v / v) contendo 0,2% TFA; taxa de fluxo: 3 mL / min].
- Recolher a fração purificada contendo [18 F] SFB (retenção time: 8-10 minutos) no frasco D (pré-cheias com 10 ml de H 2 O) (Figura 2). Etapa crítica: Se realizado corretamente, o volume de fracção recolhida, aqui deve ser ml 4-5.
- Passe a mistura de reação diluída através de cartucho de SPE (II) para prender purificada [18 F] SFB utilizando nitrogênio (10 psi). Seque o cartucho com uma corrente de azoto por 2-3 minutos.
- [18 F] SFB foi eluída com éter dietílico em RV3 usando (3 mL) do reservatório E..
- Evaporar o solvente em RV3 à secura por um fluxo suave de gás nitrogênio (10 psi), utilizando um banho de água (40 ° C). A seca final [18 F] SFB pode ser reconstituído em tampão PBS para a aplicação a jusante.
8. Resultados representativos:
Nós desenvolvemos uma versão simplificada, rápida, um pot-método para a síntese de [18 F] SFB utilizando uma estratégia de desproteção em condições anidro e aquecimento por microondas durante cada transformação radioquímica / química. A Figura 1 apresenta os detalhes de nossa radiosynthesis. A identidade do produto final foi confirmado pela comparação de HPLC tempo de retenção com uma referência SFB não-radioativo. A purificada [18 F] SFB também foi analisada por meio de rádio-TLC e-HPLC para determinar a sua pureza radioquímica e química. O RCY de [18 F] SFB foi de 35 ± 5% em 60 min após HPLC purificação (n> 30), com alta pureza radioquímica (> 99%) e pureza química boa (veja o traço UV no perfil HPLC, a Figura 3 ). A atividade específica foi ca. 67-330 GBq / mmol (1,8-9,0 Ci / mmol), dependendo da radioatividade de partida.

Figura 1. Microondas assistida radiosynthesis um pot-de [18 F] SFB. Primeiro, o radiofluorination de etil 4 - (N, N, N-trimetilamônio) benzoato triflate (1) foi realizada sob aquecimento por microondas (50 W, 1 min) na presença de [K ⊃ 2.2.2] [18 F] F - complexos em dimetilsulfóxido (DMSO) para pagar etílico 4 - [18 F] fluorobenzoate ([18 F] 2). Sem purificação, uma solução de DMSO de potássio terc-butóxido (t BuOK) foi adicionado ea reação foi navio de microondas irradiada (40 W, 1 min) para concluir a desproteção anidro. A conversão final do [18 F] 3 em [18 F] SFB foi realizada com O-(N-succinimidyl) - N, N, N ', N' tetramethyluronium-tetrafluorborato ativação (TSTU). TSTU em acetonitrila foi adicionado à mistura de reação contendo o 4 - [18 F] fluorobenzoate ([18 F] 3) de sal; esta última etapa sintética rendeu bruto [18 F] SFB após o aquecimento (30 W, 2 min).

Figura 2. O esquema de instalação para forno de microondas, um pot-[18 F] síntese SFB.
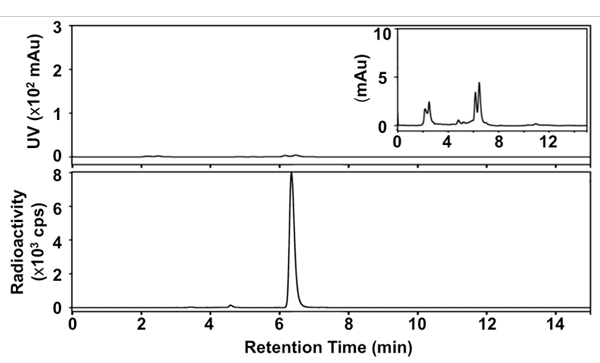
Figura 3. Radio-HPL cromatogramas da final [18 F] SFB. Top: sinal de UV a 254 nm; inferior: sinal radioativo; inset: UV sinal em 254 nm (33,3 x).
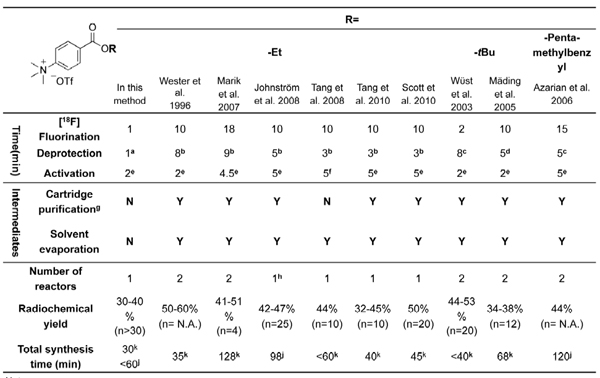
. Tabela 1 Resumo da [18 F] radiosyntheses SFB relatados na literatura usando alquila 4 - (trimetilamônio) triflate benzoato como precursores.
Discussão
Este simplificado de três etapas, um pot-radiosynthesis dos 18 reagente F-acilação [18 F] SFB é desenvolvido com base em não-aquosos química. Este processo tem excelente reprodutibilidade e pode ser usado de forma confiável para a produção de [18 F] SFB em módulos radioquímica automatizada, devido a duas modificações-chave descritas como seguintes: 1. Nós empregamos um passo desproteção / saponificação no sistema KOtBu / DMSO anidro para substituir a solução aquosa de...
Divulgações
Agradecimentos
Este estudo foi financiado pelo Departamento de Energia dos EUA (DE-FG02-09ER09-08 e DE-PS02-09ER09-18), a Jonsson Comprehensive Cancer Center da UCLA, e da Indústria-Universidade Programa Cooperativo de Pesquisa (UC Discovery Grant, bio07 -10665). Agradecemos ao Dr. Nagichettiar Satyamurthy e equipes no Centro de UCLA Cyclotron Biomédica para fornecer o F-18 radioisótopos e discussões perspicaz muitos. Agradecemos a drs. Michael Collins, Greg Leblanc, Joseph Lambert, e Keller Barnhardt de CEM para os seus conselhos e apoio técnico. Agradecemos a Dirk Williams, Darin Williams, os drs. Joseph Lin Hong Dun, e Michael van Dam para peças de design e de usinagem para modificar o reator de microondas CEM e para os módulos de purificação SPE.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| ácido acético em solução aquosa (5%, v / v) | Pescador | A38-500 | Preparado em nosso laboratório |
| Acetonitrila | Sigma-Aldrich | 75-05-8 | |
| Éter etílico | Sigma-Aldrich | 14775 | |
| Dimetilsulfóxido (DMSO) | Sigma-Aldrich | 472301 | |
| Etílico 4 - (N, N, N-trimetilamônio) benzoato triflate | Preparadas em laboratório | ||
| 4,7,13,16,21,24-Hexaoxa-1 ,10-diazabiciclo [8.8.8] hexacosane (K222) | Sigma-Aldrich | 29,111-0 | |
| O - (N-succinimidyl) - N, N, N ', N' tetramethyluronium-tetrafluorborato (TSTU) | Sigma-Aldrich | 105832-38-0 | |
| Carbonato de potássio em solução aquosa (1M) | Sigma-Aldrich | 209619 | Preparado em nosso laboratório |
| Tert-butóxido de potássio | Sigma-Aldrich | 156671 |
Referências
- Okarvi, S. M. Recent progress in fluorine-18 labeled peptide radiopharmaceuticals. Eur. J. Nucl. Med. 28, 929-938 (2001).
- Chen, X. Y., Park, R., Hou, Y. P., Khankaldyyan, V., Gonzales-Gomez, I., Tohme, M., Bading, J. R., Laug, W. E., Conti, P. S. MicroPET imaging of brain tumor angiogenesis with 18F-labeled PEGylated RGD peptide. Eur. J. Nucl. Med. Mol. Imaging. 31, 1081-1089 (2004).
- Wu, Z., Li, Z. -. B., Chen, K., Cai, W., He, L., Chin, F. T., Li, F., Chen, X. MicroPET of tumor integrin αvβ3 expression using 18F-labeled PEGylated tetrameric RGD peptide. J. Nucl. Med. 49, 1536-1544 (2007).
- Cheng, D., Yin, D., Zhang, L., Li, G., Wang, M., Li, S., Zheng, M., Cai, H., Wang, Y. Radiolabeling and in vitro and in vivo characterization of [18F]FB-[R8,15,21, L17]-VIP as a PET imaging agent for tumor over-expressed VIP receptors. Chem. Biol. Drug Des. 68, 319-325 (2006).
- Cheng, D., Yin, D., Zhang, L., Wang, M., Li, G., Wang, Y. Preparation of the novel fluorine-18-labeled VIP analog for PET imaging studies using two different synthesis methods. J. Fluorine Chem. 128, 196-201 (2007).
- Fredriksson, A., Johnstroem, P., Stone-Elander, S., Jonasson, P., Nygren, P. -. A., Ekberg, K., Johansson, B. -. L., Wahren, J. Labeling of human C-peptide by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. J. Label. Compd. Radiopharm. 44, 509-519 (2001).
- Bergmann, R., Scheunemann, M., Heichert, C., Mäding, P., Wittrisch, H., Kretzschmar, M., Rodig, H., Tourwe, D., Iterbeke, K., Chavatte, K. Biodistribution and catabolism of 18F-labeled neurotensin(8-13) analogs. Nucl. Med. Biol. 29, 61-72 (2002).
- Guenther, K. J., Yoganathan, S., Garofalo, R., Kawabata, T., Strack, T., Labiris, R., Dolovich, M., Chirakal, R., Valliant, J. F. Synthesis and in vitro evaluation of 18F- and 19F-labeled insulin: a new radiotracer for PET-based molecular imaging studies. J. Med. Chem. 49, 1466-1474 (2006).
- Zhang, X., Cai, W., Cao, F., Schreibmann, E., Wu, Y., Wu, J. C., Xing, L., Chen, X. 18F-labeled bombesin analogs for targeting GRP receptor-expressing prostate cancer. J. Nucl. Med. 47, 492-501 (2006).
- Murakami, Y., Takamatsu, H., Taki, J., Tatsumi, M., Noda, A., Ichise, R., Tait, J. F., Nishimura, S. 18F-labelled annexin V: a PET tracer for apoptosis imaging. Eur. J. Nucl. Med. Mol. Imaging. 31, 469-474 (2004).
- Yagle, K. J., Eary, J. F., Tait, J. F., Grierson, J. R., Link, J. M., Lewellen, B., Gibson, D. F., Krohn, K. A. Evaluation of 18F-annexin v as a PET imaging agent in an animal model of apoptosis. J. Nucl. Med. 46, 658-666 (2005).
- Vaidyanathan, G., Zalutsky, M. R. An improved synthesis of N-succinimidyl 4-[18F]fluorobenzoate and its application to the labeling of a monoclonal antibody fragment. Bioconjugate Chem. 5, 352-356 (1994).
- Garg, P. K., Garg, S., Zalutsky, M. R. Fluorine-18 labeling of monoclonal antibodies and fragments with preservation of immunoreactivity. Bioconjugate Chem. 2, 44-49 (1991).
- Cai, W., Olafsen, T., Zhang, X., Cao, Q., Gambhir, S. S., Williams, L. E., Wu, A. M., Chen, X. PET imaging of colorectal cancer in xenograft-bearing mice by use of an 18F-labeled T84.66 anti-carcinoembryonic antigen diabody. J. Nucl. Med. 48, 304-310 (2007).
- Cai, W., Chen, X. Multimodality molecular imaging of tumor angiogenesis. J. Nucl. Med. 49, 113-128 (2008).
- Jong, M. d. e., Breeman, W. A., Kwekkeboom, D. J., Valkema, R., Krenning, E. P. Tumor imaging and therapy using radiolabeled somatostatin analogues. Acc. Chem. Res. 42, 873-880 (2009).
- Fani, M., André, J. P., Maecke, H. R. 68Ga-PET: a powerful generator-based alternative to cyclotron-based PET radiopharmaceuticals. Contrast Media Mol. Imaging. 3, 53-63 (2008).
- Shokeen, M., Anderson, C. J. Molecular imaging of cancer with copper-64 radiopharmaceuticals and positron emission tomography (PET. Acc. Chem. Res. 42, 832-841 .
- McBride, W. J., Sharkey, R. M., Karacay, H. C., D'Souza, A., Rossi, E. A., Laverman, P., Chang, C. -. H., Boerman, O. C., Goldenberg, D. M. A novel method of 18F radiolabeling for PET. J. Nucl. Med. 50, 991-998 (2009).
- Becaud, J., Mu, L., Karramkam, M., Schubiger, P. A., Ametamey, S. M., Graham, K., Stellfeld, T., Lehmann, L., Borkowski, S., Berndorff, D., Dinkelborg, L., Srinivasan, A., Smits, R., Koksch, B. Direct one-step 18F-labeling of peptides via nucleophilic aromatic substitution. Bioconjugate Chem. 20, 2254-2261 (2009).
- Mu, L., Höhne, A., Schubiger, P. A., Ametamey, S. M., Graham, K., Cyr, J. E., Dinkelborg, L., Stellfeld, T., Srinivasan, A., Voigtmann, U., Klar, U. Silicon-based building blocks for one-step 18F-radiolabeling of peptides for PET imaging. Angew. Chem. Int. Ed. 47, 4922-4925 (2008).
- Schirrmacher, R., Bradtmöller, G., Schirrmacher, E., Thews, O., Tillmanns, J., Siessmeier, T., Buchholz, H. G., Bartenstein, P., Wängler, B., Niemeyer, C. M., Jurkschat, K. 18F-labeling of peptides by means of an organosilicon-based fluoride acceptor. Angew. Chem. Int. Ed. 45, 6047-6050 (2006).
- Olberg, D. E., Hjelstuen, O. K., Solbakken, M., Arukwe, J., Karlsen, H., Cuthbertson, A. A novel prosthetic group for site-selective labeling of peptides for positron emission tomography. Bioconjugate Chem. 19, 1301-1308 .
- Wuest, F., Köhler, L., Berndt, M., Pietzsch, J. Systematic comparison of two novel, thiol-reactive prosthetic groups for 18F labeling of peptides and proteins with the acylation agent succinimidyl-4-[18F]fluorobenzoate ([18F]SFB. Amino Acids. 36, 283-295 (2009).
- Vaidyanathan, G., Zalutsky, M. R. Synthesis of N-succinimidyl 4-[18F]fluorobenzoate, an agent for labeling proteins and peptides with 18F. Nat. Protocols. 1, 1655-1661 .
- Guhlke, S., Coenen, H. H., Stöcklin, G. Fluoroacylation agents based on small N.C.A. [18F]fluorocarboxylic acids. Appl. Radiat. Isot. 45, 715-727 (1994).
- Wester, H. J., Hamacher, K., Stöcklin, G. A comparative study of N.C.A. Fluorine-18 labeling of proteins via acylation and photochemical conjugation. Nucl. Med. Biol. 23, 365-372 (1996).
- Wüst, F., Hultsch, C., Bergmann, R., Johannsen, B., Henle, T. Radiolabeling of isopeptide NE epsilon-(γ-glutamyl)-L-lysine by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. Appl. Radiat. Isot. 59, 43-48 (2003).
- Zijlstra, S., Gunawan, J., Burchert, W. Synthesis and evaluation of a 18F-labelled recombinant annexin-V derivative, for identification and quantification of apoptotic cells with PET. Appl. Rad. Isot. 58, 201-207 (2003).
- Mäding, P., Füchtner, F., Wüst, F. Module-assisted synthesis of the bifunctional labeling agent N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB. Appl. Rad. Isot. 63, 329-332 (2005).
- Marik, J., Sutcliffe, J. L. Fully automated preparation of N.C.A. 4-[18F]fluorobenzoic acid and N-succinimidyl 4-[18F]fluorobenzoate using a Siemens/CTI chemistry process control unit (CPCU). Appl. Rad. Isot. 65, 199-203 (2007).
- Johnström, P., Clark, J. C., Pickard, J. D., Davenport, A. P. Automated synthesis of the generic peptide labelling agent N-succinimidyl 4-[18F]fluorobenzoate and application to 18F-label the vasoactive transmitter urotensin-II as a ligand for positron emission tomography. Nucl. Med. Biol. 35, 725-731 (2008).
- Tang, G., Zeng, W. B., Yu, M. X., Kabalka, G. Facile synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for protein labeling. J Label. Compd. Radiopharm. 51, 68-71 .
- Azarian, V., Gangloff, A., Seimbille, Y., Delaloye, S., Czernin, J., Phelps, M. E., Silverman, D. H. S. Synthesis and liposome encapsulation of a novel 18F-conjugate of ω-conotoxin GVIA for the potential imaging of N-type Ca2+ channels in the brain by positron emission tomography. J. Label. Compd. Radiopharm. 49, 269-283 (2006).
- Toretsky, J., Levenson, A., Weinberg, I. N., Tait, J. F., Uren, A., Mease, R. C. Preparation of F-18 labeled annexin V: a potential PET radiopharmaceutical for imaging cell death. Nucl. Med. Biol. 31, 747-752 (2004).
- Glaser, M., Arstad, E., Luthra, S. K., Robins, E. G. Two-step radiosynthesis of [18F]N-succinimidyl-4-fluorobenzoate ([18F]SFB. J. Label. Compd. Radiopharm. 52, 327-330 (2009).
- Carroll, M., Yan, R., Aigbirhio, F., Soloviev, D., Brichard, L. The first nucleophilic synthesis of 3-[18F]fluoroethylbenzoate. J. Nucl. Med. 49, 303P-303P (2008).
- Stone-Elander, S., Elander, N. Microwave application in radiolabeling with short-lived positron-emitting radionuclides. J. Label. Compd. Radiopharm. 45, 715-746 (2002).
- Guo, N., Alagille, D., Tamagnan, G., Price, R. R., Baldwin, R. M. Microwave-induced nucleophilic [18F]fluorination on aromatic rings: synthesis and effect of halogen on [18F]fluoride substitution of meta-halo (F, Cl, Br, I)-benzonitrile derivatives. Appl. Rad. Isot. 66, 1396-1402 (2008).
- Mandap, K. S., Ido, T., Kiyono, Y., Kobayashi, M., Lohith, T. G., Mori, T., Kasamatsu, S., Kudo, T., Okazawa, H., Fujibayashi, Y. Development of microwave-based automated nucleophilic [18F]fluorination system and its application to the production of [18F]flumazenil. Nucl. Med. Biol. 36, 403-409 (2009).
- Scott, P. J. H., Shao, X. Fully automated, high yielding production of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB), and its use in microwave-enhanced radiochemical coupling reactions. J. Label. Compd. Radiopharm. 53, 586-591 (2010).
- Tang, G., Tang, X., Wang, X. A facile automated synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for 18F-labeled cell-penetrating peptide as PET tracer. J. Label. Compd. Radiopharm. 53, 543-547 (2010).
- Olma, S., Liu, K., Chen, Y. -. C., Dam, R. v. a. n., Shen, C. K. -. F. Microfluidic Droplet Mixer for Fluorine-18 Labeling of Biomolecules. J. Label. Compd. Radiopharm. 52, S10-S10 (2009).
- Olma, S., Lambert, J., Barnhardt, E., Liu, K., Shen, C. K. -. F., van Dam, R. A compact microwave system for rapid, semi-automated radiosyntheses. J. Label. Compd. Radiopharm. 52, S509-S509 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados