É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Site-specific Engenharia cromossomo bacteriano: ΦC31 Integrase Mediated Cassette Exchange (IMCE)
Neste Artigo
Resumo
Um método rápido e eficiente para integrar DNA estranho de juros em cepas pré-fabricados receptoras, chamadas de tensões almofada de aterragem, é descrito. O método permite site-specific integração de uma cassete de ADN no locus engenharia aterragem almofada de uma estirpe dada, por meio de conjugação e expressão da integrase ΦC31.
Resumo
O cromossoma bacteriano pode ser utilizado para manter de forma estável de ADN estranho na gama mega-base 1. Integração no cromossoma contorna questões tais como a replicação do plasmídeo, a estabilidade do plasmídeo, a incompatibilidade do plasmídeo, e variância número plasmídeo de cópia. Este método utiliza a integrase site-specific a partir do fago de Streptomyces (Φ) C31 2,3. A integrase ΦC31 catalisa uma recombinação direta entre dois sítios de DNA específicas: attB e attP (34 e 39 pb, respectivamente) 4. Esta recombinação é estável e não revertem 5. A "pista" sequência (LP), constituído por um gene de resistência à espectinomicina, aadA (SPR), ea E. gene coli ß-glucuronidase (uidA) ladeado por sites attP foi integrado nos cromossomos de Sinorhizobium meliloti, anthropi Ochrobactrum e Agrobacterium tumefaciens em uma região intergênica, a ampC locus, eo locus Teta, respectivamente. S. meliloti é usado neste protocolo. Vectores de dadores contendo locais attB mobilizável que flanqueiam um stuffer vermelho fluorescente proteína do gene (SDP) e um gene de resistência a antibiótico também têm sido construída. Neste exemplo, o pJH110 resistente gentamicina plasmídeo é usado. O gene rfp 6 pode ser substituída com uma construção desejada utilizando Sph I e Pst I. Alternativamente um construto sintético flanqueado por sítios attB podem ser sub-clonado num vector mobilizável, tais como pK19mob 7. A expressão do gene da integrase ΦC31 (clonado a partir de pHS62 8) é conduzida pelo promotor lac, em uma ampla gama de hospedeiros mobilizável plasmídeo pRK7813 9.
Um protocolo de acasalamento tetraparental é usado para transferir a cassete de doador na estirpe LP substituindo assim os marcadores na sequência de LP com a cassete de dador. Estas células são trans-integrantes. Trans-integrantes são formados com uma eficiência típica de 0,5%. Trans-integrantes são tipicamente encontrados nos primeiros 500-1,000 colónias filtradas através da sensibilidade aos antibióticos ou azul-branco rastreio utilizando 5-bromo-4-cloro-3-indolil-beta-D-glucurónico ácido (X-gluc). Este protocolo contém os procedimentos de acasalamento e de seleção para criar e isolar trans-integrantes.
Protocolo
1. Produção de Cultura
- Preparar meios líquidos estéreis: TY 10 (5 g / l de triptona, extracto de levedura 3 g / l, 0,44 g / l de cloreto de cálcio hidratado), e LB 11 (10 g / l de triptona, 5 g de extracto de levedura / l, 5 g / cloreto de sódio, pH 7).
- Inocular a partir de uma única colônia: SmUW227 (S. meliloti LP-deformação: a construção será descrito em outro lugar, a estirpe detalhes de construção disponíveis mediante solicitação) () em 5 ml de TY media com 50 mg / ml espectinomicina. Inocular as seguintes estirpes em 5 ml de meio líquido LB, que complementa com o antibiótico dado: E. coli DH5a 12 contendo pJC2, a expressão da integrase plasmídeo, com 10 ug / ml de tetraciclina; E. coli MT616 13, o mobilizador, com 10 ug / ml de cloranfenicol; e E. coli DH5a contendo pJH110, a cassete de plasmídeo dador, com 5 ug / ml de gentamicina.
- Incubar E. cepas de Escherichia durante a noite a 37 e°; C com agitação constante. Incubar S. meliloti estirpe a 30 ° C durante dois dias, com agitação. É possível obter uma S. meliloti cultura durante a noite com uma maior inoculo (1:500 subcultura de uma cultura saturada).
2. Preparação Cultura e Mixing
- Lavar 1,5 ml de cultura para cada estirpe, recolhendo o sedimento de células por centrifugação a 17.000 xg durante 30 segundos e ressuspensão em 1 ml estéril NaCl 0,85%; repetição uma vez.
- Ressuspender o sedimento em 100 uL de estéril NaCl 0,85%.
- Individualmente manchar 10 ul de cultura lavada para cada estirpe em uma placa de agar TY liso. Estes pontos são pontos de controle.
- Adicionar 40 ul de cada estirpe excluindo a E. coli DH5a 12 contendo pJC2 num tubo estéril, mistura, e uL local 120 desta mistura sobre uma placa de agar TY liso. Este ponto é o controle não integrase-negativo.
- Adicionar 40 ul de cada estirpe em um t estérilube, misturar, e ponto 160 ul desta mistura em um prato simples de ágar TY. Este ponto é o local de acasalamento IMCE.
- Permitir pontos para secar em uma capela de fluxo laminar.
- Placas de vedação e incubar a 30 ° C durante a noite.
3. Isolamento de Trans-integrantes
- Manchas de registo contínuo de controlo e no local IMCE em placas de agar TY suplementado com 200 ug / ml de estreptomicina (SmUW227 baseia-se na Rm1021 que transporta uma mutação que confere alto nível de resistência à estreptomicina 14) e gentamicina 30 ug / ml.
- Para o cálculo da eficiência IMCE, ressuspender aproximadamente ¼ do local de acasalamento IMCE em 500 ul de NaCl 0,85% estéril. Fazer 10 diluições em série de 10 -7. Diluições placa 10 por meio de 10 -5 -2 em placas de agar TY suplementado com 200 ug / ml de estreptomicina e 30 ug / ml de gentamicina, à selecção de trans-integrantes. Diluições placa 10 thr -3ough 10 -7 em placas de agar TY suplementado com 200 ug / ml de estreptomicina, para seleccionar para ambos os trans-integrantes e potenciais receptores, isto é, receptores totais.
- Para o isolamento de markerless trans-integrantes ressuspender aproximadamente um quarto do local de acasalamento IMCE em 500 uL de estéril NaCl 0,85%. Fazer 10 diluições em série de 10 -6. Diluições placa 10 -4 a 10 -6 em quatro placas de agar TY suplementado com 200 ug / ml de estreptomicina e 200 ug / ml X-gluc.
- Incubar as placas a 30 ° C durante 3 dias.
- Visualização RFP trans-integrantes sob luz verde (525 nm) e através de um filtro vermelho (> 610 nm) 15.
- Calcula-se a eficiência IMCE por cento como CFU de trans-integrantes em comparação com o CFU de destinatários totais. Cerca de metade dos trans-integrantes terão sofrido troca cassete verdadeiro tornando-os brancos e espectinomicina sensível.
- Para encontrar os markerless trans-integrantes (waqui o vector dador não contém Gm r como em pJH110) tela para uma colónia branca (um período de incubação prolongada, 1-2 dias adicionais à temperatura ambiente, irá aumentar a diferenciação de colónias por meio de X-gluc, isto é necessário em S. meliloti SmUW227), confirmar a sensibilidade da colónia espectinomicina por triagem de uma placa de agar TY sem antibióticos e uma placa de agar TY contendo 100 ug / ml espectinomicina.
4. Os resultados representativos
Após três dias de incubação em TY suplementado com estreptomicina e gentamicina as estrias de controlo deve ter nenhum crescimento. A raia IMCE deve ter crescimento confluente na raia cabeça e muitas colónias sobre o segundo raia, como visto na Figura 2. A eficiência da integração-trans, expresso como a percentagem de trans-integrantes aos destinatários totais, deve estar no intervalo de 0,5%. Cerca de metade dos trans-integrantes será espectinomicina sensível e brancomostrando que eles foram submetidos a troca de cassetes verdade. Trans-integrantes contendo o testador cassete doador rfp de pJH110 deve exibir fluorescência RFP perceptível quando visto sob luz verde (525 nm) e através de um filtro vermelho (> 610 nm) 15.
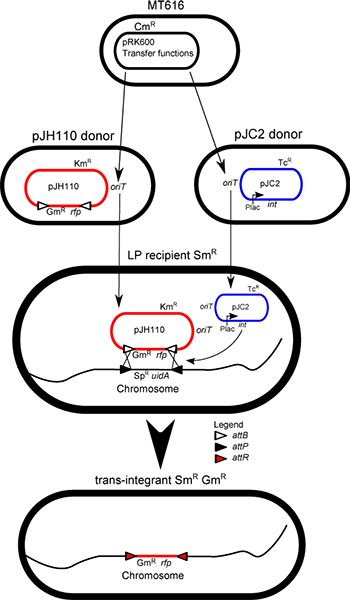
. Figura 1 ilustração mistura Conjugação: Aided pela expressão dos genes de transferência de pRK600, todos os plasmídeos são transferidos aleatoriamente a partir de célula para célula. Esta transferência resulta na criação de trans-integrantes na mistura, por meio de aquisição da estirpe LP-de os dois plasmídeos necessários para IMCE, a integrase (int) pJC2 plasmídeo ajudante eo pJH110 plasmídeo dador. A cassete de dador, do dador não-replicante plasmídeo (pJH110) é transferida através de ΦC31 actividade da integrase com os marcadores do LP-cassete no cromossoma, resultando na perda do LP-marcadores (SpR e uidA) e para a manutenção da cassete de dador (rfp e GM r) na resultante trans-integrante.
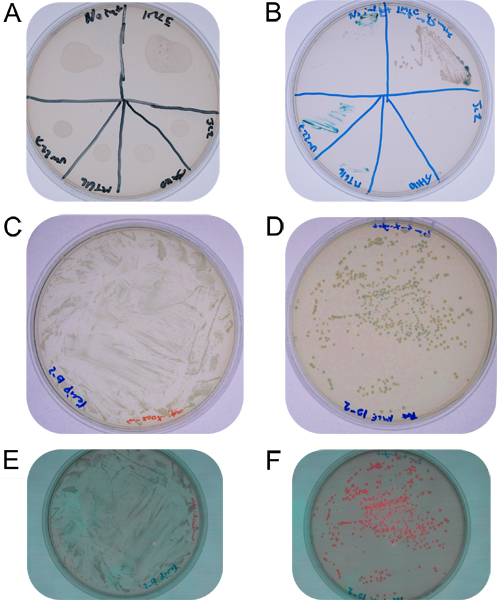
Figura 2. A: B placa de acoplamento mancha sobre uma placa de TY não selectivo mostrando misturas de células secas na superfície de agar:. Manchas listras de acoplamento na placa de estreptomicina-gentamicina-X-gluc, a partir de topo esquerdo no sentido horário nenhum controlo integrase, IMCE em S. meliloti, E. coli DH5a contendo controle pJC2, E. coli DH5a contendo pJH110 controlo, E. controle coli MT616, e S. . meliloti controle UW227 C: 10 diluição -2 de ressuspensão local de acasalamento em TY estreptomicina-X-agar glic D: 10. diluição -2 de ressuspensão local de acasalamento em ágar TY-estreptomicina gentamicina-X-glic (colônias azuis são recombinantes individuais, colônias brancas foram submetidos a verdadetroca cassete) E: 10. diluição -2 de ressuspensão acasalamento mancha na TY agar estreptomicina-X-gluc mostrando a falta de fluorescência F: 10. diluição -2 de ressuspensão local de acasalamento em agar TY-estreptomicina gentamicina-X-gluc mostrando dois níveis de fluorescência (colônias brilhantes correspondem a colônias azuis e têm maior expressão rfp presumivelmente devido ao promotor de leitura que a partir de seqüência do vetor, onde colônias ter sido submetido a verdadeiro troca-cassete conter RFP com apenas promotor sua imediata sem leitura por meio do promotor lac em o vector, que está ausente.).
Discussão
A técnica IMCE permite a eficiente integração de uma cassete de ADN único attB flanqueada no LP-locus de uma estirpe previamente manipulada. Uma vez que a construção desejada é clonado no lugar de rfp para criar a cassete de dador, a técnica não requer purificação de ADN e transformação subsequente, o que torna muito robusta. É crítico que controla o crescimento adequados estão incluídos, para ser determinada a resistência a antibióticos é devido à criação de trans-integrantes e ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Para Margaret CM Smith por gentilmente fornecer o clone integrase
Apoio financeiro de:
Genoma Canadá / Genoma Prairie
NSERC Discovery e subsídios projeto estratégico
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Estreptomicina | Bioshop Canada Inc. | STP101 | |
| Espectinomicina | Bioshop Canada Inc. | SPE201 | |
| Gentamicina | Bioshop Canada Inc. | GTA202 | |
| Choramphenicol | Bioshop Canada Inc. | CLR201 | |
| Tetraciclina | Bioshop Canada Inc. | TET701 | |
| Canamicina | Bioshop Canada Inc. | KAN201 | |
| Agar grau bacteriológica | Bioshop Canada Inc. | AGR001 | |
| Triptona | Bioshop Canada Inc. | TRP402 | |
| Extracto de levedura | Bioshop Canada Inc. | YEX401 | |
| Cloreto de Sódio | Bioshop Canada Inc. | SOD001 | |
| Cloreto de cálcio | Bioshop Canada Inc. | CCL444 | |
| X-gluc | Ouro Biotecnologia Inc. | G1281C1 | |
| E. coli estirpe MT616 | Disponível em cima do pedido | Também é usado fora do nosso laboratório | |
| E. coli estirpe pJC2 | Em casa, disponíveis mediante solicitação | ||
| E. coli estirpe pJH110 | Em casa, disponível por Request | ||
| SmUW227 tensão | Em casa, disponíveis mediante solicitação |
Referências
- Itaya, M., Tsuge, K., Koizumi, M., Fujita, K. Combining two genomes in one cell: Stable cloning of the Synechocystis PCC6803 genome in the Bacillus subtilis 168 genome. Proc. Natl. Acad. Sci. U.S.A. 102, 15971-15976 (2005).
- Kushtoss, S., Rao, R. N. Analysis of the Integration Function of the Streptomycete Bacteriophage FC31. J. Mol. Biol. 222, 897-908 (1991).
- Brown, W. R., Lee, N. C., Xu, Z., Smith, M. C. Serine recombinases as tools for genome engineering. Methods. 53, 372-379 (2011).
- Groth, A. C., Olivares, E. C., Thyagarajan, B., Calos, M. P. A phage integrase directs efficient site-specific integration in human cells. Proc. Natl. Acad. Sci. U.S.A. 97, 5995-6000 (2000).
- Rowley, P. A., Smith, M. C., Younger, E. A motif in the C-terminal domain of FC31 integrase controls the directionality of recombination. Nuc. Acid. Res. 36, 3879-3891 (2008).
- Campbell, R. E. A monomeric red fluorescent protein. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882 (2002).
- Schafer, A. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutumicum. Gene. 145, 69-73 (1994).
- Thorpe, H. M., Smith, M. C. In vitro site-specific integration of bacteriophage DNA catalyzed by a recombinase of the resolvase/invertase family. Proc. Natl. Acad. Sci. 95, 5505-5510 (1998).
- Jones, J. D., Gutterson, N. An efficient mobilizable cosmid vector, pRK7813, and its use in a rapid method for marker exchange in Pseudomonas fluorescens strain HV37a. Gene. 61, 299-306 (1987).
- Beringer, J. E. R Factor transfer in Rhizobium leguminosarum. J. Gen. Microbiol. 84, 188-198 (1974).
- Lennox, E. S. Transduction of linked genetic characters of the host by bacteriophage P1. Virology. 1, 190-206 (1955).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166, 557-580 (1983).
- Charles, T. C., Finan, T. M. Genetic map of Rhizobium meliloti megaplasmid pRmeSU47b. J. Bacteriol. 172, 2469-2476 (1990).
- Leigh, J. A., Signer, E. R., Walker, G. C. Exopolysaccharide-deficient mutants of Rhizobium meliloti that form ineffective nodules. Proc. Natl. Acad. Sci. U.S.A. 82, 6231-6235 (1985).
- Heil, J. R., Nordeste, R. F., Charles, T. C. The fluorescence theatre: a cost-effective device using theatre gels for fluorescent protein and dye screening. Can. J. Microbiol. 57, 339-342 (2011).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97, 6640-6645 (2000).
- Lesic, B., Rahme, L. G. Use of the lambda Red recombinase system to rapidly generate mutants in Pseudomonas aeruginosa. BMC Mol. Biol.. 9, 20-20 (2008).
- Choi, K. -. H., Schweizer, H. P. mini-Tn7 insertion in bacteria with single attTn7 sites: example Pseudomonas aeruginosa. Nat. Protocols. 1, 153-161 (2006).
- Thomason, L. C., Calendar, R., Ow, D. W. Gene insertion and replacement in Schizosaccharomyces pombe mediated by the Streptomyces bacteriophage FC31 site-specific recombination system. Molecular Genetics and Genomics. 265, 1031-1038 (2001).
- Katzen, F. Gateway recombinational cloning: a biological operating system. Expert Opin. Drug Discovery. , 571-586 (2007).
- Charles, T. C., Doty, S. L., Nester, E. W. Construction of Agrobacterium strains by electroporation of genomic DNA and its utility in analysis of chromosomal virulence mutations. Appl. Environ. Microbiol. 60, 4192-4194 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados