É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Purificação de vacúolos patógeno de
Neste Artigo
Resumo
Este artigo descreve um método para o isolamento e purificação de intacta Legionella Contendo vacúolos (VCL) da ameba e macrófagos. O protocolo de dois passos compreende enriquecimento LCV por imuno-magnético de separação utilizando um anticorpo contra um marcador LCV bacteriana e mais purificação por centrifugação em gradiente de densidade.
Resumo
O patógeno oportunista Legionella pneumophila é uma bactéria resistente à ameba, que também replica em macrófagos alveolares, assim causando o grave pneumonia "Legionários doença '" 1. Em fagócitos protozoários e de mamíferos, L. pneumophila emprega um mecanismo conservado para formar um específico, compartimento de replicação permissiva, a "Legionella contendo vacúolo" (LCV). Formação requer a LCV bacteriana Icm / Dot tipo de sistema de secreção IV (T4SS), que transloca tantos como 275 "" efectoras proteínas em células hospedeiras. Os efetores manipular proteínas do hospedeiro, bem como lipídios e se comunicar com secreção, organelas endossômicas e mitocondrial 2-4.
A formação de LCVs representa um processo complexo, robusto e redundante, que é difícil de agarrar de uma maneira redutora. Uma abordagem integrativa é necessária para compreender a formação abrangente LCV, incluindo uma análise global do caminhoOgen-host as interações e sua dinâmica temporal e espacial. Como um primeiro passo para este objetivo, LCVs intactos são purificados e analisados por proteômica e lipidomics.
A composição e formação de vacúolos contendo agente patogénico foi investigado por análise proteômica utilizando cromatografia líquida ou 2-D de electroforese em gel acoplado a espectrometria de massa. Vacúolos isolados, quer social discoideum a ameba Dictyostelium solo ou fagócitos mamíferos abrigou Leishmania 5, 6 Listeria, Mycobacterium 7, Rhodococcus 8, 9 ou Salmonella Legionella spp. 10. No entanto, os protocolos de purificação utilizados nestes estudos são demorados e tedioso, em que requerem microscopia electrónica por exemplo, para analisar LCV morfologia, integridade e pureza. Além disso, estes protocolos não exploram características específicas do vacúolo patógeno para enrichment.
O método aqui apresentado supera essas limitações, empregando D. discoideum produzir um marcador fluorescente e LCV por alvo a proteína bacteriana SIDC efectora, que selectivamente âncoras para a membrana LCV ligando-se à fosfatidilinositol 4-fosfato (PtdIns (4) P) 3,11. LCVs são enriquecidos num primeiro passo por imuno-magnético de separação utilizando um anticorpo de afinidade purificada primária contra SIDC e um anticorpo secundário acoplado a esferas magnéticas, seguido de uma segunda etapa por uma centrifugação de gradiente de densidade clássica Histodenz 12,13 (Fig. 1) .
Um estudo do proteoma de VCL isolados de D. discoideum revelou mais de 560 proteínas da célula hospedeira, incluindo proteínas associadas com vesículas fagocíticas, mitocôndrias, ER e de Golgi, bem como vários GTPases, que não têm sido implicados na formação LCV antes de 13. LCVs enriquecido e purificado com oprotocolo descrito aqui pode ser ainda analisada por microscopia (imunofluorescência, microscopia electrónica), métodos bioquímicos (Western blot) e abordagens proteómicos ou lipidomic.
Protocolo
1. Preparativos para isolamento LCV
- Streak a Legionella pneumophila produzir DsRed-Express 13,14 a partir de ações de glicerol em placas de ágar CYE com 5 mg / ml de cloranfenicol (Cam) quatro dias antes do isolamento LCV. Incubar as bactérias a 37 ° C.
- Semente out 1 x 10 7 D. discoideum produzindo GFP-calnexin ou RAW264.7 macrófagos murinos em cultura de tecidos 75 cm 2 balões uma infecção dias antes. Use 10 ml HL5 médio com 20 mcg / mL para D. G418 discoideum e incubar a amebas a 23 ° C. Para RAW264.7 macrófagos usar 10 ml de meio RPMI 1640 suplementado com FCS 10% (inactivado pelo calor) e 1% de glutamina, e cultivar as células a 37 ° C e 5% de CO 2. Use pelo menos três frascos de 75 cm 2 por infecção e amostra (mínimo 6 x 10 7 células).
- Inocule uma cultura durante a noite com L. pneumophila a partir da placa CYE. Pegue um tubo de ensaio 15 mL com 3 mL EJA médioe 5 ug / mL Cam. Inocular com 100 uL de uma suspensão bacteriana para se obter um 600nm OD de 0,1. Incubar a cultura durante a noite sobre uma roda de rotação sobrecarga a 37 ° C durante 21-22 hr.
2. LCV isolamento
- Alterar o meio de D. células discoideum para remover o antibiótico, que iriam interferir com a infecção a seguir.
- Medir a OD da cultura durante a noite. As bactérias devem ter atingido a sua infectividade do pico a uma OD de 600 nm ≥ 3, o que corresponde a 2 x 10 9 bactérias / ml.
- Infectar as células por adição de aproximadamente 500 ul da L. pneumophila cultura durante a noite para as células que crescem em 10 ml HL5 médio (D. discoideum) ou 10 ml de RPMI 1640 (macrófagos). Isto corresponde a uma multiplicidade de infecção (MOI) de 50. Subsequentemente, a infecção é sincronizado por centrifugação das bactérias sobre as células a 500 × g durante 10 min. A centrifugação é seguidopor uma incubação do D. células discoideum a 25 ° C e os macrófagos RAW264.7 a 37 ° C e 5% de CO 2, respectivamente. O tempo de infecção de 1 hr inclui o passo de centrifugação.
- Após a infecção remover o meio e lavar as células uma vez para remover bactérias extracelulares. Use tampão gelado Sorc para D. discoideum e PBS gelado para RAW264.7 macrófagos. Adicionar 3 ml de tampão SH, suplementado com inibidores da protease (Roche) a cada frasco e recolher as células, usando um raspador de células. Reunir as amostras correspondentes em um tubo de ensaio de 15 mL.
- Para a homogeneização da amostra de uso 3 mL de plástico Luer-Lock seringas e da bola de aço inoxidável homogeneizador. Certifique-se de que você trabalha em gelo. Antes de começar, lave o homogeneizador bola com água destilada, para evitar qualquer contaminação detergente e lave-o com gelo tampão HS frio para se livrar de bolhas de ar. Use a bola 8 apuramento mM.
- Encha a 3 mL primeiro no und seringa montá-lo no diae homogeneizador. Pressione a amostra e para trás nove vezes através do homogeneizador. Trocar as seringas em seguida para evitar a contaminação com material não-homogeneizado. Recolha e reunir a amostra homogeneizada num tubo de ensaio de 15 mL e levar uma amostra 150 ul para análise microscópica. Antes de prosseguir com uma amostra diferente desmontar e lavar o homogeneizador de bola.
- Bloquear o homogeneizado com CS 2% ou FCS durante 30 min num agitador em gelo ou em uma roda de sobrecarga de fiação (10-20 rpm) a 4 ° C.
- Após o bloqueio utilizar um anticorpo de afinidade purificada primária contra SIDC (diluição 1:3000) ou contra qualquer outro marcador bacteriana exclusivamente de ligação à membrana LCV. Solução vórtice do anticorpo antes de o adicionar ao homogeneizado. Incubar a amostra durante 1 hora num agitador em gelo ou em uma roda de sobrecarga de fiação (10-20 rpm) a 4 ° C.
- Enquanto isso, prepare o gradiente Histodenz. Use um tubo de ensaio 15 mL por gradiente e três frascos de 75 cm 2 de uma amostra. Abetor, adicionar 5,75 mL de Histodenz 35% para o tubo, e em segundo lugar, cuidadosamente adicionar 5,75 mL de solução a 10% Histodenz no topo. Depois cuidadosamente colocar os tubos na horizontal para baixo por 1 hora.
- Após a incubação do homogeneizado com o reagente de bloqueio e do anticorpo primário, de centrifugação a 600 × g durante 15 min a 4 ° C para sedimentar a amostra. Descartar o sobrenadante e ressuspender o pellet em 1,5 mL de tampão SH. Transferir as amostras a um tubo de ensaio fresco 15 mL e levar uma amostra de 40 ul para análise microscópica mais tarde.
- Incubar a pelete com o anticorpo secundário - MACS cabra anti-coelho IgG grânulos micro (diluição 1:25) - para 30 min num agitador a 4 ° C. Enquanto isso, colocar as colunas no suporte magnético MACS e equilibrar-los com 0,5 mL de tampão HS.
- Subsequentemente, aplicam-se as amostras à coluna. Collect 150 uL do fluxo através de análise microscópica subsequente. Lavar a coluna três vezes com 0,5 mL de tampão SH.
- Remova as colunas de tele ímã e eluato os LCVs com 0,5 mL de tampão HS de imediato squirting. Tomar uma amostra de 20 l para análise microscópica. O passo de purificação por imuno-magnético separação Espera-se que o rendimento por 1 × 10 7 infectado D. células discoideum aproximadamente 1 × 10 6 LCVs intactas, que são cerca de sete vezes enriquecidos no eluído em comparação com o 13 flow-through.
- Colocar os tubos de gradiente Histodenz de volta para uma posição vertical e cuidadosamente carregar o eluato em cima. Centrifugar os tubos a 3350 × g durante 1 hora a 4 ° C.
- Após centrifugação tomar 1,5 mL fracções a partir da parte inferior do tubo de ensaio, utilizando uma pipeta de Pasteur de vidro longo. No total recolher oito fracções, cada um a partir do fundo do tubo. Sem camadas visíveis são observados no gradiente Histodenz contínua. O rendimento mais elevado de LCVs é tipicamente esperado na fracção 4, à razão de 2 × 10 ~ 5 LCVs intactas por 1 × 10 7 emtadas amebas 13. Pequenas quantidades de LCVs também estão presentes nas fracções 3 e 5, respectivamente. Assim, o rendimento global de LCVs purificadas é ~ 1 × 10 6 LCVs intactos por 6 × 10 7 infectado D. células discoideum 13. A recuperação de VCL podem ser realizados à temperatura ambiente (RT), e os LCVs aparecem estável durante várias horas.
3. A análise microscópica das amostras coletadas
- Prepara-se uma de 24 poços de fundo plano placa de cultura de tecido com poli-L-lisina lamelas revestidas.
- Pipetar cada amostra colhida durante a purificação LCV mais 150 uL de cada fracção de gradiente de densidade para a placa de 24 cavidades. Adicionar 0,5 mL de tampão de HS a cada poço para diluir a concentração Histodenz elevada. Depois, centrifugar a placa a 600 × g durante 10 min a 4 ° C. Cuidadosamente remover o sobrenadante e fixar as amostras com paraformaldeído a 4% (PFA) durante 20 min à TA. Após a fixação lavar as amostras duas vezes. Nose Sorc para D. discoideum e PBS para RAW264.7 macrófagos.
- Montar as amostras de GFP-calnexin que expressam D. discoideum, tomadas em diferentes etapas durante LCV isolamento, diretamente no vidro de slides usando Vectashield por exemplo.
- Incubar as amostras de RAW264.7 macrófagos, tomadas em diferentes etapas durante o isolamento VCL, com solução de bloqueio (1% BSA em PBS) durante 10 min à TA. Use um anticorpo anti-SIDC primário para corar as LCVs e incubar durante 1 hora numa câmara húmida à RT (purificado por afinidade de coelho anti-SIDC; 1:1000 em tampão de bloqueio). Subsequentemente, lavar as amostras três vezes com PBS. Incubar com um anticorpo secundário (por exemplo anti-coelho Cy5; 1:200 em solução de bloqueio) durante 30 min numa câmara húmida e escuro à temperatura ambiente. Por fim, lave as amostras três vezes com PBS e montá-los em vidro de slides usando Vectashield por exemplo.
- Integridade, Morfologia e quantidade dos LCVs isoladas de GFP-calnexin expressar D. discoideum ou a partir de RAW264.7 macrófagos são analisados por um microscópio de fluorescência equipado com os filtros adequados.
4. Os resultados representativos
A qualidade e rendimento da purificação LCV por imuno-afinidade de separação e centrifugação em gradiente de densidade pode ser seguido por microscopia de fluorescência (Fig. 1). Uma visão geral das amostras coletadas durante o isolamento LCV de D. discoideu m ou macrófagos é mostrado (Fig. 2). O homogenato de L. pneumophila infectadas fagócitos mostra LCVs intactos, mas também uma grande quantidade de detritos de células e as bactérias extracelulares. Depois de granulação a amostra, a imagem é semelhante ao homogenato, por vezes, uma mais densa de bits. Uma vez que LCVs intactas deve manter a coluna, o fluxo através contém principalmente bactérias extracelulares e restos celulares. Após eluição da amostra a partir da coluna, o eluato contém LCVs intactas em grandes quantidades. Em nossas mãos, o purificati LCV em parece ser mais eficaz para a D. discoideum do que para macrófagos. Em D. discoideum dos vacúolos de agentes patogénicos aparecem redondo eo rendimento de LCVs isoladas é de mais de 10 vezes maior em comparação com os macrófagos (Fig. 3). Em macrófagos intactos SCBV corados com diferentes anticorpos também aparecem mais de forma irregular.
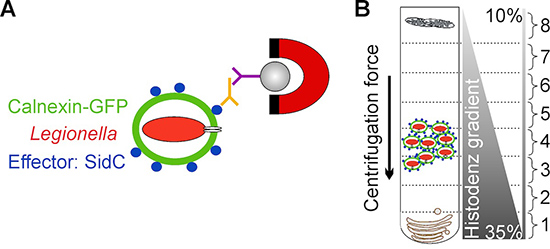
Figura 1. Visão esquemática do isolamento LCV. A) Isolamento de LCVs por imuno-magnético de separação utilizando um anticorpo de afinidade purificada contra a proteína bacteriana SIDC efectora, localizando exclusivamente para a membrana LCV. A secundários MACS micro anticorpo grânulo acoplado e um íman são usadas para isolar LCVs a partir de fragmentos de células. B) Após LCVs imuno-magnéticos de separação são ainda purificado por Histodenz centrifugação em gradiente de densidade. LCVs são enriquecidos na fração de 4.
upload/4118/4118fig2.jpg "/>
Amostras Figura 2. Coletados durante a purificação LCV. Imagens de homogeneizado, pellet, flow-through e eluato de D. discoideum ou macrófagos são representados. As amostras mostram L. pneumophila produzir DsRed-Express (vermelho) em D. discoideum produzindo GFP-calnexin sinal (painel, verde superior) ou em macrófagos corados com um anticorpo anti-SIDC (ciano, painel inferior). Bares, 10 mM.
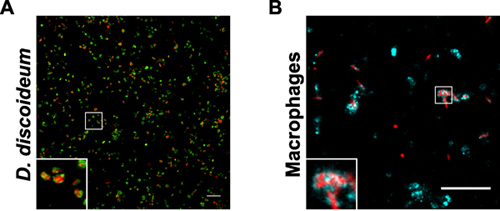
Figura 3. Purificada a partir de LCVs D. discoideum ou macrófagos. As amostras mostram fracção 4, após Histodenz centrifugação em gradiente de densidade de L. pneumophila produzindo DsRed-expresso (vermelho) em (A) D. discoideum produzindo GFP-calnexin sinal (verde) ou (B) em macrófagos corados com um anticorpo anti-SIDC (ciano). Bares, 10 mM.
Discussão
Em contraste com os métodos publicados anteriormente, este protocolo é baseada em dois passos, primeiro a separação dos LCVs por uma abordagem imuno-magnética, e em segundo lugar, a purificação de LCVs por centrifugação em gradiente de densidade. O isolamento LCV pode ser facilmente seguido por microscopia de fluorescência, quando tanto as bactérias fluorescente etiquetado e GFP-produtoras de células ou de coloração de anticorpo é usado. O protocolo aqui descrito é um método simples, hetero-a frente, o ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Pesquisa em nosso laboratório foi suportado pelo Max von Pettenkofer Institute, da Universidade Ludwig-Maximilians de Munique, a Fundação Alemã de Pesquisa (DFG, HI 1511/3-1) eo Bundesministerium für Bildung und Forschung (BMBF) "Genomics Infecção médicos" iniciativa ( 0315834C).
Referências
- Hilbi, H., Hoffmann, C., Harrison, C. F. Legionella spp. outdoors: colonization, communication and persistence. Environ. Microbiol. Rep. 3, 286-296 (2011).
- Zhu, W. Comprehensive identification of protein substrates of the Dot/Icm type IV transporter of Legionella pneumophila. PLoS ONE. 6, e17638 (2011).
- Hilbi, H., Weber, S., Finsel, I. Anchors for effectors: subversion of phospho-inositide lipids by Legionella. Front Microbiol. 2, 91 (2011).
- Hubber, A., Roy, C. R. Modulation of host cell function by Legionella pneumophila type IV effectors. Annu. Rev. Cell Dev. Biol. 26, 261-283 (2010).
- Kima, P. E., Dunn, W. Exploiting calnexin expression on phagosomes to isolate Leishmania parasitophorous vacuoles. Microb. Pathog. 38, 139-145 (2005).
- Lührmann, A., Haas, A. A method to purify bacteria-containing phagosomes from infected macrophages. Methods Cell Sci. 22, 329-341 (2000).
- Sturgill-Koszycki, S., Haddix, P. L., Russell, D. G. The interaction between Mycobacterium and the macrophage analyzed by two-dimensional polyacrylamide gel electrophoresis. Electrophoresis. 18, 2558-2565 (1997).
- Fernandez-Mora, E., Polidori, M., Lührmann, A., Schaible, U. E., Haas, A. Maturation of Rhodococcus equi-containing vacuoles is arrested after completion of the early endosome stage. Traffic. 6, 635-653 (2005).
- Mills, S. D., Finlay, B. B. Isolation and characterization of Salmonella typhimurium and Yersinia pseudotuberculosis-containing phagosomes from infected mouse macrophages: Y. pseudotuberculosis traffics to terminal lysosomes where they are degraded. Eur. J. Cell Biol. 77, 35-47 (1998).
- Shevchuk, O. Proteomic analysis of Legionella-containing phagosomes isolated from Dictyostelium. Int. J. Med. Microbiol. 299, 489-508 (2009).
- Brombacher, E. Rab1 guanine nucleotide exchange factor SidM is a major phosphatidylinositol 4-phosphate-binding effector protein of Legionella pneumophila. J. Biol. Chem. 284, 4846-4856 (2009).
- Urwyler, S., Finsel, I., Ragaz, C., Hilbi, H. Isolation of Legionella-containing vacuoles by immuno-magnetic separation. Curr. Protoc. Cell Biol. Chapter 3, Unit 3 (2010).
- Urwyler, S. Proteome analysis of Legionella vacuoles purified by magnetic immunoseparation reveals secretory and endosomal GTPases. Traffic. 10, 76-87 (2009).
- Mampel, J. Planktonic replication is essential for biofilm formation by Legionella pneumophila in a complex medium under static and dynamic flow conditions. Appl. Environ. Microbiol. 72, 2885-2895 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados