Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Очистка Возбудитель вакуоли с
В этой статье
Резюме
В этой статье описывается метод выделения и очистки интактных Legionella Содержащего вакуоли (LCV) от амебы и макрофагов. Двухступенчатый протокол включает в себя LCV обогащения иммуно-магнитной сепарации с использованием антитела против бактериальных маркеров LCV и дальнейшей очистки центрифугирования в градиенте плотности.
Аннотация
The opportunistic pathogen Legionella pneumophila is an amoeba-resistant bacterium, which also replicates in alveolar macrophages thus causing the severe pneumonia "Legionnaires' disease"1. In protozoan and mammalian phagocytes, L. pneumophila employs a conserved mechanism to form a specific, replication-permissive compartment, the "Legionella-containing vacuole" (LCV). LCV formation requires the bacterial Icm/Dot type IV secretion system (T4SS), which translocates as many as 275 "effector" proteins into host cells. The effectors manipulate host proteins as well as lipids and communicate with secretory, endosomal and mitochondrial organelles2-4.
The formation of LCVs represents a complex, robust and redundant process, which is difficult to grasp in a reductionist manner. An integrative approach is required to comprehensively understand LCV formation, including a global analysis of pathogen-host factor interactions and their temporal and spatial dynamics. As a first step towards this goal, intact LCVs are purified and analyzed by proteomics and lipidomics.
The composition and formation of pathogen-containing vacuoles has been investigated by proteomic analysis using liquid chromatography or 2-D gel electrophoresis coupled to mass-spectrometry. Vacuoles isolated from either the social soil amoeba Dictyostelium discoideum or mammalian phagocytes harboured Leishmania5, Listeria6, Mycobacterium7, Rhodococcus8, Salmonella9 or Legionella spp.10. However, the purification protocols employed in these studies are time-consuming and tedious, as they require e.g. electron microscopy to analyse LCV morphology, integrity and purity. Additionally, these protocols do not exploit specific features of the pathogen vacuole for enrichment.
The method presented here overcomes these limitations by employing D. discoideum producing a fluorescent LCV marker and by targeting the bacterial effector protein SidC, which selectively anchors to the LCV membrane by binding to phosphatidylinositol 4-phosphate (PtdIns(4)P)3,11 . LCVs are enriched in a first step by immuno-magnetic separation using an affinity-purified primary antibody against SidC and a secondary antibody coupled to magnetic beads, followed in a second step by a classical Histodenz density gradient centrifugation12,13 (Fig. 1).
A proteome study of isolated LCVs from D. discoideum revealed more than 560 host cell proteins, including proteins associated with phagocytic vesicles, mitochondria, ER and Golgi, as well as several GTPases, which have not been implicated in LCV formation before13. LCVs enriched and purified with the protocol outlined here can be further analyzed by microscopy (immunofluorescence, electron microscopy), biochemical methods (Western blot) and proteomic or lipidomic approaches.
протокол
1. Подготовка к изоляции LCV
- Подряд из Legionella Pneumophila производства DsRed-Express 13,14 с глицерином акций на CYE пластин агар с 5 мкг / мл хлорамфеникола (Cam) за четыре дня до изоляции LCV. Инкубируйте бактерии при температуре 37 ° C.
- Семенной выход 1 х 10 7 D. discoideum производства GFP-calnexin или RAW264.7 мышиных макрофагов в 75 см 2 ткани культуры колб за день до заражения. Используйте 10 мл HL5 среду с 20 мкг / мл G418 для D. discoideum и инкубировать амеб при 23 ° C. Для RAW264.7 макрофагов использовать 10 мл RPMI 1640 с добавлением 10% FCS (тепло инактивированная) и 1% глютамина, и роста клеток при 37 ° С и 5% CO 2. Используйте по крайней мере три 75 см 2 колбы на инфекции и образец (не менее 6 х 10 7 клеток).
- Инокулировать ночной культуры L. Pneumophila от CYE пластины. Возьмите 15 мл пробирку с 3 мл АЙЕ среднегои 5 мкг / мл Cam. Инокулировать 100 мкл бактериальной суспензии для получения диаметр 600 нм до 0,1. Инкубируйте ночь культуры на накладные расходы вращения колеса при 37 ° С в течение 21-22 часов.
2. LCV изоляции
- Изменение среды D. discoideum клетки, чтобы удалить антибиотик, который будет влиять на следующие инфекции.
- Измерение ОП ночной культуры. Бактерии должны достигли своего пика в инфекционной диаметром 600 нм ≥ 3, что соответствует 2 х 10 9 бактерий / мл.
- Инфицировать клетки, добавив примерно 500 мкл L. Pneumophila ночь культуре клеток, растущих в 10 мл HL5 среды (D. discoideum) или 10 мл RPMI 1640 (макрофагов). Это соответствует множественность заражения (МВД) 50. Затем инфекция синхронизируется путем центрифугирования бактерий на клетках 500 × г в течение 10 мин. Центрифугирования следуетпо инкубации D. discoideum клеток при 25 ° С и RAW264.7 макрофагов при 37 ° С и 5% CO 2, соответственно. Инфекция время 1 час включает в себя центрифугирования шаг.
- После заражения удалить среды и промыть клетки один раз, чтобы удалить внеклеточных бактерий. Используйте ледяной СУРС буфер D. discoideum и ледяным PBS для RAW264.7 макрофагов. Добавьте 3 мл HS буфера, дополненные ингибиторы протеаз (Roche) в каждую колбу и собирает клетки с помощью клетки скребком. Бассейн соответствующие образцы в 15 мл пробирке.
- Для гомогенизации образца использованием 3 мл пластиковых Луер-Лок шприцы и нержавеющей стальной шарик гомогенизатора. Убедитесь, что вы работаете на льду. Перед началом работы мыть шар гомогенизатор с дистиллированной водой, чтобы избежать любых моющих средств загрязнения и промойте его с ледяной буфер HS, чтобы избавиться от пузырьков воздуха. Используйте 8 мкм оформления мяча.
- Заполните первые 3 мл в шприц унд смонтировать его на еэлектронной гомогенизатора. Нажмите образца и обратно девять раз через гомогенизатор. Заменить шприцы впоследствии, чтобы избежать загрязнения с не-гомогенизированный материал. Собрать и объединить усредненного образца в 15 мл пробирке и принимать по 150 мкл образцов для микроскопического анализа. Прежде чем перейти к другой пример разбирать и мыть шар гомогенизатора.
- Блок гомогената с 2% CS и ФТС в течение 30 минут на шейкере со льдом или на накладные расходы, прялка (10-20 мин) при температуре 4 ° C.
- После блокировки использовать аффинно очищенных антител к первичным SIDC (разведение 1:3000) или в отношении любой другой бактериальный маркер исключительно привязка к мембраны легких коммерческих автомобилей. Vortex раствор антител перед добавлением гомогената. Инкубируйте образца в течение 1 часа на качалке на льду или на накладные расходы, прялка (10-20 мин) при температуре 4 ° C.
- В то же время, подготовить градиент Histodenz. Используйте 15 мл пробирке в градиент и три 75 см 2 колбах одного образца. Ельм, добавляют 5,75 мл 35% Histodenz к трубе, а во-вторых, осторожно добавить 5,75 мл 10% Histodenz решением сверху. Затем тщательно заложить трубы горизонтально в течение 1 часа.
- После инкубации гомогената с блокированием реагентов и первичные антитела, центрифуги 600 × г в течение 15 мин при 4 ° С в гранулах образца. Удалите супернатант и ресуспендируют осадок в 1,5 мл буфера HS. Передача образцов новой 15 мл пробирки и принять 40 мкл образца для микроскопического анализа в дальнейшем.
- Инкубируйте гранул с вторичными антителами - MACS козьего анти-IgG кролика микро-шарики (разведение 1:25) - в течение 30 минут на шейкере при температуре 4 ° C. В то же время, поставить колонки на MACS магнитный держатель и уравновешивать их с 0,5 мл буфера HS.
- Впоследствии, применяются образцы столбца. Соберите 150 мкл проточной для последующего микроскопического анализа. Промойте колонку в три раза с 0,5 мл буфера HS.
- Удалить столбцы из тОн магнита и элюата легких коммерческих автомобилей с 0,5 мл буфера HS непосредственным впрыскиванием. Возьмите 20 мл образец для микроскопического анализа. Очистка шаг за иммуно-магнитной сепарации ожидается выход в 1 × 10 7 заражены D. discoideum клетки около 1 × 10 6 нетронутыми легких коммерческих автомобилей, которые в семь раз о обогащенный элюата по сравнению с потоком до 13.
- Положите трубки Histodenz градиент обратно в вертикальное положение и аккуратно загружать элюата на вершине. Центрифуга труб в 3350 × г в течение 1 часа при температуре 4 ° C.
- После центрифугирования взять 1,5 мл фракции, начиная с нижней части пробирки, используя длинный стеклянный пипетки Пастера. Всего собрать восемь фракций, каждая из нижней части трубы. Нет видимых слоев наблюдаются в непрерывный градиент Histodenz. Наибольший выход легких коммерческих автомобилей, как правило, ожидается в часть 4 в соотношении ~ 2 × 10 5 нетронутыми легких коммерческих автомобилей на 1 × 10 7инфицированы амеб 13. Незначительные количества легких коммерческих автомобилей также присутствуют в долях 3 и 5, соответственно. Таким образом, общий выход очищенного легких коммерческих автомобилей составляет ~ 1 × 10 6 нетронутыми легких коммерческих автомобилей в 6 × 10 7 заражены D. discoideum клеток 13. Восстановление легких коммерческих автомобилей могут быть выполнены при комнатной температуре (RT) и легких коммерческих автомобилей появится стабильный в течение нескольких часов.
3. Микроскопический анализ проб
- Подготовка 24-и плоским дном культуры тканей пластины с поли-L-лизин покрытием покровные.
- Пипетировать каждого образца, принятых в ходе очистки LCV плюс 150 мкл каждой фракции градиента плотности в 24-луночного планшета. Добавить 0,5 мл HS буфера в каждую лунку, чтобы разбавить высокая концентрация Histodenz. После центрифуги пластины 600 × г в течение 10 мин при 4 ° C. Осторожно удалите супернатант и исправить образцов с 4% параформальдегид (PFA) в течение 20 мин при комнатной температуре. После фиксации мыть образцы в два раза. Намэлектронной СУРС для D. discoideum и PBS для RAW264.7 макрофагов.
- Установить образцы GFP-calnexin выражения D. discoideum, взятые на разных этапах в течение LCV изоляции, прямо на стекло слайдов с использованием, например Vectashield.
- Инкубируйте образцы RAW264.7 макрофагов, взятых на различных этапах в процессе выделения LCV, блокирующим раствором (1% BSA в PBS) в течение 10 мин при комнатной температуре. Использование анти-SIDC первичных антител к пятно легких коммерческих автомобилей и инкубировать в течение 1 ч во влажной камере при комнатной температуре (аффинно очищенных кроличьих анти-SIDC; 1:1000 в блокирующем буфере). Затем вымыть образцов три раза PBS. Инкубируйте с вторичными антителами (например, анти-кролик Cy5, 1:200 в блокирующем растворе) в течение 30 мин во влажной и темной камере при комнатной температуре. Наконец, промойте образцы три раза PBS и смонтировать их на стекло, слайды, используя, например, Vectashield.
- Морфология, целостность и количество легких коммерческих автомобилей изолированы от GFP-calnexin выражения D. расcoideum или RAW264.7 макрофагов анализируются флуоресцентный микроскоп оснащен адекватной фильтров.
4. Представитель Результаты
Качество и выход очистки LCV по иммуно-близость разделение и центрифугирование градиента плотности можно проследить с помощью флуоресцентной микроскопии (рис. 1). Обзор образцов, собранных во время изоляции LCV от D. discoideu м и макрофагов показано на рисунке (рис. 2). Гомогената Л. Pneumophila-инфицированных фагоцитов показывает нетронутыми легких коммерческих автомобилей, а также много обломков клеток и внеклеточных бактерий. После гранулирования образца, изображение похоже на гомогената, иногда немного плотнее. С нетронутыми легких коммерческих автомобилей должны придерживаться колонки, проточные содержит в основном внеклеточной бактерии и клеточные обломки. После элюирования образца из колонки элюата содержится нетронутыми легких коммерческих автомобилей в больших количествах. В наших руках, LCV purificati по-видимому, более эффективны для D. discoideum, чем для макрофагов. В D. discoideum возбудителя вакуоли появляются круглее и выход изолированных легких коммерческих автомобилей более чем в 10 раз выше по сравнению с макрофагами (рис. 3). В интактных макрофагов СНП окрашивали различные антитела появляются более неправильной формы.
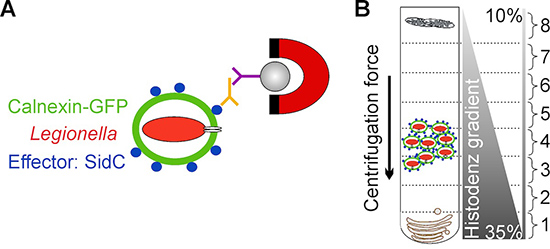
Рисунок 1. Схема обзор изоляции LCV. А) выделение легких коммерческих автомобилей на иммуно-магнитной сепарации использованием аффинно очищенные антитела против бактериальных эффекторных SIDC белков, локализации исключительно мембраны легких коммерческих автомобилей. Микро вторичном MACS шарик связью антитела и магнита используется для изоляции легких коммерческих автомобилей с мобильного мусора. Б) После того, как иммуно-магнитного разделения легких коммерческих автомобилей дополнительно очищают Histodenz центрифугирования в градиенте плотности. Легких коммерческих автомобилей обогащены часть 4.
upload/4118/4118fig2.jpg "/>
Рисунок 2. Проб, взятых во время очистки легких коммерческих автомобилей. Изображения из гомогената, окатышей, проточные и элюата из D. discoideum или макрофагов изображены. Пробы показывают, Л. Pneumophila производства DsRed-Express (красный) в области D. discoideum производства GFP-calnexin сигнала (зеленый, вверху) или в макрофагах окрашенных анти-SIDC антител (голубой, нижняя панель). Бары, 10 мкм.
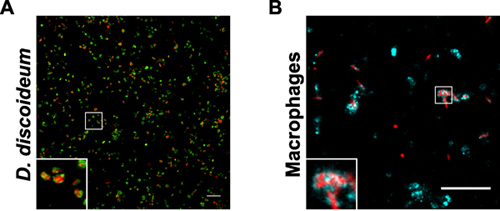
Рисунок 3. Очищенный от легких коммерческих D. discoideum или макрофагов. Пробы показывают, фракция 4 после Histodenz центрифугирования в градиенте плотности Л. Pneumophila производства DsRed-Express (красный) в (A) D. discoideum производства GFP-calnexin сигнала (зеленый) или (B) в макрофагах окрашенных анти-SIDC антител (голубой). Бары, 10 мкм.
Обсуждение
В отличие от ранее опубликованных методов, этот протокол основан на два этапа, первый разделения легких коммерческих автомобилей на иммуно-магнитного подход, а во-вторых, очищение легких коммерческих автомобилей на центрифугирования в градиенте плотности. Изоляция LCV можно легко прос...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Исследования в нашей лаборатории было поддержано Макс фон Петтенкофер Института Людвига-Максимилиана университета Мюнхена, Германское научно-исследовательское общество (DFG, HI 1511/3-1) и Bundesministerium für Bildung унд Forschung (BMBF) "Медицинская геномика инфекция" инициативы ( 0315834C).
Ссылки
- Hilbi, H., Hoffmann, C., Harrison, C. F. Legionella spp. outdoors: colonization, communication and persistence. Environ. Microbiol. Rep. 3, 286-296 (2011).
- Zhu, W. Comprehensive identification of protein substrates of the Dot/Icm type IV transporter of Legionella pneumophila. PLoS ONE. 6, e17638 (2011).
- Hilbi, H., Weber, S., Finsel, I. Anchors for effectors: subversion of phospho-inositide lipids by Legionella. Front Microbiol. 2, 91 (2011).
- Hubber, A., Roy, C. R. Modulation of host cell function by Legionella pneumophila type IV effectors. Annu. Rev. Cell Dev. Biol. 26, 261-283 (2010).
- Kima, P. E., Dunn, W. Exploiting calnexin expression on phagosomes to isolate Leishmania parasitophorous vacuoles. Microb. Pathog. 38, 139-145 (2005).
- Lührmann, A., Haas, A. A method to purify bacteria-containing phagosomes from infected macrophages. Methods Cell Sci. 22, 329-341 (2000).
- Sturgill-Koszycki, S., Haddix, P. L., Russell, D. G. The interaction between Mycobacterium and the macrophage analyzed by two-dimensional polyacrylamide gel electrophoresis. Electrophoresis. 18, 2558-2565 (1997).
- Fernandez-Mora, E., Polidori, M., Lührmann, A., Schaible, U. E., Haas, A. Maturation of Rhodococcus equi-containing vacuoles is arrested after completion of the early endosome stage. Traffic. 6, 635-653 (2005).
- Mills, S. D., Finlay, B. B. Isolation and characterization of Salmonella typhimurium and Yersinia pseudotuberculosis-containing phagosomes from infected mouse macrophages: Y. pseudotuberculosis traffics to terminal lysosomes where they are degraded. Eur. J. Cell Biol. 77, 35-47 (1998).
- Shevchuk, O. Proteomic analysis of Legionella-containing phagosomes isolated from Dictyostelium. Int. J. Med. Microbiol. 299, 489-508 (2009).
- Brombacher, E. Rab1 guanine nucleotide exchange factor SidM is a major phosphatidylinositol 4-phosphate-binding effector protein of Legionella pneumophila. J. Biol. Chem. 284, 4846-4856 (2009).
- Urwyler, S., Finsel, I., Ragaz, C., Hilbi, H. Isolation of Legionella-containing vacuoles by immuno-magnetic separation. Curr. Protoc. Cell Biol. Chapter 3, Unit 3 (2010).
- Urwyler, S. Proteome analysis of Legionella vacuoles purified by magnetic immunoseparation reveals secretory and endosomal GTPases. Traffic. 10, 76-87 (2009).
- Mampel, J. Planktonic replication is essential for biofilm formation by Legionella pneumophila in a complex medium under static and dynamic flow conditions. Appl. Environ. Microbiol. 72, 2885-2895 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены