Method Article
Técnica para as aquisições de fígado de porco e Transplante ortotópico usando um Active Porto-Caval Shunt
Neste Artigo
Resumo
Experimental animal research plays a pivotal role in the development of clinical transplantation practice. The porcine orthotopic liver transplantation model (OLTx) closely resembles human conditions and is frequently used in clinically oriented research. The following protocol contains all information for a reliable porcine OLTx model using an active porto-caval-jugular shunt.
Resumo
The success of liver transplantation has resulted in a dramatic organ shortage. Each year, a considerable number of patients on the liver transplantation waiting list die without receiving an organ transplant or are delisted due to disease progression. Even after a successful transplantation, rejection and side effects of immunosuppression remain major concerns for graft survival and patient morbidity.
Experimental animal research has been essential to the success of liver transplantation and still plays a pivotal role in the development of clinical transplantation practice. In particular, the porcine orthotopic liver transplantation model (OLTx) is optimal for clinically oriented research for its close resemblance to human size, anatomy, and physiology.
Decompression of intestinal congestion during the anhepatic phase of porcine OLTx is important to guarantee reliable animal survival. The use of an active porto-caval-jugular shunt achieves excellent intestinal decompression. The system can be used for short-term as well as long-term survival experiments. The following protocol contains all technical information for a stable and reproducible liver transplantation model in pigs including post-operative animal care.
Introdução
O transplante hepático (transplante hepático ortotópico) é a única opção de tratamento para pacientes com doença hepática em estágio final ou carcinoma hepatocelular avançado. Para os últimos 25 anos, o número de candidatos na lista de espera tem aumentado gradualmente e agora excede em muito o número de enxertos disponíveis. Na maioria das regiões de transplante, de 20 a 30% dos pacientes em lista de espera para transplante de fígado morrem sem receber um transplante de órgão ou são excluídos devido à progressão da doença. Estratégias para aumentar a lista de dadores e, assim, o número de enxertos disponíveis, são desesperadamente necessários. Critérios de alocação de órgãos estendidas, de preservação do enxerto prolongado, e de indução de tolerância imunológica ainda representam grandes desafios clínicos 1-3. Por isso, a investigação experimental transplante hepático ortotópico é fundamental, a fim de otimizar a prática clínica transplante hepático ortotópico.
Porcina transplante hepático ortotópico é um modelo experimental bem estabelecido que se assemelha o transplante hepático ortotópico humana em muitos aspectos, incluindo a Ltamanho iver, anatomia, fisiologia e 4-6. Assim, tornou-se um método experimental padrão em campos de pesquisa, tais como técnicas cirúrgicas, fisiologia, imunologia, preservação e lesão de isquemia-reperfusão. Numerosas técnicas de aquisição de enxerto, hepatectomia destinatário e, em particular, a reconstrução vascular, foram descritos na literatura 5. A escolha da técnica apropriada varia de acordo com a preferência do pesquisador e capacidade técnica.
Em contraste com a situação humana, congestão splanchnic durante a fase anepática representa um problema importante no transplante hepático ortotópico porcino. Isquemia intestinal subsequente e dano vascular congestiva pode causar instabilidade hemodinâmica grave, comprometendo a sobrevivência de porco e, assim, o sucesso da experiência 7-9. Portanto, a descompressão intestinal suficiente é obrigatória, especialmente em ambientes experimentais tecnicamente menos refinados.
Nósing um ativo shunt porto-cava-jugular para a duração da fase de anepática é uma opção confiável para evitar o congestionamento intestinal. O sistema pode ser usado para as experiências iniciais de reperfusão, bem como cenários de sobrevivência a longo prazo. O protocolo a seguir contém todas as informações para um modelo estável e reprodutível transplante de fígado em suínos, incluindo os contratos fígado do doador, operação destinatário, incluindo hepatectomia e técnicas de reconstrução navio end-to-end, e cuidados pós-operatórios.
Protocolo
Todos os animais receberam cuidados de acordo com os '' Princípios do Laboratório Animal Care '' formuladas pela Sociedade Nacional de Pesquisa Médica e da '' Guia para o Cuidado de Animais de Laboratório '' publicado pelo National Institutes of Health, Ontario, Canada . O Comité do Instituto Geral de Toronto Research Animal Care aprovado todos os estudos.
1. Órgão Retrieval
- Casa do sexo masculino porcos Yorkshire entre 30 e 35 kg no centro de pesquisa para uma semana antes do transplante para evitar uma reação física induzida por estresse (que pode alterar o resultado da perfusão 10,11) e para aclimatar os animais para as condições de habitação. Jejuar o porco por um período mínimo de 6 horas antes da indução da anestesia.
- Anestesiar do porco dador por uma injecção intramuscular (im) injecção de uma mistura de cetamina (25 mg / kg), a atropina (0,04 mg / kg) e midazolam (0,15 mg / kg).
- Antes de intubação, garantir o porco respira espontaneamente 2 L de oxigênio doseado com 5% de isoflurano. Em decúbito dorsal, pulverizar as cordas vocais com lidocaína a 2% 2 min antes da intubação para evitar espasmos nas cordas vocais. Para um 35 kg porco, usar um tubo traqueal 6,5 Fr. Bloquear o tubo traqueal com 3-5 ml de ar ambiente.
- Após a intubação, use capnometria para confirmar a intubação correta. Monitorar a freqüência cardíaca e saturação de oxigênio por oximetria de pulso em rabo de porco. Abaixe o vaporizador isoflurano a 2%.
- Ajustar a profundidade de anestesia por valores de concentração alveolar mínima (MAC); apontar para 2-2,5 MAC. Definir o ventilador para 14-16 respirações / min e um volume corrente de 10 - 15 ml / kg de peso corporal.
- Inserir um 18 L intravenosa (iv) do cateter numa das veias da orelha para permitir a infusão de solução de Lactato de Ringer (200 ml / h). Esfregue o porco e cobri-lo com campos estéreis.
- Depois de garantir condições estéreis, fazer uma laparotomia mediana folloconduzido por uma extensão lateral esquerda. Use uma toalha para cobrir grandes e pequenas intestinos antes de movê-los para o lado esquerdo.
- Divida o ligamento falciforme eo ligamento triangular usando um cautério.
- Solte o fígado a partir do diafragma do lado direito usando um eletro-cautério; usar a tesoura para a parte superior, entre a veia e diafragma. Dissecar a veia infrahepatic baixo para o ramo da veia adrenal no lado direito ea veia renal do lado esquerdo.
- Separa-se a cava e na aorta distai infrahepatic um do outro; ligadura ramos da aorta para a coluna; isolar e artérias renais livres do tecido aderente. Cerque cada artéria renal com um empate 2-0.
- Craniana à veia renal esquerda, dissecção da aorta e da artéria mesentérica. Cerque a artéria mesentérica com um empate 2-0.
- Depois de abrir o crânio peritônio à artéria mesentérica, siga com atenção a aorta para o tronco celíaco. Dissecar o tronco celíaco caudalmente ao portal veno; rodeiam as artérias esplênica e gástrica esquerda, que posteriormente sucursal fora do tronco celíaco. Dissecar o tronco celíaco fora da veia portal.
- Solte a veia porta por uma incisão peritoneal entre o pâncreas ea veia portal. Tie fora veias de drenagem do pâncreas para a veia porta.
- Separe o ducto biliar do ligamento hepatoduodenal e dividi-lo distally após a ligadura.
- Ligadura dos vasos linfáticos dentro do ligamento hepatoduodenal para evitar vazamento linfático. Divida a artéria gastroduodenal e artérias gástrica direita entre laços. Ligadura veias menores.
- Dissecar a aorta por trás do diafragma entre o coração eo tronco celíaco. Coloque um empate 2-0 ao redor da aorta cranial para o tronco celíaco.
- Remover a vesícula biliar e cauterizar o sangramento do leito da vesícula biliar.
- Abra o diafragma. Administrar 1000 UI / kg de peso do dador de heparina intracardial ou iv Definir isoflurano a 5% (> 2,5 MAC), a fim de alcançarum nível maior do anestésico. Para um doador após a morte circulatório (DCD) modelo, induzir uma parada cardíaca por injeção intracardíaca de 40 mval KCl 3 min após a administração de heparina. Definir parada cardíaca como o ponto de partida da isquemia quente.
- Amarre os laços previamente definidos em todo o renal, baço, mesentérica, e artérias gástricas esquerdas. Tie fora da aorta, distalmente entre renais e artérias ilíacas e canular a aorta com uma linha de limpeza de órgãos.
- Tie fora da veia porta como proximal possível e canular-lo com outro órgão resplendor linha.
- Depois de fechar o empate pré-definido ao redor da aorta proximal, lave o fígado com 2 L de frio Universidade de solução (UW) Wisconsin usando dupla perfusão via aorta (saco de pressão) e veia porta (orientada por gravidade).
- Extirpar o fígado, deixando os restantes navios de comprimento. Deixe um aro diafragmática generoso ao redor da veia supra-hepática. Inserir o fígado para um saco estéril de órgãos em gelo.
- Durante back-mesa preparação, clamplificar a veia suprahepática usando uma braçadeira Satinsky e lave o fígado uma segunda vez com cerca de 0,5 L de solução de UW retrogradamente através da veia cava inferior até que a saída inferior da veia portal é clara.
- Empate fora todos os ramos arteriais da aorta e tronco celíaco. Executar uma perfusão pressão arterial back-mesa com os restantes 0,5 L de solução UW 12.
- Lave o ducto biliar usando solução UW.
- Apare o patch diafragmática para um tamanho decente. Feche todas as veias frênico - geralmente 3, 1 cada esquerda e direita, e um posterior - usando 4-0 pontos de monofilamento de polipropileno.
- Feche o saco e armazenar o órgão fígado em gelo.
2. Destinatário Hepatectomia
- Anestesiar do porco receptor através de uma injecção intramuscular de uma mistura de cetamina (25 mg / kg), a atropina (0,04 mg / kg) e midazolam (0,15 mg / kg).
- Coloque o porco em posição supina numa mesa cirúrgica em cima de um tapete de aquecimento. Cubra o wi-gusath um cobertor de circulação de calor.
- Antes de intubação, garantir o porco respira espontaneamente 2 L de oxigênio doseado com 5% de isoflurano. Pulverizar as cordas vocais com lidocaína a 2% 2 min antes da intubação para evitar espasmos nas cordas vocais. Para um 35 kg porco, usar um tubo traqueal 6,5 Fr. Bloquear o tubo traqueal com 3-5 ml de ar ambiente.
- Após a intubação, use capnometria para confirmar a intubação correta. Monitorar a freqüência cardíaca e saturação de oxigênio por oximetria de pulso em rabo de porco. Coloque e fixar uma sonda de temperatura no focinho do porco. Abaixe o vaporizador isoflurano a 2% (o objectivo para 2-2,5 MAC). Definir o ventilador para 14-16 respirações / min e um volume corrente de 10 - 15 ml / kg de peso corporal.
- Use pomada nos olhos para evitar a secura sob anestesia.
- Utilize uma técnica de Seldinger 13 para inserir um indutor bainha (8,5 Fr) na veia jugular externa esquerda. Utilize este cateter mais tarde para uma derivação portal-cava-jugular ativa.
- Use Seldinger technique inserir uma nutrição parentérica (NPT) cateter total (9,5 Fr) na veia jugular externa direita.
- Sob condições estéreis, dissecção da artéria carótida direita e inserir um cateter de polipropileno (18 L) para monitorização da pressão arterial invasivo. Cerque a artéria com um empate 2-0 seda para permitir a ligação de emergência.
- Desligar o vaporizador isoflurano a 1% (1,5-2 MAC) e adicionar o propofol (5-8 mg / kg / h IV) para manter a profundidade da anestesia. Para analgesia, utilização em infusão contínua iv de citrato de fentanil (mais preferido, 2 ug / kg / h) ou de remifentanil (segunda escolha, 15 ug / kg / h).
- Antes de incisão na pele, dar 1,000 mg de cefuroxima e 500 mg de metronidazol iv. Configurar uma bomba de infusão usando Lactato de Ringer com glicose a 5% em 150 ml / hr.
- Coloque o cobertor de circulação de calor para a área da cabeça e pescoço. Esfregue o porco e cobri-lo com campos estéreis.
- Sob condições estéreis, fazer uma laparotomia mediana. Insira um r abdominaletractor para ter acesso suficiente para o quadrante superior direito.
- Divida o ligamento falciforme eo ligamento triangular com bisturi.
- Em várias etapas, dividir o ligamento hepatoduodenal perto do fígado entre laços. Identificar, dividir, e marcar os ramos da artéria e ducto biliar hepática.
- Dissecar a artéria hepática retrógrado até à divisão da artéria gastroduodenal. Certifique-se que uma braçadeira bulldog se encaixa em torno do comum proximal da artéria hepática com a artéria gastroduodenal para mais tarde aperto.
- Liberte a veia portal a partir de tecido aderente.
- Mobilizar a veia cava do retroperitônio no lado direito usando um eletro-cautério. Use a tesoura para a parte superior, entre a veia e diafragma. Dissecar a veia infrahepatic baixo para o ramo da veia adrenal no lado direito ea veia renal do lado esquerdo.
- Exponha o hilo do baço. Aproximadamente a meio caminho ao longo do comprimento do baço, cuidadosamente clara def a artéria e veia esplênicas de camadas peritoneal aderiram. Cerque tanto artéria e veia esplênicas com 4 2-0 gravatas de seda.
- Insira um 8,5 Fr indutor bainha com dois furos adicionais na ponta do cateter na veia esplênica, apontando para distal para a veia portal. Fixe o cateter distal à sua inserção com uma das 2-0 laços e fechar a veia próxima à inserção com outro 2-0 empate. Deixe os outros dois vínculos aberto.
- Extrair sangue do cateter, lavá-la com 10 ml de solução salina, e fechar a braçadeira do cateter.
- Encha salina num desvio constituído por uma cabeça da bomba centrífuga, um tubo jugular (3/16 "), e uma entrada de ambos ramo portal (3/16") e um ramo da veia cava (1/4 ", um conector Luer Lock em proximal abertura). Coloque um grampo tubagem sobre a extremidade proximal do tubo de cava.
- Ligue o portal e a abertura do canal de derivação jugular para ambos os cateteres bainha (Figura 1) e selar o connecção com um anel braçadeira metálica. Coloque a cabeça da bomba centrífuga para a sua posição da bomba.
- Dê 1.000 mg de ácido tranexâmico e 10.000 UI de heparina 3 min iv antes de pinçamento. Reduzir a taxa de perfusão de propofol a 2 mg / kg / h durante o tempo da fase de anepática. Ajuste a concentração de isoflurano para a pressão arterial ea reatividade do porco.
- Abra os grampos de ambos os cateteres bainha do introdutor e de pinçamento da veia portal. Certifique-se de que o sangue está correndo através do desvio passivamente.
- Inicie a bomba centrífuga a cerca de 1.500 rounds / min. Continue pinçamento se a) o porco é cardiovascularly estável e b) o desvio está sendo executado em cerca de 500 ml / min. Se o porco não tolera o pinçamento, o volume substituto (cristalóides ou colóides) e agentes inotrópicos (norepinefrina no pequeno bolo).
- Cruz braçadeira veia cava infrahepatic apenas craniano para as veias renais, usando uma braçadeira De Bakey-Beck. Aplique uma pressão firme sobre as tiss fígadoue para espremer uma porção do sangue remanescente. Cross-braçadeira veia cava supra-hepática incluindo um aro diafragmática utilizando uma braçadeira Satinsky enquanto retraindo o fígado caudalmente.
- Corte a veia cava suprahepática diretamente na sua fronteira com o tecido do fígado. Em seguida, corte a veia portal perto do hilo hepático.
- Aproximadamente 4 cm cranial do grampo infrahepatic cava, cortado um furo na parede anterior da veia cava. Dentro deste buraco, posicione o conector da abertura de bypass da veia cava 'com o bloqueio Luer enfrentando anteriormente.
- Prenda o conector na veia infrahepatic com 1-0 gravatas de seda. Em seguida, abra a braçadeira de tubulação do ramo da veia cava do bypass.
- Finalmente, abrir o grampo infrahepatic cava para permitir um desvio cava-jugular, para além do desvio-jugular existente. Aumentar a velocidade da bomba de cerca de 2500 voltas / min de modo a que a saída de desvio no lado da jugular é entre 900 - 1100 ml / min.
- Extirpar o fígado no seu c remanescenteONEXÃO cranial ao conector de desvio infrahepatic, garantindo que os laços que prendem a ligação de desvio não são cortadas. Posicione o desvio de tubagem com cuidado para evitar vincada. Dar 500 mg de metilprednisolona para inicializar imunossupressão.
Reconstrução 3. Vessel
- Usando 4-0 polipropileno monofilamento, feche todos os 3 óstios das veias frênico do lado do destinatário na abertura da cava supra-hepática. Costure suturas duplas-armado polipropileno monofilamento 4-0 de dentro para fora em ambos os cantos da veia supra-hepática no lado do destinatário.
- Retire o saco de órgãos de doadores da caixa de gelo. Abrir o saco de órgãos, remover o fígado doador, e colocá-lo dentro da cavidade abdominal.
- Para uma anastomose fim-de-final da veia supra-hepática, aparar o doador da veia cava supra-hepática para caber lado do destinatário. Usando as agulhas para dentro dos pontos de canto do lado receptor, fazer um ponto de canto interior-fora em cada um dos lados do suprahcava doador epatic.
- Tiro ambas as extremidades da sutura juntos direita. Aproximar ambos os óstios de receptor e doador cava, em seguida, amarre as duas finais da sutura esquerda.
- Tiro o final mais curto e fazer um ponto fora-dentro da cava destinatário volta parede ao lado do empate. Correr sobre a parede de trás, idealmente eversão das paredes da veia cava.
- Adicionar 2-3 pontos da parede frontal com a mesma sutura uma vez que o lado direito foi alcançado, em seguida, atirou esse final de sutura. Correr sobre a parede frontal usando a sutura restante do canto esquerdo. Unir ambas as suturas utilizadas para as costas e paredes frontais. Amarre os outros dois finais de sutura no canto direito.
- Após o corte da veia portal de dador para um comprimento adequado, a anastomose veia porta extremidade-a-extremidade do mesmo modo, utilizando suturas 6-0 de monofilamento de polipropileno. Pouco antes de terminar com a parede frontal, entubar o lúmen da veia infrahepatic com outra linha de limpeza e lavar a solução UW com 1 L de solução salinaà TA através da veia cavaportal infrahepatic.
- Complete a anastomose e amarre as suturas, deixando aproximadamente 0,5 cm de fator de crescimento. Dito de outra De Bakey- Beck são fixados na parte cava doador infrahepatic.
- Abra a braçadeira cava supra-hepática e verificar se há sangramento. Em seguida, reperfundir o fígado através da abertura do grampo de portal.
- Utilize suturas de polipropileno monofilamento 6-0 para pontos hemostáticos. Diminuir a velocidade da bomba manual para cerca de 1.500 rounds / min e feche a braçadeira do introdutor de cateter portal bainha.
- Reclamp lado o destinatário da veia cava infrahepatic e colocar uma braçadeira de tubulação por parte cava do bypass. Parar a bomba centrífuga.
- Cortar os laços do conector cava e removê-lo. Devolver o sangue restante do manual para o porco através do cateter jugular.
- Feche a braçadeira do cateter jugular e desconecte o desvio. Dar 100 mg de sulfato de protamina para antagonizar a heparina. Tome especial cuidado do pihemodinâmica do g durante estes passos; usar catecolaminas para suporte de pressão e bicarbonato de sódio substituto para a acidose metabólica.
- Executar uma anastomose extremidade-a-extremidade da veia infrahepatic novamente do modo descrito acima, utilizando 5-0 suturas de monofilamento de polipropileno. Reperfundir a cava inferior infrahepatic liberando ambas as braçadeiras.
- Apare um remendo da aorta ao redor do tronco celíaco do doador. Tie fora da artéria gastroduodenal destinatário junto à artéria hepática comum. Coloque um grampo de bulldog para a artéria hepática comum proximal à junção da artéria gastroduodenal. Cortar um pequeno pedaço arterial com uma tesoura Potts, usando o tecido vascular em torno da junção.
- Lave a artéria hepática doador com 10 ml de solução salina heparinizada e colocar outro bulldog apertar ainda mais distalmente para evitar voltar a sangrar. Anastomosar o fim-de-final óstios arterial em uma técnica de pára-quedas em execução, usando um fio de polipropileno monofilamento 6-0. Reperfundir pela primeira opeNing distal e, em seguida, os grampos de buldogue proximais.
- Anastomose extremidade a extremidade-para-dois do ducto biliar com 6-0 suturas de monofilamento de polipropileno, utilizando a técnica de execução acima descrito. Certifique-se que grandes porções de tecido peribiliary estão incluídas porque o ducto biliar suíno é muito frágil e rasga facilmente.
- Depois de verificar para hemostasia, remover o cateter introdutor da veia esplênica. Feche as extremidades proximais e distais com os restantes 2 empates.
- Feche a parede abdominal com uma sutura absorvível monofilamentos tamanho 1. Feche a pele ou com um grampeador pele ou qualquer executando 2-0 sutura.
Fase 4. Pós-operatório
- Use a almofada de aquecimento e cobertor de circulação de calor para aquecer o porco.
- Gases sanguíneos de exemplo a cada hora. Ajustar a desidratação através do aumento da taxa de infusão.
- Desmamar a anestesia. Ventilar o porco por mais 2 horas.
- Remover o introdutor de cateter da jugular esquerda ve. Pressione firmemente por alguns minutos para evitar sangramento.
- Túnel do cateter por via subcutânea TPN para o lado do pescoço do porco. Prenda-o com 2-0 suturas.
- Remova a linha arterial após 2 horas se o porco é estável hemodinamicamente, sem apoio de catecolaminas. Certifique-se de que o lado da punção não está sangrando. Caso contrário, fazer um 6-0 bolsa-corda ponto em torno do buraco arterial sem fechar a artéria. Feche o local da incisão.
- Parar a ventilação assim que o porco é capaz de respirar de forma independente. Desconecte o tubo de ventilação do tubo traqueal. Repetidamente verificar se o porco está respirando suficientemente.
- Coloque o porco em uma posição propensa em um único curral provido de uma lâmpada de aquecimento. Extubação uma vez que o porco é capaz de manter-se a cabeça de forma independente. Não deixe um animal sem supervisão até que tenha recuperado a consciência suficiente para manter decúbito esternal. Casa do porco separadamente para todo o período pós-operatório.
- Forneceriv medicação para a dor suficiente no pós-operatório (por exemplo, buprenorfina 0,01-0,05 mg / kg a cada 6 horas).
- Se o porco não bebe de forma independente, substituir o suficiente iv de volume
- Continue metilprednisolona como imunossupressão (dia 250 mg de pós-operatório (POD) uma manhã e, em seguida, 125 mg diariamente). Iniciar a cefalosporina de 2 mg / kg PO duas vezes por dia a partir POD2 diante.
- Administrar 500 mg de metronidazole e 1000 mg duas vezes por dia de cefazolina, bem como 20 mg de pantoprazole de uma vez por dia até Pod3.
- Monitorar o porco de perto. Não hesite em sacrificar-lo se ele mostra sinais de sofrimento (por exemplo, letargia, refusion para beber, acidose persistente ou hipoglicemia, ou sinais de hemorragia ou peritonite). Por eutanásia, desangrar o porco sob anestesia profunda isoflurano (5%,> 2,5 MAC) cortando a veia supra-hepática.
Resultados
Em um primeiro estudo de transplante, um modelo de dador bater-coração (HBD, n = 5) foi comparado com um modelo TDC (n = 10) expostas a 45 min de isquemia quente in situ. Em ambos os grupos, os enxertos foram preservados em gelo durante 10 horas após a aquisição.
No grupo HBD, 100% dos porcos receptores sobreviveu até ao fim do acompanhamento no dia 5 após o transplante. No grupo DCD, apenas 50% dos receptores sobreviveu porcos durante 5 dias, devido a problemas de coagulação ou descompensação metabólica, como resultado da diminuição da função do fígado pós-operatório.
Todas as amostras de sangue foram coletadas a partir do cateter venoso central. Após centrifugação, as amostras de soro foram obtidas e analisadas para a lesão hepatocelular (aspartato aminotransferase, AST), a função biliar (bilirrubina e fosfatase alcalina total), e função hepática (INR). O curso de tempo de cada marcador é mostrado nas Figuras 2-5.
Níveis de AST atingiu um pico ao fim de 24 horas (1414 ± 538 U / L no grupo de HBD e 2.296 ± 1.313 U / L no grupo DCD, p = 0,13) e voltou a valores quase normais após 5 dias. Do mesmo modo, valores da fosfatase alcalina foram marcadamente aumentada após 36 horas no grupo DCD (224 ± 111 U / L) quando comparado com o grupo de HBD (162 ± 54 U / L, p = 0,27). Enquanto bilirrubina total era estável no grupo HBD (≤ 10 umol / L ao longo), é gradualmente aumentada no grupo DCD até ao dia 5 (23 ± 31 umol / L, p = 0,43). O grande desvio padrão dos valores de bilirrubina no grupo DCD heterogeneidade mostra uma lesão biliar peculiar deste grupo. INR como marcador de função hepática mostraram uma tendência semelhante aos valores de AST. Valores atingiu um pico de 24 horas e foram restauradas aos valores normais quase após 5 dias. O grupo HBD tinha valores mais baixos, com um pico a 1,47 ± 0,34 em comparação com o grupo DCD (pico de 1,70 ± 0,36, p = 0,32).
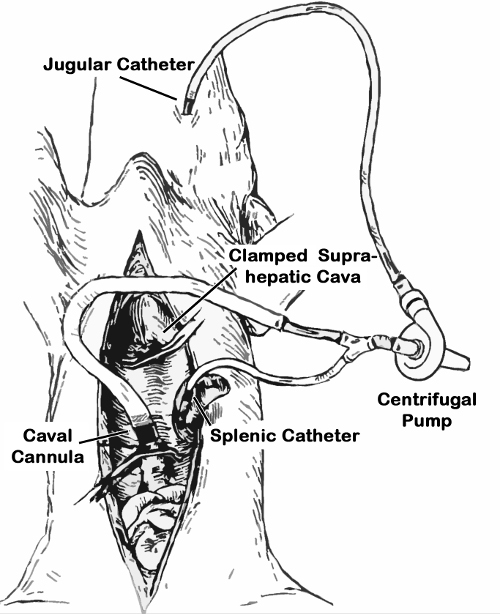
Figura 1. Esquema do shunt porto-cava-jugular. O bypass é preenchido com solução de Ringer com lactato. Em seguida, a parte da veia cava é presa com uma pinça tubulação, as partes jugulares e esplênicos estão ligados aos cateteres pré-estabelecidos, o desvio é aberto, e da bomba centrífuga é iniciado após o pinçamento da veia porta. Após a ressecção do fígado, a parte da veia cava do bypass é inserido e fixado na infrahepatic coto da veia cava, cranial para as veias renais. A braçadeira de tubo é libertado para permitir a descompressão da veia cava, para além da descompressão porta.
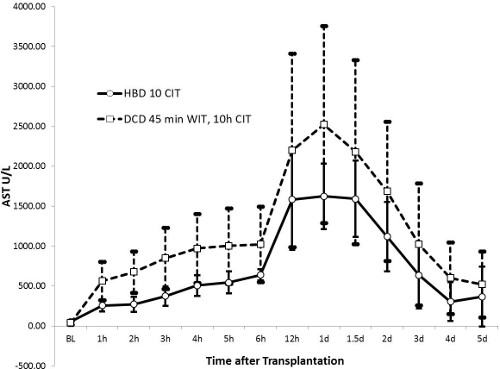
Figura 2. aspartato aminotransferase (AST) (HBD n = 5, n = 10 DCD). AST é um marcador sensível da lesão hepatocelular. A ré picoer 24 horas é inferior no HBD do que no grupo DCD, sugerindo lesão de reperfusão menos hepática; o menor desvio padrão mostra resultados mais homogêneos no grupo HBD.
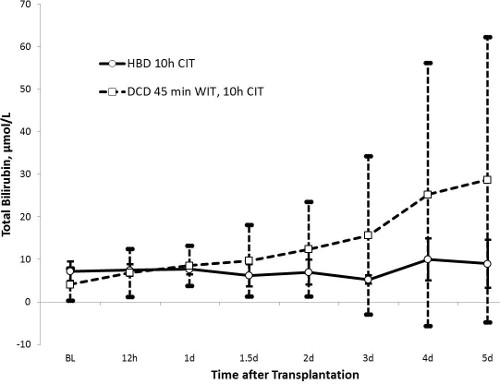
Figura 3. A bilirrubina total (HBD n = 5, n = 10 DCD). A bilirrubina total, como um marcador de depuração biliar e integridade do ducto biliar, mostra uma tendência estável e homogénea com valores inferiores a 10 mmol / L no grupo de HBD. A curva de bilirrubina no grupo DCD aumenta gradualmente ao longo do tempo e mostra um desvio-padrão elevado, sugerindo lesão biliar em apenas uma porção do grupo experimental.
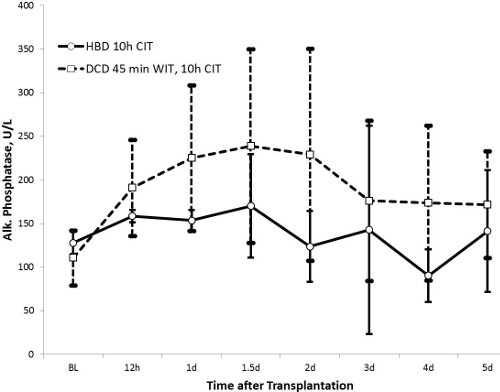
Figura 4. A fosfatase alcalina (HBD n = 5, n = 10 DCD). A fosfatase alcalina ié um indicador de lesão biliar. Os valores para o grupo de HBD são mais baixas do que a do grupo DCD, o que implica menos lesão biliar.
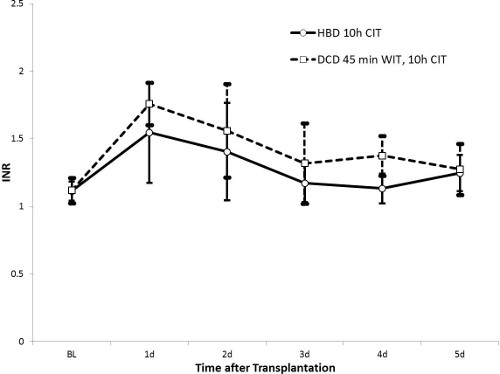
Figura 5. INR (HBD n = 5, DCD n = 10). Um valor alto indica INR função hepatocelular diminuída devido à diminuição da liberação de fatores de coagulação. Em ambos os grupos HBD e DCD, os valores de INR regresso aos valores normais de 5 dias após o transplante, sugerindo que a recuperação da função do fígado. Os valores para o grupo de HBD aparecem inferior.
Discussão
Experimental suína transplante hepático ortotópico é um procedimento desafiador para um ambiente de pesquisa, sem os recursos de terapia intensiva de um cenário clínico. Complicações possíveis incluem instabilidade hemodinâmica, hemorragia, isquemia de órgãos, hipotermia, e metabólica, bem como respiratória, descompensação. Para qualquer grupo de pesquisa, formação processual suficiente da técnica cirúrgica 5, bem como a anestesia 14,15 porco é obrigatória a fim de alcançar resultados representativos e reprodutíveis.
Muitos subtilezas técnicas têm sido descritos na literatura, especialmente em relação à fase de reconstrução vascular 5. O protocolo de transplante hepático ortotópico descrito acima fornece as informações necessárias para um modelo de substituição de cava que assemelha-se o transplante hepático ortotópico humano. Os resultados fornecidos demonstrar sobrevivência do animal confiável e recuperação do enxerto em ambos os modelos HBD e DCD. O protocolo é aplicável em cenários de sobrevivência de curto prazo utilizados na reperfusão do enxerto experiments, por exemplo, bem como em modelos de sobrevivência a longo prazo, tais como estudos de tolerância.
Um grande obstáculo de suíno transplante hepático ortotópico é relativamente pobre tolerância de cava e da veia portal pinçamento. Congestão esplâncnica durante a fase anepática provoca hipertensão venosa capilar e danos que podem levar à isquemia intestinal major e instabilidade hemodinâmica, a ponto de um choque irreversível mesmo após reperfusão de órgãos 7. Desde a veia cava é completamente imersos em parênquima hepático, um procedimento piggy-back-preservando cava não é viável. A oclusão total da veia cava, durante a fase de reconstrução cava prejudica a estabilidade hemodinâmica do porco. Embora alguns relatos mostram que o transplante hepático ortotópico suína pode ser realizado durante a cava e da veia portal oclusão total de menos de 25 min 16,17, uma técnica de bypass porto-cava-jugular para o tempo de reconstrução vascular é a opção mais segura e mais prática 7- 9,18. Em thexperiência e dos autores, uma derivação porto-jugular passivo não é o ideal para manter o hemodinamicamente estável porco durante a fase anepática. O modelo de bypass, incluindo descompressão ativa de ambos cava infrahepatic e veia portal, permite uma fase de reconstrução calma das anastomoses cava e portal supra-hepáticas, mesmo com tempo de pinçamento prolongado devido a complicações imprevistas. Ao contrário do que relatórios anteriores 7, uma esplenectomia não é obrigatória quando o cateter de derivação portal é removido. Ambos artéria e veia esplênicas estão fechados sobre a meio caminho ao longo do comprimento do baço deixando a metade proximal suficientemente perfusão. Complicações como hemorragia ou embolia devido a desvio de desconexão são evitáveis, garantindo que o desvio é colocada com cuidado e protegido adequadamente.
Em sobrevivência a longo prazo transplante hepático ortotópico experimentos, a anastomose do ducto biliar é considerado um ponto fraco, devido à sua alta taxa de complicações 19. O tecido biliar é muito frágil e needs cuidado especial quando está sendo manipulado. Muitas técnicas de anastomose diferentes têm sido descritas 5,19. Uma anastomose end-to-end é tecnicamente fácil e associado com o mínimo de complicações 19. Uma sutura contínua com uma agulha de não corte, incluindo grandes secções do tecido conjuntivo peribiliary parece ser superior a um sutura interrompida. O ducto biliar é colocado sob tensão desnecessária quando os pontos únicos de sutura interrompida estão atadas. Isso pode resultar em lágrimas de tecidos e vazamentos biliares consecutivos. O material de sutura - absorvível ou não absorvível - geralmente não é importante, dada a sua duração limitada até que o porco é encerrado. Para os modelos de sobrevivência a longo prazo ao longo de vários meses, suturas absorvíveis - como no transplante hepático ortotópico humano - são preferíveis.
Cuidados específicos devem ser tomados com o pós-operatório follow-up. Alimentação suficiente e de fornecimento de fluido, um protocolo de alívio da dor de confiança, e uma imunossupressão adequadaregime são obrigatórios. Para as experiências de longo prazo, a imunossupressão parece particularmente importante. Em comparação com outros mamíferos, os porcos mostram uma surpreendentemente baixa taxa de rejeição imunológica após o transplante hepático ortotópico 20,21. Infiltrações de células redondas são máxima durante a segunda semana após o transplante e diminuir espontaneamente, mesmo sem imunossupressão. Rejeição é raramente a causa da morte após o transplante hepático ortotópico suíno 22. No entanto, mesmo com o protocolo de imunossupressão, envolvendo a administração de esteróides IV e inibidores da calcineurina po mencionado aqui, a rejeição do enxerto é indicado por um ligeiro aumento de transaminases a partir de cerca de 4 dias após o transplante hepático ortotópico e confirmada por aparente campo portal de infiltração de células redondas. Inibidores da calcineurina pode ser dada, quer po 23,24 ou iv 25,26; Ambos os métodos têm desvantagens. Mesmo com ajudas aplicação oral, a quantidade real de atingir o trato gastro-intestinal permanece indefinida. Por outro lado, a infusão intravenosa contínua, emcaneta de um porco com um animal ativo é difícil. Assim, a aplicação iv deve ser realizada como um bolus, o que resulta em picos de concentração de droga elevada, juntamente com os potenciais efeitos tóxicos. No entanto, ambos os métodos de aplicação parece permitir a sobrevivência a longo prazo.
Semelhante a um ambiente clínico, recomenda a profilaxia pós-operatório úlcera de estresse. Sangramento pós-operatório de úlceras pépticas é um problema freqüente e pode estar relacionada com uma disfunção hepática 27. Depois de alguns casos de hemorragia digestiva em ambos os grupos transplante hepático ortotópico, os autores começaram a profilaxia regular com pantoprazol e não experimentar qualquer hemorragia gastrointestinal desde então.
Manutenção rigorosa de condições estéreis no intra-operatório, comparáveis com as condições de uma sala de cirurgia, clínica e consequentes profilaxia antibiótica, diminui o risco de complicações infecciosas.
Em conclusão, este artigo pferece informações práticas para o estabelecimento de um programa de transplante hepático ortotópico suína em um ambiente de pesquisa. Dedicação suficiente, prática, e trabalho de equipa é importante, a fim de diminuir o período de aprendizagem, para produzir resultados fiáveis, e para reduzir os custos e o número de animais de pesquisa.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The study was supported by research grants from the Roche Organ Transplant Research Foundation (ROTRF) and Astellas. Markus Selzner was supported by an ASTS Career Development Award. Matthias Knaak was supported by the Astellas Research Scholarship. We thank Uwe Mummenhoff and the Birmingham family for their generous support.
Materiais
| Name | Company | Catalog Number | Comments |
| Atropine Sulphate 15 mg/30ml | Rafter 8 Products | 238481 | |
| Buprenorphine 0.3 mg/ml | RB Pharmaceuticals LDT | N/A | |
| Cefazolin 1 g | Pharmaceutical Partners of Canada Inc. | 2237138 | |
| Cyclosporin Oral Solution 5,000 mg/50 ml | Novartis Pharmaceuticals Canada Inc. | 2150697 | |
| Fentanyl Citrate 0.25 mg/5 ml | Sandoz Canada Inc. | 2240434 | |
| Heparin 10,000 iU/10 ml | Leo Pharma A/S | 453811 | |
| Isoflurane 99.9%, 250 ml | Pharmaceutical Partners of Canada Inc. | 2231929 | |
| Ketamine Hydrochloride 5000 mg/50 ml | Bimeda-MTC Animal Health Inc. | 612316 | |
| Lactated Ringer’s + 5% Dextrose, 0.5 L | Baxter Corporation | 61131 | |
| Lacteted Ringer’s, 1 L | Baxter Corporation | 61085 | |
| Metronidazole 500 mg/100 ml | Baxter Corporation | 870420 | |
| Midazolam 50 mg/10 ml | Pharmaceutical Partners of Canada Inc. | 2242905 | |
| Pantoprazole 40 mg | Sandoz Canada Inc. | 2306727 | |
| Potassium Chloride 40 mEq/20 ml | Hospira Healthcare Corporation | 37869 | |
| Propofol 1,000 mg/100 ml | Pharmascience Inc. | 2244379 | |
| Protamine Sulfate 50 mg/5 ml | Pharmaceutical Partners of Canada Inc. | 2139537 | |
| Saline 0.9%, 1 L | Baxter Corporation | 60208 | |
| Sodium Bicarbonate 50 mEq/50 ml | Hospira Healthcare Corporation | 261998 | |
| Solu-Medrol 500 mg | Pfizer Canada Inc. | 2367963 | |
| Tranexamic Acid 1,000 mg/10 ml | Pfizer Canada Inc. | 2064413 | |
| University of Wisconsin Solution, SPS-1 | Organ Recovery Systems | SPS-1 | |
| Xylocaine Endotracheal 10 mg/50 ml | AstraZeneca | 2003767 | |
| Appose ULC 35 W skin stapler | Covidien Canada | 803712 | |
| Maxon, 1 | Covidien Canada | 606173 | |
| Sofsilk, 0 | Covidien Canada | S606 | |
| Sofsilk, 2-0 | Covidien Canada | S405 | |
| Sofsilk, 3-0 | Covidien Canada | S404 | |
| Surgipro II, 4-0 | Covidien Canada | VP581X | |
| Surgipro II, 5-0 | Covidien Canada | VP725X | |
| Surgipro II, 6-0 | Covidien Canada | VP733X | |
| Catheter i.v, 18 G | BD Canada | 381147 | |
| Cook TPN catheter, 9.5 Fr | Cook Medical Company | C-TPNS-9.5-90 | |
| PSI Kit for sheath catheter, 8.5 Fr | Arrow International | ASK-09803-UHN | |
| Infusion Pump Line | Smith Medical ASD Inc. | 21-0442-25 | |
| Liver Admin Set (flush line) | CardioMed Supplies Inc | 17175 | |
| Mallinckrodt, Tracheal Tube, 6.5 mm | Covidien Canada | 86449 | |
| Med-Rx Suction Connecting Tube | Benlan Inc. | 70-8120 | |
| Organ Bag | CardioMed Supplies Inc | 2990 | |
| Suction Tip | Tyco Healthcare Group LP | 8888501023 | |
| Valleylab, Cautery Pencil | Covidien Canada | E2515H | |
| Valleylab, Patient Return Electrode | Covidien Canada | E7507 | |
| Bypass Connector 3/8” x 1/4“ | Raumedic AG | 955083-001 | |
| Bypass Connector 3/8” x 3/8” Luer Lock | Raumedic AG | 955163-001 | |
| Bypass Connector Y 3/8” x 3/8” x 1/4” | Raumedic AG | 961360-002 | |
| Bypass Tubing 1/4” x 1/16” | Raumedic AG | 039505-010 | |
| Bypass Tubing 3/8” x 3/32” | Raumedic AG | 039535-005 | |
| Rotaflow Centrifugal Pump | Maquet-Dynamed | HC 2821 | |
| Stainless Steel Hose Clamp Ring, 5mm | Oetiker | 16700007 | |
| Abdominal Retractor | Medite GmbH | N/A | |
| De Bakey – Beck, Infrahepatic Cava Clamp | Aesculap Inc. | FB519R | |
| Deithrich, Atraumatic Clamp (Portal Vein) | Aesculap Inc. | FB525R | |
| Gregory Bulldog Clamp, curved | Aesculap Inc. | FB382R | |
| Gregory Bulldog Clamp, straight | Aesculap Inc. | FB381R | |
| Potts – De Martel, Scissors | Aesculap Inc. | BC648R | |
| Satinsky, Suprahepatic Cava Clamp | Aesculap Inc. | FB605R | |
| Symetrical Tubing Clamp | Codman Instruments | 198010 | |
| Anesthesia Machine, Optimax | Moduflex Anesthesia Equipment | SN5180 | |
| Bypass Flow meter, HT 110 | Transonic Systems Inc. | HT110B11106 | |
| Flow meter probe, H6XL | Transonic Systems Inc. | H6Xl689 | |
| Heat Therapy Pump, T/Pump | Gaymar Industries Inc | TP500-G89D19 | |
| Infusion Pump 3,000 | SIMS Graseby LTD. | SN300050447 | |
| Isoflurane Vapor 19.1 | Draeger Medical Canada Inc. | N/A | |
| Monitor, Datex AS 3 | Instrumentarium Corp./ Hitachi | D-VHC14-23-02 | |
| Rotaflow Centrifugal Drive Unit | Maquet-Dynamed | 952301 | |
| Rotaflow Console | Maquet-Dynamed | 706035 | |
| Temperature Therapy Pad | Gaymar Industries Inc | TP26E | |
| Valleylab Force Tx | Valleylab Inc. | 216151480 | |
| Ventilator, AV 800 | DRE Medical Equipment | 40800AVV | |
| Warm Touch, Patient Warming System | Nellcor/ Covidien Canada | 5015300A |
Referências
- Mehrabi, A., Fonouni, H., Muller, S. A., Schmidt, J. Current concepts in transplant surgery: liver transplantation today. Langenbecks Arch. Surg. 393 (3), 245-260 (2008).
- Qiu, J., Ozawa, M., Terasaki, P. I. Liver transplantation in the United States. Clin. Transpl. , 17-28 (2005).
- Chalstrey, L. J. Technique of orthotopic liver transplantation in the pig. Br. J. Surg. 58 (3), 585-588 (1971).
- Esmaeilzadeh, M. Technical guidelines for porcine liver allo-transplantation: a review of literature. Ann. Transplant. 17 (2), 101-110 (2012).
- Calne, R. Y. Observations of orthotopic liver transplantation in the pig. Br. Med. J. 2 (5550), 478-480 (1967).
- Memsic, L., Quinones-Baldrich, W., Kaufman, R., Rasool, I., Busuttil, R. W. A comparison of porcine orthotopic liver transplantation using a venous-venous bypass with and without a nonpulsatile perfusion pump. J. Surg. Res. 41, 33-40 (1986).
- Torres, O. J. Hemodynamic alterations during orthotopic liver experimental transplantation in pigs. Acta. Cir. Bras. 23 (2), 135-139 (2008).
- Battersby, C., Hickman, R., Saunders, S. J., Terblanche, J. Liver function in the pig. 1. The effects of 30 minutes' normothermic ischaemia. Br. J. Surg. 61 (1), 27-32 (1974).
- Smith, A. C., Swindle, M. M. Preparation of swine for the laboratory. Ilar. J. 47 (4), 358-363 (2006).
- Swindle, M. M., Smith, A. C. Best practices for performing experimental surgery in swine. J. Invest. Surg. 26 (2), 63-71 (2013).
- Moench, C., Moench, K., Lohse, A. W., Thies, J., Otto, G. Prevention of ischemic-type biliary lesions by arterial back-table pressure perfusion. Liver Transpl. 9 (3), 285-289 (2003).
- Koski, E. M., Suhonen, M., Mattila, M. A. Ultrasound-facilitated central venous cannulation. Crit. Care Med. 20 (3), 424-426 (1992).
- Lange, J. J., Hoitsma, H. F., Meijer, S. Anaesthetic management in experimental orthotopic liver transplantation in the pig. Eur. Surg. Res. 16 (6), 360-365 (1984).
- Kaiser, G. M., Heuer, M. M., Fruhauf, N. R., Kuhne, C. A., Broelsch, C. E. General handling and anesthesia for experimental surgery in pigs. J. Surg. Res. 130 (1), 73-79 (2006).
- Heuer, M. Liver transplantation in swine without venovenous bypass. Eur. Surg. Res. 45 (1), 20-25 (2010).
- Gruttadauria, S. Porcine orthotopic liver autotransplantation: facilitated technique. J. Invest. Surg. 14 (2), 79-82 (2001).
- Falcini, F. Veno-venous bypass in experimental liver transplantation: portal-jugular versus caval-portal-jugular. G. Chir. 11 (4), 206-210 (1990).
- Filipponi, F., Benassai, C., Falcini, F., Martini, E., Cataliotti, L. Biliary tract complications in orthotopic liver transplantation: an experimental study in the pig. Ital. J. Surg. Sci. 19 (2), 131-136 (1989).
- Terblanche, J. Orthotopic liver homotransplantation: an experimental study in the unmodified pig. S. Afr. Med. J. 42 (20), 486-497 (1968).
- Calne, R. Y. Prolonged survival of liver transplants in the pig. Br. Med. J. 4 (5580), 645-648 (1967).
- Battersby, C., Egerton, W. S., Balderson, G., Kerr, J. F., Burnett, W. Another look at rejection in pig liver homografts. Surgery. 76 (4), 617-623 (1974).
- Net, M. The effect of normothermic recirculation is mediated by ischemic preconditioning in NHBD liver transplantation. Am. J. Transplant. 5 (10), 2385-2392 (2005).
- Guarrera, J. V. Hypothermic machine perfusion of liver grafts for transplantation: technical development in human discard and miniature swine models. Transplant Proc. 37 (1), 323-325 (2005).
- Minor, T. Hypothermic reconditioning by gaseous oxygen improves survival after liver transplantation in the pig. Am. J. Transplant. 11 (12), 2627-2634 (2011).
- Kelly, D. M. Porcine partial liver transplantation: a novel model of the 'small-for-size' liver graft. Liver Transpl. 10 (2), 253-263 (2004).
- Meijer, S., Hoitsma, H. F., Visser, J. J., de Lange, J. J. Long term survival following orthotopic liver transplantation in pigs; with special reference to gastric ulcer complications. Neth. J. Surg. 36 (6), 168-171 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados