Method Article
Robotic Ablação de Fibrilação Atrial
Neste Artigo
Resumo
Pulmonary vein isolation (PVI) with an ablation catheter is a curative treatment for atrial fibrillation (AF). Robotic catheter systems aim to improve catheter steerability. Here, a procedure with a new robotic catheter system is presented. The goal of the procedure is electrical block between pulmonary vein and left atrium.
Resumo
Antecedentes: isolamento das veias pulmonares (IVP) é um tratamento estabelecido para a fibrilação atrial (FA). Durante PVI um bloqueio de condução elétrica entre veia pulmonar (PV) e átrio esquerdo (AE) é criado. Este bloqueio de condução evita AF, que é desencadeada por atividade elétrica irregular proveniente do PV. No entanto, lesões atriais transmurais são necessários que pode ser um desafio. Re-condução e recorrência de AF ocorrem em 20-40% dos casos. Sistemas de cateter robóticos visam melhorar cateter dirigibilidade. Aqui, um procedimento com um novo sistema de cateter remoto (RCS), é apresentado. Objetivo deste artigo é mostrar a viabilidade de ablação de FA robótico com um novo sistema. Materiais e Métodos: Após a punção trans-septo interatrial é realizada utilizando uma agulha e bainha longa sob orientação fluoroscópica. A agulha é removida e um fio de guia é colocada no VP superior esquerdo. Em seguida, um cateter de ablação é posicionado no LA, utilizando a bainha e do fio de guiapara o LA. LA angiografia é realizada através da bainha. Um cateter de mapeamento circular é posicionado através da bainha longa para o LA e A (3-D) anatómica reconstrução tridimensional do AL é realizada. O identificador do cateter de ablação é posicionado no braço robótico do sistema Amigo e inicia o procedimento de ablação. Durante o procedimento de ablação, o operador manipula o cateter de ablação por meio do braço robótico com a utilização de um controlo remoto. A ablação é realizada através da criação de lesões ponto-a-ponto ao redor dos óstios PV esquerda e direita. Contato força é medida na ponta do cateter para fornecer feedback do contato cateter-tecido. Bloqueio de condução é confirmado por gravar os potenciais PV sobre o cateter de mapeamento circular e por manobras de estimulação. O operador fica de fora do radiationfield durante a ablação. Conclusão: O sistema de cateter de ablação com romance permite uma elevada estabilidade em baixa operador de exposição fluoroscopia.
Introdução
FA é a arritmia cardíaca mais comum com uma prevalência de 1-2% na população em geral. Os sintomas incluem palpitações, tontura, dispnéia e redução da capacidade de exercício. Além disso, o risco de AVC é substancialmente aumentada em pacientes com FA. Durante a última década, tornou-se PVI uma opção de tratamento curativo estabelecido para os pacientes que sofrem de AF 1,2.
O princípio básico do PVI é a aplicação de lesões circulares ao redor do óstio PV com radiofreqüência (RF) para criar um bloco de condução elétrica entre PV e do átrio esquerdo. Este bloqueio de condução evita a fibrilação atrial, que é desencadeada por atividade elétrica irregular proveniente do PV. No entanto, lesões transmurais são necessários para atingir bloqueio de condução e aplicação de lesões transmurais pode ser um desafio. Re-condução e recorrência da fibrilação atrial após ablação por cateter ocorrer em 20-40% dos casos 1,2.
Como foi demonstrado recentemente, suficiente contato cateter-tecido e estabilidade são pré-requisitos cateter de ablação de lesões eficazes 3,4. Numerosas técnicas de ablação e abordagens foram desenvolvidas para melhorar a estabilidade do cateter, e streerability contacto cateter-tecido. Entre outros, sistemas robóticos são de especial interesse. As vantagens e os princípios da ablação robótico foram discutidos antes 5-7. Estes sistemas não só pode melhorar a estabilidade do cateter através da minimização artefactos de manipulação manual do cateter, mas também tem a vantagem de reduzir a exposição fluoroscopia para o operador uma vez que o sistema é operado por controlo remoto de fora do campo de radiação. Um sistema robótico novo com cateter remoto direccionamento foi recentemente introduzido. Viabilidade e eficácia deste sistema para PVI e outros procedimentos eletrofisiológicos, como AV-nodal-reentrada-tachcardia, vias acessórias ou flutter atrial e fibrilação ou ventriculataquicardias r foi avaliado 7-9. Uma redução significativa de operador de exposição fluoroscopia em comparação com a ablação manual foi mostrado, enquanto todos os outros parâmetros processuais e taxa de sucesso em 12 meses de follow up não foram significativamente diferentes 7.
Um procedimento de mapeamento do átrio esquerdo e PVI com a utilização deste novo sistema de cateter remota é apresentado aqui.
Depois de obter o acesso vascular através da veia femoral, punção trans-septo atrial é realizada usando uma bainha transeptal longa e uma agulha transeptal sob orientação fluoroscópica. Após a punção trans-septal, a agulha é removida e um fio de guia é efectuada através da bainha transeptal na veia pulmonar superior esquerda. Em seguida, a bainha na atraído de volta para a veia cava inferior e um cateter de ablação está posicionado no LA, usando o fio de guia para as fossa oval eo LA ("one-punção, de acesso duplo" -technique). Uma vez que o ablation cateter tenha entrado no LA, a bainha é movida para a frente para o LA, bem como, o fio guia é removido e o cateter de ablação é posicionado no ventrículo esquerdo. A angiografia do átrio esquerdo é realizada através da bainha, enquanto o cateter de ablação é usado para a estimulação ventricular de alta taxa de contraste para melhorar a opacificação. Após angiografia LA é completado, um cateter de mapeamento circular é posicionado através da bainha longa para o LA e uma reconstrução 3-D-anatómico se a LA é realizada com a utilização de um sistema de mapeamento. O cateter de mapeamento circular é posicionado na VP superior direito de registrar potenciais PV e confirmar bloqueio de condução depois de PVI. A ablação por cateter é puxado para trás a partir do ventrículo esquerdo para o átrio esquerdo e o identificador do cateter de ablação é posicionado no braço robótico do sistema amigo. Durante o procedimento de ablação, o operador manipula o cateter de ablação por meio do braço robótico com a utilização de um controlo remoto. A ablação é executada por crcomer lesões ponto-a-ponto ao redor dos óstios PV esquerda e direita. Bloqueio de condução é confirmado por gravar os potenciais PV sobre o cateter de mapeamento circular e por manobras de estimulação.
APRESENTAÇÃO DO CASO
Execute este procedimento em um paciente com paroxística refratária ao tratamento medicamentoso sintomático AF sem graves co-morbidades e sem cirurgia cardíaca prévia. Execute os testes de pré-diagnóstico que são descritos abaixo.
Diagnóstico, de avaliação, E PLANO
O diagnóstico da AF é confirmada por registros de ECG holter repetidas, incluindo correlação de AF e sintomas (palpitações, dispnéia e redução da capacidade de exercício). Se FA é gravado e sintomas são relatados, apesar do tratamento com, pelo menos, uma droga anti-arrítmica, PVI é indicado para o tratamento da FA-droga refractário sintomático de acordo com as orientações actuais. PVI é programado e consentimento informado é obtido do paciente. Antes de PVI physiexame cal, testes de laboratório, ecocardiografia transesofágica e transtorácica são realizados para excluir trombo no átrio esquerdo e doença cardíaca estrutural grave. PVI procedimento é realizado em jejum sob sedação profunda. Antagonistas da vitamina K são interrompidas cinco dias antes da ablação, heparina de baixo peso molecular é iniciado quando a relação normalizada internacional é <2.
Protocolo
O protocolo apresentado aqui é a abordagem padrão de ablação por cateter robótico RCS no departamento de cardiologia, Charité - Universitätsmedizin Berlim, Campus Virchow. O protocolo e análise dos procedimentos e os resultados dos pacientes foi aprovado pelo comitê de ética local da Charité - Universitätsmedizin Berlim.
1. O Sistema de Cateter remoto (RCS)
- Que liga o braço robótico para a mesa de operações, como descrito antes 7 (Figura 1).
NOTA: A RCS consiste de um manipulador cateter remoto, o qual é um braço robótico que podem ser movidos por comando à distância. - Coloque o cateter de ablação na estação de encaixe do RCS. Manipular o cateter com o uso de um controlador remoto, enquanto o médico operador fica de fora do campo de radiação 7. Advance, retirar, girar e desviar o cateter com o uso da RCS.
2. Preparação de Pré-ablação
- Posicione o paciente na mesa de operação e induzir sedação profunda com Midazolam (0,03 mg / kg bolus) e Propofol (infusão contínua 4 mg / kg / h).
- Coloque uma sonda de temperatura no esôfago para medir a temperatura do esôfago e prevenir lesões esofágicas.
- Encaixe de ECG e eléctrodos de superfície de 12 derivações do sistema 3D-Mapeamento para o corpo do paciente.
- Antes de iniciar o procedimento de garantir que o seguinte material estiver pronto.
- Uma agulha transseptal (71 cm) e um 8,5 F sl0 bainha com fio-guia. A 6 e 7 F F 25 centímetros da bainha. A decapolar e um cateter diagnóstico streerable circular. Um cateter de ablação open-irrigada e um gerador de ablação.
- Além disso, garantir que uma seringa de contraste e uma bandeja pericardiocentesis estão disponíveis para o tratamento agudo de complicações.
- Posicione o braço robótico do sistema em uma cortina estéril e pronto para usar. Fixe o cont remoto handheldrolo para o braço robótico (Figura 1).
- Obter acesso venoso por punção venosa bilateral com um 6 F, 7 F e 8,5 F bainha e colocar um cateter diagnóstico decapolar no seio coronário (CS).
- Realize a punção transseptal sob orientação fluoroscópica usando um 8,5 F bainha longa SLO e uma agulha transseptal 71 centímetros.
- Após a punção trans-septal, retire a agulha e introduzir um fio-guia através da bainha trans-septal na veia pulmonar superior esquerda. Em seguida, chamar de volta a bainha na veia cava inferior.
- Coloque um 8,5 F longo SRO bainha com um fio no átrio esquerdo (LA), usando o fio de guia para as fossa oval eo LA ("one-punção, de acesso duplo" -technique). Avançar um cateter de ablação open-irrigada com uma ponta 3,5 milímetros com medição de força de contacto através da bainha SR0 ao LA.
- Administrar heparina com uma taxa de 15 IU / kg / h após um bolus de 140 UI / kg de manter um tempo de coagulação activado (ACT) entre 300 e 350 segundos ao longo do procedimento.
- Uma vez que o cateter de ablação entrou no LA, introduzir a bainha na LA bem. Remover o fio de guia e do dilatador da bainha SLO e posicionar o cateter de ablação no ventrículo esquerdo. Realizar LA angiografia através da bainha, durante a utilização do cateter de ablação para estimulação ventricular elevada taxa para melhorar o contraste opacificação (LA angiografia é mostrado na Figura 2A).
- Avançar um cateter de mapeamento circular através da bainha longa para o LA (cateter de mapeamento circular mostrada na Figura 2B).
- Realizar uma reconstrução anatómica 3-D do LA com a utilização de um sistema de mapeamento e o cateter de mapeamento circular. Criar uma reconstrução 3-D-anatómica do LA movendo o cateter circular na superfície interna do LA, todas as quatro veias pulmonares e a aurícula esquerda, enquanto usando um sistema de mapeamento computadorizado para registo do movimento em relação a um eletrodo de referência (complete-mapa 3-D é mostrado na figura 2C e D).
- Coloque o cateter de mapeamento circular na VP superior direito de registrar potenciais PV e confirmar bloqueio de condução depois de PVI. Retire-se o cateter de ablação a partir do ventrículo esquerdo para o átrio esquerdo (posição final de ambos os cateteres mostrados na Figura 2B).
- Drape o RCS com uma cobertura estéril. Posicionar a pega do cateter de ablação no braço robótico do sistema amigo.
3. Ablação Procedimento
- Executar a ablação por cateter de ablação circunferencial larga antral (WACA) usando uma temperatura máxima de 43 ° C e uma potência máxima de 35 W (septo) ou 25 W (parede posterior), respectivamente anúncio uma taxa de fluxo de 17 ml / min. Manipular o cateter de ablação por meio do braço robótico com a utilização de um controlo remoto de fora do campo de radiação.
- Realização da ablação, criando lesões ponto-a-ponto ao redor dos óstios PV esquerda e direita. Medida de forças de contato during ablação. Utilizar a redução da amplitude de electrogramas locais gravados na ponta do cateter de ablação, ou eliminação de dissociação dos electrogramas PV sobre o cateter circular e bloquear a entrada / saída como parâmetros de ablação.
- Marque cada ponto de ablação na reconstrução 3-D.
- Confirmar bloqueio de condução para cada PV pelo registro do potencial sobre o cateter de mapeamento circular dentro do PV (bloco de entrada) e pela estimulação de dentro do PV sem a captura do átrio (bloco de saída).
4. Pós-ablação Procedimento e recuperação do paciente
- Pare de infusão de propofol e remover todos os cateteres.
- Medir o tempo de coagulação ativado (TCA) e administrar 3.000 IE protamina se ACT> 300 segundos antes da remoção das bainhas. Retirar as bainhas e executar a compressão manual sobre o local da punção durante 10 minutos e até parar hemorragias. Coloque um curativo compressivo na virilha e aconselhar o paciente a colocar ainda durante 8 horas.
- Transferência patient a uma unidade de passo para baixo e monitorar durante 4 horas e até totalmente sensível.
- Administrar heparina de baixo peso molecular como anticoagulante até a alta. Comece a anticoagulação oral (varfarina ou um anticoagulante oral directa) do dia após o procedimento.
- Execute ecocardiografia transtorácica no dia após o procedimento, conforme descrito antes de 17. Descartar derrame pericárdio e determinar a função valvular e fração de ejeção do ventrículo esquerdo 17.
Resultados
Ponto final do procedimento é o isolamento eléctrico completo de todas as veias pulmonares. Recentemente, foi demonstrado em um estudo com 119 pacientes, que os parâmetros processuais e os resultados não foram significativamente diferentes nos procedimentos com o RCS (n = 40) em comparação com a abordagem padrão manual (n = 79). A análise estatística (Mann-Whitney-U-test) não revelou diferenças significativas na duração do procedimento (159,1 ± 45,4 vs 146 ± 30,1 min, p = 0,19) de fornecimento de energia total (78.146,3 ± 26992,4 87963,9 ± vs. 79.202,1 Ws, p = 0,57 ) e tempo de fluoroscopia total (21,2 ± 8,6 vs. 23,9 ± 5,4 min, p = 0,15). No entanto, o operador de exposição fluoroscopia foi significativamente reduzida no grupo RCS (13,4 ± 6,1 vs 23,9 ± 5,4 min, p <0,001) 7.
Adicionalmente, foi realizada análise dos primeiros 21 doentes com o PVI de RCS. As características do paciente e os dados clínicos são apresentados na Tabela 1 . Esta análise representa uma experiência em um único centro. Foram analisados dados de uma série de 20 pacientes com PVI (dados de um paciente estava indisponível devido a razões técnicas). A análise estatística dos parâmetros processuais foi realizada utilizando o-Whitney U-test de Mann. Os resultados são apresentados como média ± desvio padrão (SD) para variáveis contínuas e como números e porcentagens para variáveis discretas. Duração total do procedimento foi de 137,3 ± 24,2 min, tempo de fluoroscopia total foi de 26,1 ± 6,1 min, operador de exposição fluoroscopia foi de 14,8 ± 6,1 min. O isolamento das veias pulmonares (VP) foi conseguida em todos os pacientes com a utilização do sistema remoto. Comparação de duração do procedimento, tempo de fluoroscopia total e operador de duração da exposição fluoroscopia entre foi realizado para analisar melhoria processual com a crescente experiência com a técnica. A média de duração dos processos 11 - 20 foi significativamente reduzida em comparação aos casos 1 - 10 (125,5 ± 18,1 vs.149 ± 24,6 min, p = 0,029), enquanto que a redução do tempo de fluoroscopia total (23,1 ± 6,4 vs. 28,7 ± 9,3 min, p = 0,21) e o tempo de exposição do operador fluoroscopia (12,9 ± 5,35 ± 6,48 vs 17 min, p = 0,2 ) não atingiu significância (Figuras 3 e 4). Medição da força de contacto não foi realizada. Não houve complicações.
Estes resultados preliminares sugerem que o mapeamento do átrio esquerdo e PVI é viável e eficaz. O isolamento das veias pulmonares foi alcançada em todos os casos. A curva de aprendizagem foi curto, com uma redução significativa do tempo de procedimento no caso de 11-20. Operador de exposição fluoroscopia foi consideravelmente reduzido.
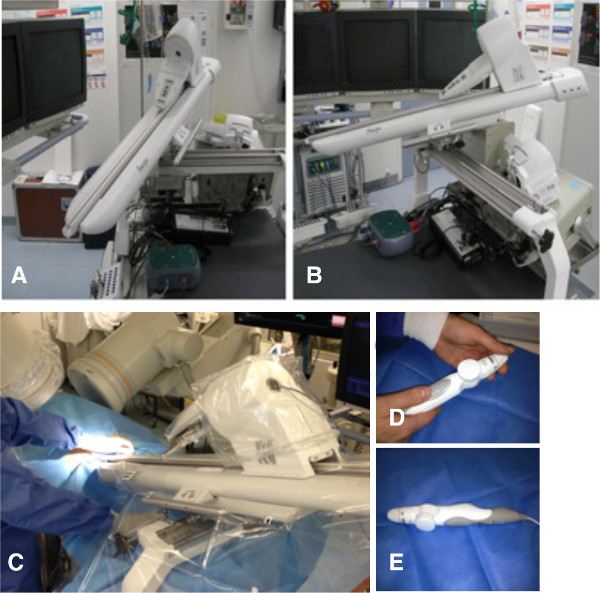
Figura 1. O sistema de cateter remoto. Braço robótico ligado à tabela de cateter antes de (A e B) edepois (C) inserção da ablação catheter.Handheld controlador remoto (D e E). Por favor clique aqui para ver uma versão maior desta figura.
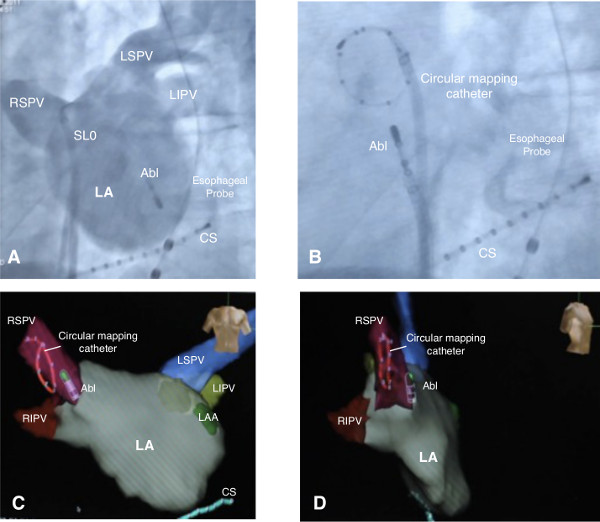
Figura 2. Imagens do átrio esquerdo. Angiografia atrial esquerda em projeção oblíqua anterior esquerda com o uso de uma bainha SLO para angiografia e um cateter de ablação por ventricular de alta frequência de estimulação (A). Cateter de mapeamento circular posicionado na veia pulmonar superior direita (B). 3-D-reconstrução do átrio esquerdo. O cateter de mapeamento circular é mostrado na veia pulmonar superior direita. Átrio esquerdo é mostrado em ântero-posterior (C) e vista (D) lateral direito. Abl = ablação catheter, CS = cateter do seio coronariano, LAA = apêndice atrial esquerdo, LA = átrio esquerdo, VPIE = veia pulmonar inferior esquerda, VPSE = veia pulmonar superior esquerda, VPID = veia pulmonar inferior direita, RSPV = veia pulmonar superior direita. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Os dados processuais para procedimento 1-10 vs. 11 - 20. O tempo do procedimento (A), tempo de fluoroscopia total (B), e operador de tempo de exposição fluoroscopia (C) para o procedimento 1 - 10 e 11 - 20. * estatisticamente significativa .
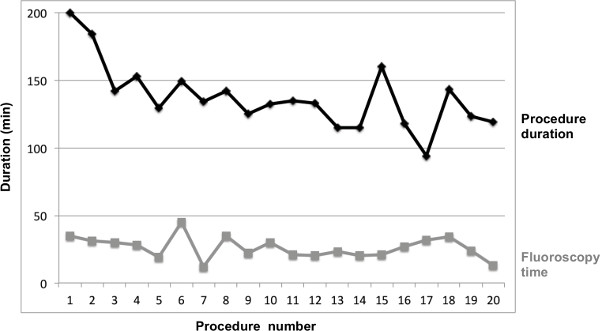
Figura 4. Processo durção e tempo de fluoroscopia total para procedimento 1-20.
| As características basais | |
| Número de pacientes | 21 |
| Idade (anos) (SD) | 64,1 (8,5) |
| Masculino (%) | 17 (81) |
| IMC (SD) | 28,1 (4,1) |
| FA paroxística (%) | 14 (66,7) |
| Hipertensão (%) | 16 (76,2) |
| CAD (%) | 5 (23.8) |
| FEVE (%) (SD) | 56,9 (4,6) |
| LA diâmetro (mm) (SD) | 42,4 (4,9) |
Tabela 1. Os pacientes 'características e dados clínicos. Características e dados clínicos dos primeiros 20 pacientes submetidos a ablação de FA com o cathet remotosistema er no nosso centro. AF = atrial, CAD = doença arterial coronariana, LA = átrio esquerdo, FEVE = fração de ejeção do ventrículo esquerdo atrial
Discussão
Tem sido relatado pelo grupo de Haissaguerre que antral PVI é um tratamento curativo para FA paroxística 1,2,10. Dados mais recentes em comparação PVI com o tratamento médico em FA paroxística e encontrou uma menor taxa de recorrência de FA após PVI em comparação com antiarrhythmia tratamento após 2 anos de seguimento 11. No entanto, como os autores do estudo concluem RAAFT-2, as taxas de recorrência após os dois tipos de tratamento são elevados 11. Por isso, a melhoria da técnica é necessário.
Tem sido discutido antes, que o controle manual do cateter pode resultar em movimentos imprecisos cateter 5,7. Por conseguinte, é de interesse clínico, se a ablação com o uso de um braço robótico é viável e eficaz. Por outro lado, o aumento da estabilidade pode conduzir a complicações graves tais como perfuração da parede cardíaca e lesão das estruturas adjacentes. Em um estudo publicado anteriormente, se mostrou que o mapeamento do átrio esquerdo e PVIcom a RCS é factível e eficaz. Nenhuma complicação maior foi observada 7, confirmando os resultados anteriormente publicados sobre a segurança da ablação robótico 12,13. Operador de exposição fluoroscopia é significativamente menor, sem diminuição das taxas de sucesso do procedimento 7.
O primeiro passo crítico é a punção trans-septal. Há um risco significativo de perfuração da parede atrial e tamponamento cardíaco, bem como de prejuízo para a aorta. Punção deve ser realizada em fossa oval sob orientação fluoroscópica e com um cateter CS como marco para minimizar o risco. O próximo passo crítico é o 3-D-reconstrução. Precisão do-imagem 3-D depende anatomia do paciente, a estabilidade do cateter e imobilização do paciente. Portanto, sedação do paciente suficiente é crucial para evitar artefatos de movimento e criar uma imagem de confiança. O terceiro passo crítico é a aplicação das lesões de ablação. Optima estabilidade do cateter eo contato parede deve ser achieved.
Uma das principais vantagens dos RCS (em comparação com outros sistemas robóticos) é que é possível mudar a ablação manual durante o procedimento e de volta para a ablação robótico. Isto pode ser muito útil em caso de anormalidades anatômicas ou estruturas difíceis (por exemplo, um óstio comum de PVs esquerda). O operador pode realizar a ablação manualmente em áreas difíceis e utilizar os RCS para os locais de ablação restantes. Por conseguinte, a mudança de robótico para ablação manual pode ser uma solução para situações difíceis durante o procedimento.
Como mencionado antes, a medição da força de contacto poderia adicionar informações valiosas para o operador 7. No caso aqui apresentado, à força de contacto e contato com o tecido cateter com o uso do sistema de mapeamento são avaliados. Contato mapeamento força poderia aumentar ainda mais a eficácia ea segurança do procedimento 14.
É importante notar que, apesar de os EUAe da RCS certos passos do processo ainda tem que ser realizada manualmente, tais como furos e o posicionamento do cateter de mapeamento circular no interior das veias pulmonares transeptal. No entanto, essas etapas geralmente pode ser levada a cabo rapidamente e não necessitam de tempo longo fluoroscopia.
Além disso, o feedback tátil está faltando durante a ablação por cateter robótico. O médico tem que contar com a fluoroscopia, a reconstrução 3-D e medição de força de contato. Estudos sobre o uso da medição de força de contato durante a ablação de FA têm mostrado que feedback tátil é de valor muito limitado para a estimativa da força de contacto 15. Portanto, a medida de força de contato é considerada superior à de feedback tátil em termos de eficácia. No entanto, o valor de retorno táctil para terminais de segurança (por exemplo, a prevenção da perfuração da parede auricular) é menos clara, uma vez que a incidência de perfuração é muito inferior à incidência de recorrência de fibrilação atrial devido a PV reconexão. Theoretcamente, a medição da força de contacto também devem evitar excessivamente alto vigor e perfuração da parede. Um estudo anterior descobriu uma incidência relativamente elevada de lesões esofágicas após robótico AF ablação 16. Embora um sistema robótico diferente foi usado e não força de contacto foi medido os resultados do estudo por Tilz et ai. Pode pelo menos em parte para aplicar as RCS utilizados no nosso protocolo. Grandes estudos prospectivos e randomizados estão faltando, mas vários estudos sobre a experiência inicial com os RCS apoiar a visão de que a ablação robótico com o RCS é seguro 7-9.
Nós aqui apresentamos um protocolo para a ablação de FA robótico. Em contraste com os estudos anteriores que utilizam um cateter com medição de força de contacto para aumentar a segurança e eficácia do processo. Exposição do operador a fluoroscopia podem ser significativamente reduzidos. Estabilidade cateter é mais provável aumentou e os resultados são comparáveis a ablação manual. Além disso, a alternância entre o manual de roboablação tique é fácil, o que é um aspecto único da RCS. Em conclusão, a ablação com o uso da RCS pode nos procedimentos futuros otimizar PVI, reduzir a exposição do operador radiação e aumentar a precisão da técnica. Por conseguinte, a ablação robótico com a RCS é uma abordagem promissora no tratamento de FA.
Divulgações
Free access to this article was sponsored by Catheter Robotics, Inc. Alexander Wutzler has received moderate lecture fees from Biotronik and travel grants from Boston Scientific. Leif-Hendrik Boldt has received moderate lecture fees from Catheter Robotics, St. Jude Medical and Boston Scientific.
Agradecimentos
The authors have no acknowledgements.
Materiais
| Name | Company | Catalog Number | Comments |
| Amigo Remote Catheter System | Catheter Robotics/Boston Scientific | Robotic system | |
| BRK transseptal needle (71 cm) | St Jude Medical | Needle for transseptal puncture | |
| 8.5 F SR0 sheath | Swartz/St Jude Medical | long sheath to access the left atrium and to provide stability for the ablation catheter | |
| 8.5 F SL0 sheath | Swartz/St Jude Medical | long sheath to access the left atrium and to provide stability for the LASSO catheter | |
| LASSO catheter + cable | Biosense Webster | Circular mapping catheter (7 F) to measure electrical activity in the pulmonary veins | |
| IBI inquiry decapolar catheter + cable | St Jude Medical | Coronary sinus catheter | |
| Thermocool SmartTouch | Biosense Webster | open-irrigated ablation catheter (7,5 F) with a 3,5 mm tip and contact force measurement, the tip is heated to apply thermal lesions in the left atril myocardium | |
| Heparin | Braun | 1. heparinized irrgation solution for preparation of the sheath,2. intravenous unfractionated heparin for procedural anticoagulation | |
| Propofol | Fresenius | Procedural sedation | |
| Midazolam | Roche | Procedural sedation | |
| NaCl solution | Braun | Irrigation solution for the ablation catheter | |
| CARTO | Biosense Webster | Mapping System and contact force measurement; this system allows a 3-D- reconstrcution of the left atrium and navigation of the moving catheter | |
| UHS-20 | Biotronik | Electrical Stimulator for stimulation of cardiac tissue via catehetr tip of the LASSO-, CS- or ablation catheter | |
| EP Shuttle | Stockert | Ablation Generator for application of energy and thermal lesion via the catheter tip | |
| 6 F sheath | Terumo | sheath to provide femoral access | |
| Lifepack 15 defibrillator | Physio Control | Defibrillator/monitoring device | |
| Pericardiocentesis set | variuous | Emergency set |
Referências
- Camm, A. J., et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: An update of the 2010 ESC Guidelines for the management of atrial fibrillation * Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 33 (21), 2719-2747 (2012).
- Calkins, H., et al. HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. J Interv Card Electrophysiol. 33, 171-257 (2012).
- Ouyang, F., et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the PVs: lessons from double Lasso technique. Circulation. 111, 127-135 (2005).
- Reddy, V. Y., et al. Low catheter-tissue contact force results in late pv reconnection—initial results from. EFFICAS I. Heart Rhythm. 8, S26 (2011).
- Nguyen, B. L., Merino, J. L., Gang, E. S. Remote Navigation for Ablation Procedures – A New Step Forward in the Treatment of Cardiac Arrhythmias. European Cardiology. 6, 50-56 (2010).
- Malcolme-Lawes, L. C., et al. Robotic assistance and general anaesthesia improve catheter stability and increase signal attenuation during atrial fibrillation ablation. Europace. 15 (1), 41-47 (2013).
- Wutzler, A., et al. Robotic ablation of atrial fibrillation with a new remote catheter system. J Interv Card Electrophysiol. 40 (3), 215-219 (2014).
- Datino, T., et al. Comparison of the safety and feasibility of arrhythmia ablation using the Amigo Robotic Remote Catheter System versus manual ablation. Am J Cardiol. 113 (5), 827-831 (2014).
- Khan, E. M., et al. First experience with a novel robotic remote catheter system: Amigo™ mapping trial. J Interv Card Electrophysiol. 37 (2), 121-129 (2013).
- Hocini, M., et al. Prevalence of pulmonary vein disconnection after anatomical ablation for atrial fibrillation: consequences of wide atrial encircling of the pulmonary veins. Eur Heart J. 26 (7), 696-704 (2005).
- Morillo, C. A., et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA. 311 (7), 692-700 (2014).
- Rillig, A., et al. Persistent iatrogenic atrial septal defect after a single-puncture, double-transseptal approach for pulmonary vein isolation using a remote robotic navigation system: results from a prospective study. Europace. 12 (3), 331-336 (2010).
- Hlivák, P., Mlčochová, H., Peichl, P., Cihák, R., Wichterle, D., Kautzner, J. Robotic navigation in catheter ablation for paroxysmal atrial fibrillation: midterm efficacy and predictors of postablation arrhythmia recurrences. J Cardiovasc Electrophysiol. 22 (5), 534-540 (2011).
- Saliba, W., et al. Atrial fibrillation ablation using a robotic catheter remote control system: initial human experience and long-term follow-up results. J Am Coll Cardiol. 51 (25), 2407-2411 (2008).
- Haldar, S., et al. Contact force sensing technology identifies sites of inadequate contact and reduces acute pulmonary vein reconnection: a prospective case control study. Int J Cardiol. 168 (2), 1160-1166 (2013).
- Tilz, R. R., et al. Unexpected high incidence of esophageal injury following pulmonary vein isolation using robotic navigation. J Cardiovasc Electrophysiol. 21 (8), 853-858 (2010).
- Hahn, R. T., et al. Guidelines for Performing a Comprehensive Transesophageal Echocardiographic Examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. Anesth Analg. (1), 21-68 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados