Method Article
Robotic Ablazione della fibrillazione atriale
In questo articolo
Riepilogo
Pulmonary vein isolation (PVI) with an ablation catheter is a curative treatment for atrial fibrillation (AF). Robotic catheter systems aim to improve catheter steerability. Here, a procedure with a new robotic catheter system is presented. The goal of the procedure is electrical block between pulmonary vein and left atrium.
Abstract
Contesto: isolamento della vena polmonare (PVI) è un trattamento stabilito per la fibrillazione atriale (FA). Durante PVI viene creato un blocco di conduzione elettrica tra vena polmonare (PV) e atrio sinistro (LA). Questo blocco di conduzione impedisce AF, che viene attivato da attività elettrica irregolare proveniente dal fotovoltaico. Tuttavia, le lesioni atriale transmurali sono necessari, che può essere difficile. Re-conduzione e recidiva AF verificarsi in 20 - 40% dei casi. Sistemi robotizzati catetere mirano a migliorare il catetere manovrabilità. Qui, una procedura con un nuovo sistema di catetere a distanza (RCS), viene presentato. Obiettivo di questo articolo è quello di mostrare la fattibilità di robotica di ablazione FA con un nuovo sistema. Materiali e Metodi: Dopo interatriale puntura trans-settale viene eseguita utilizzando una lunga guaina e ago sotto guida fluoroscopica. L'ago viene rimosso e un filo guida viene inserito nel fotovoltaico superiore sinistro. Poi un catetere di ablazione è posizionato nel LA, utilizzando la guaina e filo come guidail Los Angeles. LA angiografia viene eseguita sulla guaina. Un catetere di mappatura circolare è posizionato attraverso la guaina lunga nel LA e viene eseguito un tridimensionale (3-D) ricostruzione anatomica della LA. Il manico del catetere di ablazione è posizionato nel braccio robotico del sistema Amigo e la procedura di ablazione inizia. Durante la procedura di ablazione, l'operatore manipola il catetere per ablazione tramite il braccio robotico con l'utilizzo di un telecomando. L'ablazione è eseguita creando lesioni punto per punto attorno osti PV sinistra e destra. Forza di contatto è misurata sulla punta del catetere di fornire valutazioni di contatto catetere-tessuto. Blocco di conduzione è confermata registrando i potenziali fotovoltaici sul catetere di mappatura circolare e manovre di stimolazione. L'operatore rimane fuori dal radiationfield durante l'ablazione. Conclusione: il sistema del catetere romanzo permette l'ablazione con alta stabilità a basso operatore esposizione fluoroscopia.
Introduzione
AF è l'aritmia cardiaca più comune, con una prevalenza di 1-2% nella popolazione generale. I sintomi includono palpitazioni, vertigini, dispnea e capacità di esercizio ridotti. Inoltre, il rischio di ictus è notevolmente aumentata nei pazienti con fibrillazione atriale. Negli ultimi dieci anni, PVI è diventata una opzione di trattamento curativo stabilito per i pazienti affetti da FA 1,2.
Il principio di base del PVI è l'applicazione di lesioni circolari attorno dell'ostio PV con radiofrequenza (RF) per creare un blocco di conduzione elettrica tra PV e l'atrio sinistro. Questo blocco di conduzione previene la fibrillazione atriale, che viene attivato da attività elettrica irregolare proveniente dal fotovoltaico. Tuttavia, le lesioni transmurali sono tenuti a realizzare blocco di conduzione e l'applicazione delle lesioni transmurali può essere impegnativo. Re-conduzione e recidiva di fibrillazione atriale dopo ablazione transcatetere verifica in 20 - 40% dei casi 1,2.
Come è stato dimostrato di recente, sufficiente contatto catetere-tessuto e la stabilità del catetere sono i presupposti di efficaci lesioni ablazione 3,4. Sono state sviluppate numerose tecniche e approcci di ablazione per migliorare catetere stabilità, streerability e contatto catetere tessuti. Tra gli altri, sistemi robotici sono di particolare interesse. I vantaggi e principi di ablazione robotica sono stati discussi prima di 5-7. Questi sistemi possono migliorare non solo la stabilità del catetere minimizzando artefatti del manuale manipolazione del catetere, ma hanno anche il vantaggio di ridurre l'esposizione fluoroscopia per l'operatore in quanto il sistema è gestito tramite telecomando dall'esterno del campo di radiazione. Recentemente è stato introdotto un sistema robot romanzo con catetere a distanza manovrabilità. Fattibilità e l'efficacia di questo sistema per PVI e altre procedure elettrofisiologiche, quali AV-nodali-rientro-tachcardia, vie accessorie o flutter atriale e atriale o ventriculatachicardie r è stata valutata 7-9. Una riduzione significativa di operatori dell'esposizione fluoroscopia rispetto al ablazione manuale è stato mostrato, mentre tutti gli altri parametri procedurali e percentuale di successo a 12 mesi di follow up non erano significativamente differenti 7.
Una procedura di mappatura atriale sinistra e PVI con l'utilizzo di questo nuovo sistema catetere remoto è presentato qui.
Dopo aver ottenuto l'accesso vascolare attraverso la vena femorale, interatriale puntura trans-settale viene eseguita utilizzando una lunga guaina trans-settale e un ago trans-settale sotto guida fluoroscopica. Dopo puntura trans-settale, l'ago viene rimosso e un filo guida è posto tramite la guaina trans-settale nella vena polmonare superiore sinistro. Poi la guaina in tirato indietro nella vena cava inferiore e una ablazione transcatetere è posizionato nella Los Angeles, con il filo come guida ai fossa ovale e la LA ("one-foratura, doppio accesso" -technique). Una volta che il ablation catetere è entrato nel LA, la guaina viene spostata in avanti per la LA pure, il filo guida viene rimosso e l'ablazione con catetere è posizionato nel ventricolo sinistro. Una angiografia atriale sinistra è eseguita sulla guaina, mentre il catetere per ablazione viene utilizzato per alta frequenza ventricolare stimolazione per aumentare il contrasto opacizzazione. Dopo LA angiografia è completata, un catetere di mappatura circolare è posizionato attraverso la guaina lunga in LA e una ricostruzione 3-D-anatomica se il LA viene eseguita con l'uso di un sistema di mappatura. Il catetere mappatura circolare è posizionato nel fotovoltaico destro superiore di registrare i potenziali fotovoltaici e confermare blocco della conduzione dopo PVI. Il catetere di ablazione viene ritirato dal ventricolo sinistro nell'atrio sinistro e la maniglia del catetere di ablazione è posizionato nel braccio robotico del sistema amigo. Durante la procedura di ablazione, l'operatore manipola il catetere per ablazione tramite il braccio robotico con l'utilizzo di un telecomando. L'ablazione è eseguita da crmangiare lesioni punto per punto tutto il osti PV sinistra e destra. Blocco di conduzione è confermata registrando i potenziali fotovoltaici sul catetere di mappatura circolare e manovre di stimolazione.
CASE PRESENTAZIONE
Eseguire questa procedura in un paziente con sintomatica parossistica farmaco refrattaria AF senza gravi comorbilità e nessuna cardiochirurgia precedente. Eseguire i test pre-diagnostici che sono descritti di seguito.
DIAGNOSI, VALUTAZIONE E PIANO
La diagnosi di AF è confermato dalle ripetute registrazioni Holter ECG, tra cui la correlazione della FA e sintomi (palpitazioni, dispnea, ridotta capacità di esercizio). Se AF viene registrato ed i sintomi sono segnalati nonostante il trattamento con almeno 1 farmaco antiaritmico, PVI è indicato per il trattamento di farmaco-refrattario AF sintomatica secondo le linee guida attuali. PVI è prevista e il consenso informato scritto è ottenuto dalla paziente. Prima di PVI physiesame cal, le prove di laboratorio, transesofagea e l'ecocardiografia transtoracica vengono eseguite per escludere sinistra trombo atriale e grave malattia cardiaca strutturale. Procedura PVI è eseguita in uno stato di digiuno sotto sedazione profonda. Antagonisti della vitamina K sono sospesi 5 giorni prima dell'ablazione, eparina a basso peso molecolare è avviato quando il rapporto internazionale normalizzato è <2.
Protocollo
Il protocollo presentato qui è l'approccio standard di robot ablazione transcatetere RCS presso il dipartimento di cardiologia, Charité - Universitätsmedizin Berlino, Campus Virchow. Il protocollo e l'analisi delle procedure e dei risultati dei pazienti è stato approvato dal comitato etico locale della Charité - Universitätsmedizin Berlino.
1. Il catetere Remote System (RCS)
- Fissare il braccio robotico al tavolo operatorio, come descritto prima 7 (Figura 1).
NOTA: La RCS è costituito da un manipolatore catetere a distanza, che è un braccio robotico che può essere spostato tramite telecomando. - Posizionare il catetere per ablazione nella docking station della RCS. Manipolare il catetere con l'utilizzo di un telecomando, mentre il medico operativo rimane fuori del campo di radiazione 7. Advance, ritirare, ruotare e deviare il catetere con l'uso della RCS.
2. Pre-ablazione Preparazione
- Posizionare il paziente sul tavolo operatorio e indurre sedazione profonda con Midazolam (0,03 mg / kg in bolo) e Propofol (infusione continua 4 mg / kg / ora).
- Inserire una sonda di temperatura in esofago per misurare la temperatura esofagea e prevenire lesioni esofagee.
- Attaccare ECG e gli elettrodi di superficie 12 derivazioni del sistema 3D-Mapping al corpo del paziente.
- Prima di avviare la procedura assicura che il materiale seguente sono pronti.
- Un ago transettale (71 cm) e un 8.5 F SL0 fodero con filo guida. A 6 F e 7 F 25 centimetri guaina. Un decapolare e un catetere diagnostico streerable circolare. Un catetere per ablazione open-irrigata e un generatore di ablazione.
- Inoltre, garantiscono che una siringa contrasto e un vassoio pericardiocentesi sono disponibili per il trattamento acuto di complicanze.
- Posizionare il braccio robotico del sistema in una garza sterile e pronto all'uso. Fissare il telec palmareroller al braccio robotico (Figura 1).
- Ottenere accesso venoso tramite puntura venosa bilaterale con 6 F, 7 F e 8,5 F guaina e posizionare un catetere diagnostico decapolare nel seno coronarico (CS).
- Eseguire transettale puntura sotto guida fluoroscopica utilizzando un F lungo fodero 8.5 SLO e un ago transettale 71 centimetri.
- Dopo puntura trans-settale, rimuovere l'ago e introdurre un filo guida tramite la guaina trans-settale in vena polmonare superiore sinistro. Quindi disegnare indietro la guaina nella vena cava inferiore.
- Posizionare una F fodero lungo SRO 8.5 con un filo in atrio sinistro (LA), utilizzando il cavo come guida ai fossa ovale e la LA ("one-foratura, doppio accesso" -technique). Far avanzare un catetere per ablazione open-irrigate con una punta da 3,5 mm misura forza di contatto con la guaina SR0 al Los Angeles.
- Amministrare eparina con un tasso di 15 UI / kg / h in seguito a un bolo di 140 UI / kg per mantenere un tempo di coagulazione attivato (ACT) tra il 300 e 350 sec durante tutta la procedura.
- Una volta che l'ablazione transcatetere è entrato nel Los Angeles, di introdurre la guaina in Los Angeles pure. Rimuovere il filo guida e dilatatore della guaina SLO e posizionare il catetere di ablazione nel ventricolo sinistro. Eseguire LA angiografia sulla guaina, mentre usando il catetere di ablazione per alta frequenza ventricolare stimolazione per migliorare opacizzazione contrasto (LA angiografia è mostrato in Figura 2A).
- Avanzare di un catetere di mappatura circolare attraverso la guaina lunga in LA (catetere mappatura circolare illustrato nella Figura 2B).
- Eseguire una ricostruzione anatomica 3-D della LA con l'uso di un sistema di mappatura e il catetere di mappatura circolare. Creare una ricostruzione 3-D-anatomica della LA spostando il catetere circolare sulla superficie interna della LA, tutti i quattro PV e dell'atrio sinistro, mentre si utilizza un sistema di mappatura computerizzato per la registrazione del movimento in relazione ad un elettrodo di riferimento (complete 3-D-map è mostrato in Figura 2C e D).
- Posizionare il catetere mappatura circolare nella giusta PV superiore per registrare i potenziali fotovoltaici e confermare blocco della conduzione dopo PVI. Arretrare il catetere di ablazione dal ventricolo sinistro all'atrio sinistro (posizione di destinazione di entrambi cateteri mostrato nella Figura 2B).
- Passare il RCS con una copertura sterile. Posizionare la maniglia del catetere di ablazione nel braccio robotico del sistema amigo.
3. Ablazione Procedura
- Eseguire catetere ablazione vasta antrale ablazione circonferenziale (WACA) utilizzando una temperatura massima di 43 ° C e una potenza massima di 35 W (setto) o 25 W (parete posteriore) rispettivamente ad una velocità di flusso di 17 ml / min. Manipolare il catetere di ablazione tramite il braccio robotico con l'utilizzo di un telecomando dall'esterno del campo di radiazione.
- Eseguire l'ablazione con la creazione di lesioni punto per punto tutto il osti PV sinistra e destra. Misura contatto forza during ablazione. Utilizzare locale riduzione dell'ampiezza dell'elettrogramma registrata sulla punta del catetere di ablazione, eliminazione o dissociazione dei elettrogrammi fotovoltaici sul catetere circolare e ingresso blocco / uscita come endpoint ablazione.
- Segnare ogni punto di ablazione sulla ricostruzione 3-D.
- Confermare blocco di conduzione per ogni singolo PV registrando potenziali sul catetere mappatura circolare all'interno del PV (blocco ingresso) e stimolazione dall'interno del fotovoltaico senza cattura dell'atrio (blocco uscita).
4. post-ablazione Procedura e il recupero del paziente
- Smettere di infusione di Propofol e rimuovere tutti i cateteri.
- Misurare il tempo di coagulazione attivato (ACT) e somministrare 3.000 protamina IE se ACT> 300 sec prima della rimozione delle guaine. Rimuovere le guaine ed eseguire la compressione manuale sul sito di puntura per 10 minuti e fino a quando i sanguinamenti fermate. Mettere una medicazione all'inguine e consigliare al paziente di gettare ancora per 8 ore.
- Trasferimento patient ad una unità passo verso il basso e monitor per 4 ore e fino a completo reattivo.
- Amministrare eparina a basso peso molecolare, come anticoagulante fino alla dimissione. Inizia anticoagulante orale (Warfarin o un anticoagulante orale diretta), il giorno dopo la procedura.
- Eseguire l'ecocardiografia transtoracica, il giorno dopo la procedura come descritto in precedenza 17. Escludere pericardico e determinare la funzione valvolare e ventricolare sinistra frazione di eiezione 17.
Risultati
Endpoint della procedura è un completo isolamento elettrico di tutti i PV. E 'stato dimostrato di recente in uno studio con 119 pazienti, che i parametri procedurali e gli esiti non erano significativamente differenti nelle procedure con RCS (n = 40) rispetto al metodo standard manuale (n = 79). L'analisi statistica (Mann-Whitney U-test) ha evidenziato differenze significative nella durata procedura (159.1 ± 45.4 vs 146 ± 30,1 min, p = 0,19) consegna dell'energia totale (78.146,3 26.992,4 ± contro 87.963,9 79.202,1 ± Ws, p = 0.57 ) e il tempo di fluoroscopia totale (21,2 ± 8,6 vs 23,9 ± 5,4 min, p = 0,15). Eppure, operatore esposizione fluoroscopia è stata significativamente ridotta nel gruppo RCS (13,4 ± 6,1 vs 23,9 ± 5,4 min, p <0.001) 7.
Inoltre, è stata eseguita l'analisi dei primi 21 pazienti del PVI la RCS. Le caratteristiche dei pazienti e dei dati clinici sono illustrati nella tabella 1 . Questa analisi rappresenta un'esperienza singolo centro. I dati sono stati analizzati per una serie di 20 pazienti con PVI (i dati di un paziente non era disponibile per motivi tecnici). L'analisi statistica dei parametri processuali stata effettuata utilizzando il Mann-Whitney U-test. I risultati sono presentati come media ± deviazione standard (SD) per le variabili continue e come numeri e percentuali per le variabili discrete. Durata totale procedura è stata 137,3 ± 24,2 minuti, il tempo totale è stato di 26,1 fluoroscopia ± 6,1 min, operatore esposizione fluoroscopia era 14,8 ± 6,1 min. Isolamento delle vene polmonari (PV) è stata raggiunta in tutti i pazienti con l'utilizzo del sistema remoto. Confronto di durata di procedura, il tempo totale e fluoroscopia operatore durata fluoroscopia esposizione tra stato eseguito per analizzare miglioramento procedurale con crescente esperienza con la tecnica. La durata media dei casi 11-20 era significativamente ridotto rispetto ai casi 1 - 10 (125.5 ± 18.1 vs149 ± 24,6 min, p = 0,029), mentre la riduzione dei tempi di fluoroscopia totale (23,1 ± 6,4 vs 28,7 ± 9,3 min, p = 0,21) e l'operatore il tempo di esposizione di fluoroscopia (12.9 ± 5,35 vs 6,48 ± 17 min, p = 0.2 ) non hanno raggiunto la significatività (figure 3 e 4). Misurazione della forza di contatto non è stato eseguito. Nessuna complicanza si è verificato.
Questi primi risultati suggeriscono che la sinistra mappatura atriale e PVI è fattibile ed efficace. Isolamento delle PV è stato ottenuto in tutti i casi. La curva di apprendimento è stato breve, con una significativa riduzione dei tempi procedura in caso 11-20. Operatore esposizione fluoroscopia è stata notevolmente ridotta.
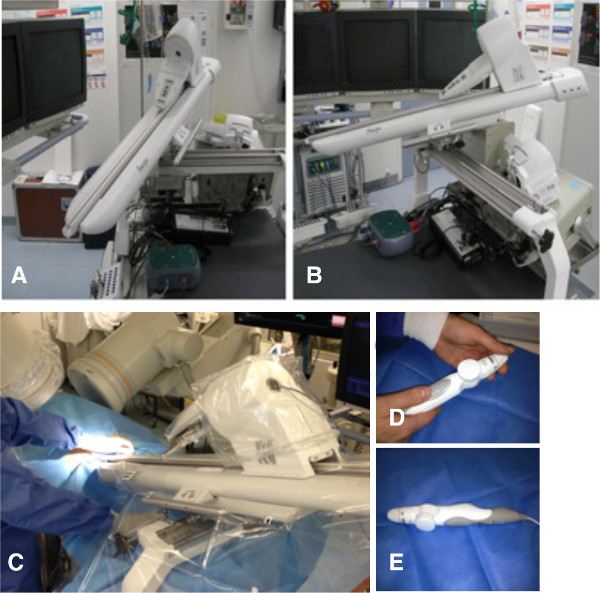
Figura 1. Sistema catetere remoto. Braccio robotico collegato alla tabella catetere prima (A e B) edopo (C) inserimento dell'ablazione catheter.Handheld telecomando (D ed E). Cliccate qui per vedere una versione più grande di questa figura.
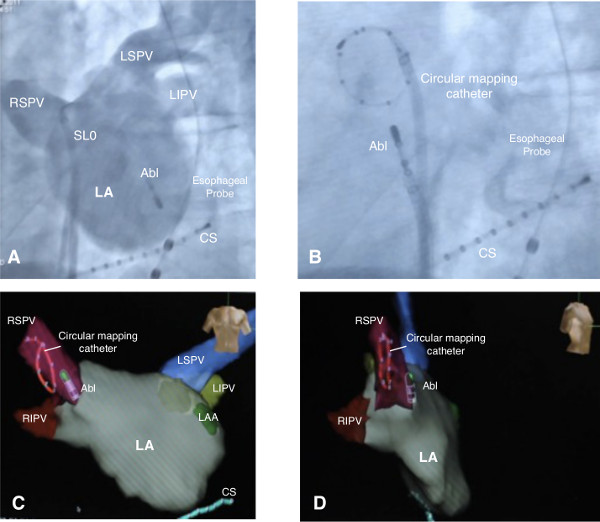
Figura 2. Immagini dell'atrio sinistro. Angiografia atriale in anteriore sinistra vista obliqua con l'uso di una guaina SLO per angiografia e un catetere di ablazione per alta frequenza di stimolazione ventricolare (A). Catetere mappatura circolare posizionate a destra vena polmonare superiore (B). 3-D-ricostruzione dell'atrio sinistro. Il catetere di mappatura circolare è mostrato nella giusta vena polmonare superiore. Atrio sinistro è mostrato in antero-posteriore (C) e laterale destro (D) view. Abl = ablazione catetereter, CS = catetere seno coronarico, LAA = sinistra appendice atriale, LA = atrio sinistro, LIPV = sinistra vena polmonare inferiore, LSPV = sinistra vena polmonare superiore, RIPV = destra vena polmonare inferiore, RSPV = destra della vena polmonare superiore. Cliccate qui per visualizzare una versione più grande di questa figura.

Figura 3. Dati procedurali per la procedura 1-10 contro 11 - 20. Procedura durata (A), tempo di fluoroscopia totale (B), e l'operatore di tempo di esposizione fluoroscopia (C) per la procedura 1 - 10 e 11 - 20. * statisticamente significativo .
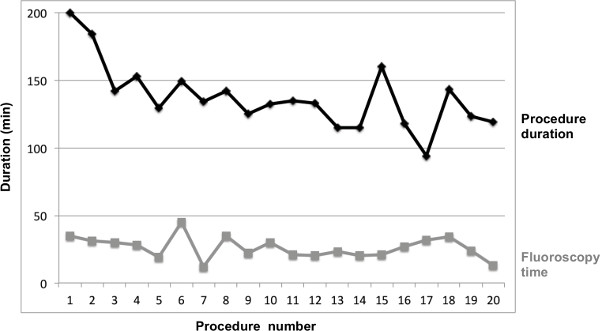
Figura 4. Procedura durzione e il tempo di fluoroscopia totale per la procedura 1 - 20.
| Caratteristiche basali | |
| Numero di pazienti | 21 |
| Età (anni) (SD) | 64.1 (8.5) |
| Maschio (%) | 17 (81) |
| BMI (SD) | 28.1 (4.1) |
| Parossistica AF (%) | 14 (66,7) |
| Ipertensione (%) | 16 (76,2) |
| CAD (%) | 5 (23.8) |
| FEVS (%) (SD) | 56,9 (4,6) |
| Diametro LA (mm) (SD) | 42.4 (4.9) |
Tabella 1. Pazienti caratteristiche ei dati clinici. Caratteristiche e dati clinici dei primi 20 pazienti sottoposti a ablazione FA con il cathet a distanzaSistema er presso il nostro centro. AF = fibrillazione, CAD = malattia coronarica, LA = atrio sinistro, FEVS = frazione di eiezione ventricolare sinistra atriale
Discussione
E 'stato riportato dal gruppo di Haissaguerre che antral PVI è un trattamento curativo per parossistica 1,2,10. Dati più recenti rispetto PVI con cure mediche in FA parossistica e hanno trovato un tasso più basso di recidiva di fibrillazione atriale dopo PVI rispetto al antiaritmici trattamento dopo 2 anni di follow-up 11. Tuttavia, come del processo RAAFT-2, concludono gli autori, i tassi di recidiva dopo entrambi i tipi di trattamento sono alte 11. Pertanto, il miglioramento della tecnica è necessaria.
Si è discusso in precedenza, che il controllo del catetere manuale può causare movimenti imprecisi catetere 5,7. Si è quindi di interesse clinico, se l'ablazione con l'uso di un braccio robotico è fattibile ed efficace. D'altra parte, una maggiore stabilità potrebbe portare a complicazioni gravi come la perforazione della parete cardiaca e lesioni di strutture adiacenti. In uno studio pubblicato in precedenza, è stato dimostrato che la mappatura atriale sinistra e PVIcon la RCS è fattibile ed efficace. Nessuna complicanza maggiore è stata osservata 7, conferma i risultati pubblicati in precedenza sulla sicurezza di ablazione robotica 12,13. Operatore esposizione fluoroscopia è significativamente inferiore, senza riduzione di tassi di successo procedurale 7.
Il primo passo fondamentale è la puntura trans-settale. Vi è un rischio significativo di perforazione della parete atriale e tamponamento cardiaco, nonché lesioni all'aorta. Puntura deve essere eseguita in fossa ovale sotto guida fluoroscopica e con un catetere CS come punto di riferimento per ridurre al minimo il rischio. Il prossimo passo critico è il 3-D-ricostruzione. Precisione del 3-D-immagine dipende dalla conformazione anatomica del paziente, la stabilità del catetere e l'immobilizzazione del paziente. Pertanto, sufficiente sedazione del paziente è fondamentale per evitare artefatti di movimento e creare un'immagine affidabile. Il terzo passaggio critico è l'applicazione delle lesioni ablazione. Optima stabilità catetere e contatto della parete deve essere ragved.
Uno dei principali vantaggi dei RCS (rispetto ad altri sistemi robotici) è che è possibile passare ad ablazione manuale durante la procedura e ritorna ablazione robotico. Questo può essere molto utile in caso di anomalie anatomiche o strutture difficili (ad esempio, un ostio comune di PV a sinistra). L'operatore può eseguire l'ablazione manualmente in zone difficili e utilizzare i RCS per i siti di ablazione rimanenti. Pertanto, il passaggio da robotico per ablazione manuale potrebbe essere una soluzione per situazioni difficili durante la procedura.
Come accennato prima, la misura della forza di contatto potrebbe aggiungere informazioni preziose per l'operatore 7. Nel caso qui presentato, sono valutati forza di contatto e contatto del tessuto catetere con l'utilizzo del sistema di mappatura. Contatto forza mappatura potrebbe aumentare ulteriormente l'efficacia e la sicurezza della procedura 14.
È importante notare che, nonostante la use di RCS alcune fasi della procedura devono ancora essere effettuati manualmente, come foratura e posizionamento del catetere mappatura circolare all'interno delle vene polmonari trans-settale. Tuttavia, tali misure generalmente possono essere eseguite velocemente e non richiedono molto tempo fluoroscopia.
Inoltre, il feedback tattile è carente durante robotica ablazione transcatetere. Il medico deve fare affidamento su fluoroscopia, 3-D la ricostruzione e la misurazione forza di contatto. Studi sull'uso di misura forza di contatto durante l'ablazione AF hanno dimostrato che il feedback tattile è di valore molto limitato per la stima della forza di contatto 15. Pertanto, la misurazione forza di contatto è considerato superiore a un feedback tattile in termini di efficacia. Tuttavia, il valore di feedback tattile per gli endpoint di sicurezza (ad esempio, la prevenzione di perforazione parete atriale) è meno chiaro, poiché incidenza di perforazione è molto più basso di incidenza di recidiva di fibrillazione atriale causa di riconnessione PV. Theoretcamente, la misurazione della forza di contatto dovrebbe anche evitare troppo elevata forza e parete di perforazione. Uno studio precedente ha trovato una relativamente alta incidenza delle lesioni esofagee dopo l'ablazione robotica FA 16. Anche se un sistema robotico diverso è stato utilizzato e nessuna forza di contatto è stato misurato i risultati dello studio di Tilz et al. Potrebbe almeno in parte applica ai RCS utilizzati nel nostro protocollo. Grandi prospettici randomizzati prove mancano, ma numerosi studi su esperienza iniziale con i RCS sostengono l'idea che l'ablazione robotico con la RCS è sicuro 7-9.
Noi qui presentiamo un protocollo per l'ablazione della fibrillazione atriale robotica. In contrasto con gli studi precedenti si usa un catetere con misurazione forza di contatto per aumentare la sicurezza e l'efficacia della procedura. Operatore esposizione fluoroscopia può essere ridotto significativamente. Stabilità catetere è probabilmente aumentata ei risultati sono paragonabili a ablazione manuale. Inoltre, il passaggio tra il manuale di roboablazione tic è facile, che è un aspetto unico della RCS. In conclusione, l'ablazione con l'uso della RCS può in futuro procedure ottimizzare PVI, ridurre l'esposizione alle radiazioni dell'operatore e aumentare la precisione della tecnica. Pertanto, l'ablazione robotico con la RCS è un approccio promettente nel trattamento della fibrillazione atriale.
Divulgazioni
Free access to this article was sponsored by Catheter Robotics, Inc. Alexander Wutzler has received moderate lecture fees from Biotronik and travel grants from Boston Scientific. Leif-Hendrik Boldt has received moderate lecture fees from Catheter Robotics, St. Jude Medical and Boston Scientific.
Riconoscimenti
The authors have no acknowledgements.
Materiali
| Name | Company | Catalog Number | Comments |
| Amigo Remote Catheter System | Catheter Robotics/Boston Scientific | Robotic system | |
| BRK transseptal needle (71 cm) | St Jude Medical | Needle for transseptal puncture | |
| 8.5 F SR0 sheath | Swartz/St Jude Medical | long sheath to access the left atrium and to provide stability for the ablation catheter | |
| 8.5 F SL0 sheath | Swartz/St Jude Medical | long sheath to access the left atrium and to provide stability for the LASSO catheter | |
| LASSO catheter + cable | Biosense Webster | Circular mapping catheter (7 F) to measure electrical activity in the pulmonary veins | |
| IBI inquiry decapolar catheter + cable | St Jude Medical | Coronary sinus catheter | |
| Thermocool SmartTouch | Biosense Webster | open-irrigated ablation catheter (7,5 F) with a 3,5 mm tip and contact force measurement, the tip is heated to apply thermal lesions in the left atril myocardium | |
| Heparin | Braun | 1. heparinized irrgation solution for preparation of the sheath,2. intravenous unfractionated heparin for procedural anticoagulation | |
| Propofol | Fresenius | Procedural sedation | |
| Midazolam | Roche | Procedural sedation | |
| NaCl solution | Braun | Irrigation solution for the ablation catheter | |
| CARTO | Biosense Webster | Mapping System and contact force measurement; this system allows a 3-D- reconstrcution of the left atrium and navigation of the moving catheter | |
| UHS-20 | Biotronik | Electrical Stimulator for stimulation of cardiac tissue via catehetr tip of the LASSO-, CS- or ablation catheter | |
| EP Shuttle | Stockert | Ablation Generator for application of energy and thermal lesion via the catheter tip | |
| 6 F sheath | Terumo | sheath to provide femoral access | |
| Lifepack 15 defibrillator | Physio Control | Defibrillator/monitoring device | |
| Pericardiocentesis set | variuous | Emergency set |
Riferimenti
- Camm, A. J., et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: An update of the 2010 ESC Guidelines for the management of atrial fibrillation * Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 33 (21), 2719-2747 (2012).
- Calkins, H., et al. HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. J Interv Card Electrophysiol. 33, 171-257 (2012).
- Ouyang, F., et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the PVs: lessons from double Lasso technique. Circulation. 111, 127-135 (2005).
- Reddy, V. Y., et al. Low catheter-tissue contact force results in late pv reconnection—initial results from. EFFICAS I. Heart Rhythm. 8, S26 (2011).
- Nguyen, B. L., Merino, J. L., Gang, E. S. Remote Navigation for Ablation Procedures – A New Step Forward in the Treatment of Cardiac Arrhythmias. European Cardiology. 6, 50-56 (2010).
- Malcolme-Lawes, L. C., et al. Robotic assistance and general anaesthesia improve catheter stability and increase signal attenuation during atrial fibrillation ablation. Europace. 15 (1), 41-47 (2013).
- Wutzler, A., et al. Robotic ablation of atrial fibrillation with a new remote catheter system. J Interv Card Electrophysiol. 40 (3), 215-219 (2014).
- Datino, T., et al. Comparison of the safety and feasibility of arrhythmia ablation using the Amigo Robotic Remote Catheter System versus manual ablation. Am J Cardiol. 113 (5), 827-831 (2014).
- Khan, E. M., et al. First experience with a novel robotic remote catheter system: Amigo™ mapping trial. J Interv Card Electrophysiol. 37 (2), 121-129 (2013).
- Hocini, M., et al. Prevalence of pulmonary vein disconnection after anatomical ablation for atrial fibrillation: consequences of wide atrial encircling of the pulmonary veins. Eur Heart J. 26 (7), 696-704 (2005).
- Morillo, C. A., et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA. 311 (7), 692-700 (2014).
- Rillig, A., et al. Persistent iatrogenic atrial septal defect after a single-puncture, double-transseptal approach for pulmonary vein isolation using a remote robotic navigation system: results from a prospective study. Europace. 12 (3), 331-336 (2010).
- Hlivák, P., Mlčochová, H., Peichl, P., Cihák, R., Wichterle, D., Kautzner, J. Robotic navigation in catheter ablation for paroxysmal atrial fibrillation: midterm efficacy and predictors of postablation arrhythmia recurrences. J Cardiovasc Electrophysiol. 22 (5), 534-540 (2011).
- Saliba, W., et al. Atrial fibrillation ablation using a robotic catheter remote control system: initial human experience and long-term follow-up results. J Am Coll Cardiol. 51 (25), 2407-2411 (2008).
- Haldar, S., et al. Contact force sensing technology identifies sites of inadequate contact and reduces acute pulmonary vein reconnection: a prospective case control study. Int J Cardiol. 168 (2), 1160-1166 (2013).
- Tilz, R. R., et al. Unexpected high incidence of esophageal injury following pulmonary vein isolation using robotic navigation. J Cardiovasc Electrophysiol. 21 (8), 853-858 (2010).
- Hahn, R. T., et al. Guidelines for Performing a Comprehensive Transesophageal Echocardiographic Examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. Anesth Analg. (1), 21-68 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon