Method Article
Culturas placentária e Decidual órgão humano para estudar Infecções na interface materno-fetal
Neste Artigo
Resumo
Um método simples para estabelecer placentária primária humana (vilosidades) e culturas de órgãos deciduais é descrito. culturas de órgãos vilosidades e deciduais são ferramentas inestimáveis para estudar patogenia na interface materno-fetal humano. A infecção com a bactéria intracelular Listeria monocytogenes facultativos é demonstrada.
Resumo
A placenta mostra um elevado grau de variabilidade anatômica entre espécies. Para melhor compreender a biologia e fisiopatologia da placenta humana, é imperativo para projetar experimentos usando células e tecidos humanos. Uma vantagem de cultura de órgãos é a manutenção de tridimensional (3D) e organização estrutural da matriz extracelular. O objetivo do método descrito aqui é o sucesso do estabelecimento de ex vivo culturas de órgãos de tecido gestacional humanos e sua manutenção de cultura saudável para 72-96 horas. Detalhes do protocolo a transformação imediata da pesquisa-consentida, placentária e espécimes deciduais frescos da sala de cirurgia. Estes são espécimes abundantes que seriam descartados. Instruções detalhadas sobre a coleta estéril dessas amostras, incluindo detalhes morfológicos sobre como escolher tecidos apropriados para estabelecer culturas de órgãos em 3D, é fornecido. Tecidos vilosidades e deciduais da placenta são microdissectados em 2-3 mm 3 peçase colocados separadamente em filtros Transwell alinhado-matriz e cultivadas durante vários dias. Vilosa e culturas de órgãos deciduais são bem adequados para o estudo da interacção hospedeiro-patogénio humano. Em comparação com outros organismos modelo, estas culturas humanas são particularmente vantajosos para examinar mecanismo da infecção por agentes patogénicos que demonstram padrões variáveis de especificidade de hospedeiro. Como um exemplo, podemos demonstrar infecção de culturas de órgãos da placenta e deciduais com os facultativos, agentes patogénicos bacterianos intracelulares Listeria monocytogenes clinicamente relevantes.
Introdução
A infecção e inflamação na interface materno-fetal representa a principal fonte de morbilidade e de mortalidade em mulheres e crianças. Entender como agentes patogénicos infectar estes tecidos é crítico para o desenvolvimento de novas estratégias para prevenir e tratar doenças, tais como trabalho de parto prematuro e morte fetal. No entanto, a variabilidade inter-espécies de alto da interface materno-fetal complica investigação experimental. Além disso, patógenos mais microbianas mostram especificidade do hospedeiro, assim, muitos modelos animais não pode recapitular totalmente doenças infecciosas humanas. Certos organismos (Haemophilus influenzae, Salmonella typhi, Vibrio cólera, e numerosos outros) são estritamente patogênico em humanos, enquanto outros, como a Listeria monocytogenes, mostram um nível mais intermediário de especificidade do hospedeiro 1. Especificidade do hospedeiro tem sido documentado em muitos aspectos da patogênese, incluindo a colonização 2, a divulgação 3, evasão imune 4 e aquisição de nutrientes 5. Assim, é de extrema importância para selecionar melhores sistemas modelo de acolhimento.
Composto de células fetais e sangue materno, a placenta é um órgão que se desenvolve rapidamente ao longo da gestação 6. Em termos mais simples, a placenta humana é construída de estruturas fetais "vilosidades" árvore-como banhadas em sangue materno. Gás e troca de nutrientes ocorre em camadas de células fetais especializadas chamadas trofoblastos que revestem a superfície das árvores vilosidades. O revestimento da mucosa uterina materna, denominado endométrio na fêmea não grávida, transforma estrutural e funcionalmente para o decídua para acomodar a unidade de fetoplacentária. árvores vilosidades estão ancoradas no útero por trofoblastos extravilosas (EVT), que migram de ancoragem colunas de células na decídua. A interface materno-fetal, portanto, consiste em decídua e da placenta.
A técnica de cultura de órgãos descrito aquifoi usado para examinar onde e como clinicamente patógenos humanos relevantes, incluindo L. monocytogene s e Toxoplasma gondii, atravessa a barreira placentária 2,7. Estas culturas de órgãos ex vivo replicar na arquitetura do tecido vivo, e são sistemas modelo indiscutivelmente fisiologicamente altamente relevantes para placentation humano. técnicas de cultura adicionais incluem explantes inteiros de órgãos, fatias de órgãos e de tecidos ou caule Organóides celulares embarcados em 3D-matriz. Para mais detalhes sobre estas opções, consulte com uma recente revisão abrangente 8. Por favor note que este protocolo é para a cultura separada da decídua e vilosidades da placenta. Para estudar a interacção entre as células da placenta e células deciduais, uma técnica de co-cultura pode ser o preferido. Referimo-nos ao leitor interessado a técnica de co-cultura das vilosidades-decidual descrito anteriormente, utilizado por pesquisadores que estudam a remodelação vascular decidual mediada por trophoblast 9-11.
Protocolo
Os experimentos foram conduzidos de acordo com os princípios expressos na Declaração de Helsinki. Este estudo foi aprovado pelo Conselho de Revisão Institucional da Universidade da Califórnia, San Francisco (CHR # 11-05530). Todos os pacientes fornecidos consentimento informado por escrito para a recolha de amostras e análise posterior. O tecido foi recolhido como espécimes de-identificados.
NOTA: O pesquisador deve obter a aprovação do seu conselho de revisão institucional seres humanos. A exclusão de amostras com base na história da placenta ou anomalias gestacionais irá variar de acordo com as necessidades de qualquer estudo específico.
NOTA: as condições de segurança adequadas (nível de biossegurança 2) deve ser utilizado para todas as etapas deste protocolo 12.
1. Preparação, antes do dia da Colecção
- coadores de autoclave / forceps para a recolha e tesoura / pinça para micro-dissecção.
- Prepare volume adequado (500 ml por espécime) de tampão de lavagem (refer a Tabela 1 para a receita).
- Prepare volume adequado (100 ml por espécime) de 0,22 media Coleção esterilizada por filtração (consulte a Tabela 1 para a receita).
- Aliquota da Matriz Extracelular (ECM, consulte a Tabela de Reagentes para detalhes) para armazenamento a longo prazo.
- ECM loja no estado sólido à temperatura de -20 ° C. Para um melhor desempenho, evite degelo congelamento de repetição. Descongelar garrafa a uma solução viscosa a 4 ° C, e preparar-se alíquotas de 300 ul na câmara fria com pontas de pipeta refrigerados. alíquotas armazenar a -20 ° C.
2. Coleta de tecido fresco
CUIDADO: Quando se trabalha com o tecido humano fresco, os pesquisadores devem seguir as precauções universais (OSHA) para prevenir a transmissão de Bloodborne Pathogens, e deve ter recebido formação institucional adequado. equipamento de protecção individual adequado, incluindo luvas, proteção para os olhos, e jalecos são necessárias.
- Transporteautoclavados-filtros (um por espécime), autoclavados-fórceps, tampão de lavagem (garrafão), meios de cobrança (25 ml por amostra em um tubo de 50 ml), frasco de spray, 10% de água sanitária, 70% de etanol, bandeja de coleta de tecido, sharpie e balde de gelo / resfriador para o hospital / clínica.
NOTA: As amostras são recebidas em um espaço designado para a investigação localizado em uma sala perto da sala de cirurgia. A capa de cultura de tecidos estéreis não é necessária, mas a recolha deverá ocorrer de forma expedita e o pesquisador deve higienizar adequadamente as superfícies, como descrito abaixo. - Lugar garrafão de tampão de lavagem ao lado da pia, torneira e spray com 10% de água sanitária e 70% de etanol. tabuleiro de recolha de tecidos lugar de vidro sobre a fonte de luz (bloco de luz ou caixa de luz), e higienizar com 10% de água sanitária e 70% de etanol. Deixar secar ao ar.
- Tem o clínico espécimes transportar desde a sala de cirurgia para a sala de preparação da amostra. Na pia, despeje o espécime em cima do filtro de mão estéril, lavar o tecido várias vezes, duroutampão h, e transferir espécime inteiro em tampão para a bandeja de vidro higienizado no topo fonte de luz.
NOTA: Avaliação do tecido pelo clínico é de prioridade mais elevada, assim, os seguintes passos são executados somente após o clínico tem verbalmente indicou que ele / ela terminou a avaliação. - Use uma pinça estéreis para selecionar vilosidades da placenta e decídua (Figuras 2A e 3A) para a coleta e transferir para separar tubos de 50 ml cônico. Rotular os tubos com a idade gestacional.
NOTA: Preferred idades gestacionais são menos de 9 semanas e menos de 16 semanas para a placenta e decídua, respectivamente. Na instituição, apenas uma fração de cada espécime é obtido para fins de pesquisa, como o tecido adequado deve permanecer para o diagnóstico patológico clínica. - Armazene e transporte de espécimes no gelo para o laboratório de pesquisa.
- Para recolher mais do que um espécime, higienizar o prato de vidro, tal como descrito acima com lixívia a 10% e etanol a 70% entre o Collecção de cada espécime.
3. Preparação das placas de cultura de órgãos
NOTA: Os seguintes passos devem ser realizados utilizando uma técnica estéril em uma capa de cultura de tecidos. É ideal para o microscópio de dissecação para ser localizado num campo esterilizado. No entanto, isto não é absolutamente necessário, desde que micro-dissecção é executada de forma expedita, e instrumentos frequentemente são mergulhados em etanol a 70%.
- frasco Thaw ECM (s) no gelo. Diluir o ECM 1: 1 com a mídia Coleção gelada, misturar por pipetagem. Pipeta lentamente para evitar a introdução de bolhas. Cada poço de uma placa de cultura de tecidos de 6 poços requer 100 ul desta suspensão e irá acomodar 3-4 culturas de órgãos.
- inserções Transwell lugar (tamanho de poro 0,4 um) em cada poço da placa de 6 poços de cultura de tecidos.
- Revestimento cada Transwell inserir com uma fina camada (100 ul) da suspensão de ECM / meios.
- Coloque a placa no gelo e proceder imediatamente a establishmenT de culturas de órgãos. Em alternativa, preparar a placa antes da recolha de tecidos, caso em que envolvê-la em para-filme e armazenar a 4 ° C para uso posterior. Armazenamento de mais de 6 horas não é recomendado como o ECM vai secar.
4. Estabelecimento de culturas de órgãos
Nota: Esta etapa descreve como colocar culturas de órgãos deciduais e culturas de órgãos de vilosidades no transwells separadas. Os tecidos não estão em contato. Pesquisadores interessados em uma técnica de co-cultura onde decídua e vilosidades estão em contato direto um com o outro, pode se referir a literatura prévia 9,10.
- Lavar as amostras duas vezes em media coleção, e centrifugar a 1000 xg entre cada lavagem. Transferir o tecido a uma placa de Petri estéril e coloque sobre o palco de um microscópio de dissecação. Mantenha a placa de 6 poços em gelo adjacente ao microscópio.
- tecido micro-dissecar com springer dissecando tesoura e uma pinça estéril, para estabelecer 2-3 mm cultura de órgão das vilosidadess (Figura 2A).
NOTA: culturas de órgãos das vilosidades são pequenos bem vascularizado "árvores", com 2 ou 3 ramos, com destaque colunas celulares trophoblast extravilosas (EVT) 11. É importante utilizar apenas tecido das vilosidades a partir de amostras no primeiro trimestre <9 semana, como invasão de trofoblastos extravilosas em ECM é mais pronunciado nestas idades jovens 13. - Selecione vilosidades bem vascularizado com colunas de células EVT proeminentes. Colunas de células EVT são visualizados como bulbosa, "difusa", as extremidades "macios" (referem-se a pontas de seta na Figura 2A).
- Use uma pinça estéril para transferir 3 ou 4 árvores vilosidades em cada Transwell. Ajuste ramos para árvore está posicionado plana no topo de ECM e ramos aglutinados separadas.
- Micro-dissecar tecido decidual com springer dissecando tesoura e uma pinça estéril, para estabelecer 3 mm 3 culturas de órgãos deciduais (Figura 3A).
NOTA: As amostras contêm dois distipos tinct de tecidos deciduais, parietalis decídua e decídua capsular (fragmentos certos tecidos, respectivamente, Figura 3A esquerda e). - Aparar com uma tesoura para criar 3 mm 3 pedaços de parietalis decídua. Decídua capsular não é utilizado para estas culturas. Use uma pinça para provocar afastado qualquer sangue materno coagulado.
- Use uma pinça estéril para transferir 3-4 pedaços de decídua em cada Transwell.
- Adicionar 1 mL de meios de Recolha para o fundo do poço. Incubar a placa durante a noite a 37 ° C em 5% de CO 2
- Para as experiências em que é importante para imitar o normal primeiro trimestre tensão de oxigénio da placenta, manter culturas de órgãos de vilosidades em hipoxia relativa (3% de O2).
NOTA: As opções laboratoriais incluem pequenas câmaras hipóxia incubadora que se encaixam dentro de incubadoras existentes, ou uma incubadora de tri-gás que introduz gás externa N 2 para diminuir a concentração de oxigênio. - Adicionar 1 ml de vilosidades ou médio Decidual (Table 1) até ao topo da transpoço após 12-16 horas de cultura.
NOTA: A ausência de meios durante o primeiro dia para o outro em cultura de células permite que as colunas trofoblasto extravilosas para invadir (cultura de vilosidades), e por o tecido (tanto das vilosidades e deciduais) para ficar firmemente encaixado no ECM. Em nossa experiência, culturas de órgãos deciduais permanecer viáveis por 72 horas e de órgãos das vilosidades culturas durante 96 horas. Recomendamos endpoints experimentais que caem dentro deste prazo. Ver Tabela 1 para composição do meio das vilosidades e Decidual. Médio das vilosidades tem uma elevada percentagem de FBS, enquanto que o meio é suplementado com decidual hormonas da gravidez (progesterona, 17p-estradiol) que mantêm o estado decidualizado (Tabela 1).
5. Preparação de L. monocytogenes culturas
NOTA: Para o protocolo detalhado no armazenamento a longo prazo de L. monocytogenes, e a cultura e crescimento de this organismo em infusão de cérebro e coração (BHI) e agar, consulte Wang et al 14.
- Escolha uma única L. monocytogenes colónia da placa de ágar BHI com listras e inocular 3 ml de caldo BHI.
- Incubar a L. monocytogenes cultura durante a noite (16 h), numa posição inclinada, a 30 ° C.
NOTA:. Estas condições de cultura permitir o crescimento bacteriano para atingir a fase estacionária L. monocytogenes é flagelado a 30 ° C, o que aumenta a invasão da célula hospedeira 15.
6. A infecção de culturas de órgãos com L. monocytogenes
- Quente PBS e das vilosidades ou meio decidual (Tabela 1) a 37 ° C.
- Use uma pinça estéreis para remover todos os pedaços de cultura órgão que não invadem para a ECM, e, portanto, estão flutuando no poço.
- Aspirar cuidadosamente a mídia da parte inferior da Transwell. Lavar transwells superior e inferior duas vezes com cuidado pipetando 1 ml de guerram PBS em bem, e cuidadosamente aspiração no meio. Gentilmente pipeta 1 ml de vilosidades ou Decidual meio sem antibiótico para transpoço superior e inferior. Tenha cuidado para não perturbar a cultura de órgãos.
- Deixe o tecido incubar em meio isento de antibiótico durante pelo menos uma hora para assegurar que os antibióticos foram removidos.
NOTA: Na fase estacionária a densidade do L. cultura monocytogenes é de aproximadamente 1 x 10 9 unidades formadoras de colónias (CFU) por ml. O número de bactérias utilizadas para infectar culturas de órgãos deve ser determinada empiricamente para satisfazer as necessidades experimentais. - Para o tipo selvagem L. monocytogenes experiências de infecção mostram rotina invasão robusta com uma diluição de 1:50 dos durante a noite (4 x 10 7 L. monocytogenes em 1 ml de meio por poço). Ressuspender o número apropriado de bactérias em meio de vilosidades ou decidual isento de antibiótico.
- media aspirado de topo da transwells. Delicadamente adicionar 1 ml de inóculo. Incubar as placas a 37° C em 5% de CO2 para permitir a invasão bacteriana.
- Remover as bactérias extracelulares, aspirando a mídia da transwells superiores e inferiores. Lavar os poços duas vezes com PBS quente. Adicionar 1 ml de vilosidades ou mídia deciduais suplementado com 50 ug ml -1 gentamicina. Incubar as placas a 37 ° C em 5% de CO 2.
NOTA: L. monocytogenes é uma bactéria intracelular facultativo que podem crescer no meio extracelular, crescem dentro de células, e se espalhar de célula-a-célula sem aceder ao espaço extracelular. A gentamicina tem um efeito bactericida sobre L. extracelular monocytogenes, e, assim, permite a medição de L. intracelular monocytogenes crescimento e espalhar através da cultura de órgão 16.
NOTA: reproduzível L. infecção monocytogenes de culturas de órgãos vilosidades e decídua ocorre com tempos de incubação de 5 horas. O tempo de incubação antes da adição de gentamicina pode ser modificado com base nas necessidades experimentais ea ability do organismo para invadir o tecido. Para entender melhor os locais anatômicos mais vulneráveis à infecção, períodos de incubação mais curtos podem ser usados 2. - Manter placas a 37 ° C em 5% de CO2 durante a duração da experiência. Mudança de mídia toda em cada poço diariamente.
NOTA: Em nossa experiência, L. monocytogenes infectados por culturas de órgãos deciduais permanecer viáveis por 48 horas e de órgãos das vilosidades culturas durante 72 horas.
7. Colheita de Órgãos culturas para Histopatologia
- Prepara-se uma solução fresca de 4% de paraformaldeído, diluindo 10 ml de uma ampola de estoque de 16% em 30 ml de PBS. Loja 4% de paraformaldeído a 4 ° C, protegida da luz, e utilizar no prazo de uma semana. Levar à temperatura ambiente antes de usar.
- media aspirado de transpoço superiores e inferiores. Suavemente lavar os poços duas vezes com PBS à temperatura ambiente. Adicionar cuidadosamente 1 mL de 4% de paraformaldeído para o topo Transwell para cobrir completamente a cultura de órgãos.
- Incubarem 4% de paraformaldeído à temperatura ambiente durante 20 min. Evitar tempos de incubação mais longos, pois isso pode levar a um excesso de fixação do tecido.
- paraformaldeído aspirado e os poços de lavagem duas vezes com PBS à temperatura ambiente. Incorporar as culturas de órgãos fixos em meio OCT, congelamento, e seção sobre um criostato ( "fixed congelado"). Em geral, tecidos congelados fixo é mais fácil de secção de tecido congelado sem fixação prévia.
NOTA: Para o protocolo completo em outubro de incorporação e secção congelada, acesse secções relevantes de protocolos publicados 17,18. Dependendo das necessidades experimentais e equipamentos de laboratório disponíveis e de armazenamento, o tecido pode não ser segmentado e num micrótomo 19 embebido em parafina. - Além disso preparar lâminas de tecido para Hematoxilina e Eosina coloração de rotina, imunofluorescência, ou 18,20,21 imuno-histoquímica.
Resultados
Figura 1 (modificado de Zeldovich & Bakardjiev 22) Diagramas da placenta relevantes e anatomia do útero. A Figura 2 mostra bruto representativo e imagens histológicos de vilosidades da placenta, enquanto a Figura 3 demonstra tecido decidual.
Este protocolo primeira descreve a coleção de placenta fresca e tecido decidual no hospital ou clínica. A amostra recolhida é uma mistura de placenta fetal (vilosidades) e componentes uterinas maternas (decídua). Após lavagem com tampão contendo antibióticos de amplo espectro e antifúngicos, toda a amostra é inspecionado por olho usando uma caixa de luz. Vilosidades e decídua são colocadas em tubos separados e transportados em gelo para o laboratório. No laboratório, um microscópio de dissecação é utilizada para apreciar as belas características morfológicas de tecido saudável. fotografias representativas devilosidades (Figura 2A) e tecidos deciduais (Figura 3A), que foram obtidas com um microscópio de dissecação com duas fontes de luz externas pescoço de ganso são apresentados para referência.
culturas de órgãos vilosidades são gerados a partir de amostras no primeiro trimestre. Culturas consistem em pequenas árvores vilosidades terminais com 2-6 ramos. É importante para dissecar ramos vilosidades que terminam nas colunas do trofoblasto extravilosas e são bem vascularizado. Estas características são vistas como fins Branch (setas) "macia" ou "difusa", ea tonalidade rosa-a-vermelho fraco linear que percorre os ramos da árvore à esquerda na Figura 2A. Em contraste, a vasculatura e trofoblastos extravilosas não são facilmente visualizados para a árvore do lado direito desta imagem, o que seria abaixo do ideal para a cultura. Durante o primeiro dia de cultura, os trofoblastos extravilosas migrar para dentro do ECM, thus ancoragem das árvores vilosidades no interior da matriz no Transwell.
culturas de órgãos deciduais são gerados a partir de amostras trimestre primeiro e início do segundo. O revestimento uterino inteira é transformada em decídua muito pouco tempo após a implantação. Mais especificamente, decidua basalis define a mucosa uterina subjacente directamente o local da placenta / implante, decídua capsular define mucosa que cobre o feto, e decídua parietal refere-se à parte restante do revestimento uterino. A visualização sob um microscópio de dissecação mostra que a amostra consiste em grande parte gestacional precoce de parietal decídua e decídua capsular (esquerda e fragmentos de tecido a direita, respectivamente, na Figura 3A). A decídua capsular é facilmente distinguidos pela sua natureza fina, membranoso. Para culturas de órgãos, decídua parietal é aparada a 3 mm3 fragmentos com uma tesoura micro-dissecção e Adhealuguel sangue coagulado é removido com uma pinça.
Após incubação durante a noite, os tecidos são infectados com L. monocytogenes. O protocolo de infecção acima descrito baseia-se no ensaio de protecção de gentamicina utilizado para estudar o crescimento intracelular e propagação de bactérias intracelulares facultativas 16. Culturas de órgãos em meio isento de antibiótico são incubadas com L. monocytogenes, durante 5 h. As culturas são lavadas com PBS estéril para remover bactérias a partir do meio. Em seguida, gentamicina é adicionado para eliminar organismos extracelulares. Antes da literatura nosso laboratório usado imunofluorescência e microscopia confocal para determinar a localização do tecido bacteriana em vários pontos de tempo após a infecção 2. culturas de órgãos são lavadas em PBS, fixadas em paraformaldeído a 4%, e ou congelados-incorporado em meio de outubro e armazenado a -80 ° C, ou e armazenado à temperatura ambiente embebidos em parafina. As secções de tecido podem ser STAined para imunofluorescência (IF) ou análise imuno-histoquimica (IHC) de bactérias e localização de células eucarióticas. A Figura 2B é um representante se a imagem de uma secção congelada preparada a partir de uma cultura de órgãos viloso 8,3 semanas a 72 h após a infecção. Note-se a pesada carga bacteriana (fluorescência verde) nas TEVs nas extremidades dos ramos vilosidades, ea relativa falta de bactérias dentro da camada (fluorescência vermelha) Árvore-alinhadas sinciciotrofoblasto. Em trabalhos anteriores, foram utilizados semelhante, se a coloração para localizar L. monocytogenes em culturas de órgãos de vilosidades em momentos diferentes depois da infecção. Mais de 72 horas, a infecção se espalhou da EVT em citotrofoblastos sub-sincicial e estroma das vilosidades subjacente. Notavelmente, a camada synyctiotrophoblast era resistente à infecção 2.
imagens microscópicas de luz representativas de cortes de tecido deciduais embebidos em parafina H & E-manchadas preparado a partir de 14,3 semanas specimeNS são mostradas nas Figuras 3B e 3C. Esta membrana Transwell revestidas com MEC foi incorporado para mostrar a cultura de órgãos in situ (Figura 3B). A imagem mostra glândulas forrado de epiteliais (asterisco) e vasculatura-alinhado endotelial (diamante) posicionado de forma heterogênea dentro do compartimento de células do estroma da decidual. Além disso, existem células imunitárias maternas espalhados por todo o estroma decidual a uma densidade variável. IHC e se a fluorescência pode ser utilizado para determinar a localização microanatômico bacteriana, relativamente a células imunes específicas residentes. Como um exemplo, macrófagos CD14 + (fluorescência verde) localizam o revestimento da vasculatura e são dispersos dentro do estroma (figura 3D), enquanto que grandes agregados de L. monocytogenes (fluorescência vermelha) são observados, predominantemente no estroma decidual em 48 horas após a infecção (Figura 3D).
| tampão de lavagem | meio de recolha | meio das vilosidades | médio decidual |
| PBS | DMEM / F-12 com GlutaMAX | DMEM / F-12 com GlutaMAX | DMEM / F-12 com GlutaMAX |
| Penicilina 100 UI / ml | Soro Fetal Bovino a 2,5% | Soro Fetal de Bovino 20% | Soro Fetal Bovino a 2,5% |
| Estreptomicina 100 ug / ml | Penicilina 100 UI / ml | Penicilina 100 UI / ml | 17β-estradiol de 300 pg / mL |
| A gentamicina 50 ug / ml | Estreptomicina 100 ug / ml | Estreptomicina 100 ug / ml | A progesterona a 20 ng / mL |
| A anfotericina B de 1,25 ug / ml | A gentamicina 50 ug / ml | ||
| < / Td> | A anfotericina B de 1,25 ug / ml |
Tabela 1:. Receitas Media Components e concentrações para a preparação de solução de lavagem, médio coleção, médio das vilosidades, e médio Decidual.
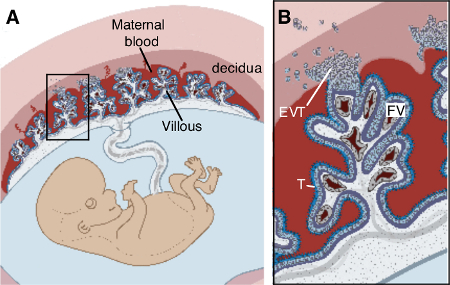
Figura 1. Placentário estrutura. (A) Estrutura da unidade feto-placentária em útero materno, (B) Alargamento da caixa em (A) ressalta que trofoblasto fetal (T) alinhado vilosidades da placenta são banhadas em sangue materno e ancorado na decídua por trofoblastos extravilosas (EVT). Contido dentro de vilosidades são vasos fetais (FV), fibroblastos e macrófagos fetais. Modificado de Zeldovich & Bakardjiev 22. "> Por favor clique aqui para ver uma versão maior desta figura.
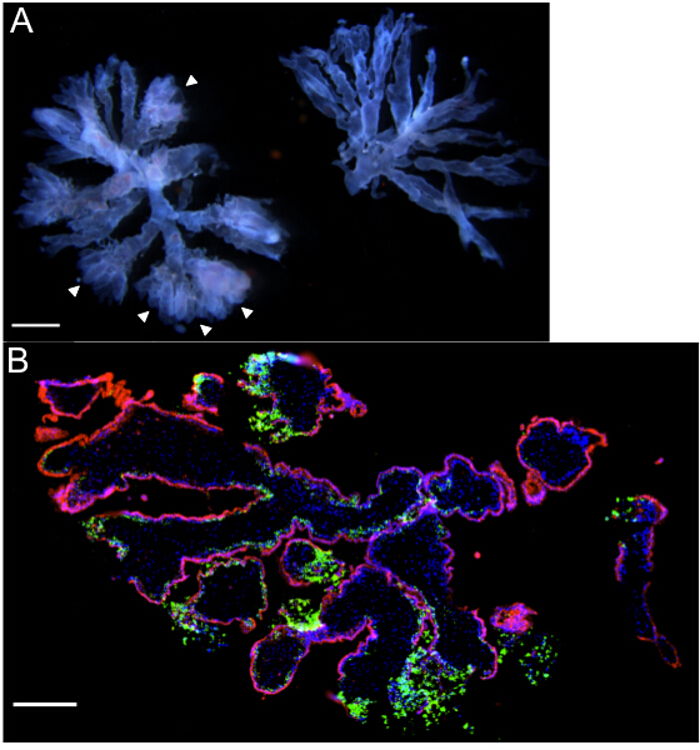
Figura 2: culturas de órgãos das vilosidades - gross Representante e imagens microscópicas (A) Duas árvores vilosidades terminais com uma idade gestacional de 6 semanas, como vistos sob um microscópio de dissecação.. Observe os fins "macias" (setas) e vascularização fetal proeminente percorrendo os ramos da árvore à esquerda que tornam esta peça adequado para cultura de órgãos. (B) Microscopia de imunofluorescência de cultura de órgãos (idade gestacional 8,3 semanas) infecção pós 72 h com Listeria monocytogenes, destacando carga bacteriana pesada [green] em trofoblastos extravilosas. DAPI é mostrado em azul, e βHCG + sinciciotrofoblastos em vermelho. Barras de escala = 1 mm (A), 250 um (B).7 / 54237fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
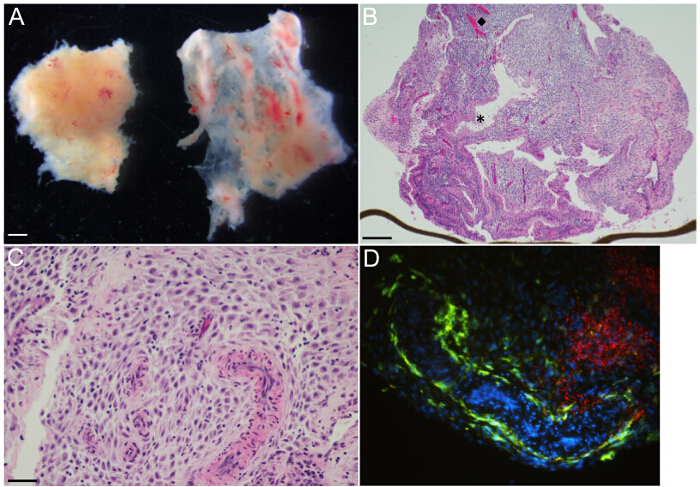
Figura 3:. Cultura de órgão Decidual - gross Representante e imagens microscópicas (A) decídua parietal [esquerda] e decídua capsular [direita] na idade gestacional 6 semanas, como visto sob um microscópio de dissecação. Seção (B) H & E manchada de cultura de órgãos 14,3 semanas de idade gestacional decídua parietal mostra glândulas e vasos organizados de forma heterogênea em todo estroma decidual. O (diamante, ◆) eo (asterisco, *) destacam navio representativo e glândula, respectivamente. linha marrom na borda inferior é transpoço membrana, na borda. (C) H & E-manchado seção de 14,3 semanas decídua idade gestacional parietalis cultura de órgão em maior ampliação demonstrates arteríolas espiral muscular de parede embutidos em estroma decidual. células imunes maternas são pequenas com núcleos redondos escuros, e são distribuídas irregularmente ao longo do estroma. (D) Microscopia de imunofluorescência de cultura de órgãos de 48 horas após a infecção com L. monocytogenes, destacando grandes zonas de bactérias [vermelho] no estroma decidual, e CD14 + materna macrófagos [green] alinhando um espaço vascular tortuoso e espalhadas no estroma. Barras de escala = 1 mm (A), 250 mm (B), 50 mm (C e D). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Puras, transgênicos e rato knockout cepas podem servir em sistemas experimentais para testar robustamente mecanismos. No entanto, apesar de conservação geral do material genético do núcleo, os genomas funcionais de ratos e seres humanos demonstram diferenças significativas nos elementos reguladores 23. Não é de surpreender, portanto, que os estudos pré-clínicos promissores em modelos animais são por vezes não recapitulou em pacientes humanos. A placenta mostra muito elevada diversidade interespécies, tornando assim modelos animais menos de ideal para o estudo das doenças humanas 24. Reconhecendo tanto as diferenças notáveis em imunologia humana e do rato 25, ea evolução divergente pronunciada em anatomia da placenta, é prudente considerar o uso de ex vivo culturas de órgãos de tecidos gestacional humanos para a investigação experimental.
As descrições, imagens fotográficas e de vídeo instrucional neste protocolo instruir pesquisadores emcomo estabelecer vilosidades e culturas de órgãos deciduais em inserções de cultura de tecido Transwell revestido de ECM. As vantagens desta técnica incluem a simplicidade relativa do micro-dissecção e sistema Transwell suporte mecânico, particularmente quando comparado com métodos alternativos, tais como matrizes de embutidos 3D ou culturas de fatias de órgãos. A suspensão da cultura de órgãos no suporte de membrana permite a troca de nutrientes em todas as superfícies de tecido e viabilidade é mantida para a cultura de curto prazo (96 horas para as culturas vilosidades, 72 h para culturas deciduais) .Este técnica permite estudar a biologia de placenta humana no tecido nível, inegavelmente biologicamente mais relevantes do que os modelos de cultura de células monocamada.
O passo mais crítico neste protocolo é o micro-dissecção de peças vilosidades e deciduais apropriadas para cultura de órgãos. Peças ideais de tecido são demonstrados fotograficamente (Figura 2A e 3A) para auxiliar pesquisadores para quemvisualização de espécimes gestacional é nova. É particularmente importante para seleccionar árvores vilosidades cujos ramos terminam em colunas EVT, uma vez que estas células vão migrar para dentro do ECM e ajudar a ancorar o vilosidades à membrana. Para ambos os tipos de culturas de órgãos é útil para minimizar perturbações no tecido durante alterações na mídia por pipetagem de uma forma cuidadosa e sem pressa.
Esta técnica apresenta dificuldades única mínimos. Na ocasião, as amostras apresentaram contaminação. A contaminação bacteriana é normalmente (ocasionalmente poli-microbianos), e só se torna evidente após 1-2 dias em cultura. Uma vez que a contaminação é observada, lixívia deve ser aplicada, a cultura rejeitado e o incubador de cultura de tecido esterilizado para impedir um problema a longo prazo. Existem várias maneiras possíveis contaminações podem surgir: em infecção útero, durante a cirurgia, durante espécime colheita / processamento, ou durante a manutenção da cultura de órgãos. As etapas de colheita e processamento são o momento mais provávele lugar para a contaminação de ser introduzidas. Assim, é importante reduzir a quantidade de tempo que a amostra é manipulado durante a colheita e micro-dissecção. Isto irá reduzir a exposição da amostra à ambiente, ambiente não-estéril. Dependendo da configuração do laboratório, do microscópio de dissecação pode estar localizado dentro do capuz de cultura de tecido estéril.
A análise histopatológica de culturas de órgãos após a infecção com o patógeno clinicamente relevante L. monocytogenes, é mostrado aqui como uma possível aplicação do protocolo. localização imunofluorescência de ambas as bactérias e células do sistema imunológico do hospedeiro após produz infecção novos insights sobre a resposta do hospedeiro humano para patógenos. Culturas de órgãos deciduais pode servir como um ex vivo técnica experimento complementar ao examinar os dados gerados a partir de infecções de rato in vivo, incluindo relatórios intrigantes que mostram defeitos de funções de defesa macrófagos deciduais murino 26,27. Além disso, Org humanoum culturas podem ser usados em estratégias de infecção mista, tal como um inoculo competitivo composto por várias estirpes isogénicas de L. monocytogenes. infecção competitiva de culturas de órgãos é uma forma sensível para testar a relevância de fatores de virulência no hospedeiro humano. Uma limitação deste método é a viabilidade do tecido, que é limitada a cultura de curto prazo (96 horas para as culturas vilosidades, 72 horas para culturas deciduais). Isto é ideal para a infecção com micróbios de rápido crescimento, tais como L. monocytogenes, mas as culturas mais longos pode ser necessário para agentes patogénicos que levam mais tempo para estabelecer e se espalhou através do tecido.
Para reduzir a carga global de complicações na gravidez, a pesquisa deve se concentrar na compreensão da fisiopatologia da interface materno-fetal humano. Bacterianas, fúngicas e virais patógenos que cruzam da mãe para o feto causa devastadoras complicações da gravidez e infecção fetal. Controlados de infecção in vivo de ani laboratóriomals é normalmente considerada o padrão ouro para abordar como patógenos colonizar e trânsito entre órgãos 28. Porque anatomia placentário varia marcadamente entre as espécies de mamíferos, é de extrema importância para incorporar tecido humano nas estratégias de pesquisa. culturas de órgãos vilosidades e deciduais humanas são sistemas modelo altamente relevantes para investigar as interações patógeno-hospedeiro. Para estudar este órgão vital ainda mal compreendida, os pesquisadores podem tirar proveito da abundância de placenta humana de outra forma descartados e amostras deciduais, utilizando estratégias de cultura de órgãos, como descrito aqui.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We are grateful to Cristina Faralla and David Lowe for helpful discussions. We acknowledge Mark Weinstein and San Francisco General Hospital Pathology Department for expert advice. This work was supported by National Institute of Health grants R01AI084928 and Burroughs Wellcome Fund 41259 to A.I.B; G.A.R. was supported by F32AI108195, Society for Pediatric Pathology Young Investigator Research grant, and University of California Partnerships for Faculty Diversity President's Post-doctoral Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Sterilization pouches | Fisher Scientific | 01-812-54 | For autoclaving individual dissecting tools |
| Fine mesh strainer | Cuisinart (Amazon.com) | NA | Wrap completely in aluminum foil and autoclave prior to tissue collection. |
| Carboy with spigot | Fisher Scientific | 03-007-647 | For large volume preparation of Wash buffer. |
| Ice packs | Nortech labs | GB8818 | These do not have to be purchased, rather they can be recycled/reused from any routine laboratory shipment that includes them in the packaging. |
| 70% Ethanol | VWR | V1001 | 70% solution made by adding dH20 to 190 or 200 proof research grade alcohol. |
| 10% Bleach | Waxie Sanitary Supply | CLO 30966 | 10% solution made by adding dH20. |
| Light Box | Litebox Lumina (dickblick.com) | 55305-2009 | Note replacement bulbs also purchased on Blick (55305.0100) |
| Micro dissecting forceps | Stoelting | 52102-43 | 4 inches, 1 x 2 x 0.5 mm3, Slight Curve |
| Micro dissecting forceps | Stoelting | 52102-06 | 4 inches, Straight Fine, Sharp |
| Micro dissecting vannas spring scissors | Stoelting | 52130-01P | McPherson-Vannas Spring Scissors, 8.5 cm, 0.33 Tip, Slight Curve |
| Dissecting microscope | Leica Microsystems | MZ16 or M60 | We have had success with the listed models. External gooseneck flexible light sources are helpful but not necessary. |
| 50 ml conical tubes | Sigma-Aldrich (Corning) | CLS4558 | |
| Phosphate Buffered Saline | Gibco (ThermoFisher Scientific) | 10010023 | We purchase from our university Tissue Culture Core facility, alternate options such as this are available. |
| 10x Phosphate Buffered Saline | Teknova | P0195 | For preparation of Wash buffer we use 10x PBS |
| DMEM/F-12 nutrient mixture (Ham's) with GlutaMAX | Gibco (Life Technologies) | 10565-018 | We purchase this specific media formulation, containing 2.438 g/L sodium bicarbonate, 55 mg/L sodium pyruvate, and 4.5 g/L glucose |
| Gentamicin | Thermofisher Scientific | 15710072 | 1, 000x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Amphotericin B | Gibco (ThermoFisher Scientific) | 15290-018 | 500x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| progesterone | Sigma-Aldrich | P8783 | A 1 mM stock solution is made by reconstituting 15.7 mg progesterone powder in 15.7 ml Ethanol and adding 34.3 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| 17β-estradiol | Sigma-Aldrich | E2758 | A 10 μM stock solution is made by reconstituting 13.5 mg estradiol powder in 10 ml ethanol and adding 40 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| Bottle-top vaccum filter (0.22 μm) | Sigma-Aldrich (Corning) | CLS430769 | For sterile filtration of Collection media after preparation |
| 6-well tissue culture plate | BD Falcon | 353224 | Polystyrene, Tissue culture treated |
| 6-well transwells | Millipore | PICM03050 | Insert - 30 mm diameter, 0.4 μm pore size hydrophilic PTFE membrane |
| Extracellular Matrix (for example, Matrigel Matrix) | BD Biosciences | 354234 | We have utilized Matrigel Matrix in our studies. It is a solid at room temperature and at -20 °C. Avoid repeat freeze/thawing. Thaw bottle to viscous solution at 4 °C, and prepare ~ 300 μL aliquots in the cold room with chilled pipette tips. Store aliquots at -20 °C. |
| Paraformaldehyde, 16% w/v aqueous solution | Alfa Aesar | 30525-89-4 | For tissue fixation, a fresh preparation of 4% paraformaldehyde is made by diluting this stock in PBS. |
| Tissue culture incubator, maintained at 37 °C, 5% CO2, 3% oxygen (optional for villous organ cultures) | For some experiments, hypoxia may be preferred. This can be established multiple ways, including addition of exogenous nitrogen via gas cylinder, Tygon tubing, and a regulator. | ||
| Bench top centrifuge |
Referências
- Pan, X., Yang, Y., Zhang, J. R. Molecular basis of host specificity in human pathogenic bacteria. Emerging microbes & infections. 3, e23 (2014).
- Robbins, J. R., Skrzypczynska, K. M., Zeldovich, V. B., Kapidzic, M., Bakardjiev, A. I. Placental syncytiotrophoblast constitutes a major barrier to vertical transmission of Listeria monocytogenes. PLoS pathogens. 6, e1000732 (2010).
- Zhang, J. R., et al. The polymeric immunoglobulin receptor translocates pneumococci across human nasopharyngeal epithelial cells. Cell. 102, 827-837 (2000).
- Ngampasutadol, J., et al. Human C4b-binding protein selectively interacts with Neisseria gonorrhoeae and results in species-specific infection. Proceedings of the National Academy of Sciences of the United States of America. 102, 17142-17147 (2005).
- Pishchany, G., et al. Specificity for human hemoglobin enhances Staphylococcus aureus infection. Cell host & microbe. 8, 544-550 (2010).
- Benirschke, K., Kaufmann, P., Baergen, R. N. . Pathology of the Human Placenta. , (2012).
- Robbins, J. R., Zeldovich, V. B., Poukchanski, A., Boothroyd, J. C., Bakardjiev, A. I. Tissue barriers of the human placenta to infection with Toxoplasma gondii. Infection and immunity. 80, 418-428 (2012).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature reviews. Molecular cell biology. 15, 647-664 (2014).
- Hazan, A. D., et al. Vascular-leukocyte interactions: mechanisms of human decidual spiral artery remodeling in vitro. The American journal of pathology. 177, 1017-1030 (2010).
- Dunk, C., et al. A novel in vitro model of trophoblast-mediated decidual blood vessel remodeling. Laboratory investigation; a journal of technical methods and pathology. 83, 1821-1828 (2003).
- Hunkapiller, N. M., Fisher, S. J. Chapter 12. Placental remodeling of the uterine vasculature. Methods in enzymology. 445, 281-302 (2008).
- Miller, J. M., et al. Guidelines for safe work practices in human and animal medical diagnostic laboratories. Recommendations of a CDC-convened, Biosafety Blue Ribbon Panel. MMWR Surveill Summ. 61 Suppl, 1-102 (2012).
- Lash, G. E., et al. Low oxygen concentrations inhibit trophoblast cell invasion from early gestation placental explants via alterations in levels of the urokinase plasminogen activator system. Biol Reprod. 74, 403-409 (2006).
- Wang, N., Strugnell, R., Wijburg, O., Brodnicki, T. Measuring bacterial load and immune responses in mice infected with Listeria monocytogenes. Journal of visualized experiments : JoVE. , (2011).
- Palmer, M. E., Watson, A. L., Burton, G. J. Morphological analysis of degeneration and regeneration of syncytiotrophoblast in first trimester placental villi during organ culture. Hum Reprod. 12, 379-382 (1997).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods in enzymology. 236, 405-420 (1994).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of visualized experiments : JoVE. , (2010).
- Croy, B. A., Yamada, A. T., DeMayo, F. J., Adamson, S. L. . The Guide to Investigation of Mouse Pregnancy, 1st Edition. , (2014).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. JoVE. , (2016).
- Troy, T. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on paraffin sections of mouse epidermis using fluorescent antibodies. Journal of visualized experiments : JoVE. , (2008).
- Chi, V., Chandy, K. G. Immunohistochemistry: paraffin sections using the Vectastain ABC kit from vector labs. Journal of visualized experiments : JoVE. , e308 (2007).
- Zeldovich, V. B., Bakardjiev, A. I. Host defense and tolerance: unique challenges in the placenta. PLoS pathogens. 8, e1002804 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515, 355-364 (2014).
- Robbins, J. R., Bakardjiev, A. I. Pathogens and the placental fortress. Current opinion in microbiology. 15, 36-43 (2012).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. J Immunol. 172, 2731-2738 (2004).
- Redline, R. W., Shea, C. M., Papaioannou, V. E., Lu, C. Y. Defective anti-listerial responses in deciduoma of pseudopregnant mice. The American journal of pathology. 133, 485-497 (1988).
- Redline, R. W., McKay, D. B., Vazquez, M. A., Papaioannou, V. E., Lu, C. Y. Macrophage functions are regulated by the substratum of murine decidual stromal cells. The Journal of clinical investigation. 85, 1951-1958 (1990).
- Bakardjiev, A. I., Theriot, J. A., Portnoy, D. A. Listeria monocytogenes traffics from maternal organs to the placenta and back. PLoS pathogens. 2, e66 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados