Method Article
인간의 태반과 탈락 오르간 문화는 산모 - 태아 인터페이스에서 감염을 연구하는
요약
기본 인간의 태반 (융모) 및 탈락 기관 배양을 설정하는 간단한 방법을 설명한다. 융모와 탈락 기관 배양은 인간의 모체 - 태아 인터페이스에서 발병 기전을 연구하기위한 귀중한 도구입니다. 통성 세포 내 세균 리스테리아 균에 감염이 증명된다.
초록
태반은 종간 해부학 적 변화의 큰 정도를 보여줍니다. 가장 생물학 및 인간 태반의 병태 생리를 이해하기 위해서는, 인간의 세포 및 조직을 이용한 실험을 설계하는 것이 필수적이다. 기관 배양의 장점은 3 차원 구조의 유지 조직과 세포 외 기질이다. 여기에 기술 된 방법의 목적은 인간의 생체 조직 임신성 기관 배양 물을 성공적으로 확립하고 72-96 시간 동안 배양 건강한 유지된다. 이 프로토콜은 운영 스위트에서 신선한 연구 합의 된, 태반과 탈락 표본의 즉각적인 처리를 자세히 설명합니다. 이러한 그렇지 않으면 폐기 될 풍부한 표본이다. 3D 기관 문화를 확립하기 위해 적절한 조직을 선택하는 방법에 대한 형태 학적 세부 사항을 포함하여 이러한 샘플의 멸균 컬렉션 자세한 설명이 제공된다. 태반 융모와 탈락 조직 2-3mm 3 조각으로 microdissected된다몇 일 동안 매트릭스 늘어선 트랜스 웰 필터에 별도로 배치 배양 하였다. 융모와 탈락 기관 배양은 인간 숙주 - 병원균 상호 작용의 연구에 적합하다. 다른 모델 유기체에 비하여, 이러한 인간의 문화 호스트 특이성 변수 패턴을 보여 병원체 감염의 메커니즘을 조사하는 것이 특히 유리하다. 예를 들어, 우리는 임상 적, 통성 세포 내 세균 병원체 리스테리아와 태반과 탈락 기관 배양의 감염을 보여줍니다.
서문
모체 - 태아 인터페이스에서의 감염 및 염증은 여성과 어린이의 이환율과 사망률의 주요 원인을 나타냅니다. 병원균이 조직을 감염하는 방법을 이해하는 것은 방지 및 조산 및 태아 사망과 같은 질병을 치료하는 새로운 전략의 발전을 위해 중요하다. 그러나, 산모 - 태아 인터페이스의 높은 종간 변화는 실험 조사를 복잡하게한다. 또한, 대부분의 미생물 병원균은 숙주 특이성이, 이렇게 많은 동물 모델이 완전한 인간 전염병을 요점을 되풀이 할 수 없습니다 보여줍니다. 예, 리스테리아 균 등 다른 호스트 특이성 1의 이상의 중간 레벨을 표시하는 동안 특정 생물 (인플루엔자 균, 살모넬라 typhi, 비브리오 콜레라, 그리고 수많은 다른 사람), 인간 엄격하게 병원성입니다. 호스트 특이성은 식민 2, 보급 3, 면역 회피 (4)을 포함하여, 병원의 여러 측면에서 설명하고있다 , 영양 인수 5. 따라서, 최적의 호스트 시스템의 모델을 선택하는 가장 중요하다.
태아 세포와 산모의 혈액으로 구성, 태반이 빠르게 임신 6의 과정을 통해 개발 기관이다. 간단히 말해서, 인간의 태반은 산모의 혈액에서 목욕 태아 "융모"나무와 같은 구조로 구성되어있다. 가스와 영양 교환은 융모 나무의 표면을 줄 trophoblasts라는 전문 태아 세포 층에 걸쳐 발생합니다. 임산부 자궁 점막 라이닝, 비 임신 여성에서 자궁 내막 불리는 fetoplacental 장치를 수용하기 위해 탈락에 구조적 및 기능적으로 변환합니다. 융모 나무는 탈락으로 셀 열을 고정 마이그레이션 extravillous trophoblasts (EVT)에 의해 자궁에 고정된다. 모체 - 태아 인터페이스는, 따라서, 탈락 막과 태반으로 구성되어 있습니다.
장기 배양 기술은 여기에 설명L. 포함 위치 및 방법을 임상 적으로 인간의 병원체를 검사하는 데 사용되었습니다 monocytogene들과 톡소 포자충은 태반 장벽 2,7 교차합니다. 이러한 생체 기관 배양은 생체 조직 구조에서 복제 인간 태반에 대한 논란의 여지 생리 학적 관련성이 높은 모델 시스템입니다. 추가 배양 기술은 3D 매트릭스에 포함 된 전체 장기 외식, 장기 조각, 조직 또는 줄기 세포 organoids를 포함한다. 이러한 옵션에 대한 자세한 내용은 포괄적 최근 리뷰 (8)을 참조하십시오. 이 프로토콜은 탈락 막과 태반 융모의 별도의 문화이므로주의 해주십시오. 태반 세포 및 탈락 막 세포 사이의 상호 작용을 연구하는 공동 배양 기술이 바람직 할 수있다. 우리는 영양막 세포 매개 탈락 혈관 재 9-11을 공부하는 연구자들에 의해 사용되는 전술 한 융모-탈락 공동 배양 기술에 관심있는 독자를 참조하십시오.
프로토콜
실험은 헬싱키 선언에 표현 된 원칙에 따라 실시 하였다. 본 연구는 캘리포니아 대학에서 임상 시험 심사위원회, 샌프란시스코 (CHR 번호 11-05530)에 의해 승인되었다. 제공하는 모든 환자 샘플 및 후속 분석의 수집에 대한 동의를 통보하여 작성. 조직은 해제 확인 된 표본으로 수집 하였다.
주 : 연구원은 기관 인간 주제 검토위원회의 승인을 받아야합니다. 임신 역사 또는 태반의 이상에 따라 표본의 제외는 특정 연구의 필요에 따라 달라집니다.
참고 : 적절한 안전 조건 (바이오 안전성 레벨 2)이 프로토콜 12의 모든 단계에 이용되어야한다.
컬렉션의 날 1. 준비, 이전
- 오토 클레이브 스트레이너 / 수집 용 집게, 마이크로 해부 가위 / 집게.
- 적절한 세척 버퍼의 양 (시편 500 ㎖) (재 준비) 조리법은 표 1에 FER.
- 적절한 볼륨 0.22 μM 멸균 여과 컬렉션 미디어 (시편 100 ㎖) 준비 (레시피 표 1 참조).
- 나누어지는 세포 외 매트릭스의 장기 저장을 위해 (ECM은 자세한 내용은 시약의 표 참조).
- -20 ° C에서 고체 형태로 저장 ECM. 최적의 성능을 위해, 반복 동결 해동을 피하십시오. 해동 4 ° C에서 점성 용액 병 및 냉장 피펫 팁 추운 방에 300 μL 씩 준비를합니다. -20 ° C에서 보관 씩.
신선한 조직의 2 컬렉션
주의 : 신선한 인체 조직과 작업 할 때, 연구자들은 혈액 유래 병원체의 전송을 방지하기위한 범용주의 사항 (OSHA)를 수행해야하며, 적절한 제도적 교육을받은해야합니다. 장갑, 눈 보호 및 실험실 코트를 포함하여 적절한 개인 보호 장비는 필요하다.
- 수송멸균-스트레이너 (표본 당 하나), 멸균 - 집게, 워시 버퍼 (상자 속에 든 대형 유리 병), 컬렉션 미디어 (50 ML 원뿔 튜브에 시료 당 25 ㎖), 스프레이 병, 10 %의 표백제, 70 % 에탄올, 조직 수집 트레이, 샤피 그리고 얼음 양동이 / 병원 / 클리닉에 쿨러입니다.
참고 : 시편 운영 제품군에 가까운 방에있는 연구 지정된 공간에 수신된다. 멸균 조직 배양 후드가 필요하지 않고, 수집 신속히 발생했을 후술 연구자가 적절하게 표면을 살균한다. - 워시의 장소 상자 속에 든 대형 유리 병은 싱크대에 인접 버퍼, 10 % 표백제와 70 % 에탄올로 스피 스프레이. 장소 유리 조직 수집 광원 (빛 패드 또는 라이트 박스)에 트레이와 10 % 표백제와 70 % 에탄올로 소독. 공기 건조 할 수 있습니다.
- 시편 준비 방 운영 스위트에서 임상 캐리 표본을 가지고있다. 싱크대에서, WAS에 조직을 여러 번 세척, 살균 핸드 헬드 스트레이너 꼭대기 시편을 부어시간 버퍼는, 광원 꼭대기에 소독 유리 트레이에 버퍼에 전체 표본을 전송합니다.
주 : 임상의 조직 평가 임상 구두 그 / 그녀가 평가 완료되었음을 나타낸 후 따라서 다음 단계 만이 수행되며, 가장 높은 우선 순위이다. - 컬렉션의 태반 융모와 탈락 막 (도 2A 및 3A)를 선택하고 50 ML 원뿔 튜브를 분리 전송하는 멸균 집게를 사용합니다. 임신 주수와 튜브 라벨.
참고 : 바람직한 재태 연령 미만의 구주 각각 태반과 탈락, 미만 16주 있습니다. 기관에서, 각 시험편의 일부만 적절한 임상 조직 병리학 적 진단을 유지해야하기 때문에, 연구 목적으로 조달한다. - 연구 실험실에 얼음 저장 및 전송 표본.
- 콜레 사이 10 % 표백제 및 70 % 에탄올로 전술 한 바와 같이 하나 이상의 표본을 수집하기 위해, 유리 트레이 살균각 시편의 ction.
장기 문화 플레이트 3. 준비
주 : 다음 단계는 조직 배양 후드에서 무균 기술을 사용하여 수행되어야한다. 해부 현미경은 무균 영역에 위치하는 것이 적합하다. 미세 절개가 신속하게 수행되고, 기기는 70 % 에탄올에 침지 빈번하지만,이 긴 절대적으로 필요하지 않다.
- 얼음에 해동 ECM 유리 병 (들). 피펫으로 혼합, 얼음처럼 차가운 컬렉션 매체와 1 : ECM 1을 희석. 피펫 천천히 거품을 도입 피하기 위해. 6 웰 조직 배양 플레이트의 각 웰이 현탁액 100 ㎕를 필요 3-4 기관 배양 물을 수용한다.
- 6- 웰 조직 배양 플레이트의 각 웰에 배치 트랜스 웰 인서트 (공경 0.4 μM).
- 코트는 각 ECM / 미디어 서스펜션의 얇은 층 (100 μL)에 삽입 트랜스 웰.
- 얼음에 접시를 놓고 즉시 establishmen로 진행기관 배양의 t. 또한, 케이스는 나중에 사용하기 위해 4 ° C에서 파라 - 영화와 저장소에 포장하는 조직 수집하기 전에 판을 준비합니다. 전자 재료가 건조하므로 더 이상 6 시간 이상 저장하지 않는 것이 좋습니다.
기관 배양 4. 설립
참고 :이 단계는 별도의 트랜스 웰에서 탈락 장기 문화와 융모 기관 배양을 배치하는 방법에 대해 설명합니다. 조직이 접촉하지 않습니다. 탈락 및 융모가 서로 직접 접촉하는 공동 배양 방법에 관심이 연구자들은 이전 문헌 9, 10을 참고 할 수있다.
- 각 린스 사이에 1,000 XG에서 수집 미디어, 원심 분리기에 두 번 표본을 씻어. 해부 현미경의 무대에서 멸균 페트리 접시와 장소에 조직을 전송합니다. 현미경에 인접한 얼음에 6 웰 플레이트를 유지합니다.
- 2-3mm 융모 장기 문화를 확립하기 위해 멸균 스프링 해부 가위와 집게와 마이크로 해부 조직S (도 2A).
참고 : 산모 기관 배양은 2 ~ 3 분기 작은, 잘 혈관 "나무", 그리고 눈에 띄는 extravillous 영양막 세포 (EVT) 셀 열 (11)와 함께. 이 ECM에 extravillous trophoblasts의 침입으로 대부분이 젊은 나이 (13)에 발음 <구주 첫 번째 임신 표본 만 융모 조직을 활용하는 것이 중요하다. - 눈에 띄는 EVT 세포 열이 잘 혈관 융모를 선택합니다. EVT 세포 열이 구상으로 가시화하고있다 "퍼지", "무성"끝 (그림 2A에서 화살촉 참조).
- 각 트랜스 웰에 3 ~ 4 융모 나무를 전송하는 멸균 집게를 사용합니다. 나무가 ECM과 별도의 응집되어 나뭇 가지 꼭대기 평면에 위치되도록 가지를 조정합니다.
- 3mm 3 탈락 기관 배양 (그림 3A)를 설정, 멸균 스프링 해부 가위와 집게로 탈락 조직을 마이크로 - 해부.
참고 : 시편은이 창피를 포함탈락 조직의 탈락 parietalis 및 탈락의 capsularis tinct의 종류 (각각 오른쪽 조직편,도 3a는 왼쪽). - 탈락의 parietalis의 3mm 3 개를 만들 가위로 자르기. 탈락의 capsularis 이러한 문화에 사용되지 않습니다. 어떤 응고 산모의 혈액을 멀리 애타게 집게를 사용합니다.
- 각 트랜스 웰에 탈락의 3 ~ 4 개를 전송하는 멸균 집게를 사용합니다.
- 우물의 바닥에 컬렉션 미디어의 1ml를 추가합니다. 5 % CO 2에서 37 ℃에서 밤새 인큐베이션 플레이트
- 실험은 정상 임신 초기 태반 산소 장력을 모방 상대 저산소증 (3 % O 2)의 융모 장기 문화를 유지하는 것이 중요입니다.
참고 : 실험실 옵션은 작은 내부에 기존의 인큐베이터에 맞게 저산소증 인큐베이터 실, 또는 산소 농도를 낮추기 위해 외부 N 2 가스를 도입 트라이 가스 인큐베이터를 포함한다. - 산모 또는 탈락 매체 (탭의 1 ML을 추가제작 : 1) 문화의 12-16 시간 후 트랜스 웰의 맨.
주 : 문화 제 하룻밤 동안 매체의 부재는 extravillous 영양막 세포 열 (융모 문화)에 침입 할 수 있으며, 조직에 대해 (융모와 탈락 모두) 안전하게 ECM에 포함되기. 우리의 경험에서 탈락 기관 배양 96 시간, 72 시간 및 융모 기관 문화에 대한 실행 가능한 남아있다. 우리는이 기간 내에 실험 엔드 포인트를 권장합니다. 산모와 탈락 매체의 구성은 표 1을 참조하십시오. 탈락 매체가 decidualized 상태 (표 1) 임신 유지 호르몬 (프로게스테론, 17β-에스트라 디올)로 보충하면서 융모 매체 FBS의 높은 비율을 갖는다.
L. 5. 준비 문화 모노 사이토 겐
참고 : L.의 장기 저장에 대한 자세한 프로토콜의 모노 사이토, 그리고 문화와 생의 성장뇌 심장 주입 (BHI) 국물과 한천에서의 유기체는 왕 등을 참조하시기 바랍니다. (14)
- 단일 L. 선택 줄무늬 BHI 한천 플레이트에서 식민지 모노 사이토 겐과 BHI 배지 3 ㎖를 접종.
- L.을 품어 30 ° C에서, 경사 위치에서 밤새 (16 시간) 배양 모노 사이토 겐.
주 :. 이러한 배양 조건은 세균 증식이 정상기에 도달하도록 L. 모노 사이토 겐은 숙주 세포의 침윤을 증가 15 ~ 30 ° C에서 flagellated된다.
L.와 오르간 문화 6. 감염 모노 사이토
- 따뜻한 PBS 및 산모 또는 37 ° C에 탈락 매체 (표 1).
- 전자 재료에 침입하지 않았다, 따라서 우물에 떠되는 모든 기관 배양 조각을 제거하는 살균 핀셋을 사용합니다.
- 조심스럽게 트랜스 웰의 바닥에서 미디어를 대기음. 부드럽게 전쟁 1 ㎖를 피펫 팅에 의해 두 번 상하 트랜스 웰을 씻어물론 조심스럽게 사이에 흡입으로 PBS를 해요. 부드럽게 상하 트랜스 웰에 항생제가없는 산모 또는 탈락 미디어 1 ㎖를 피펫. 장기 문화를 방해하지 않도록주의하십시오.
- 조직 항생제가 제거되었는지 확인하기 위해 적어도 시간 동안 항생제없는 배지에서 배양 할 수 있습니다.
참고 : 고정 단계에서, L.의 밀도를 모노 사이토 문화 ml의 당 약 1 × 10 9 집락 형성 단위 (CFU)입니다. 기관 배양 물을 감염시키기 위해 사용되는 세균의 수가 실험 요구를 충족 경험적으로 결정되어야한다. - 야생형 L. 들어 일상적인 감염 실험 모노 사이토는 (물론 당 미디어 1 ml의 4 × 10 7 리스테리아 모노 사이토 겐) 하룻밤의시 50 분 희석과 강력한 침략을 보여줍니다. 항생제없는 산모 또는 탈락 배지에서 세균의 적절한 수를 재현 탁.
- 트랜스 웰의 상단에서 대기음 미디어. 부드럽게 접종 1 ㎖를 추가합니다. 37 판을 품어5 % CO 2 ° C는 세균의 침입을 허용합니다.
- 상부 및 하부 트랜스 웰에서 미디어를 흡입하여 세포 외 박테리아를 제거합니다. 따뜻한 PBS로 두 번 우물을 씻어. 50 μg의 ml의 -1 겐타 마이신으로 보충 산모 또는 탈락 미디어의 1 ML을 추가합니다. 5 % CO 2에서 37 ℃에서 플레이트를 인큐베이션.
참고 : L. 모노 사이토 겐은 세포 외 배지에서 성장하는 세포의 내부 성장하고, 세포 외 공간에 액세스하지 않고 세포 간에서 확산 할 수있는 통성 박테리아 세포이다. 겐타 마이신은 세포 외 L.에 살균 효과가있다 모노 사이토 겐, 따라서 세포 L. 측정을 허용 모노 사이토 겐의 성장 및 기관 배양 물 (16)를 통해 확산.
참고 : 재현 L. 융모와 탈락 기관 배양의 모노 사이토 감염은 5 시간의 배양 시간에 발생합니다. 젠타 마이신을 첨가하기 전에 배양 시간은 실험적인 요구와 구간에 기초하여 수정 될 수있다유기체의 ility는 조직을 침범합니다. 더 감염 해부학 적 부위가 가장 취약한 이해하기 위해, 짧은 배양 시간이 사용될 수있다. - 실험 기간 동안 5 % CO 2에서 37 ℃에서 플레이트를 유지한다. 또한 매일 각 전체 미디어를 변경합니다.
참고 : 우리의 경험, L.에서 -infected 탈락 기관 배양 72 시간 동안 48 시간 및 융모 기관 문화에 대한 실행 가능한 유지 모노 사이토 겐.
조직 병리학 7. 수확 기관의 문화
- 30 ml의 PBS에서 16 %의 재고 앰플 10ml를 희석하여 4 % 파라 포름 알데히드의 새로운 솔루션을 준비합니다. 4 ° C에서 보관 4 % 파라 포름 알데히드는, 빛으로부터 보호, 1 주일 이내에 사용한다. 사용하기 전에 실온으로 준비한다.
- 상하의 트랜스 웰로부터 대기음 매체. 부드럽게 실온에서 PBS로 두 번 씻어 웰. 조심스럽게 완전히 기관 배양을 커버하는 트랜스 웰 상단으로 1ml의 4 % 파라 포름 알데히드를 추가합니다.
- 품다20 분 동안 실온에서 4 % 파라 포름 알데히드에서. 이 조직의 과도한 고정으로 이어질 수도로 긴 배양 시간을 피하십시오.
- 실온에서 PBS로 두번 대기음 파라 포름 알데히드 및 린스 웰. 그라 이오 스탯에 간섭 단층 매체, 동결 및 섹션의 고정 장기 문화를 포함 ( "냉동 고정"). 일반적으로, 고정 냉동 조직은 이전에 고정하지 않고 고정 된 조직보다 섹션 쉽다.
참고 : 간섭 단층 삽입 및 냉동 절편에 대한 전체 프로토콜, 출판 프로토콜 17, 18에서 관련 부분에 액세스하시기 바랍니다. 실험의 요구와 가능한 실험실 장비 및 스토리지에 따라 조직 대신 파라핀 - 임베디드 및 마이크로톰 (19)에 구분 될 수있다. - 또한 일상 헤 마톡 실린 및 에오신 염색, 면역 형광 또는 면역 조직 화학의 18,20,21에 대한 조직 슬라이드를 준비합니다.
결과
그림 1 (젤 도비 크 (Zeldovich) 및 Bakardjiev 22에서 수정)은 관련 태반과 자궁의 해부학 다이어그램.이 대표 총과 태반 융모의 조직 학적 이미지를 보여주고, 그림 3은 탈락 조직을 보여줍니다있다.
이 프로토콜은 먼저 병원이나 병원에서 신선한 태반과 탈락 막 조직의 컬렉션을 설명합니다. 수집 된 표본은 태아의 태반 (융모)과 산모의 자궁 구성 요소 (탈락)의 혼합물이다. 광범위 항생제와 항진균제를 함유하는 완충액으로 세척 한 후, 시료 전체가 빛 상자를 사용하여 눈으로 검사된다. 융모와 탈락 실험실에 얼음에 별도의 튜브에 넣고 운반된다. 실험실에서 해부 현미경은 건강한 조직의 미세 형태 학적 특징을 감사하는 데 사용됩니다. 대표 사진융모 (그림 2A) 및 탈락 조직 두 개의 외부 거위 광원과 해부 현미경으로 획득 하였다 (도 3A)는 참조 용으로 도시된다.
융모 기관 배양은 임신 초기 표본에서 생성됩니다. 문화는 2-6 가지 작은 단말기 융모 나무로 구성되어 있습니다. extravillous 영양막 세포의 열 종료하고 잘 혈관된다 융모 가지를 해부하는 것이 중요하다. 이러한 기능은 "무성"또는 "퍼지"분기 종료 (화살촉), 그리고 희미한 핑크 - 투 - 붉은 선형 색상으로 간주되는 그림 2A에서 왼쪽에있는 나무의 가지를 통해 코스. 반면, 혈관 및 extravillous trophoblasts 쉽게 문화 차선 것이 이미지의 오른쪽에있는 나무에 대한 가시화되지 않습니다. 문화의 첫 날 동안, extravillous trophoblasts는 ECM, t로 마이그레이션해바라기 껍데기 트랜스 웰의 매트릭스에 융모 나무를 고정.
탈락 기관 배양 먼저 초기 둘째 임신 표본에서 생성됩니다. 전체 자궁 안감은 주입 후 매우 곧 탈락로 변환됩니다. 구체적으로는, 탈락의 basalis 직접 태반 / 이식 장소의 기초 자궁 점막, 탈락의 capsularis은 점막 태아 놓인 정의 정의하고, 탈락의 parietalis은 자궁 내막 나머지를 의미한다. 해부 현미경으로 시각화는 초기 임신 시편 (그림 3a에 각각 좌우 조직 단편) 크게 탈락의 parietalis과 탈락의 capsularis로 구성되어 있음을 보여준다. 탈락의 capsularis 쉽게 그것의 얇은 막의 특성에 의해 구별된다. 기관 배양 들어, 탈락의 parietalis 3 내지 3mm 트리밍 마이크로 해부 가위 및 adhE 유전자와 조각임대 응고 혈액 집게로 제거됩니다.
밤새 배양 한 후에, 조직을 L. 감염된 모노 사이토. 상기 감염 프로토콜은 세포 성장 및 세포 내 박테리아 통성 (16)의 확산을 연구하기 위해 사용 젠타 마이신 보호 분석에 기초한다. 항생제가없는 배지에서 기관 배양으로 배양 L. 5 시간 동안 모노 사이토 겐. 문화 매체에서 박테리아를 제거하기 위해 멸균 PBS로 세척한다. 그 후, 세포들은 젠타 마이신 생물을 제거하기 위해 첨가된다. 우리 연구실에서 이전 문학 감염이 후 다양한 시점들에서 세균 조직의 현지화를 결정하기 위해 면역 및 공 초점 현미경을 사용했다. 기관 배양 물을 4 % 파라 포름 알데히드로 고정, PBS로 세정하고, 동결되는 어느 매립의 OCT 매질 중에 -80 ℃에서 보관하거나 파라핀 실온에서 저장된다. 조직 절편은 STA 일 수있다면역 형광 (IF) 또는 세균의 면역 조직 화학 (IHC) 분석 및 진핵 세포의 현지화 이네.도 2b는 대표적인 경우 감염 후 72 시간에서 8.3 주 융모 기관 배양에서 제조 한 동결 절편의 이미지입니다. 융모 가지의 단부에서 EVTs에 무거운 부담 박테리아 (녹색 형광) 및 트리 라이닝는 syncytiotrophoblast (적색 형광) 층 내의 세균의 상대적인 부족합니다. 염색 L.을 지역화 할 경우 이전의 연구에서, 우리는 유사한 사용 감염 후 다른 시점들에서 융모 기관 배양에서 모노 사이토. 72 시간, 하위 세포 융합 cytotrophoblasts 및 기본 융모 기질에 EVT에서 감염 확산을 통해. 특히, synyctiotrophoblast 층 감염에 내성이 있었다.
H & E 염색 파라핀 탈락 조직 섹션의 대표적인 광학 현미경 이미지는 14.3 주 specime에서 준비NS는도 3B 및 3C에 표시됩니다. ECM이 코팅 된 트랜스 웰 막을 원위치에서 기관 배양 물 (도 3b)을 표시하는 삽입 하였다. 이미지는 상피 늘어선 샘 (별표)와 내피가 늘어선 혈관 (다이아몬드)가 탈락 기질 세포 구획 내에서 이질 위치이다. 또한, 가변 밀도에서 탈락 기질에 흩어져 산모의 면역 세포가있다. IHC 및 염색 특정 상주 면역 세포에 대하여 세균 microanatomical 현지화를 결정하는 데에 이용 될 수있는 경우. , 예를 들어, CD14 +의 대 식세포 (녹색 형광)은 혈관의 내벽에 지역화와 기질 (그림 3D) 내에 분산되어있는 동안 L.의 큰 집계 모노 사이토는 (적색 형광) 감염 후 48 시간 (그림 3D)에서 탈락 기질에서 주로 관찰된다.
| 세척 버퍼 | 컬렉션 매체 | 융모 매체 | 탈락 매체 |
| PBS | 루타와 DMEM / F-12 | 루타와 DMEM / F-12 | 루타와 DMEM / F-12 |
| 페니실린 100 IU / ㎖ | 태아 소 혈청 2.5 % | 태아 소 혈청 20 % | 태아 소 혈청 2.5 % |
| 스트렙토 마이신 100 μg의 / ㎖ | 페니실린 100 IU / ㎖ | 페니실린 100 IU / ㎖ | 17β-estradiol과 300 pg / ml 인 |
| 겐타 마이신 50 μg의 / ㎖ | 스트렙토 마이신 100 μg의 / ㎖ | 스트렙토 마이신 100 μg의 / ㎖ | 프로게스테론 (20) NG / ㎖ |
| 암포 테리 신 B 1.25 μg의 / ㎖ | 겐타 마이신 50 μg의 / ㎖ | ||
| < / TD> | 암포 테리 신 B 1.25 μg의 / ㎖ |
표 1. 미디어 요리법 구성 요소 및 세척 버퍼, 컬렉션 매체 융모 매체와 탈락 매체의 준비를위한 농도.
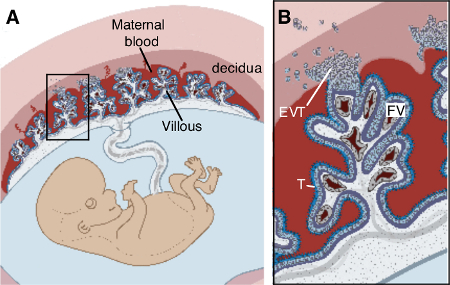
산모의 자궁에서 태아 - 태반 유닛의 그림 1. 태반 구조. (A) 구조에서 상자의 (B) 확대 (A)는 태아의 영양막 세포 (T)는 태반의 융모가 산모의 혈액에서 목욕과에 의해 탈락에 고정되는 줄 지어 있음을 강조 extravillous trophoblasts (EVT). 융모에 포함 된 태아 혈관 (FV), 섬유 아 세포, 태아 식세포이다. 젤 도비 크 (Zeldovich) 및 Bakardjiev (22)에서 수정. ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
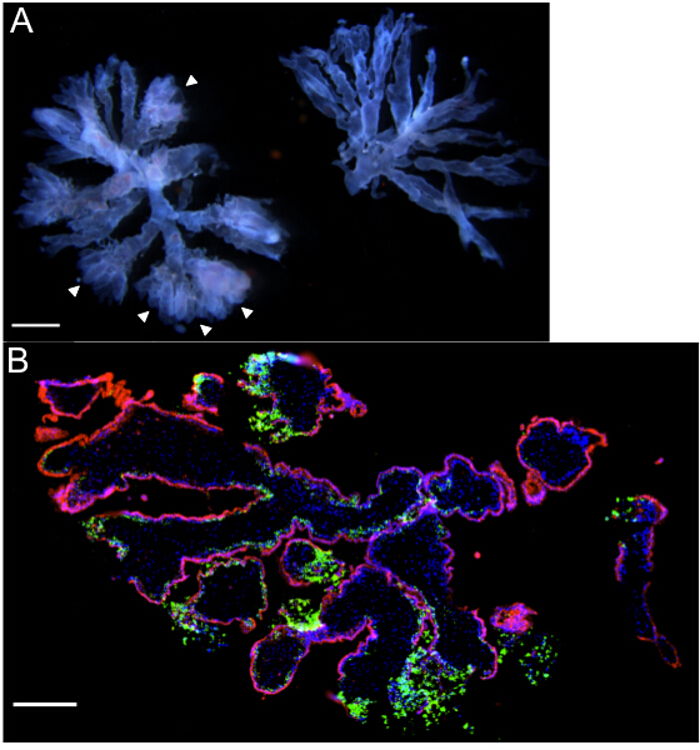
그림 2 : 산모 기관 배양 - 대표 총 현미경 이미지 (A) 해부 현미경으로 볼 때 육주의 임신 주수와 함께 두 개의 터미널 융모 나무,.. 기관 배양이 조각 적합하다 왼쪽에있는 나무의 가지를 통해 전기가은 "무성"끝 (화살촉)과 눈에 띄는 태아의 혈관을합니다. extravillous trophoblasts 무거운 세균 부담 [녹색]을 강조 리스테리아와 기관 배양 (재태 기간 8.3 주) 72 시간 게시물 감염 (B) 면역 형광 현미경. DAPI는 파란색으로 표시되며, 빨간색 βHCG는 + syncytiotrophoblasts. 스케일 바 = 1mm (A) 250 ㎛의 (B).7 / 54237fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
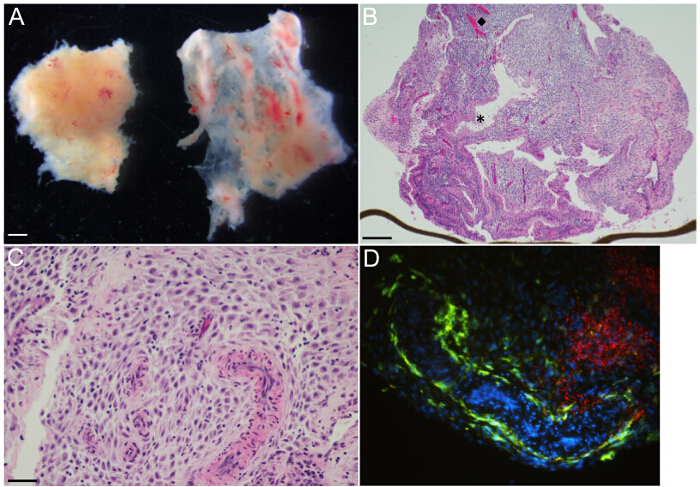
그림 3 :. 탈락 기관 배양 - 대표 총 현미경 이미지 (A) 탈락 parietalis [왼쪽]과 탈락의 capsularis [오른쪽] 재태 연령 육주에서, 해부 현미경으로 볼 때. 14.3 주 임신 연령 탈락 parietalis 기관 배양의 (B) H & E 염색 부분은 탈락 기질에 걸쳐 균질 조직 땀샘과 혈관을 보여줍니다. 제 (다이아몬드, ◆) 및 (별표, *)를 각각 대표하는 용기와 선을 강조 표시합니다. 하단에서 갈색 선은 가장자리에, 트랜스 웰 막이다. 14.3 주 임신 연령 탈락의 (C) H & E 염색 부분은 더 높은 배율 D에 장기 문화를 parietalis탈락 기질에 포함 된 근육 벽 나선 세동맥을 emonstrates. 산모의 면역 세포는 어두운 둥근 핵 작은, 그리고 불규칙 기질을 통해 배포됩니다. (D) L.와 기관 배양 48 시간 게시물 감염의 면역 형광 현미경 박테리아의 큰 영역 탈락 기질에 [레드], 산모 CD14 + 대 식세포 [녹색] 구불 구불 한 혈관 공간을 안감과 기질에 흩어져을 강조 모노 사이토. 스케일 바 = 1mm (A), 250 μm의 (B), 50 μm의 (C와 D). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
근친 교배, 유전자 변형 및 녹아웃 마우스 균주는 견고 메커니즘을 테스트하는 실험 시스템에서 검색 할 수 있습니다. 그러나 핵심 유전 물질의 일반적인 보존에도 불구하고, 마우스 및 인간의 기능 게놈 규제 요소 (23)에서 유의 한 차이를 보여줍니다. 그것은 따라서, 동물 모델에서 그 유망한 임상 시험은 때때로 인간의 환자에서하지 놀라운 효과적으로 요약되지 않습니다. 태반 따라서 인간의 질병 (24)의 연구를위한 동물 모델 적은 이상적인 다음 렌더링 매우 높은 종간의 다양성을 보여줍니다. 인간 및 마우스 면역학 (25)의 주목할만한 차이, 그리고 태반 해부학의 발음 발산 진화를 모두 인정, 실험 조사에 대한 인간의 임신 조직의 생체 장기 문화의 사용을 고려하는 것이 현명하다.
이 프로토콜에 대한 설명, 사진 이미지, 교육 비디오에 연구원 지시ECM 코팅 된 트랜스 웰 조직 배양 삽입에 융모와 탈락 기관 배양을 설정하는 방법. 이 방법의 장점은 특히 3D 매립 행렬 또는 기관 슬라이스 배양 등 다른 방법에 비해 미세 절개 상대적인 단순성 및 기계적지지 트랜스 웰 시스템을 포함한다. 막 지원에 대한 장기 문화의 서스펜션은 모든 조직 표면에서 영양소를 교환 할 수 있습니다과 생존 단기 문화 (융모 문화 96 시간, 탈락 문화에 대한 72 시간) .This 기술은 조직에서 인간 태반 생물학을 공부 수 있습니다 동안 유지 레벨 단층 세포 배양 모델보다 명백하게 더 생물학적으로 중요한.
이 프로토콜에서 가장 중요한 단계는 장기 배양에 적합한 융모와 탈락 피스의 미세 절개한다. 조직의 최적의 조각을 사진으로 보여 주었다 (그림 2A 그림 3a는)에 대한 연구를 지원하기 위해임신 표본의 시각화의 새로운 기능입니다. 이들 세포가 ECM에 이주하고 막에 융모을 고정 도움이 될 것입니다, 그 가지 EVT 열에서 종료 융모 나무를 선택하는 것이 특히 중요하다. 기관 배양 두 가지 유형에 대한 신중하고 서두르지 않는 방식으로 피펫으로 미디어 변경시 조직에 장애를 최소화하는 것이 도움이된다.
이 기술은 최소한의 어려움을 나타낸다. 경우에 따라, 표본 오염을 보여줍니다. 오염은 일반적으로 세균 (가끔 폴리 미생물)이며, 단지 문화 1-2 일 후에 분명해진다. 오염이 관찰되면, 표백제 배양 폐기 적용되어야하고, 조직 배양 인큐베이터 장기적인 문제를 방지하기 위해 살균. 표본 수확 / 처리 중 자궁 내 감염, 수술 중, 또는 장기 배양 유지 보수시 : 여러 가지 오염이 발생할 수있는 방법이 있습니다. 수확 및 처리 단계는 대부분의 시간이다오염에 대 한 장소를 소개합니다. 따라서, 시료가 수집 및 미세 절개 중에 조작되는 시간을 줄이는 것이 중요하다. 이것은 주변의 비 멸균 환경에 시료의 노출을 감소시킬 것이다. 실험 설정에 따라 해부 현미경 멸균 조직 배양 후드의 내부에 위치 할 수있다.
의학적 관련 병원균 L. 감염 후 기관 배양의 조직 병리학 적 분석 모노 사이토는, 프로토콜의 하나의 가능한 응용 프로그램으로 여기에 표시됩니다. 병원균에 대한 인간의 호스트 응답에 감염 수익률 새로운 통찰력 후 모두 세균과 숙주 면역 세포의 면역 형광 현지화. 탈락 기관 배양은 쥐의 탈락 식세포 방어 기능 (26, 27)의 결함을 보여주는 흥미로운 보고서를 포함하는 생체 마우스 감염에서 생성 된 데이터를 검사 할 수있는 보완적인 생체 실험 기술이 될 수 있습니다. 또한, 인간의 조직배양은 L. 여러 동질 계통 이루어지는 경쟁 접종로 혼합 전략 감염에 사용될 수있다 모노 사이토. 기관 배양의 경쟁 감염은 인간 숙주 내에서 병원성 인자의 관련성을 테스트하기위한 중요한 방법이다. 이 방법의 한 가지 제약 조건은 단기 문화 (융모 문화 96 시간, 탈락 문화에 대한 72 시간)으로 제한된다 조직의 생존이다. 이것은 L. 빠른 속도로 성장하는 미생물 감염에 이상적입니다 모노 사이토,하지만 더 이상 문화 확립하고 조직을 통해 확산하는 데 시간이 더 걸릴 병원균에 대한 필요가있다.
임신 합병증의 글로벌 부담을 줄이기 위해, 연구는 인간의 모체 - 태아 인터페이스의 병태 생리를 이해에 초점을해야합니다. 세균, 곰팡이, 임신 및 태아 감염의 합병증을 파괴 원인이 태아에 어머니로부터 교차 바이러스 성 병원체. 실험실 애니의 생체 감염 제어MALS는 일반적으로 병원균이 식민지 및 기관 (28) 사이의 전송 방법을 해결하기위한 황금 표준으로 간주됩니다. 태반 해부학 포유류 종에 걸쳐 현저하게 변화하기 때문에, 연구 전략으로 인체 조직을 포함하는 가장 중요하다. 인간 융모와 탈락 기관 배양 호스트 병원체 상호 작용을 조사하기 관련성이 높은 모델 시스템입니다. 이 중요한 아직 제대로 이해 기관을 연구하기 위해 연구자는 여기에 설명 된 바와 같이 기관 배양 전략을 사용하여, 그렇지 않으면 폐기 인간의 태반과 탈락 표본의 풍요 로움을 이용할 수 있습니다.
공개
The authors have nothing to disclose.
감사의 말
We are grateful to Cristina Faralla and David Lowe for helpful discussions. We acknowledge Mark Weinstein and San Francisco General Hospital Pathology Department for expert advice. This work was supported by National Institute of Health grants R01AI084928 and Burroughs Wellcome Fund 41259 to A.I.B; G.A.R. was supported by F32AI108195, Society for Pediatric Pathology Young Investigator Research grant, and University of California Partnerships for Faculty Diversity President's Post-doctoral Fellowship.
자료
| Name | Company | Catalog Number | Comments |
| Sterilization pouches | Fisher Scientific | 01-812-54 | For autoclaving individual dissecting tools |
| Fine mesh strainer | Cuisinart (Amazon.com) | NA | Wrap completely in aluminum foil and autoclave prior to tissue collection. |
| Carboy with spigot | Fisher Scientific | 03-007-647 | For large volume preparation of Wash buffer. |
| Ice packs | Nortech labs | GB8818 | These do not have to be purchased, rather they can be recycled/reused from any routine laboratory shipment that includes them in the packaging. |
| 70% Ethanol | VWR | V1001 | 70% solution made by adding dH20 to 190 or 200 proof research grade alcohol. |
| 10% Bleach | Waxie Sanitary Supply | CLO 30966 | 10% solution made by adding dH20. |
| Light Box | Litebox Lumina (dickblick.com) | 55305-2009 | Note replacement bulbs also purchased on Blick (55305.0100) |
| Micro dissecting forceps | Stoelting | 52102-43 | 4 inches, 1 x 2 x 0.5 mm3, Slight Curve |
| Micro dissecting forceps | Stoelting | 52102-06 | 4 inches, Straight Fine, Sharp |
| Micro dissecting vannas spring scissors | Stoelting | 52130-01P | McPherson-Vannas Spring Scissors, 8.5 cm, 0.33 Tip, Slight Curve |
| Dissecting microscope | Leica Microsystems | MZ16 or M60 | We have had success with the listed models. External gooseneck flexible light sources are helpful but not necessary. |
| 50 ml conical tubes | Sigma-Aldrich (Corning) | CLS4558 | |
| Phosphate Buffered Saline | Gibco (ThermoFisher Scientific) | 10010023 | We purchase from our university Tissue Culture Core facility, alternate options such as this are available. |
| 10x Phosphate Buffered Saline | Teknova | P0195 | For preparation of Wash buffer we use 10x PBS |
| DMEM/F-12 nutrient mixture (Ham's) with GlutaMAX | Gibco (Life Technologies) | 10565-018 | We purchase this specific media formulation, containing 2.438 g/L sodium bicarbonate, 55 mg/L sodium pyruvate, and 4.5 g/L glucose |
| Gentamicin | Thermofisher Scientific | 15710072 | 1, 000x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Amphotericin B | Gibco (ThermoFisher Scientific) | 15290-018 | 500x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| progesterone | Sigma-Aldrich | P8783 | A 1 mM stock solution is made by reconstituting 15.7 mg progesterone powder in 15.7 ml Ethanol and adding 34.3 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| 17β-estradiol | Sigma-Aldrich | E2758 | A 10 μM stock solution is made by reconstituting 13.5 mg estradiol powder in 10 ml ethanol and adding 40 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| Bottle-top vaccum filter (0.22 μm) | Sigma-Aldrich (Corning) | CLS430769 | For sterile filtration of Collection media after preparation |
| 6-well tissue culture plate | BD Falcon | 353224 | Polystyrene, Tissue culture treated |
| 6-well transwells | Millipore | PICM03050 | Insert - 30 mm diameter, 0.4 μm pore size hydrophilic PTFE membrane |
| Extracellular Matrix (for example, Matrigel Matrix) | BD Biosciences | 354234 | We have utilized Matrigel Matrix in our studies. It is a solid at room temperature and at -20 °C. Avoid repeat freeze/thawing. Thaw bottle to viscous solution at 4 °C, and prepare ~ 300 μL aliquots in the cold room with chilled pipette tips. Store aliquots at -20 °C. |
| Paraformaldehyde, 16% w/v aqueous solution | Alfa Aesar | 30525-89-4 | For tissue fixation, a fresh preparation of 4% paraformaldehyde is made by diluting this stock in PBS. |
| Tissue culture incubator, maintained at 37 °C, 5% CO2, 3% oxygen (optional for villous organ cultures) | For some experiments, hypoxia may be preferred. This can be established multiple ways, including addition of exogenous nitrogen via gas cylinder, Tygon tubing, and a regulator. | ||
| Bench top centrifuge |
참고문헌
- Pan, X., Yang, Y., Zhang, J. R. Molecular basis of host specificity in human pathogenic bacteria. Emerging microbes & infections. 3, e23 (2014).
- Robbins, J. R., Skrzypczynska, K. M., Zeldovich, V. B., Kapidzic, M., Bakardjiev, A. I. Placental syncytiotrophoblast constitutes a major barrier to vertical transmission of Listeria monocytogenes. PLoS pathogens. 6, e1000732 (2010).
- Zhang, J. R., et al. The polymeric immunoglobulin receptor translocates pneumococci across human nasopharyngeal epithelial cells. Cell. 102, 827-837 (2000).
- Ngampasutadol, J., et al. Human C4b-binding protein selectively interacts with Neisseria gonorrhoeae and results in species-specific infection. Proceedings of the National Academy of Sciences of the United States of America. 102, 17142-17147 (2005).
- Pishchany, G., et al. Specificity for human hemoglobin enhances Staphylococcus aureus infection. Cell host & microbe. 8, 544-550 (2010).
- Benirschke, K., Kaufmann, P., Baergen, R. N. . Pathology of the Human Placenta. , (2012).
- Robbins, J. R., Zeldovich, V. B., Poukchanski, A., Boothroyd, J. C., Bakardjiev, A. I. Tissue barriers of the human placenta to infection with Toxoplasma gondii. Infection and immunity. 80, 418-428 (2012).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature reviews. Molecular cell biology. 15, 647-664 (2014).
- Hazan, A. D., et al. Vascular-leukocyte interactions: mechanisms of human decidual spiral artery remodeling in vitro. The American journal of pathology. 177, 1017-1030 (2010).
- Dunk, C., et al. A novel in vitro model of trophoblast-mediated decidual blood vessel remodeling. Laboratory investigation; a journal of technical methods and pathology. 83, 1821-1828 (2003).
- Hunkapiller, N. M., Fisher, S. J. Chapter 12. Placental remodeling of the uterine vasculature. Methods in enzymology. 445, 281-302 (2008).
- Miller, J. M., et al. Guidelines for safe work practices in human and animal medical diagnostic laboratories. Recommendations of a CDC-convened, Biosafety Blue Ribbon Panel. MMWR Surveill Summ. 61 Suppl, 1-102 (2012).
- Lash, G. E., et al. Low oxygen concentrations inhibit trophoblast cell invasion from early gestation placental explants via alterations in levels of the urokinase plasminogen activator system. Biol Reprod. 74, 403-409 (2006).
- Wang, N., Strugnell, R., Wijburg, O., Brodnicki, T. Measuring bacterial load and immune responses in mice infected with Listeria monocytogenes. Journal of visualized experiments : JoVE. , (2011).
- Palmer, M. E., Watson, A. L., Burton, G. J. Morphological analysis of degeneration and regeneration of syncytiotrophoblast in first trimester placental villi during organ culture. Hum Reprod. 12, 379-382 (1997).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods in enzymology. 236, 405-420 (1994).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of visualized experiments : JoVE. , (2010).
- Croy, B. A., Yamada, A. T., DeMayo, F. J., Adamson, S. L. . The Guide to Investigation of Mouse Pregnancy, 1st Edition. , (2014).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. JoVE. , (2016).
- Troy, T. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on paraffin sections of mouse epidermis using fluorescent antibodies. Journal of visualized experiments : JoVE. , (2008).
- Chi, V., Chandy, K. G. Immunohistochemistry: paraffin sections using the Vectastain ABC kit from vector labs. Journal of visualized experiments : JoVE. , e308 (2007).
- Zeldovich, V. B., Bakardjiev, A. I. Host defense and tolerance: unique challenges in the placenta. PLoS pathogens. 8, e1002804 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515, 355-364 (2014).
- Robbins, J. R., Bakardjiev, A. I. Pathogens and the placental fortress. Current opinion in microbiology. 15, 36-43 (2012).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. J Immunol. 172, 2731-2738 (2004).
- Redline, R. W., Shea, C. M., Papaioannou, V. E., Lu, C. Y. Defective anti-listerial responses in deciduoma of pseudopregnant mice. The American journal of pathology. 133, 485-497 (1988).
- Redline, R. W., McKay, D. B., Vazquez, M. A., Papaioannou, V. E., Lu, C. Y. Macrophage functions are regulated by the substratum of murine decidual stromal cells. The Journal of clinical investigation. 85, 1951-1958 (1990).
- Bakardjiev, A. I., Theriot, J. A., Portnoy, D. A. Listeria monocytogenes traffics from maternal organs to the placenta and back. PLoS pathogens. 2, e66 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유