Method Article
Человеческие Культуры плацентарной и децидуальной Орган по изучению инфекций на материнской плода интерфейс
В этой статье
Резюме
Простой метод для установления первичной плацентарной (ворсинок) и децидуальной культуры органа описано. Ворсинок и децидуальной органных культур являются бесценными инструментами для изучения патогенеза у человека материнской плода интерфейс. Инфекция с факультативным внутриклеточным бактерий листерий демонстрируется.
Аннотация
Плацента показывает большую степень межвидовых анатомической изменчивости. Чтобы лучше понять биологию и патофизиологии плаценты человека, крайне важно разработать эксперименты с использованием человеческих клеток и тканей. Преимуществом органной культуры является обеспечение трехмерной (3D) структурной организации и внеклеточного матрикса. Цель метода , описанного здесь успешное создание бывших естественных культур органов гестационный тканей человека и их поддержания здоровой культуры в течение 72-96 часов. Протокол детализирует немедленную обработку исследований-дал согласие, плацентарного и децидуальных образцов свежей из операционной. Это обильные образцы, которые в противном случае будут отброшены. Подробные инструкции по стерильного сбора этих образцов, в том числе морфологическими подробную информацию о том, как выбрать подходящие ткани для создания 3D культуры органов, обеспечивается. Плацентарные ворсинчатые и децидуальной ткани микродиссекции на 2-3 мм 3 шти размещены отдельно на матричных подкладке Transwell фильтров и культивировали в течение нескольких дней. Ворсинок и децидуальной органных культур хорошо подходят для изучения взаимодействия хозяин-патоген человека. По сравнению с другими модельных организмов, эти человеческие культуры являются особенно предпочтительными для изучения механизма инфекции патогенов, демонстрирующих вариабельные паттерны принимающей специфичности. В качестве примера, мы демонстрируем инфекцию плацентарных и децидуальных культур органов с клинически значимых, факультативных внутриклеточных бактериальных патогенов листерий.
Введение
Инфекция и воспаление на границе раздела матери и плода представляет собой основной источник заболеваемости и смертности среди женщин и детей. Понимание того, как патогены заражают этих тканей имеет решающее значение для разработки новых стратегий для профилактики и лечения заболеваний, таких как преждевременные роды и смерть плода. Тем не менее, высокая межвидовая изменчивость интерфейса материнской плода затрудняет экспериментальное исследование. Кроме того, большинство микробные патогены показывают специфичность хозяина, поэтому многие животные модели не могут в полной мере перепросматривать инфекционных заболеваний человека. Некоторые организмы (гемофильная палочка, сальмонеллы брюшного тифа, холерный вибрион, и многие другие) являются строго патогенные для человека, в то время как другие, такие как листерий, показывают более промежуточный уровень принимающей специфичности 1. Принимающая специфичность была зарегистрирована во многих аспектах патогенеза, в том числе колонизации 2, 3, распространение иммунного уклонения от 4 , а также питательных веществ приобретение 5. Таким образом, крайне важно, чтобы выбрать оптимальные модельные системы хоста.
Состоящий из клеток плода и материнской крови, плацента является органом , который быстро развивается в течение беременности 6. Проще говоря, человеческая плацента изготовлен из фетальных "ворсинок" древовидных структур купались в крови матери. Газ и питательных веществ происходит обмен через специализированные слои эмбриональных клеток, называемых трофобласта, что линия на поверхности ворсинок деревьев. Матки слизистой оболочки матери, называется эндометрий в небеременных самок, превращает структурно и функционально в децидуальной для размещения фетоплацентарной единицы. Ворсинок деревья закрепляются в матку с помощью extravillous трофобласта (EVT), которые мигрируют из анкерных колонн клеток в децидуальной. Интерфейс матери плоду, поэтому, состоит из децидуальной и плаценты.
Техника органной культуры, описанный здесьбыл использован для изучения , где и как клинически значимых человеческих патогенов, включая L. monocytogene s и токсоплазма, проникают через плацентарный барьер 2,7. Эти ех VIVO органных культур репликации в естественных условиях архитектуры ткани, и, возможно , являются физиологически весьма соответствующие модельные системы для человеческого плацентации. Дополнительные методы культуры включают в себя целые эксплантаты органа, дольки органа и ткани или стволовых клеток органоиды, встроенные в 3D-матрицу. Для получения дополнительной информации об этих параметрах, пожалуйста , обратитесь к всеобъемлющему недавнем обзоре 8. Обратите внимание, что этот протокол для отдельной культуры децидуальной и плацентарный ворсинок. Для изучения взаимодействия плацентарных клеток и децидуальными клетками, может быть предпочтительным метод совместного культивирования. Мы отсылаем заинтересованного читателя к ранее описанным ворсинок-децидуальный техники совместного культивирования, используемой исследователей , изучающих трофобласта опосредованной децидуальных ремоделирования сосудов 9-11.
протокол
Эксперименты проводились в соответствии с принципами, выраженными в Хельсинкской декларации. Данное исследование было одобрено Институциональным наблюдательным советом Университета Калифорнии, Сан-Франциско (CHR # 11-05530). Все пациенты дали письменное информированное согласие на сбор образцов и последующего анализа. Ткань была собрана в качестве обезличенной образцов.
Примечание: Исследователь должен получить одобрение от их институциональных субъектов человека наблюдательный совет. Исключение образцов основано на гестационного истории или плацентарных аномалий будет варьироваться в зависимости от потребностей любого конкретного исследования.
Примечание: Соответствующие условия безопасности (уровень биологической безопасности 2) следует использовать для всех шагов в этом протоколе 12.
1. Подготовка, до дня сбора
- Автоклавы сетчатые / Щипцы для сбора и ножницы / щипцы для микро-рассечение.
- Приготовьте достаточный объем (500 мл на образец) буфера для промывки (повторнотающих по таблице 1 для рецепта).
- Приготовьте достаточный объем (100 мл на особь) 0,22 мкм стерильно отфильтрованного медиаколлекцию (см таблицу 1 для рецепта).
- Алиготе внеклеточного матрикса (ECM, обратитесь к таблице реагентов для деталей) для длительного хранения.
- Магазин ЕСМ в твердой форме при температуре -20 ° C. Для лучшей производительности, во избежание повторного замораживания-размораживания. Разморозить флакон с вязким раствором при температуре 4 ° С, и подготовить 300 мкл аликвоты в холодной комнате с охлажденным наконечники пипеток. Храните аликвоты при -20 ° C.
2. Сбор свежей ткани
ВНИМАНИЕ: При работе с свежей человеческой ткани, исследователи должны следовать универсальных мер предосторожности (OSHA) для предотвращения передачи патогенных микроорганизмов, передающихся через кровь, и должны получить надлежащую организационную подготовку. Правильное средства индивидуальной защиты, в том числе перчатки, средства защиты глаз и халатах нужны.
- Транспортавтоклавного-сетчатые (по одному на образце), автоклавного-пинцеты, промывочный буфер (бутыль), медиаколлекцию (25 мл на образец в 50 мл коническую трубку), спрей бутылки, 10% отбеливателя, 70% этанола, коллекция тканей лоток, шулер и ведро льда / охладитель в больницу / клинику.
ПРИМЕЧАНИЕ: Образцы, полученные в научно-исследовательском отведенном пространстве, расположенном в комнате, рядом с операционной. Стерильный тканевой культуры капот не требуется, но коллекция должна происходить оперативно и исследователь должен надлежащим образом дезинфицировать поверхности, как описано ниже. - Место бутыль промывочного буфера рядом с раковиной и опрыскивают затычку с 10% отбеливателя и 70% этанола. Место стекла коллекция тканей лоток на источник света (свет пусковой площадки или светового короба), и дезинфицировать с 10% отбеливателя и 70% этанола. Дайте высохнуть на воздухе.
- У клиницист образцы перенос из операционной, в комнату подготовки образца. В раковине, налить образец поверх стерильной ручной сетчатый фильтр, промыть ткани несколько раз былч буфер, и передать весь образец в буфере для санированном стеклянный поднос на вершине источника света.
Примечание: Оценка ткани клиницист имеет наивысший приоритет, таким образом, следующие шаги выполняются только после того, как врач-консультант в устной форме указал, что он / она закончила оценку. - Использование стерильного пинцета , чтобы выбрать плацентарный ворсинки и децидуальной (рис 2А и 3А) для сбора и передачи для разделения 50 мл конические пробирки. Пометьте пробирки гестационного возраста.
Примечание: Предпочтительный гестационный возраст менее 9 недель и менее 16 недель для плаценты и децидуальной соответственно. В учреждении только часть каждого образца закупается для исследовательских целей, как адекватные ткани должны оставаться для клинической патологической диагностики. - Хранения и транспортировки образцов на льду в исследовательской лаборатории.
- Чтобы собрать более одного образца, дезинфицировать стеклянный поддон, как описано выше, с 10% хлорной извести и 70% этанола между Коллефикция каждого образца.
3. Подготовка пластин органной культуры
Примечание: Следующие шаги должны быть выполнены с использованием стерильной техники в капюшоне культуры ткани. Он идеально подходит для рассечения микроскоп, чтобы находиться в стерильной зоне. Тем не менее, это не является абсолютно необходимым, пока микро-рассечение производится в кратчайшие сроки, и инструменты часто погружают в 70% этаноле.
- Оттепель ECM флакон (ы) на льду. Развести ECM 1: 1 с ледяными медиафонда, перемешать с помощью пипетки. Пипетка медленно, чтобы избежать введения пузырьков. В каждую лунку 6-луночного планшета для культуры ткани в требует 100 мкл этой суспензии и будет вмещать 3-4 органных культур.
- Место Transwell вставки (размер пор 0,4 мкм), в каждую лунку 6-луночного планшета для культуры ткани.
- Шерсть каждый Transwell вставки с тонким слоем (100 мкл) ECM / суспензионной среды.
- Поместите пластину на льду и сразу же приступить к establishmenт органных культур. В качестве альтернативы, подготовить пластину до сбора ткани, и в этом случае обернуть его в пара-пленкой и хранить при температуре 4 ° С для последующего использования. Хранение дольше 6 часов не рекомендуется, поскольку ЕСМ высохнут.
4. Создание органных культур
Примечание: Этот шаг описывает, как поместить децидуальной культуры органов и органов ворсинчатых культур в отдельных transwells. Ткани не контактируют. Исследователи , заинтересованные в методике сокультуры где децидуальной и ворсинки находятся в непосредственном контакте друг с другом, могут относиться к предварительному литературе 9,10.
- Промыть образцы дважды в медиаколлекцию и центрифуге при 1000 XG между каждым полосканием. Перенесите ткань в стерильную чашку Петри и место на сцене рассекает микроскопа. Хранить 6-луночный планшет на льду, прилегающей к микроскопу.
- Микро-рассекают ткани с стерильным спрингер рассечения ножницами и щипцами, чтобы установить 2-3 мм культуры ворсинок органаs (фиг.2А).
Примечание: ворсинок культуры органов маленькие, хорошо развитую сосудистую сеть "деревья" с 2 -х или 3 -х ветвей, а также с известными extravillous трофобласт (ЭВТ) колонн клеток 11. Важно использовать только ворсинок ткани из <9 недель образцов первого триместра, как вторжение extravillous трофобласта в ECM наиболее ярко выражена в этих молодом возрасте 13 лет . - Выберите хорошо развитую сосудистую сеть ворсинки с выступающими колоннами EVT клеток. Столбцы EVT ячеек визуализируются как луковичные, "пушистых", "пушистые" концы (см наконечниками на рисунке 2А).
- Использование стерильного пинцета для передачи 3 или 4 ворсинчатых деревьев в каждом Transwell. Отрегулировать ветви дерева так позиционируется плоской вершине ECM и отдельных ветвей слипаются.
- Микро-рассекать децидуальной ткани с стерильным спрингер рассечение ножницами и щипцами, чтобы установить 3 мм 3 децидуальной органных культур (рис 3А).
Примечание: Образцы содержат два дисдалась отчетливая типы децидуальных тканей, децидуальной parietalis и децидуальной capsularis (левый и правый фрагменты ткани, соответственно, рис 3А). - Обрежьте ножницами , чтобы создать 3 мм 3 части децидуальной parietalis. Децидуальной capsularis не используется для этих культур. Используйте пинцет, чтобы дразнить прочь любой сгустками крови матери.
- Использование стерильного пинцета для передачи 3-4 части децидуальной в каждую Transwell.
- Добавить 1мл медиаколлекцию в нижней части скважины. Инкубируйте пластины в течение ночи при 37 ° С в 5% CO 2
- Для экспериментов , где важно , чтобы имитировать нормальный первый триместр напряжение плацентарный кислород, поддерживать ворсинчатых культур органов при относительной гипоксии (3% O 2).
Примечание: Варианты Лабораторные включают небольшие гипоксия инкубационных камер , которые соответствуют внутри существующих инкубаторы, или три-газовый инкубатор , который вводит внешнее N 2 газа , чтобы снизить концентрацию кислорода. - Добавьте 1 мл ворсинок или децидуальной среды (таблле 1) до верхней части Transwell после 12-16 ч культуры.
Примечание: Отсутствие средств массовой информации в течение первой ночи в культуре позволяет extravillous столбцы трофобласта клеток вторгаться (ворсинок культуру), так и для ткани (как ворсинок и децидуальный), чтобы стать надежно встроен в ECM. По нашему опыту, децидуальной органных культур сохраняют жизнеспособность в течение 72 ч и ворсинок органов культур в течение 96 ч. Мы рекомендуем экспериментальные конечные точки, которые попадают в этот период времени. Таблицу 1 для состава ворсинок и децидуальной среды. Ворсинок среда имеет высокий процент FBS, в то время как децидуальной среда дополнена беременности гормоны (прогестерон, 17b-эстрадиол) , которые поддерживают decidualized состояния (таблица 1).
5. Получение L. моноцитогенес Культуры
ПРИМЕЧАНИЕ: Для получения более подробной протокола о длительном хранении Л. моноцитогенес, а также культура и рост Тзиs организм в сердце мозга инфузионной (BHI) бульон и агар, пожалуйста , обратитесь к Wang и др. 14
- Выберите одну L. моноцитогенес колонии от мелированных BHI агаром и инокуляции 3 мл бульона BHI.
- Выдержите L. моноцитогенес культуры в течение ночи (16 ч), в наклонном положении, при 30 ° С.
Примечание:. Эти условия культивирования позволяют рост бактерий достичь стационарной фазы L. моноцитогенес является жгутиковых при 30 ° С, что увеличивает вторжение клетки - хозяина 15.
6. Заражение Organ культур с L. моноцитогенес
- Теплый PBS и ворсинок или децидуальной среда (таблица 1) до 37 ° С.
- Используйте стерильные пинцеты для удаления любых частей культуры орган, который не вторгался в ECM, и, следовательно, плавающие в скважине.
- Тщательно аспирата носитель из нижней части Transwell. Промыть верхнюю и нижнюю transwells дважды, осторожно пипеткой 1 мл войныМ PBS в скважину, и тщательно аспирационных между ними. Аккуратно пипеткой 1 мл антибиотика свободной ворсинок или децидуальной СМИ верхней и нижней Transwell. Будьте осторожны, чтобы не нарушить органной культуры.
- Пусть ткань инкубировать в антибиотической среды, свободной течение по крайней мере часа, чтобы гарантировать, что антибиотики были удалены.
ПРИМЕЧАНИЕ: На стационарной фазе плотность L. моноцитогенес культура составляет приблизительно 1 х 10 9 колониеобразующих единиц (КОЕ) на мл. Число бактерий, используемых для инфицирования органных культур должны быть определены эмпирически для удовлетворения потребностей экспериментальным. - Для дикого типа L. моноцитогенес рутинные эксперименты инфекции показывают сильный вторжение с 1:50 разбавлением в течение ночи (4 х 10 7 L. моноцитогенес в 1 мл среды на лунку). Ресуспендируют соответствующее количество бактерий в антибактериальной свободных ворсинок или децидуальной среде.
- Аспирируйте средств массовой информации из верхней части transwells. Осторожно добавьте 1 мл посевного материала. Инкубируйте пластин при 37° C в 5% CO 2 , чтобы позволить бактериальной инвазии.
- Удалить внеклеточные бактерии аспирационных носитель из верхней и нижней transwells. Промыть лунки дважды с теплым PBS. Добавьте 1 мл ворсинок или децидуальной, дополненной 50 мкг мл -1 гентамицин. Инкубируйте пластин при 37 ° С в 5% CO 2.
Примечание: L. моноцитогенес является факультативным внутриклеточным бактерия , которая может расти в внеклеточной среде, растут внутри клеток, и передается от клетки к клетке без доступа к межклеточное пространство. Гентамицин оказывает бактерицидное действие на внеклеточный L. моноцитогенес, и , таким образом , позволяет производить измерение внутриклеточного L. моноцитогенес рост и распространение через органной культуры 16.
Примечание: Воспроизводимое Л. моноцитогенес инфекция ворсинок и децидуальной культур органов происходит с 5 ч времени инкубации. Время инкубации перед добавлением гентамицина может быть модифицирована на основе экспериментальных потребностей и СПРility организма, чтобы вторгнуться в ткани. Для того, чтобы лучше понять анатомические сайты наиболее уязвимы к инфекции, более короткое время инкубации может быть использован 2. - Поддерживать пластины при температуре 37 ° С в 5% CO 2 в течение всего срока эксперимента. Изменение всей СМИ в каждую лунку ежедневно.
Примечание: В нашем опыте, Л. моноцитогенес -infected децидуальных органных культур сохраняют жизнеспособность в течение 48 ч и ворсинок органов культур в течение 72 ч.
7. Урожай органной культуры для гистопатологией
- Готовят свежий раствор 4% параформальдегида разбавлением 10 мл 16% акций ампулу в 30 мл PBS. Магазин 4% параформальдегида при 4 ° С, в защищенном от света месте и использовать в течение одной недели. Довести до комнатной температуры перед использованием.
- Аспирируйте средств массовой информации из верхней и нижней Transwell. Осторожно полоскать лунки дважды PBS при комнатной температуре. Аккуратно добавить 1мл 4% параформальдегида к началу Transwell, чтобы полностью покрыть органной культуры.
- высиживатьв 4% параформальдегид при комнатной температуре в течение 20 мин. Избегайте более длительного времени инкубации, так как это может привести к чрезмерной фиксации ткани.
- Отберите параформальдегида и полоскание лунки дважды PBS при комнатной температуре. Встраивание фиксированных органных культур в ОСТ среде, замораживания и секции на криостата ( "Fixed заморожен"). В общем, фиксированная замороженной ткани легче, чем секции замороженной ткани без предварительной фиксации.
ПРИМЕЧАНИЕ: Для получения полного протокола о ОКТ вложении и замороженных секционирования, пожалуйста , доступ к соответствующим разделам из опубликованных протоколов 17,18. В зависимости от экспериментальных потребностей и имеющегося лабораторного оборудования и систем хранения, ткань может вместо того, чтобы быть парафин и разрезали на микротома 19. - Далее готовят слайды ткани для рутинного гематоксилином и эозином, иммунофлюоресценции или иммуногистохимического 18,20,21.
Результаты
Рисунок 1 (модифицированный от Зельдовича & Бакырджиева 22) диаграммы соответствующей плацентарного и матки анатомии. Рисунок 2 показывает репрезентативную брутто и гистологические изображения плацентарной ворсинок, а на рисунке 3 демонстрирует децидуальной ткани.
Этот протокол описывает первый сбор свежей плацентарного и децидуальной ткани в больнице или клинике. Собранный образец представляет собой смесь плода плацентарного (ворсинки) и компонентов материнской матки (децидуальной). После промывки буфером, содержащим антибиотики широкого спектра действия и имидазола, весь образец проверяется на глаз с помощью светового короба. Вили и децидуальной помещены в отдельные пробирки и транспортируют на льду в лабораторию. В лаборатории рассекает микроскоп используется, чтобы оценить тонкие Морфологические особенности здоровой ткани. Типичные фотографииворсинок (рис 2А) и децидуальной ткани (Рисунок 3A) , которые были приобретены с рассекает микроскопом с двумя внешними источниками света гусиная приведены для справки.
Ворсинок культуры органов формируются из первых образцов триместра. Культуры состоят из маленьких концевых ворсинок деревьев с 2-6 ветвями. Важно, чтобы рассекать ворсинчатых ветви, которые оканчиваются в extravillous колонках трофобласта и хорошо развитую сосудистую сеть. Эти функции рассматриваются как "пушистые" или "пушистых" концах ветвей (наконечники стрел) и слабый розовый к красный оттенок линейного , которая проходит через ветви дерева слева на рисунке 2А. В противоположность этому, васкулатура и extravillous трофобласты не легко визуализированы дереве справа от этого образа, который был бы неоптимальным для культуры. За первый день культуры, extravillous трофобласты мигрируют в ECM, тHUS якорь ворсинчатого деревья в матрицу на Transwell.
Децидуальных культуры органов формируются из первого и начале второго триместра образцов. Весь слизистую оболочку матки превращается в децидуальной вскоре после имплантации. Более конкретно, децидуальной базального определяет слизистой оболочки матки непосредственно лежащие в основе сайта плацента / имплантации, децидуальной capsularis определяет слизистая оболочка, закрывающая плод, и децидуальной parietalis относится к остальной части слизистой оболочке матки. Визуализация под рассекает микроскопом показывает , что ранний гестационный образец состоит в основном из децидуальной parietalis и децидуальной capsularis (слева и фрагменты тканей правого, соответственно, на фигуре 3А). Децидуальной capsularis легко отличается своим тонким мембранным природы. Для культур органов, децидуальная parietalis обрезается до 3 мм 3 фрагменты с микро-рассечение ножницами и адгезиваренда сгустками крови удаляется пинцетом.
После инкубации в течение ночи, ткани заражены L. моноцитогенес. Протокол инфекция , описанный выше, основан на анализе защиты гентамицина используется для изучения внутриклеточного роста и распространения факультативных внутриклеточных бактерий 16. Органные культуры в среде с антибиотиком бесплатно инкубируют с L. моноцитогенес в течение 5 часов. Культуры промывают стерильной PBS для удаления бактерий из среды. После этого Гентамицин добавляется устранить внеклеточные микроорганизмы. До литературы из нашей лаборатории использовали иммунофлюоресценции и конфокальной микроскопии для определения локализации бактериальной ткани в различные моменты времени после заражения 2. Органные культуры ополаскивают в PBS, фиксировали в 4% параформальдегида, и замороженном встраиваемый в ОСТ среде и хранили при -80 & deg; С, или парафин и хранить при комнатной температуре. Срезы ткани могут быть STAIned для иммунофлуоресценции (IF) или иммуногистохимического (IHC) анализа бактерий и локализации эукариотических клеток. Рисунок 2B является представителем IF изображение замороженных срезов , полученного из 8,3 недели ворсинок органной культуры в 72 часа после заражения. Обратите внимание на тяжелую бактериальную нагрузку (зеленая флуоресценция) в EVTs на концах ветвей ворсинок, а также относительное отсутствие бактерий внутри (красная флуоресценция) слоя дерева подкладка syncytiotrophoblast. В предыдущей работе мы использовали аналогично IF окрашивания для локализации L. моноцитогенес в ворсинчатыми органных культурах в разные моменты времени после заражения. В течение 72 ч, распространения инфекции от ЭВТ в суб-синцитиальный cytotrophoblasts и подстилающей ворсинок стромы. Следует отметить, что synyctiotrophoblast слой был устойчив к инфекции 2.
Типичные легкие микроскопические изображения H & E-окрашенные срезы децидуальной ткани залитых парафином получают из 14,3 недели specimeнс, показаны на фигурах 3B и 3C. Этот ЕСМ покрытием Transwell мембрану погружали , чтобы показать органной культуры на месте (фигура 3В). Изображение показывает эпителиальные подкладке железы (звездочка) и эндотелиальной подкладке васкулатура (алмаз) расположены гетерогенно в децидуальной стромальных клеток отсека. Кроме того, существуют материнские иммунные клетки, разбросанные по всей децидуальной стромы с переменной плотностью. ВВК и ЕСЛИ окрашивание может быть использовано для определения локализации бактериальной микроанатомической, по отношению к иммунных клеток, специфических резидентных. В качестве примера, CD14 + макрофаги (зеленая флуоресценция) локализуются в подкладке и сосудистую разбросаны в строме (рис 3D), в то время как крупные агрегаты L. моноцитогенес (красная флуоресценция) наблюдаются преимущественно в децидуальной стромы через 48 часов после заражения (рис 3D).
| буфер Wash | Коллекция среда | ворсинок среда | децидуальных среда |
| PBS | DMEM / F-12 с GlutaMAX | DMEM / F-12 с GlutaMAX | DMEM / F-12 с GlutaMAX |
| Пенициллин 100 МЕ / мл | Фетальной бычьей сыворотки 2,5% | Фетальной бычьей сыворотки 20% | Фетальной бычьей сыворотки 2,5% |
| Стрептомицин 100 мкг / мл | Пенициллин 100 МЕ / мл | Пенициллин 100 МЕ / мл | 17β-эстрадиол 300 пг / мл |
| Гентамицин 50 мкг / мл | Стрептомицин 100 мкг / мл | Стрептомицин 100 мкг / мл | Прогестерон 20 нг / мл |
| Амфотерицин 1,25 мкг / мл | Гентамицин 50 мкг / мл | ||
| < / TD> | Амфотерицин 1,25 мкг / мл |
Таблица 1:. СМИ рецепты Компоненты и концентрации для приготовления промывочного буфера, среды сбора, ворсинок среды и децидуальной среды.
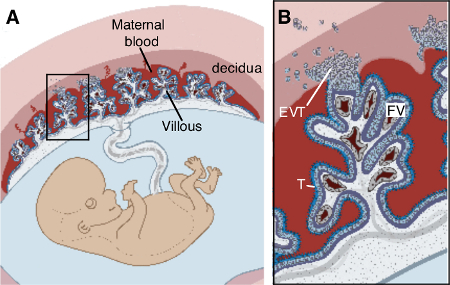
Рисунок 1. Структура плацентарный. (А) Структура фетоплацентарного единицы в материнской утробе, (B) Увеличение в окне (A) подчеркивает , что фетальный трофобласт (Т) на подкладке плацентарные ворсинки купаются в материнской крови и закреплены в децидуальной путем extravillous трофобласты (EVT). Содержится в ворсинки являются эмбриональные сосуды (FV), фибробласты и макрофаги плода. Модифицированный от Зельдовича и Бакырджиева 22. "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
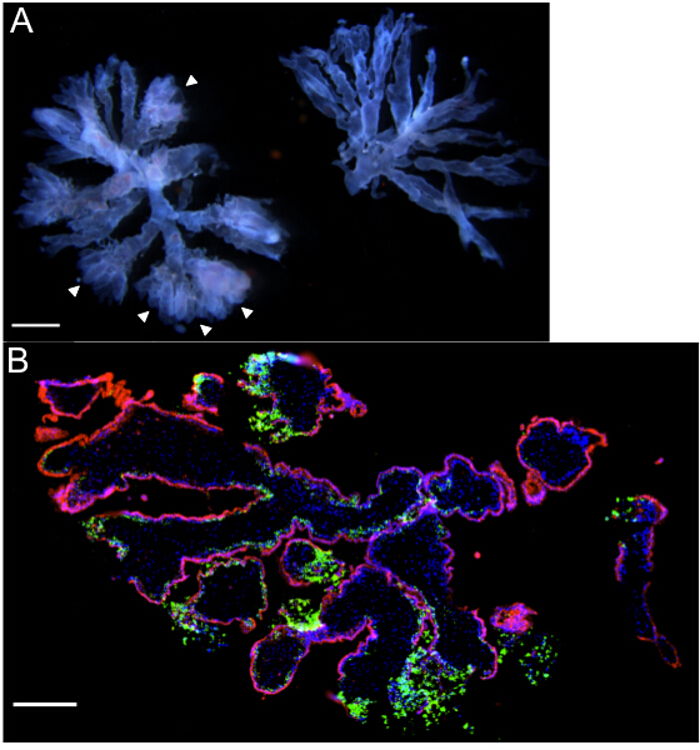
Рисунок 2: ворсинок органных культур - представитель Гросс и микроскопические изображения (A) Два концевых ворсинчатые деревьев с гестационного возраста 6 недель, как видно под микроскопом рассекает.. Обратите внимание на "пушистые" концы (наконечники стрел) и видную плода сосудистую пронизала ветвей дерева слева, которые делают этот кусок подходит для органной культуры. (B) Иммунофлуоресценции микроскопия органной культуры (гестационный возраст 8,3 недели) 72 ч после заражения листерий, выделяя тяжелую бактериальную нагрузку [зеленый] в extravillous трофобласта. DAPI показаны синим цветом, и βHCG + syncytiotrophoblasts в красном цвете. Масштабные полоски = 1 мм (A), 250 мкм (Б).7 / 54237fig2large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
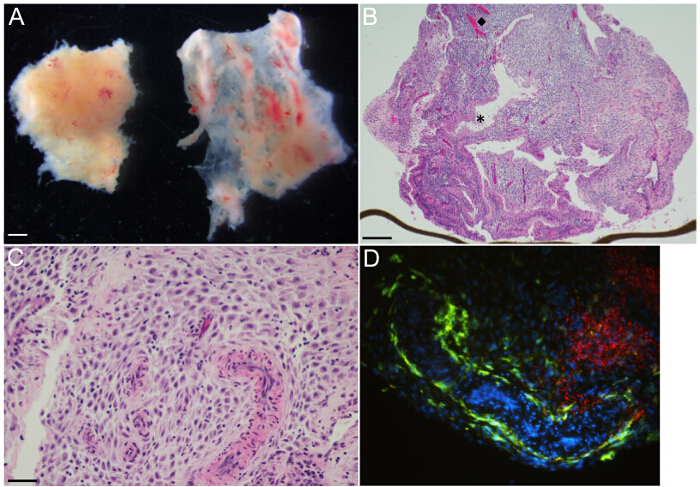
Рис . 3: децидуальных органной культуры - представитель грубых и микроскопических изображений (A) децидуальной parietalis [Влево] и децидуальной capsularis [право] на гестационного возраста 6 недель, как видно под микроскопом рассекает. (B) H & E-окрашенных раздел 14.3 за неделю гестационный возраст децидуальной parietalis органной культуры показывает железы и сосудистую сеть организованных неоднородно на протяжении децидуальной стромы. (Алмаз, ◆) и (звездочка, *) выделить представительную сосуд и железу, соответственно. Коричневый цвет линии на нижнем крае является Transwell мембрана, на краю. (C) H & E-окрашенных участок 14,3 недели гестации децидуальной parietalis органной культуры при большем увеличении гemonstrates мышечной слойных спиральных артериол, внедренных в децидуальной стромы. Материнские клетки иммунной системы маленькие с темными круглыми ядрами и неравномерно распределены по всей строме. (D) Иммунофлуоресценции микроскопия органной культуры 48 ч после инфицирования L. моноцитогенес, выделяя большие зоны бактерий [красный] в децидуальной стромы, а материнская CD14 + макрофаги [зеленый] подкладка извилистый сосудистое пространство и разбросанные в строме. Масштабные полоски = 1 мм (А), 250 мкм (В), 50 мкм (C и D). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Инбредные трансгенные и нокаутных мышей штаммы могут служить в экспериментальных системах, чтобы проверить механизмы робастно. Тем не менее, несмотря на общее сохранение основного генетического материала, функциональные геномы мышей и людей демонстрируют существенные различия в регуляторных элементов 23. Не удивительно поэтому, что перспективные доклинические исследования на животных моделях иногда не обобщено больных людей. Плацента показывает очень высокое разнообразие межвидовой, таким образом делая модели на животных менее чем идеально подходит для изучения человеческой болезни 24. Признавая как заметные различия в человеческой и мышиной иммунология 25, а ярко выраженный расходящуюся эволюцию в плацентарной анатомии, целесообразно рассмотреть вопрос об использовании бывших естественных культур органов гестационного тканей человека для экспериментального исследования.
Описания, фотографические изображения, а также обучающее видео в этом протоколе проинструктировать исследователей накак установить ворсинок и децидуальной органных культур на ECM-покрытием вставками культуры Transwell ткани. Преимущества этого метода включают относительную простоту микро-рассечение и механической системы поддержки Transwell, особенно по сравнению с альтернативными методами, такими как 3D-встроенных матриц или срез органа культур. Приостановление органной культуры на поддержку мембраны позволяет для обмена питательных веществ на всех поверхностях тканей и жизнеспособность поддерживается для кратковременной культуры (96 ч для ворсинок культур, 72 ч для децидуальных культур) .Этот метод позволяет изучать человеческую плацентарную биологии в ткани уровень, несомненно, более биологически значимым, чем модели монослойной клеточной культуры.
Самым важным шагом в этом протоколе является микро-рассечение соответствующих ворсинок и децидуальных пьес для органа культуры. Оптимальные кусочки ткани демонстрируются фотографическим способом (рис 2А и 3А) , чтобы помочь ученым , для которыхвизуализация гестационного образцов нового. Особенно важно, чтобы выбрать ворсинчатых деревья, ветви которых заканчиваются в EVT столбцах, так как эти клетки будут мигрировать в ECM и помогают закрепить ворсинки к мембране. Для обоих типов культур органов полезно свести к минимуму нарушения в ткани во время смены носителя пипеткой в тщательной и неспешной манере.
Этот метод представляет только минимальные трудности. В некоторых случаях, образцы показывают загрязнение. Заражение, как правило, бактериальную (изредка поли-микробные), и только становится очевидным после 1-2 дней в культуре. После того, как загрязнение наблюдается, отбеливатель должен быть применен, культура отбрасывается, и в тканевой культуре инкубаторе стерилизовать, чтобы предотвратить долгосрочную проблему. Есть несколько возможных путей могут возникнуть загрязнение: внутриутробная инфекция, во время операции, во время уборки урожая / SPECIMEN обработки, или во время технического обслуживания органа культуры. Сбор урожая и обработки шаги являются наиболее вероятное времяи место загрязнения будут введены. Таким образом, важно, чтобы уменьшить количество времени, в течение образец манипулируют во время сбора и микро-диссекции. Это приведет к снижению образца воздействия окружающей, нестерильной среды. В зависимости от лабораторной установки, рассекает микроскоп может быть расположен внутри стерильной капот культуры ткани.
Гистопатологическая анализ органных культур после заражения с медицинской точки зрения соответствующего патогена L. моноцитогенес, показан здесь в качестве одного из возможных применений протокола. Иммунофлуоресценции локализация бактерий и иммунных клеток хозяина после инфицирования Урожайность новое понимание человеческой реакции хозяина к патогенам. Децидуальных культуры орган может служить в качестве дополнительного метода экс естественных условиях эксперимента , чтобы изучить данные , полученные от инфекций в естественных условиях мыши, в том числе интригующих отчеты , показывающие дефекты в мышиных децидуальных функций макрофагов обороны 26,27. Кроме того, человек оргН. культуры могут быть использованы в стратегиях смешанных инфекций, таких как конкурентное инокулята , состоящего из нескольких изогенных штаммов L. моноцитогенес. Конкурентное инфекция органных культур является чувствительным способом проверить актуальность факторов вирулентности в организме человека. Одним из ограничений этого метода является жизнеспособность ткани, которая ограничивается кратковременной культуры (96 часов для ворсинок культур, 72 ч для децидуальных культур). Это идеальный вариант для заражения быстро растущих микробов , таких как L. моноцитогенес, но более длинные культуры могут быть необходимы для патогенных микроорганизмов , которые занимают больше времени , чтобы установить и распространять через ткань.
Для того, чтобы уменьшить глобальное бремя осложнений беременности, исследования должны сосредоточиться на понимании патофизиологии человека материнской плода интерфейс. Бактериальные, грибковые и вирусные патогены, которые пересекают от матери к плоду причиной разрушительных осложнений беременности и внутриутробной инфекции. Контролируемые в естественных условиях заражения лабораторных аниMals , как правило , считается золотым стандартом для адресации , как патогены колонизировать и транзита между органами 28. Поскольку плацентарная анатомия заметно различается у разных видов млекопитающих, это крайне важно, чтобы включить ткани человека в исследовательских стратегий. Человеческие ворсинчатые и децидуальной органных культур весьма соответствующие модельные системы для расследования хозяин-патоген взаимодействий. Для изучения этого жизненно важного еще плохо изучены орган, исследователи могут воспользоваться изобилием иначе отбрасываются плаценты человека и децидуальных образцов, используя стратегии органной культуры, такие, как описано здесь.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We are grateful to Cristina Faralla and David Lowe for helpful discussions. We acknowledge Mark Weinstein and San Francisco General Hospital Pathology Department for expert advice. This work was supported by National Institute of Health grants R01AI084928 and Burroughs Wellcome Fund 41259 to A.I.B; G.A.R. was supported by F32AI108195, Society for Pediatric Pathology Young Investigator Research grant, and University of California Partnerships for Faculty Diversity President's Post-doctoral Fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| Sterilization pouches | Fisher Scientific | 01-812-54 | For autoclaving individual dissecting tools |
| Fine mesh strainer | Cuisinart (Amazon.com) | NA | Wrap completely in aluminum foil and autoclave prior to tissue collection. |
| Carboy with spigot | Fisher Scientific | 03-007-647 | For large volume preparation of Wash buffer. |
| Ice packs | Nortech labs | GB8818 | These do not have to be purchased, rather they can be recycled/reused from any routine laboratory shipment that includes them in the packaging. |
| 70% Ethanol | VWR | V1001 | 70% solution made by adding dH20 to 190 or 200 proof research grade alcohol. |
| 10% Bleach | Waxie Sanitary Supply | CLO 30966 | 10% solution made by adding dH20. |
| Light Box | Litebox Lumina (dickblick.com) | 55305-2009 | Note replacement bulbs also purchased on Blick (55305.0100) |
| Micro dissecting forceps | Stoelting | 52102-43 | 4 inches, 1 x 2 x 0.5 mm3, Slight Curve |
| Micro dissecting forceps | Stoelting | 52102-06 | 4 inches, Straight Fine, Sharp |
| Micro dissecting vannas spring scissors | Stoelting | 52130-01P | McPherson-Vannas Spring Scissors, 8.5 cm, 0.33 Tip, Slight Curve |
| Dissecting microscope | Leica Microsystems | MZ16 or M60 | We have had success with the listed models. External gooseneck flexible light sources are helpful but not necessary. |
| 50 ml conical tubes | Sigma-Aldrich (Corning) | CLS4558 | |
| Phosphate Buffered Saline | Gibco (ThermoFisher Scientific) | 10010023 | We purchase from our university Tissue Culture Core facility, alternate options such as this are available. |
| 10x Phosphate Buffered Saline | Teknova | P0195 | For preparation of Wash buffer we use 10x PBS |
| DMEM/F-12 nutrient mixture (Ham's) with GlutaMAX | Gibco (Life Technologies) | 10565-018 | We purchase this specific media formulation, containing 2.438 g/L sodium bicarbonate, 55 mg/L sodium pyruvate, and 4.5 g/L glucose |
| Gentamicin | Thermofisher Scientific | 15710072 | 1, 000x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Amphotericin B | Gibco (ThermoFisher Scientific) | 15290-018 | 500x stock. Recommend to prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| progesterone | Sigma-Aldrich | P8783 | A 1 mM stock solution is made by reconstituting 15.7 mg progesterone powder in 15.7 ml Ethanol and adding 34.3 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| 17β-estradiol | Sigma-Aldrich | E2758 | A 10 μM stock solution is made by reconstituting 13.5 mg estradiol powder in 10 ml ethanol and adding 40 ml PBS. Solution is sterile filtered, aliquoted, and stored at -20 °C. |
| Bottle-top vaccum filter (0.22 μm) | Sigma-Aldrich (Corning) | CLS430769 | For sterile filtration of Collection media after preparation |
| 6-well tissue culture plate | BD Falcon | 353224 | Polystyrene, Tissue culture treated |
| 6-well transwells | Millipore | PICM03050 | Insert - 30 mm diameter, 0.4 μm pore size hydrophilic PTFE membrane |
| Extracellular Matrix (for example, Matrigel Matrix) | BD Biosciences | 354234 | We have utilized Matrigel Matrix in our studies. It is a solid at room temperature and at -20 °C. Avoid repeat freeze/thawing. Thaw bottle to viscous solution at 4 °C, and prepare ~ 300 μL aliquots in the cold room with chilled pipette tips. Store aliquots at -20 °C. |
| Paraformaldehyde, 16% w/v aqueous solution | Alfa Aesar | 30525-89-4 | For tissue fixation, a fresh preparation of 4% paraformaldehyde is made by diluting this stock in PBS. |
| Tissue culture incubator, maintained at 37 °C, 5% CO2, 3% oxygen (optional for villous organ cultures) | For some experiments, hypoxia may be preferred. This can be established multiple ways, including addition of exogenous nitrogen via gas cylinder, Tygon tubing, and a regulator. | ||
| Bench top centrifuge |
Ссылки
- Pan, X., Yang, Y., Zhang, J. R. Molecular basis of host specificity in human pathogenic bacteria. Emerging microbes & infections. 3, e23 (2014).
- Robbins, J. R., Skrzypczynska, K. M., Zeldovich, V. B., Kapidzic, M., Bakardjiev, A. I. Placental syncytiotrophoblast constitutes a major barrier to vertical transmission of Listeria monocytogenes. PLoS pathogens. 6, e1000732 (2010).
- Zhang, J. R., et al. The polymeric immunoglobulin receptor translocates pneumococci across human nasopharyngeal epithelial cells. Cell. 102, 827-837 (2000).
- Ngampasutadol, J., et al. Human C4b-binding protein selectively interacts with Neisseria gonorrhoeae and results in species-specific infection. Proceedings of the National Academy of Sciences of the United States of America. 102, 17142-17147 (2005).
- Pishchany, G., et al. Specificity for human hemoglobin enhances Staphylococcus aureus infection. Cell host & microbe. 8, 544-550 (2010).
- Benirschke, K., Kaufmann, P., Baergen, R. N. . Pathology of the Human Placenta. , (2012).
- Robbins, J. R., Zeldovich, V. B., Poukchanski, A., Boothroyd, J. C., Bakardjiev, A. I. Tissue barriers of the human placenta to infection with Toxoplasma gondii. Infection and immunity. 80, 418-428 (2012).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature reviews. Molecular cell biology. 15, 647-664 (2014).
- Hazan, A. D., et al. Vascular-leukocyte interactions: mechanisms of human decidual spiral artery remodeling in vitro. The American journal of pathology. 177, 1017-1030 (2010).
- Dunk, C., et al. A novel in vitro model of trophoblast-mediated decidual blood vessel remodeling. Laboratory investigation; a journal of technical methods and pathology. 83, 1821-1828 (2003).
- Hunkapiller, N. M., Fisher, S. J. Chapter 12. Placental remodeling of the uterine vasculature. Methods in enzymology. 445, 281-302 (2008).
- Miller, J. M., et al. Guidelines for safe work practices in human and animal medical diagnostic laboratories. Recommendations of a CDC-convened, Biosafety Blue Ribbon Panel. MMWR Surveill Summ. 61 Suppl, 1-102 (2012).
- Lash, G. E., et al. Low oxygen concentrations inhibit trophoblast cell invasion from early gestation placental explants via alterations in levels of the urokinase plasminogen activator system. Biol Reprod. 74, 403-409 (2006).
- Wang, N., Strugnell, R., Wijburg, O., Brodnicki, T. Measuring bacterial load and immune responses in mice infected with Listeria monocytogenes. Journal of visualized experiments : JoVE. , (2011).
- Palmer, M. E., Watson, A. L., Burton, G. J. Morphological analysis of degeneration and regeneration of syncytiotrophoblast in first trimester placental villi during organ culture. Hum Reprod. 12, 379-382 (1997).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods in enzymology. 236, 405-420 (1994).
- Kucherenko, M. M., et al. Paraffin-embedded and frozen sections of Drosophila adult muscles. Journal of visualized experiments : JoVE. , (2010).
- Croy, B. A., Yamada, A. T., DeMayo, F. J., Adamson, S. L. . The Guide to Investigation of Mouse Pregnancy, 1st Edition. , (2014).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. JoVE. , (2016).
- Troy, T. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on paraffin sections of mouse epidermis using fluorescent antibodies. Journal of visualized experiments : JoVE. , (2008).
- Chi, V., Chandy, K. G. Immunohistochemistry: paraffin sections using the Vectastain ABC kit from vector labs. Journal of visualized experiments : JoVE. , e308 (2007).
- Zeldovich, V. B., Bakardjiev, A. I. Host defense and tolerance: unique challenges in the placenta. PLoS pathogens. 8, e1002804 (2012).
- Yue, F., et al. A comparative encyclopedia of DNA elements in the mouse genome. Nature. 515, 355-364 (2014).
- Robbins, J. R., Bakardjiev, A. I. Pathogens and the placental fortress. Current opinion in microbiology. 15, 36-43 (2012).
- Mestas, J., Hughes, C. C. Of mice and not men: differences between mouse and human immunology. J Immunol. 172, 2731-2738 (2004).
- Redline, R. W., Shea, C. M., Papaioannou, V. E., Lu, C. Y. Defective anti-listerial responses in deciduoma of pseudopregnant mice. The American journal of pathology. 133, 485-497 (1988).
- Redline, R. W., McKay, D. B., Vazquez, M. A., Papaioannou, V. E., Lu, C. Y. Macrophage functions are regulated by the substratum of murine decidual stromal cells. The Journal of clinical investigation. 85, 1951-1958 (1990).
- Bakardjiev, A. I., Theriot, J. A., Portnoy, D. A. Listeria monocytogenes traffics from maternal organs to the placenta and back. PLoS pathogens. 2, e66 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены