Method Article
Um simples, de baixo custo e sistema robusto para medir o volume de hidrogênio desprendido por reacções químicas com soluções aquosas
Neste Artigo
Resumo
The study of methods to generate on-demand hydrogen for fuel cells continues to grow in importance. However, systems to measure hydrogen evolution from the reaction of chemicals with water can be complicated and expensive. This article details a simple, low-cost, and robust method to measure the evolution of hydrogen gas.
Resumo
There is a growing research interest in the development of portable systems which can deliver hydrogen on-demand to proton exchange membrane (PEM) hydrogen fuel cells. Researchers seeking to develop such systems require a method of measuring the generated hydrogen. Herein, we describe a simple, low-cost, and robust method to measure the hydrogen generated from the reaction of solids with aqueous solutions. The reactions are conducted in a conventional one-necked round-bottomed flask placed in a temperature controlled water bath. The hydrogen generated from the reaction in the flask is channeled through tubing into a water-filled inverted measuring cylinder. The water displaced from the measuring cylinder by the incoming gas is diverted into a beaker on a balance. The balance is connected to a computer, and the change in the mass reading of the balance over time is recorded using data collection and spreadsheet software programs. The data can then be approximately corrected for water vapor using the method described herein, and parameters such as the total hydrogen yield, the hydrogen generation rate, and the induction period can also be deduced. The size of the measuring cylinder and the resolution of the balance can be changed to adapt the setup to different hydrogen volumes and flow rates.
Introdução
Devido à sua alta densidade de energia, baterias de lítio-íon são atualmente uma das fontes de energia mais populares para eletrônicos portáteis. No entanto, a quantidade de energia que pode ser fornecida por uma bateria é limitada. Há, portanto, atualmente muito interesse no desenvolvimento de métodos alternativos de fornecimento de energia portátil. Um dos métodos mais promissores é o uso de células de combustível de protões membrana de permuta (PEM), que geram electricidade e de água através da combinação de hidrogénio e oxigénio. células de combustível PEM tem duas vantagens principais sobre baterias. Em primeiro lugar, as células de combustível PEM pode fornecer energia para um muito mais longo período de tempo (desde que um fluxo de hidrogénio é mantida). Em segundo lugar, dependendo da fonte de combustível, as células de combustível PEM podem ter uma densidade de energia muito maior do que as baterias, o que significa que um sistema menor pode fornecer mais energia. 1,2 Como resultado disto, não existe actualmente uma grande quantidade de investigação dirigida em vias de desenvolvimento, as fontes de hidrogênio por demanda portáteis. 2-7 Um método que está actualmente a receber muita atenção é a geração de hidrogénio através da reacção química com a água. 8,9
Um dos parâmetros mais importantes que têm de ser medidos nestas reacções é a evolução de hidrogénio. Para as reacções simples, tais como a libertação de hidrogénio através da adição de materiais de armazenamento de hidrogénio químicos a soluções aquosas, é vantajoso ter um sistema de medição simples, de baixo custo. Um exemplo de um sistema deste tipo é o método de deslocamento de água, em que o volume de gás gerado numa reacção química é medida simplesmente seguindo o volume de água deslocado a partir de um cilindro de medição cheio de água invertida. Esta técnica se originou na calha pneumática, que foi desenvolvido pelo botânico Stephen Hales e depois adaptada e colocar ao seu uso mais famoso por Joseph Priestley para isolar vários gases, incluindo oxigênio, no século 18. 10,11 O método de deslocamento de águaé aplicável a qualquer gás que não é particularmente solúvel em água, incluindo o hidrogénio, e ainda é largamente utilizado para registar o volume de hidrogénio gerado a partir das reacções de vários produtos químicos, tais como boro-hidreto de sódio, alumínio, e ferro-silício, com água. 12 20
No entanto, o método de deslocamento de água clássico, envolvendo a gravação manual das mudanças no nível da água como libertação de gás, é tedioso e pode, a taxas de fluxo de gás mais elevadas, quando o nível da água altera-se rapidamente, ser imprecisos, uma vez que é difícil para o experimentador para tomar uma leitura precisa. dados gravados manualmente também é inerentemente baixa na resolução temporal, como um experimentador não pode realisticamente fazer leituras em intervalos menores do que ~ 10 seg.
Vários investigadores têm superar este problema, utilizando câmaras para gravar o software processo de deslocamento de água e a análise de dados para extrair a alteração no volume ao longo do tempo. 21-25 No entanto, esta requires conhecimento de programação de computadores e equipamento relativamente caro. Outros investigadores têm feito uso de medidores de fluxo de massa para registar o fluxo de hidrogénio. 26-29 No entanto, estes são muitas vezes apenas capazes de detectar o gás ao longo de um intervalo estreito, e são mais adequados para aplicações nas quais o fluxo deve ser mantida a uma relativamente constante nível.
Uma abordagem mais simples para obter resolução mais alta, os dados mais precisos é canalizar a água deslocada pela evolução de hidrogénio para um recipiente receptor, que fica colocado sobre um balanço de massa. 30-35 A variação deste método aqui descrito faz uso de objectos de vidro de grau laboratorial geral e um baixo custo, saldo disponível comercialmente para registar a evolução de hidrogénio a partir da reacção de silício com soluções aquosa de hidróxido de sódio. Ao invés de ser registrados manualmente, os dados são registrados em uma planilha usando um pacote de software de coleta de dados que permite o equilíbrio para enviar dados para o computador. Deverianotar-se que, embora esta técnica é adequada para medir a libertação de hidrogénio na escala de mililitro, ele não é adequado para medir muito pequeno (devido à incerteza no equilíbrio) ou muito grandes (devido ao tamanho limitado da proveta) volumes de hidrogênio sem adaptação adequado (por exemplo, usando um equilíbrio maior resolução ou uma proveta maior).
Protocolo
1. Set-up do Software Data-logging
- Instale a recolha de dados e software de planilha para um computador equipado com uma porta serial RS232.
- Ligue o computador para o equilíbrio através de um cabo conector RS232 adequado (neste método tanto o computador como o equilíbrio necessário um conector de 9 pinos). O saldo será tipicamente conectado a COM1.
- Abra o software de coleta de dados.
- Para registrar os dados em uma planilha (por exemplo, Excel), vá para o 'Modo', depois em 'Enviar teclas para', digite o nome apropriado do software de planilha no "Texto Aplicação barra de título" e selecione "excel.exe 'em a "linha de comando", em seguida, pressione 'OK'. Uma marca de seleção deve aparecer ao lado de "Enviar teclas para 'no menu drop-down' Modo '.
- Ir para 'Porta', depois em 'Configurações', e garantir que os valores são apropriados ao saldo em questão, em seguida, pressione 'OK';.
- Ir para 'Definir', depois 'Definir estrutura do registo de dados de entrada', e selecione 'char numérico recebido "no" início do registo de eventos' seção e 'Retorno de carro ou CrLf recebida "no" fim do registo de eventos' seção, em seguida, pressione "Continuar".
- Quando uma caixa intitulada "Entrada Estrutura de Registro 'aparece, selecione" Cada registro de dados contém um único campo de dados "e pressione" Continuar ".
- Quando uma caixa intitulada 'Record Editor de Definição de Entrada - Enviar Modo Teclar' aparece: no Campo 1, defina o 'Filtro de Entrada' para 'somente dados numéricos "e os" Campo postamble Teclas de atalho' para '{Tab} {hora}: {segundo } {} {ESQUERDA PARA BAIXO} 'e pressione' OK '.
- Ir para 'Definir', depois 'Definir teclas de atalho e ações quentes'. Selecione Hot Key 1, em seguida, selecione a tecla de ação Hot 'Suspender WinWedge "e atribuir isso a Keystroke Hot Key de" retrocesso "e pressioneESTÁ BEM.
- Ir para 'File', depois em 'Salvar como', e salvar o método em uma pasta apropriada.
2. Experimental Set-up
- Adicione água para uma tigela de vidro até que ele é de aproximadamente ¾ cheio. Em seguida, colocar o recipiente de vidro num agitador-placa de aquecimento com controlo de temperatura e de calor a 50 ° C; em alternativa, usar um banho de água com termóstato.
- Adiciona-se água desionizada (5 ml) a um frasco de 50 ml e a posição de fundo redondo, este no banho de água de tal modo que o nível da água no banho está bem acima do nível de água no balão.
- Inserir um termómetro no gargalo do balão de fundo redondo para monitorizar a temperatura da água (após o equilíbrio, a temperatura da água no balão é normalmente a ~ 5 ° C mais baixa do que o ponto de ajuste sobre a placa).
Nota: O set-up está pronto quando a temperatura da água no balão se mantém constante ao longo de um período de 10 min. - Encher um copo com água desionizada.
- Coloque um copo vazio sobre a balança de registro de dados.
- Construir uma ponte de folha de plástico que pode transferir a água da bica do copo para o copo vazio sobre a balança de registro de dados. Certifique-se de que a ponte de plástico não está em contacto físico com o copo sobre o equilíbrio de registro de dados.
- Encha de 500 ml proveta com água deionizada.
- Enquanto cobrindo a extremidade aberta com uma mão enluvada, inverter a proveta e colocá-lo no tubo de ensaio de tal modo que a extremidade aberta do cilindro de medição está logo abaixo da superfície da água.
- Use um suporte de retorta equipado com dois chefes e braçadeiras para suportar o cilindro de medição. Dependendo do tamanho do cilindro de medição, contrapesos lugar sobre a base da retorta está para evitar que ele caia devido ao peso da água.
- Ajustar a posição da taça de modo a que o bico se encontra em contacto com a ponte de plástico.
- Cuidadosamente levantar o cilindro de medição para umalLow libertação de água e a entrada de ar para assegurar que o nível de ar no cilindro de medição é consistente no início de cada experiência (por exemplo, 100 ml de ar).
- Insira a ponta junta de vidro não-chão de um adaptador modificado em um comprimento da tubulação. Selar por envolvimento com cuidado Parafilm em torno da ligação entre a junta ea tubulação.
- Inserir a extremidade do tubo para dentro do cilindro de medição.
- Certifique-se de que a adição de água em excesso vai resultar em que a correr para o equilíbrio por adição de um pouco de água para o copo. As fugas podem ocorrer com caudais elevados na conexão entre o bocal do recipiente e a ponte de plástico.
- Assegurar que o equilíbrio não lê zero. Se necessário, adicione um pouco de água para o copo sobre o equilíbrio de registro de dados.
- Usando uma balança, pesar tanto 0,05, 0,10, 0,15, 0,20, ou 0,25 g de silício em um pequeno frasco de vidro; não usar um barco de pesagem de plástico como alguns de silício tende a ser preso no interiorgargalo do frasco, quando ele é adicionado à mistura de reacção a partir de um barco de pesagem. Este problema é evitado por invertendo rapidamente, em vez de um pequeno frasco de vidro para dentro do gargalo do frasco.
3. Procedimento Experimental
- Adicionar uma solução de hidróxido de sódio (5 ml, 20% em peso) para um frasco de 50 ml e a posição de fundo redondo, este no banho de água de tal modo que o nível da água no banho está bem acima do nível de água no balão.
- Inserir um termómetro no gargalo do balão de fundo redondo para monitorizar a temperatura da solução (após o equilíbrio, a temperatura da água no balão nesta configuração é normalmente a ~ 5 ° C mais baixa do que o ponto de ajuste sobre a placa).
- Deixe por 10 minutos para equilibrar.
- Antes de terminar o período de equilíbrio, abra uma nova planilha no pacote de software de planilha e, em seguida, abra o software de coleta de dados. Carregue o método criado na Etapa 1, indo para 'Arquivo' sobre o software de coleta de dadosno menu Iniciar e, em seguida, «método aberto '.
- Pouco antes do período de equilíbrio de 10 min é devido ao fim, vá para "Ativar" e clique em "Modo Normal '. Os dados começarão a ser registado no pacote de software de planilha.
- No final do período de equilíbrio de 10 min, adicionar o silício invertendo rapidamente o frasco de vidro e depositando o silício na solução de hidróxido de sódio.
- Rapidamente colocar a junta de vidro esmerilado de o adaptador que está ligado à tubagem para dentro do gargalo do frasco de fundo redondo. Zero o equilíbrio. O momento em que o equilíbrio é reposto em zero será tomado como o tempo (t) = 0 na análise dos dados.
- Após 10 min de decorridos, parar o registro de dados pressionando a tecla de retrocesso e, em seguida, selecionando a opção 'Sair' no menu do software de coleta de dados. Salve o arquivo no pacote de software de planilha.
- Remover o adaptador que está ligado à tubagem a partir do balão de fundo redondo e adicionar água para thatNCH a reacção.
- Isolar o resíduo sólido no frasco para análise posterior por centrifugação ou filtração gravidade, ou transferir toda a mistura de reacção para uma proveta e neutraliza-se com ácido clorídrico (1 M) e eliminar os resíduos de forma adequada.
Análise 4. Dados
- Garantir que os dados são carregados em um pacote de software de planilha apropriada.
- Encontrar o ponto em que o saldo é zerado; esta é considerada como sendo o (t) = 0 ponto da reacção.
- Excluir os dados que precede esta.
- Inserir uma coluna à esquerda dos dados. Isto irá conter o tempo.
- Adicionar intervalos de tempo adequados, a partir de zero, a coluna que acaba de ser inserido. O saldo utilizado nestes estudos conectado 8,5 pontos de dados por segundo, e assim foram utilizados intervalos de tempo de 0,117647 (= 1 / 8,5) sec.
- gás considerar que foi coletada sobre a água a ser saturado com vapor de água. Durante a coletaprocesso de iões, o nível de água no cilindro de medição ajusta para manter a pressão interna no cilindro de medição, à pressão atmosférica.
- Aplicar um factor de correcção aproximada usando a lei de Dalton, o que indica que a soma das pressões parciais dos gases individuais em uma mistura (P 1 P ... n) é igual à pressão total (P tot). Como, se a temperatura é 298 K, a pressão parcial de vapor de água é 31,69.9 Pa, e a pressão total do gás no cilindro de medição é a pressão atmosférica (101,325 Pa), pode ser calculado que há, aproximadamente, 3,08% o vapor de água em volume no gás recolhido. Estimar a quantidade de vapor de água no átomo de hidrogénio a outras temperaturas, utilizando a pressão parcial de vapor de água à temperatura em questão.
- Para obter uma estimativa da quantidade de hidrogénio gerado (se a temperatura ambiente é de 298 K), multiplicando o volume de gás por 0,97.
- Estimar o hydro inicialtaxa de geração gen ajustando uma linha de tendência linear para a encosta íngreme inicial da curva de geração de hidrogênio.
- Aqui o período de indução como o tempo necessário para a água a ser deslocado a partir do cilindro de medição. Estas estimativas de período de indução não são absolutos; a reacção real geração de hidrogénio começa antes do final do "período de indução" estimado nestas experiências como uma certa quantidade de hidrogénio tem de ser gerado para ser capaz de começar a deslocar a água. No entanto, estes valores não permitem uma avaliação da mudança relativa no período de indução entre os experimentos.
Resultados
Para investigar a reprodutibilidade do conjunto experimental, reagiram diferentes massas de silício com soluções aquosas de hidróxido de sódio para gerar hidrogênio. Cada reacção foi realizada em triplicado. As curvas médias de geração de hidrogénio são mostrados na Figura 1. Rendimento total de hidrogénio, taxas de geração de hidrogénio, e os períodos médios de indução para cada massa de silício também foram calculados e são traçados com barras de erro representam um desvio padrão nas Figuras 2, 3, e 4, respectivamente. Havia muito pouco desvio nos rendimentos de hidrogênio total e taxas de geração de hidrogênio entre reações e um maior nível de desvio nos períodos de indução.
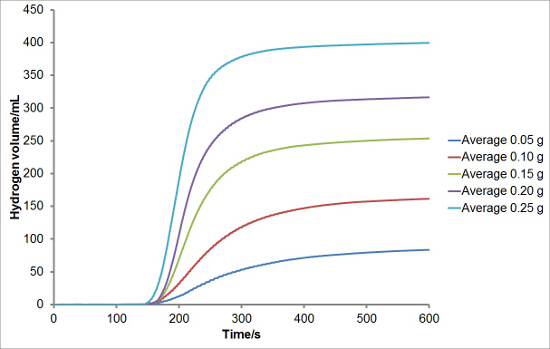
Figura 1: Exemplo de curvas de Geração de Hidrogênio da Reactina de silício com hidróxido de sódio aquoso. Vários massas de silicone (0,05, 0,10, 0,15, 0,20 e 0,25 g) foram feitos reagir com uma solução aquosa de hidróxido de sódio (5 ml, 20% em peso) a 50 ° C. geração de hidrogénio foi registada durante um período de 10 min. As reacções foram realizadas em triplicado e a média dos resultados. Por favor clique aqui para ver uma versão maior desta figura.
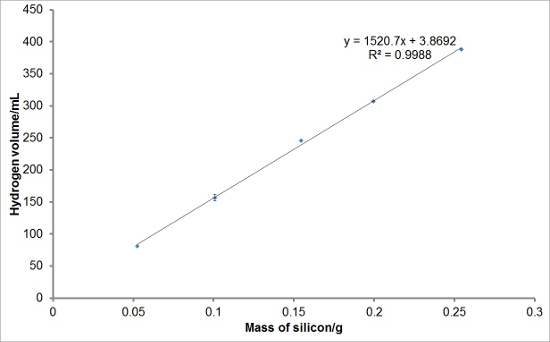
Figura 2:. Exemplo de valores de rendimento de hidrogénio da reacção de silicone com hidróxido de sódio aquoso Os volumes totais de hidrogénio evoluiu em 10 min foram deduzidas a partir das curvas de geração de hidrogénio. Os rendimentos de hidrogênio total médio para cada massa de silício foram obtidos e plotados. Pode ser visto que existe uma relação linear entre a massa óf silício usado na reacção e o volume de hidrogénio gerado sob estas condições de reacção. As barras de erro representam um desvio padrão do total de rendimentos de hidrogênio. Por favor clique aqui para ver uma versão maior desta figura.
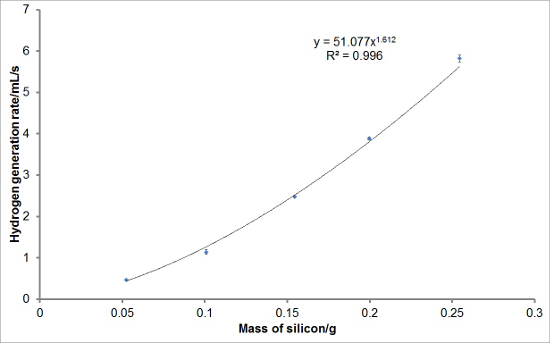
Figura 3:. Exemplo de Hidrogénio Geração de valores de taxa a partir da reacção de silicone com hidróxido de sódio aquoso As taxas iniciais ou máximas de geração de hidrogénio para cada massa de silício foram calculadas a partir das curvas de geração de hidrogénio. As taxas de geração de hidrogênio inicial ou média máxima para cada massa de silício foram obtidos e plotados. Pode ser visto que, em média, existe uma relação entre a potência de massa de silicone utilizada na reacção e o hidrogénio ou g inicial máximo eneration taxa observada sob estas condições de reacção. As barras de erro representam um desvio padrão das taxas iniciais ou máximos de geração de hidrogênio. Por favor clique aqui para ver uma versão maior desta figura.
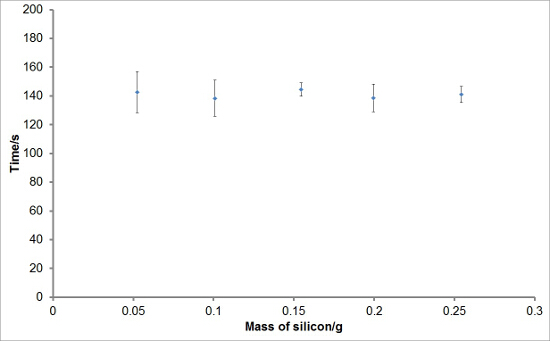
Figura 4:. Exemplo de valores do período de indução da reacção de silicone com hidróxido de sódio aquoso Os períodos de indução para a geração de hidrogénio para cada massa de silício foram deduzidas a partir das curvas de geração de hidrogénio. O período médio de indução para cada massa de silício foi obtido e plotados. Pode ser visto que, em média, não há grande mudança no período de indução entre as experiências. As barras de erro representam um desvio padrão das taxas iniciais ou máxima de geração de hidrogénio.ref = "https://www.jove.com/files/ftp_upload/54383/54383fig4large.jpg" target = "_ blank"> Clique aqui para ver uma versão maior desta figura.
A Figura 5 mostra alguns resultados representativos de um experimento de sub-óptima. Neste caso, a partir do fluxo de hidrogénio de 200 a 800 seg resulta na acumulação de gotejamento, devido à tensão superficial da água, a qual caiu para aproximadamente 400 a 710 seg. Embora estas gotas não afectam o cálculo da taxa máxima de geração de hidrogénio, eles podem ter um efeito sobre o rendimento total de hidrogénio se, por exemplo, a medição foi interrompida antes do gotejamento caiu. É, portanto, necessário ou alterar as condições de reacção (neste caso, por exemplo, por adição de uma maior massa de liga de alumínio-silício ou usando uma maior concentração de hidróxido de sódio) para garantir um fluxo maior de gás ou a configuração de reacção para evitar o acúmulo de pinga.
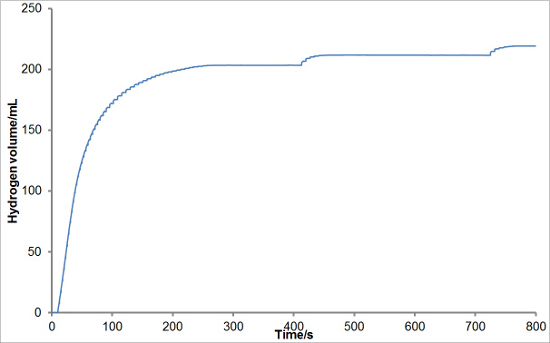
. Figura 5: Exemplo de um ensaio sub-óptima Nesta experiência, de alumínio (65,7%) - Fez-se reagir de silício (34,3%) de liga (0,2 g) com solução aquosa de hidróxido de sódio (5 ml, 10% em peso) a 40 ° C . Embora as altas velocidades iniciais de evolução de hidrogénio a gravação da geração de hidrogénio é óptimo, como o fluxo diminui a tensão superficial da água os resultados em gotas a ser formado. Os pingos caem em cerca de 400 e 710 sec, neste caso. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Os passos mais importantes do protocolo são os que ocorrem no início de uma experiência. A grande dependência da temperatura da taxa de estas reacções de hidrólise significa que um grande cuidado deve ser tomado para assegurar que a temperatura da solução ter atingido o equilíbrio, antes da adição do sólido. O sólido deve ser adicionado rápida e completamente, o Esmerilado do adaptador deve ser devidamente inserida no gargalo do balão de fundo redondo, eo saldo deve então ser zerado o mais rapidamente possível. Uma medição incorreta de hora de início e temperatura da reacção irá gerar resultados incorretos.
O método tem algumas limitações. É imperativo que a taça dentro da qual é inserido o cilindro de medição é tão estreita quanto possível para garantir que a água deslocada a partir do cilindro de medição é rapidamente canalizado para baixo a ponte de plástico para o equilíbrio. Caso contrário, a tensão superficial da água permite quebaixo nível de acumulação da água a baixos caudais (ver Figura 5) até que o ponto no qual toda a água é libertada num grande gotejamento.
O erro do equilíbrio também limita a resolução dos dados. Nestas experiências, utilizou-se um equilíbrio com um erro de ± 0,05 g, o qual é adequado ao gerar várias centenas de mililitros de hidrogénio, mas um equilíbrio com um erro menor do que seria exigido se volumes menores foram sendo medido.
Como as gotas de água deslocadas a partir da ponte sobre o equilíbrio, a massa registrados pela balança oscila, isto é, como uma gota cai no equilíbrio, o equilíbrio registra momentaneamente uma massa ligeiramente maior. Isto significa que a diferenciação da resolução dados brutos alta de tempo utilizando pacotes de software é problemático como o gradiente oscila. A forma mais apropriada para encontrar o gradiente da parte mais íngreme da curva de geração de hidrogénio, e, portanto, a taxa de geração de hidrogénio, is para caber uma linha reta para ele e calcular a sua inclinação.
Ao iniciar a sessão automaticamente os dados em uma planilha, este método oferece uma melhoria significativa na precisão e resolução temporal em relação aos métodos de deslocamento de água que dependem de gravação do volume de gás libertado manualmente. No entanto, embora seja consideravelmente menor no custo do que os métodos que utilizam câmeras e imagem de software de análise para acompanhar a evolução de gás, é geralmente mais baixos na resolução temporal, e tais métodos baseados em câmera também evitar o problema de oscilação leituras em massa de equilíbrio devido à água formando gotas e, portanto, produzir dados que podem ser mais facilmente processadas por diferenciação.
O método de deslocamento de água é aplicável para a recolha de qualquer gás que tem uma baixa solubilidade em água. Assim, este protocolo experimental poderia ser modificado para a medição das taxas de geração de gases a partir de outras reacções químicas que evolvem gás fracamente solúvel em águaes.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors thank the EPSRC and Intelligent Energy Ltd for funding this project. PB also thanks the SCI for the award of a Messel Scholarship.
Materiais
| Name | Company | Catalog Number | Comments |
| WinWedge software | Taltech | http://www.taltech.com/winwedge | |
| High Resolution Top Loader Balance | LW Measurements, LLC | HRB6001 | http://www.lwmeasurements.com/HRB-6001-High-Resoultion-Top-Loader-Balance-p/hrb6001.htm |
| Silicon | Sigma Aldrich | 215619 | 325 mesh |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent grade |
| Aluminium (65.7%)-silicon (34.3%) alloy | Goodfellow | 275-274-74 | |
| Excel | Microsoft | https://products.office.com/en-us/excel | |
| Glass sample vials, 50 x 12 mm | Scientific Laboratory Supplies | TUB1152 | |
| Plastic sheet | Recycled from a smooth-sided plastic drinks bottle | ||
| Silicone tubing, 5 x 8 mm BxO D | Scientific Laboratory Supplies | TUB3806 | |
| Parafilm (2 in. by 250 ft.) | Sigma Aldrich | P7543 | |
| Adapter | Sigma Aldrich | Z415685 | We used a custom-made adapter in our set-up, but this type of fitting would serve the same function |
Referências
- Winter, M., Brodd, R. J. What Are Batteries, Fuel Cells, and Supercapacitors?. Chem. Rev. 104, 4245-4269 (2004).
- Deng, Z. Y., Ferreira, J. M. F., Sakka, Y. Hydrogen-generation materials for portable applications. J. Am. Ceram. Soc. 91, 3825-3834 (2008).
- Grew, K. N., Brownlee, Z. B., Shukla, K. C., Chu, D. Assessment of Alane as a hydrogen storage media for portable fuel cell power sources. J. Power Sources. 217, 417-430 (2012).
- Fan, M. Q., Mei, D. S., Chen, D., Lv, C. J., Shu, K. Y. Portable hydrogen generation from activated Al-Li-Bi alloys in water. Renew. Energ. 36, 3061-3067 (2011).
- Amendola, S. C., Sharp-goldman, S. L., et al. A safe, portable, hydrogen gas generator using aqueous borohydride solution and Ru catalyst. Int. J. Hydrogen Energ. 25, 969-975 (2000).
- Sharaf, O. Z., Orhan, M. F. An overview of fuel cell technology: Fundamentals and applications. Renew. Sust. Energ. Rev. 32, 810-853 (2014).
- Wallace, A. P. Sodium silicide and the development of the portable hydrogen energy market. ECS Trans. 42, 219-230 (2012).
- Brack, P., Dann, S. E., Wijayantha, K. G. U. Heterogeneous and homogenous catalysts for hydrogen generation by hydrolysis of aqueous sodium borohydride (NaBH4) solutions. Energ. Sci. Eng. 3, 174-188 (2015).
- Huang, X., et al. A review: Feasibility of hydrogen generation from the reaction between aluminum and water for fuel cell applications. J. Power Sources. 229, 133-140 (2013).
- McEvoy, J. G. Joseph Priestley. Encyclopedia Britannica. , (2015).
- The Editors of Encyclopædia Britannica. Stephen Hales. Encyclopedia Britannica. , (2015).
- Ai, L., Gao, X., Jiang, J. In situ synthesis of cobalt stabilized on macroscopic biopolymer hydrogel as economical and recyclable catalyst for hydrogen generation from sodium borohydride hydrolysis. J. Power Sources. 257, 213-220 (2014).
- Chen, Y., Shi, Y., Liu, X., Zhang, Y. Preparation of polyvinylidene fluoride - nickel hollow fiber catalytic membranes for hydrogen generation from sodium borohydride. Fuel. 140, 685-692 (2015).
- Demirci, S., Sahiner, N. Superior reusability of metal catalysts prepared within poly (ethylene imine) microgels for H2 production from NaBH4 hydrolysis. Fuel Process. Technol. 127, 88-96 (2014).
- Loghmani, M. H., Shojaei, A. F. Hydrogen production through hydrolysis of sodium borohydride: Oleic acid stabilized Co-La-Zr-B nanoparticle as a novel catalyst. Energy. 68, 152-159 (2014).
- Manna, J., Roy, B., Vashistha, M., Sharma, P. Effect of Co+2/BH-4 ratio in the synthesis of Co-B catalysts on sodium borohydride hydrolysis. Int. J. Hydrogen Energ. 39, 406-413 (2014).
- Saha, S., et al. Graphene supported bimetallic G-Co-Pt nanohybrid catalyst for enhanced and cost effective hydrogen generation. Int. J. Hydrogen Energ. 39, 11566-11577 (2014).
- Seven, F., Sahiner, N. Superporous P (2-hydroxyethyl methacrylate) cryogel-M (M Co, Ni, Cu) composites as highly effective catalysts in H2 generation from hydrolysis. Int. J. Hydrogen Energ. 39, 15455-15463 (2014).
- Teprovich, J. A., Motyka, T., Zidan, R. Hydrogen system using novel additives to catalyze hydrogen release from the hydrolysis of alane and activated aluminum. Int. J. Hydrogen Energ. 37, 1594-1603 (2012).
- Brack, P., Dann, S. E., Wijayantha, K. G. U., Adcock, P., Foster, S. An old solution to a new problem? Hydrogen generation by the reaction of ferrosilicon with aqueous sodium hydroxide solutions. Energ. Sci. Eng. 3, 535-540 (2015).
- Akdim, O., Demirci, U. B., Miele, P. Highly efficient acid-treated cobalt catalyst for hydrogen generation from NaBH4 hydrolysis. Int. J. Hydrogen Energ. 34, 4780-4787 (2009).
- Akdim, O., et al. Anchored cobalt film as stable supported catalyst for hydrolysis of sodium borohydride for chemical hydrogen storage. Int. J. Hydrogen Energ. 36, 14527-14533 (2011).
- Chamoun, R., Demirci, U. B., et al. Cobalt-supported alumina as catalytic film prepared by electrophoretic deposition for hydrogen release applications. Appl. Surf. Sci. 256, 7684-7691 (2010).
- Akdim, O., Demirci, U. B., Muller, D., Miele, P. Cobalt (II) salts, performing materials for generating hydrogen from sodium borohydride. Int. J. Hydrogen Energ. 34, 2631-2637 (2009).
- Erogbogbo, F., et al. On-demand hydrogen generation using nanosilicon: splitting water without light, heat, or electricity. Nano Lett. 13, 451-456 (2013).
- Liu, Y., et al. Investigation on the improved hydrolysis of aluminum-calcium hydride-salt mixture elaborated by ball milling. Energy. 84, 714-721 (2015).
- Muir, S. S., et al. New electroless plating method for preparation of highly active Co-B catalysts for NaBH4 hydrolysis. Int. J. Hydrogen Energ. 39, 414-425 (2014).
- Wu, Z., et al. Mechanism and kinetics of sodium borohydride hydrolysis over crystalline nickel and nickel boride and amorphous nickel-boron nanoparticles. J. Power Sources. 268, 596-603 (2014).
- Zhuang, D. W., Zhang, J. J., Dai, H. B., Wang, P. Hydrogen generation from hydrolysis of solid sodium borohydride promoted by a cobalt-molybdenum-boron catalyst and aluminum powder. Int. J. Hydrogen Energ. 38, 10845-10850 (2013).
- Chen, Y., Pan, C. Effect of various Co-B catalyst synthesis conditions on catalyst surface morphology and NaBH4 hydrolysis reaction kinetic parameters. Int. J. Hydrogen Energ. 39, 1648-1663 (2014).
- Cheng, J., et al. Highly active nanoporous Co-B-TiO2 framework for hydrolysis of NaBH4. Ceram. Int. 41, 899-905 (2015).
- Chinnappan, A., Kim, H. Nanocatalyst: Electrospun nanofibers of PVDF - Dicationic tetrachloronickelate (II) anion and their effect on hydrogen generation from the hydrolysis of sodium borohydride. Int. J. Hydrogen Energ. 37, 18851-18859 (2012).
- Shang, Y., Chen, R., Jiang, G. Kinetic study of NaBH4 hydrolysis over carbon-supported ruthenium. Int. J. Hydrogen Energ. 33, 6719-6726 (2008).
- Shang, Y., Chen, R. Semiempirical Hydrogen Generation Model Using Concentrated Sodium Borohydride Solution. Energy Fuels. 20, 2149-2154 (2006).
- Wang, W., et al. Promoted Mo incorporated Co-Ru-B catalyst for fast hydrolysis of NaBH4 in alkaline solutions. Int. J. Hydrogen Energ. 39, 16202-16211 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados