Method Article
Determinar a composição química do inibidor de corrosão / Metal Interfaces com XPS: Minimizando Pós Immersion Oxidação
Neste Artigo
Resumo
A protocol to avoid the oxidation of metallic substrates during sample transfer from an inhibited acidic solution to an X-ray photoelectron spectrometer is presented.
Resumo
Uma abordagem para a aquisição de raios-X de dados de espectroscopia de fotoelétrons mais confiáveis de interfaces de inibidor / metal de corrosão é descrita. Mais especificamente, o foco é sobre substratos metálicos imersos em soluções ácidas contendo inibidores de corrosão orgânicos, uma vez que estes sistemas podem ser particularmente sensíveis à oxidação a seguir à remoção a partir da solução. Para minimizar a probabilidade de tal degradação, as amostras são removidas a partir da solução dentro de uma caixa de luvas purgada com um gás inerte, seja N2 ou Ar. A caixa de luva está ligado directamente à carga de bloqueio do instrumento de espectroscopia de fotoelectrão de ultra-alto vácuo de raios-X, evitando a exposição à atmosfera ambiente de laboratório, e assim reduzindo a possibilidade de oxidação do substrato pós imersão. Nesta base, pode-se ser mais certo que as características de espectroscopia de fotoelectrão de raios-X observados são susceptíveis de ser representativa da situação em situ submersa, por exemplo, o estado de oxidação do metal não é modificado.
Introdução
Os inibidores de corrosão (IC) são substâncias que, quando introduzida num ambiente agressivo, reduzem a taxa de corrosão de um material metálico através da indução de uma alteração na interface sólido / líquido 1, 2, 3, 4, 5. Esta abordagem para controlar a corrosão é amplamente utilizado na indústria, com alto desempenho IC tendo sido desenvolvida com sucesso para uma variedade de aplicações. Resta, no entanto, uma considerável falta de compreensão fundamental do desempenho CI, impedindo a otimização baseada no conhecimento. Por exemplo, a natureza exacta das interfaces formadas por orgânicos-cis em soluções ácidas corrosivos ainda não é clara.
Tendo em conta a hipótese de que orgânicos-cis inibir a corrosão ácida através da formação de uma camada adsorvida 2-D 2, uma técnica sensível de superfície é necessária to caracterizar essas interfaces. Por conseguinte, a espectroscopia de raios-X de fotoelectrão (XPS) 6 emergiu como uma técnica de escolha para sondar a composição elementar / química destas interfaces ex situ 7, 8, 9; medidas XPS são tipicamente realizadas em, ou perto de, ultra-alto vácuo (UHV). Várias ideias têm sido reivindicada, incluindo a que um óxido ou hidróxido de superfície está presente para facilitar a ligação ao substrato metálico 10, 11, 12-CI orgânica. A validade desta descrição da interface, no entanto, é discutível que os dados de XPS foram adquiridos a partir de amostras que haviam sido expostos à atmosfera no laboratório entre a remoção a partir da solução inibida e introdução no espectrómetro de UHV-XPS. Tal procedimento pode resultar em oxidação de interface, o que prejudica conclusões sobreinteragir composição química. Uma abordagem alternativa é necessária, o que minimiza o potencial de oxidação pós imersão.
Neste artigo, nós detalhe uma metodologia concebida para permitir um para adquirir dados XPS das interfaces / metal orgânicos-CI que não tenham sido submetidos a oxidação seguinte emersão da solução ácida. Uma caixa de luvas, purgado com gás inerte, o qual está ligado directamente ao vácuo carga de bloqueio do instrumento UHV-XPS é empregue. A utilidade da nossa abordagem é verificado através de apresentação de dados de XPS de duas interfaces-CI orgânico / de aço de carbono formado após a adição do IC suficiente para reduzir significativamente a taxa de corrosão do substrato em solução aquosa de ácido clorídrico 1 M (HCl).
Protocolo
1. Substrato / Preparação de Solução
- Preparação do substrato de aço de carbono
- Cortar uma cerca de 2 - 3 mm de espessura do disco a partir de uma haste cilíndrica de aço-carbono (10 ± 2 mm de diâmetro), usando uma máquina de corte de precisão. Empregar o fluido de arrefecimento durante o processo de corte para minimizar os danos mecânicos.
- Moer ambas as faces circulares, e o bordo da amostra em forma de disco com uma série de papéis de SiC, ou seja, de 600 grit, de 800 grit, 1200 grit, 2400 grit, e 4000 grit.
- Polonês ambas as faces circulares, e o bordo da amostra em forma de disco ou com pasta de diamante ou o pó de alumina (3 uM e / ou 1? M) até um acabamento de espelho é obtido.
- Sonicar a amostra à temperatura ambiente durante aproximadamente 10 minutos em cada um dos seguintes: água desionizada, acetona, etanol, e finalmente novamente água desionizada.
- Seca-se todas as superfícies da amostra sob um fluxo de ar.
- Conservar a amostra em qualquernum exsicador de vácuo ou exsicador até serem necessárias. Idealmente, concluir a preparação do substrato de aço carbono pouco antes da solução de imersão.
- Preparação de uma solução de HCl 1 M inibiu
- Adicionar M HCl 10,2 a água desionizada para produzir uma solução 1 M de HCl. CUIDADO: HCl é prejudicial e corrosivo. Realizar esta etapa em um exaustor, usando equipamento de protecção individual adequado.
- Dissolver xg de selecionado orgânico-CI (por exemplo, x = 0,300 g de 2-mercaptobenzimidazol) em solução de HCl 1 M para produzir uma solução de HCl 1 M contendo X-CI mM orgânico (por exemplo, x = 2 mM de 2-mercaptobenzimidazol).
2. Substrato imersão em solução de ácido inibido
- Pour um pequeno volume (tipicamente 25 - 50 ml) da H + x HCl 1 mM (por exemplo, x = 2 mM de 2-mercaptobenzimidazol) solução orgânica-CI para uma pequena proveta de vidro.
- Pegue a amostra de aço carbono em forma de disco com qualquer cerâmica ou plASTIC pinças que são resistentes a HCl 1M. Apenas tocar a borda da amostra com a pinça.
- Introduzir a amostra no copo de vidro contendo a M HCl 1 + x mM solução orgânica-CI. Orientar a amostra de modo a que as faces cilíndricas estão no plano vertical. Depositar a amostra, quer directamente sobre o fundo do copo, ou em cima da extremidade aberta de um tubo de vidro curta. Certifique-se de que a amostra está totalmente submerso.
3. Transferência de Amostra
- Preparação caixa de luva
- Localizar a abertura de transferência de amostra circular na base da caixa de luva para a montagem de carga XPS flange de bloqueio. Certifique-se de que a vedação entre a caixa de luva e flange de carga-lock é formado corretamente.
- Ligue o porta-luvas de um cilindro de gás inerte (ou N 2 ou Ar).
- Aderem um pequeno quadrado de carbono fita dupla face (condutora) para a barra de amostra XPS.
- Insira hardware necessário para a transferência de amostra no instrumento XPSatravés de uma porta aberta no porta-luvas, ou seja, bar amostra com fita de carbono ligado, plástico / pinças cerâmicas, luvas de borracha nitrílica, tecidos de laboratório, filme de parafina plástico, frasco de lavagem vazio / seco com bico e copo de vidro contendo ~ 200 g de Na 2 CO 3 em pó.
- Copo de vidro lugar contendo a amostra de aço carbono em HCl 1 M + x mM (por exemplo x = 2 mM 2-mercaptobenzimidazole) solução orgânica-CI caixa de luva dentro. Certifique-se de que a amostra é sempre totalmente imersa durante esta etapa.
- Selar todos os pontos de portas de entrada / no porta-luvas e começar a purga com N 2 (ou Ar).
- Continuamente purgar o porta-luvas até que a transferência da amostra é completa.
- A partir de solução a câmara de análise XPS
- Deixar a amostra ficar submersa no M de HCl 1 mM + X-CI solução orgânica, para o período de imersão desejado, por exemplo, 4 h, tal como empregue para os dados apresentados a seguir XPS.
- Verifique se o relativa de humidade dentro da caixa de luva é minimizado, o que é tipicamente conseguido após 60-90 min de iniciar purga. Um valor de 8% de humidade relativa é necessária antes de prosseguir com a transferência de amostra; valor antes da purga é tipicamente 35 - 40%.
NOTA: Normalmente, não existe um sensor de O 2 dedicado dentro da caixa de luva, mas as medições de ensaios com um dispositivo deste tipo indicam que o procedimento de purga leva a uma redução na concentração de O2 por um factor de ~ 1000. - Introduzir as mãos em luvas da caixa de luva, e em seguida, cobrir as mãos enluvadas com luvas de borracha nitrílica localizados no porta-luvas. Este passo reduz a possibilidade de contaminação durante a manipulação da amostra, bem como aumenta a facilidade de manipulação da amostra.
- Retirar a amostra de aço-carbono a partir do H HCl 1 mM + x (por exemplo, x = 2 mM de 2-mercaptobenzimidazol) solução orgânica-CI, utilizando as pinças cerâmico / plástico. Apenas tocar a borda da amostra com a pinça.
- immédiatEly após emersão, soprar a amostra seca dirigindo uma corrente de gás inerte, produzido por apertando repetidamente garrafa vazia / dry wash localizado dentro do porta-luvas, em superfícies de amostras.
NOTA: A lavagem com solventes, nesta fase, não é efectuada a minimizar o potencial de danificar a interface inibido, por exemplo, a remoção inibidor ou oxidação interface. - copo tampa contendo M HCl 1 + x solução orgânica-CI mM com película de parafina plástico.
- Apor a amostra para o pequeno quadrado de carbono fita dupla face (condutora) anexado ao bar amostra XPS. Não toque na superfície a ser sondado por XPS.
- Ventilar a câmara lock-carga XPS para N2 / Ar. Certifique-se de que a combinação da bomba associada turbo / rotativo é desligado antes de realizar esta ação.
- Abrir a flange de bloqueio de carga.
- Transferir a barra de amostras para a câmara de carga-lock e inseri-lo segurando amostra pinos.
- Fechar a flange de bloqueio de carga.
- Interruptorem combinação bomba rotativa turbo / bombear para baixo câmara de carga-lock.
- Uma vez que a pressão na câmara de lock-carga atinja pelo menos ~ 5 x 10 -7 mbar, transferir manualmente amostra a câmara intermediária usando o braço de transferência.
- Espere até que a pressão na câmara intermédia atinge ~ 1 x 10 -8 mbar e, em seguida, usar segundo braço de transferência para transferir manualmente amostra sobre o manipulador de amostra na câmara de análise.
4. Aquisição de Dados XPS
- Ângulo Oriente da amostra, usando o teclado para dirigir motores manipulador de amostra, para o ângulo de emissão de fotoelétrons desejado, por exemplo, 0 ° (emissão ao longo da superfície normal), como utilizado para os dados XPS apresentados abaixo.
- Abrir XPS software de aquisição de dados, clicando no ícone localizado na área de trabalho. Abra a janela Manual de Controle de Instrumentos.
- Entrada 10 mA e 15 kV como os valores para os parâmetros de emissão ânodo e HT ânodo, respectivamente. Em seguida, clique no botão "ON "botão na seção" X-ray Gun "para ligar a fonte de raios-X monocromada Al Ka. Depois disso, clique no botão "ON" na seção "neutralizador" para ligar o neutralizador de carga.
- Escolha um analisador de elétrons '/ híbrido Spectrum' modo de medição do 'Modo' e soltar 'Lente' down menus na seção "Analyzer".
- Entrada desejados / binding varia de energia cinética, passar energia (s), tamanho (s) passo e tempo de permanência (s) na secção "Aquisição / Controle Scan '. Exemplos de valores de parâmetros de entrada: 1.200 - 0 eV alcance energia de ligação, a energia passe de 80 eV, tamanho 0,5 eV passo, e 0,1 s habitar tempo para adquirir espectros visão geral.
- Otimizar posição da amostra pela posição do manipulador amostra ajuste, usando o teclado para dirigir motores manipulador de amostra, para maximizar o sinal do nível do núcleo selecionado, por exemplo, C 1s ou Fe 2p.
- Adquirir XPS espectros iniciando a coleta de dados em aquisição de dados XPSProgramas.
Resultados
A Figura 1 mostra descrição, O 1s, e Fe 2p dados de XPS adquirido a partir de amostras de aço de carbono que foram imersos durante 4 h em uma de duas soluções de 1 M HCl + x orgânico-CI mM diferentes, e transferido para a medição de XPS como detalhado acima . dados análogos de uma amostra polida também são exibidos. O aço-carbono possuía uma composição nominal de% de peso C (0,08-0,13), Mn (0,30-0,50), P (0,04), S (0,05), e Fe (saldo). Os dois orgânicos-cis estudados são: 2-mercaptobenzimidazole (MBI) e (Z) -2-2 (2- (octadec-9-en-1-il) -4,5-di-hidro-1H-imidazole-1- il) etanamina (OMID). Nas concentrações utilizadas (MBI: 2 mm; OMiD: 1 mM) medições da taxa de corrosão 13, 14 indicam que todas as espécies de inibir significativamente a corrosão do aço-carbono, isto é, eficiência de inibição (%) 2 η> 90%. Melhor se adapta às 1s S e Fe 2p perfis espectraistambém são exibidos. picos Fotoelétrons foram modelados com (GL) funções de forma line-Lorentzian Gauss (30% lorentzianas), com exceção do nível de ferro metálico, onde foi utilizada uma forma de linha assimétrica Lorentzian com cauda de amortecimento (LF) Fe 2p. O catiônica Fe x + estados foram modelados com envelopes multipleto que consistem em 3 e 4 funções GL para Fe 2+ e Fe 3+, respectivamente 15. Uma função Shirley tipo 16 foi usado para descrever o fundo de elétrons inelástica dispersas.
Focando nos dados visão geral XPS (Figura 1 (a)), o espectro adquirido a partir da amostra polida apresenta três picos proeminentes, isto é, Fe 2p, O 1s, e 1s C. Estas características podem ser atribuídas como se segue: Fe 2p surge a partir do aço de carbono, O 1s deriva tanto um filme de superfície oxídico e embebidos, e o sinal de 1s C é devido à acidental carbem. Submersão em qualquer um dos HCl 1 M + x mM orgânico-CI soluções resulta em mudanças significativas para o espectro visão geral correspondente. Uma característica atribuída ao 1s núcleo N nível aparece, o que é consistente com a adsorção dos inibidores; MBI e OMID ambos contêm N. Além disso, o sinal de nível de núcleo O1s é significativamente diminuída.
No que se refere O 1s dados a partir do substrato polido (Figura 1 (b)), o perfil pode ser equipado com quatro componentes. Os dois componentes em energias de ligação inferiores (BE), ~ 530,0 eV e 531,3 eV ~, pode ser atribuído ao óxido de ferro (O 2-) e hidrido (OH -) fases, respectivamente. Os dois maiores componentes de ligação de energia, ó marcada 1 (BE ~ 532,2 eV) e O 2 (BE ~ 533,3 eV), estão provavelmente associados à OH adsorvido (S 1) e espécies de carbono adventícios (O 1 e O 2) 17. Imersão em qualquer uma das tele HCl 1 M + X mM soluções orgânico-CI leva ao efeito de supressão completa do O 2- e OH - componentes. Nesta base, pode concluir-se que os inibidores de corrosão são adsorvidos nas superfícies livres de óxido / hidróxido de. O Fe 2p espectros na Figura 1 (c) são consistentes com este resultado, uma vez que apenas uma metálico de Fe (Fe 0) é de pico aparente nos substratos inibidos. Fe 2+ e Fe 3+ características estão presentes na amostra polida, devido à superfície de óxido / hidróxido.
1s O e Fe 2p do núcleo espectros XPS nível de duas amostras de aço de carbono imersos em HCl 1 M + MBI 2 mM são comparados na Figura 2. Uma amostra foi transferida utilizando uma caixa de luvas completamente N2 -purged, enquanto o outro foi removido a partir da solução dentro de uma caixa de luvas parcialmente N2 -purged, ou seja, a concentração de O 2 foi significativamente maior do que o valor alvo. Para a última amostra, it é evidente que a oxidação pós imersão ocorreu, ou seja, Fe 2 + / 3 + e O 2- / OH - características estão presentes.
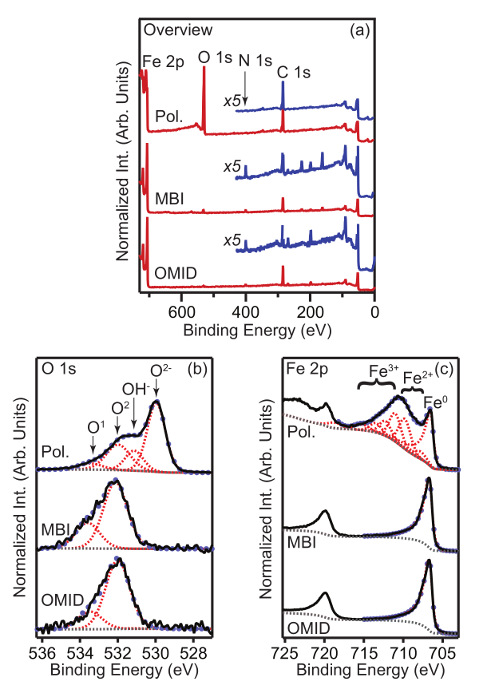
Figura 1. espectros XPS a partir de amostras de aço de carbono polido e inibida. (A) Síntese, (b) S 1s, e (c) Fe 2p espectros XPS. Os dados apresentados em cada painel foram adquiridos a partir de amostras de aço de carbono que tinham sido imersas durante 4 h em um de dois + X-CI soluções orgânicas diferentes HCl 1 M mm, isto é MBI 2 mM e 1 mM OMID. Os espectros foram todas adquiridas em um ângulo de emissão de fotoelétrons (θ E) de 0 ° (emissão ao longo da superfície normal). Para (b) e (c) os melhores ataques (luz marcadores azuis) aos dados experimentais (linhas pretas sólidas) também são exibidos, obtidos com uma combinação de GL (quebrado linhas vermelhas), LF (r quebrado linhas ed), e funções Shirley-tipo (linhas cinzentas quebrado). etiquetas de pico são explicados no texto principal. Por favor clique aqui para ver uma versão maior desta figura.
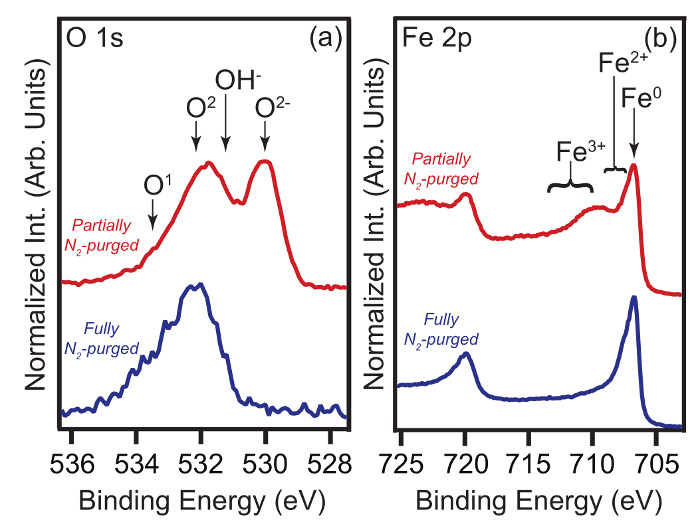
Figura 2. Impacto da oxidação pós imersão em XPS espectros. (A) S 1s e (b) Fe 2p espectros XPS. Os dados foram adquiridos a partir de amostras de aço de carbono que tinha sido imerso em HCl 1 M + 2 mM de soluções MBI (η% = 99%) durante 4 h. Os espectros foram adquiridos em q E = 0 °. Em cada painel, o espectro inferior (superior) é transferido a partir de uma amostra através de uma caixa de luvas -purged totalmente (parcialmente) N 2. etiquetas de pico são explicados no texto principal. (Versão modificada da Fig. 5 em Ref. 9.)oad / 55163 / 55163fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
Espectros XPS exibido nas Figuras 1 e 2 demonstram claramente que a atmosfera inerte utilizado durante a transferência das amostras é essencial para evitar a oxidação pós imersão destes interfaces de aço de carbono / orgânico-CI. Nesta base, os resultados de outros estudos de XPS semelhante (por exemplo, 18, 19), que envolveram a exposição do substrato inibida com a atmosfera ambiente de laboratório, deve ser criticamente re-avaliados, como a química da interface pode ter sido modificado através de oxidação. Deve notar-se que que não há razão para supor que todos os orgânicos-cis adsorver sobre óxido / hidróxido de superfícies livres em solução ácida. Em alguns casos, tais fases pode, de facto facilitar a ligação da superfície orgânico-CI. Distinguindo este cenário da oxidação pós imersão não é tão simples. Uma solução possível é a aquisição de dados a partir de uma interface de XPS referência inibida ( por exemplo, 1 M HCl + 2 MBI mM) em conjunto com a amostra de interesse para verificar que a oxidação pós imersão não é um problema.
Para garantir um resultado positivo para o procedimento de transferência das amostras, é essencial que o porta-luvas é totalmente purgado com gás inerte (N2 / Ar), ou seja, a concentração de O2 no porta-luvas é minimizado. Cuidados devem ser tomados para verificar que todos os selos nos portos porta-luvas / pontos de entrada esteja correctamente formado, incluindo a vedação entre a caixa de luva e flange de carga-lock XPS. Idealmente, um sensor in situ devem ser utilizado para monitorizar directamente a concentração de O2, embora não seja essencial, como demonstrado pelo nosso próprio trabalho. Como indicado no passo 3.3.2, que normalmente usam um sensor de umidade relativa como um guia para quando a realizar uma transferência da amostra.
Um outro problema potencial com o ambiente caixa de luvas, é a presença de componentes da solução volátil, o que pode contaminarsuperfície da amostra após a remoção a partir da solução e antes da inserção dentro da carga de bloqueio. Por exemplo, a presença de uma solução de HCl 1 M em caixa de luva leva a evolução de HCl de vapor, que pode reagir com amostras de aço de carbono que levam ao sinal Cl acidental nos dados de XPS. Para minimizar o risco de tal contaminação sendo significativa, pequenos volumes de uma solução de HCl deve ser empregue e de transferência das amostras deve ser completado tão rapidamente quanto possível. Nesta base, tal como indicado no protocolo, tipicamente, apenas um copo / amostra é inserida na caixa de luva para a transferência das amostras em qualquer uma vez. Além disso, deve-se minimizar a área de superfície da solução de HCI, assim cobrir o copo seguinte emersão amostra. Na 2 CO 3 em pó (passo 3.1.4) é inserida no porta-luvas, numa tentativa de controlar a quantidade de vapor de HCl. Além disso, ele pode ser utilizado para limpar quaisquer derrames solução ácida.
Além do controle cuidadoso da luva bambiente de boi, manipulação da amostra é também crítico para a integridade da adquiridos espectros XPS. Não se deve adquirir dados XPS a partir de qualquer superfície que tenha entrado em contato com qualquer objeto sólido, por exemplo, uma pinça ou luvas. Além disso, após a remoção de uma amostra de solução, deve ser imediatamente soprado com um gás inerte seco (passo 3.2.5). Este procedimento é realizado para evitar a evaporação e subsequente deposição física de componentes da solução sobre a superfície da amostra, o que pode conduzir a erros de interpretação de dados. Como precaução adicional, pode-se também pensar em trocar as luvas de borracha nitrílica (passo 3.2.3) por um novo par para transferir a barra de amostra para a câmara de lock-carga, ou seja, antes do passo 3.1.10.
Finalmente, dada a eficácia da abordagem descrita aqui, esperamos que ela seja aplicada a outros tópicos à corrosão (ou seja, para além da inibição de corrosão), onde a aquisição de dados de XPS a partir de interfaces sensíveis ao ar gostaria de acrescentar a understanding. Além disso, esta abordagem deve ser considerada em outros campos em que as medições são realizadas a partir de XPS de interfaces sensíveis ao ar formadas num ambiente fluido. Claramente, este procedimento não é restrita a XPS, mas também pode ser aplicado a qualquer outra medição baseado em UHV a partir de uma superfície que tenha sido previamente imerso num líquido, por exemplo, microscopia de sonda de varrimento.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
O trabalho foi apoiado pela AkzoNobel através de um acordo de colaboração com a Universidade de Manchester. PMG é grato ao Fondo Setorial CONACYT - SENER Hidrocarburos e do Instituto Mexicano de Peteróleo de apoio financeiro. TB graças Mellitah Oil & Gas companyfor financiar sua bolsa de estudo. KK reconhece o apoio financeiro do EPSRC (EP / L01680X / 1) através dos materiais para ambientes exigentes Centro de Doutorado Training. "PAL graças CONACYT para apoiar financeiramente a sua estadia em Manchester. Finalmente, todos os autores reconhecem Ben Spencer por seu suporte técnico e aconselhamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Mild steel C1010 | RCSL, BAC Corrosion Control Ltd. | n/a | |
| Polycrystallline iron 99.99+% | Goodfellow Cambridge Ltd. | FE007948 | |
| Silicon Carbide Grinding papers | Spectrographic Limited | T13316, T13317, T13318, T13156, T13153 | |
| Polishing Cloth | Spectrographic Limited | ||
| Monocrystalline Diamond compound | Spectrographic Limited | G22003 | |
| OmegaPol TWIN 250 mm Metallurgical Polisher | Spectrographic Limited | n/a | |
| BRILLANT 220 - Wet Abrasive Cut-Off Machine | ATM GmbH Advanced Materialography | n/a | |
| Ultrasonic Bath | NICKEL-ELECTRO LTD. | SW3H | |
| Heat gun, D100/200 Mfg | Mar Equipment Ltd | n/a | |
| Vacuum Desiccator | DURAN | 24 782 57 | |
| Low form beaker 25 mL | Fisher Scientific | FB33170 | |
| Regulator for N2 gas cylinders | Freshford Ltd. | MS-10B-N2 | |
| Nitrogen Purge Glove Box | Terra Universal, Inc | n/a | |
| Dual Purge System | Terra Universal, Inc | 1606-61 | |
| NitroWatch System with sensor | Terra Universal, Inc | 9500-00A, 9500-02A | |
| SEFRAM LOG 1620 Data Logger, 50000 | SEFRAM | 2475144 from Farnell Element14 | |
| Big Digit Hygro-Thermometer | FLIR Commercial Systems, Inc. Extech Instruments Division | 445703 | |
| Kratos Axis Ultra | Kratos Analytical Ltd | n/a |
Referências
- Sastri, V. S. . Corrosion Inhibitors: Principles and Applications. , (1998).
- Lindsay, R., Lyon, S. B., Cottis, R. A., et al. Introduction to Control of Corrosion by Environmental Control. In: Shreir's Corrosion, Vol. 4, Management and Control of Corrosion. , 2891-2899 (2010).
- Oguzie, E. E., Li, Y., Wang, S. G., Wang, F. Understanding corrosion inhibition mechanisms - Experimental and theoretical approach. RSC Advances. 1 (5), 866-873 (2011).
- Kokalj, A., Peljhan, S., Finšgar, M., Milošev, I. What determines the inhibition effectiveness of ATA, BTAH, and BTAOH corrosion inhibitors on copper?. Journal of the American Chemical Society. 132 (46), 16657-16668 (2010).
- Kokalj, A. Formation and structure of inhibitive molecular film of imidazole on iron surface. Corrosion Science. 68, 195-203 (2013).
- Briggs, D., Seah, M. P. . Practical surface analysis: by auger and x-ray photo-electron spectroscopy. 1, (1996).
- Finšgar, M., Jackson, J. Application of corrosion inhibitors for steels in acidic media for the oil and gas industry: A review. Corrosion Science. 86, 17-41 (2014).
- Finšgar, M. 2-Mercaptobenzimidazole as a copper corrosion inhibitor: Part II. Surface analysis using X-ray photoelectron spectroscopy. Corrosion Science. 72, 90-98 (2013).
- Morales-Gil, P., Walczak, M. S., Cottis, R. A., Romero, J. M., Lindsay, R. Corrosion inhibitor binding in an acidic medium: Interaction of 2-mercaptobenizmidazole with carbon-steel in hydrochloric acid. Corrosion Science. 85, 109-114 (2014).
- Olivares-Xometl, O., Likhanova, N. V., Martínez-Palou, R., Domínguez-Aguilar, M. A. Electrochemistry and XPS study of an imidazoline as corrosion inhibitor of mild steel in an acidic environment. Materials and Corrosion. 60 (1), 14-21 (2009).
- Flores, E. A., et al. Sodium phthalamates as corrosion inhibitors for carbon steel in aqueous hydrochloric acid solution. Corrosion Science. 53 (12), 3899-3913 (2011).
- Zarrok, H., et al. Corrosion control of carbon steel in phosphoric acid by purpald - Weight loss, electrochemical and XPS studies. Corrosion Science. 64, 243-252 (2012).
- Morales-Gil, P., et al. Corrosion inhibition of carbon-steel with 2-mercaptobenzimidazole in hydrochloric acid. Corrosion Science. 101, 47-55 (2015).
- Popova, A., Christov, M., Raicheva, S., Sokolova, E. Adsorption and inhibitive properties of benzimidazole derivatives in acid mild steel corrosion. Corrosion Science. 46 (6), 1333-1350 (2004).
- Gupta, R. P., Sen, S. K. Calculation of multiplet structure of core p -vacancy levels II. Physical Review B. 12 (1), 15-19 (1975).
- Shirley, D. A. High-resolution x-ray photoemission spectrum of the valence bands of gold. Physical Review B. 5 (12), 4709-4714 (1972).
- Al-Refaie, A. A., Walton, J., Cottis, R. A., Lindsay, R. Photoelectron spectroscopy study of the inhibition of mild steel corrosion by molybdate and nitrite anions. Corrosion Science. 52 (2), 422-428 (2010).
- Liu, X., et al. The study of self-assembled films of triazole on iron electrodes using electrochemical methods, XPS, SEM and molecular simulation. Electrochemistry Communications. 9 (4), 813-819 (2007).
- Zhang, H., et al. Corrosion inhibition of mild steel in hydrochloric acid solution by quaternary ammonium salt derivatives of corn stalk polysaccharide (QAPS). Desalination. 372, 57-66 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados