Method Article
Histológica quantificação para determinar o pulmão carga fúngica em aspergilose Experimental
Neste Artigo
Resumo
Aqui descrevemos um protocolo para determinar a carga fúngica pulmonar em camundongos com aspergilose invasiva pela quantificação de prata de methanamine modificada de Gomori coloração em cortes histológicos. Uso desse método resultou em resultados comparáveis com menos animais comparados a avaliação da carga fúngica por PCR quantitativo de DNA fúngico de pulmão.
Resumo
A quantificação da carga fúngica pulmonar é fundamental para a determinação do teor relativo de proteção imune e virulência fúngica em modelos do rato de infecção fúngica pulmonar. Embora vários métodos são usados para avaliar a carga fúngica, reação em cadeia do polymerase quantitativa (qPCR) de DNA fúngico tem emergido como uma técnica com diversas vantagens sobre os métodos baseados na cultura anteriores. Atualmente, uma avaliação abrangente de patologia pulmonar, recrutamento de leucócitos, fungo fardo e expressão gênica em camundongos com aspergilose invasiva (IA) exige o uso de um número significativo de experimental e de controle de animais. Aqui, a quantificação do pulmão histológica coloração para determinar a carga fúngica, usando um número reduzido de animais foi examinada em detalhes. Seções de pulmão foram coradas para identificar estruturas fúngicas com modificado methanamine de prata de Gomori (GMS) de coloração. Imagens foram tiradas das seções manchadas de GMS de 4 áreas distintas de cada pulmão de parafina fixada em formol. As GMS manchados áreas dentro de cada imagem foram quantificados utilizando um programa de análise de imagem, e desta quantificação, determinou-se a percentagem média de área manchada para cada amostra. Usando essa estratégia, camundongos deficientes em eosinófilo exibidos diminuíram carga fúngica e doença com terapia de caspofungina, enquanto ratos do selvagem-tipo ia não melhorou com caspofungina. Da mesma forma, carga fúngica em ratos que faltam células γδ T também foram melhorados por caspofungina, medida pelo qPCR e quantificação de GMS. Quantificação de GMS, portanto, é apresentada como um método para a determinação da carga fúngica de pulmão relativo que em última análise, pode reduzir a quantidade de animais experimentais necessários para estudos exaustivos de aspergilose invasiva.
Introdução
IA é uma infecção oportunista que podem se desenvolver em indivíduos suscetíveis com deficiência imune congênita ou adquirida devido a terapia supressiva imune ou infecção crônica1,2. Muitas vezes a infecção primária ocorre nos pulmões, embora em alguns difusão de instâncias de Aspergillus fumigatus para o fígado, rins, coração e cérebro pode ocorrer, resultando em invasão extensa de tecido de hifas acompanhada de doença severa e alta taxas de mortalidade1,2. Além disso, a eficácia de farmacoterapias existentes é limitada e pode ser ainda mais enfraquecida pelo surgimento de cepas resistentes antifúngico no ambiente3. Portanto, é importante entender os mecanismos da patologia fúngica de virulência e anfitrião que promovam o desenvolvimento ou exacerbação de doença fúngica invasiva.
Murino modelos continuam a ser importantes para estudos de IA mecanicistas, pois permitem aos pesquisadores avaliar os papéis de genes de virulência fúngica e hospedar efetores imunes à criação e crescimento da . fumigatus vivo em4,5. Consequentemente, várias estratégias foram planejadas a fim de efetivamente quantificar ou comparar a carga fúngica em grupos de animais experimentais6,7. Essas estratégias envolvem baseado em cultura, bioquímico, imunoensaio ou qPCR métodos, cada um com diferentes vantagens e desvantagens. Além disso, cada um desses métodos envolvem a dedicação de um subconjunto dos animais além daqueles sacrificados para avaliações de função imune efetora, análise da expressão de gene e histopatologia comparativa7. Assim, estudos exaustivos IA muitas vezes exigem um número significativo de animais de pesquisa, a um custo significativo. Estratégias eficazes que reduzem o tempo experimental, os custos de animais e considerações éticas, utilizando tecidos animais para múltiplas análises, portanto, são extremamente valiosas7.
Neste relatório, é apresentado um método descrevendo a quantificação dos GMS coloração em cortes histológicos para comparação da carga fúngica relativo entre grupos experimentais de ratos com IA. Cada etapa da cultura fúngica, infecção, colheita de tecidos e transformação e aquisição de imagem e análise de dados, é descrita em detalhes. Fúngicos fardos obtidos pela quantificação de GMS foram comparados com qPCR em modelos intermitente do i e em camundongos selvagem-tipo ou deficiência de eosinófilo caspofungina-tratados com IA8. Os resultados mostram semelhança com GMS quantificação e qPCR de DNA fúngico. Isto sugere que GMS quantificação pode ser útil para pesquisadores envolvidos na análise histológica, como um método alternativo ou complementar de comparação da carga fúngica relativa em camundongos com IA e, finalmente, pode reduzir o custo e a utilização de animais de pesquisa em estudos complexos, mecanicistas.
Protocolo
Todos os procedimentos de animais foram aprovados pelo Comité de Indiana State University de uso, o campus de anfitrião da Indiana University School of Medicine e cuidado Animal — Terre Haute.
1. preparação da . fumigatus conídios por infecção
- Enquanto trabalhava em uma coifa ventilada, adicione 125 µ l de solução-mãe de a. fumigatus 293 para 900 µ l célula cultura classe água (CCGW). Em seguida, transferi a solução para placa de agar (MEA) extrato através de pipeta de malte e espalhe uniformemente com um loop inoculando.
- Armazene a placa fúngica no escuro a 24 ° C durante pelo menos 14 dias e não mais de 28 dias.
- Conídios de colheita usando contas de vidro, como anteriormente descreveram9.
- Despeje 1,5 g de 0.5 mm grânulos de vidro na placa e suavemente incliná-lo para a frente e para trás até que os grânulos são revestidos a fim de extrair conídios. Recolha a mistura do grânulo/conídios em um tubo cônico de 15 mL. Suspenda em de 5ml Dulbecco tampão fosfato salino (DPBS) e vortex.
- Conte os conídios em uma diluição de 50 x de sobrenadante na DPBS usando um hemocytometer. Contar o número de conídios na área mostrada na Figura 1 e usar a equação 1 para calcular a concentração.
Fator de diluição de #Conidia × × 104= conídios/mL (equação 1)
Nota: Áreas de canto quadrado 4x4 adicionais podem ser contadas, com a média dessas áreas usadas como #Conidia na equação 1.
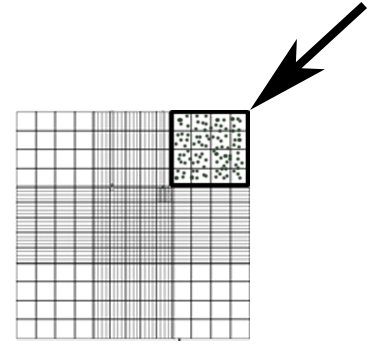
Figura 1: Hemocytometer representante área utilizada para a contagem de conídios (caixa, seta).
- Diluir a suspensão de conídios com solução salina estéril (DPBS) para obter a concentração desejada, 1,0 x 108 conídios/mL para a infecção com 5 x 106 conídios/50 µ l. preparar 50 µ l de solução de conídios por ' n + 2' ratos para ser infectado a conta para pipetar erro.
Nota: Padrão fungo colheita e preparação/filtragem podem ser usado alternativamente10. O método de grânulo de vidro é melhor usado para assegurar que amostras de conídios com mínimos pequeno/solúvel hifas antígenos são obtidas por aspiração.
2. imunossupressão e infecção do modelo murino
- Use ratos 7-10-week-old.
Nota: BALB/c, C57BL/6 (B6), deficiência de eosinófilo (ΔdblGATA, fundo BALB/c) e deficiência de células T γδ (TCRδ-/-, fundo de B6) ratos foram utilizados para este estudo. Em cada experimento, idade e gênero-combinadas ratos (machos e fêmeas) foram utilizados para cada grupo. - Empobrecem os neutrófilos via (IP) injeção intraperitoneal de anticorpo anti-mouse-Ly - 6G de 0,1 mL (0,5 mg) em soro fisiológico estéril a 45° no quadrante inferior direito lateral (para um horário experimental, ver Figura 2).
- 24h depois, infectar camundongos por aspiração com 5,0 x 106a. fumigatus conídios suspensos em 50 soro fisiológico estéril µ l (ver passos 2.4-2.10) como descrito anteriormente11. Após a infecção, injetar um subconjunto de animais com agente antifúngico como diacetato de caspofungina 5mg/kg em DPBS utilizado neste estudo (diariamente, ver Figura 2).
- ANESTHETIZE ratos com 99,9% de isoflurano usando uma máquina de anestesia veterinária.
- Coloque uma toalha de papel no chão da câmara de indução para pegar as fezes e urina.
- Posicione o mouse na câmara de indução, fixe a tampa e definido o vaporizador com isoflurano de 5% para 2 min e 30 s.
Nota: Pomada de veterinário não é usada porque o tempo total sob anestesia é menos de 5 min. - Reduzir o vaporizador para metade da configuração máxima por 30 s.
- Confirmar que o mouse é devidamente anestesiado, observando desacelerou para respirar, falta de movimento e falta de resposta ao estímulo de dedo-pinch.
- Retire o mouse da câmara de indução e coloque sobre uma prancha inclinada. Coloque o mouse com as costas contra a placa. Certifique-se de que seus incisivos superiores são tolhidos suavemente com um elástico e incisivos inferiores são tolhidos suavemente com um fio de metal.
- Cuidadosamente, segure a língua em extensão completa com pequenas pinças e pipeta, 50 µ l de suspensão de conídios/PBS na base da língua.
- Segure a língua em extensão completa; Ouça por respiração rápida e o ruído de clique distinto de aspiração. Segure por 20 s ou até suspensão é totalmente aspirado.
- Retire o mouse da prancha inclinada e Coloque suavemente em uma gaiola para observação.
- Após a aspiração, o rato deve recuperar a consciência dentro de 1 min. Monitor o mouse até totalmente consciente e capaz de andar por aí a gaiola. Os animais devem ser alojados a 21 ° C e monitorados, duas vezes ao dia, até que os pulmões são colhidos.
- Repita o esgotamento da infecção pós 24h por neutrófilos (passo 2.2) (Figura 2).
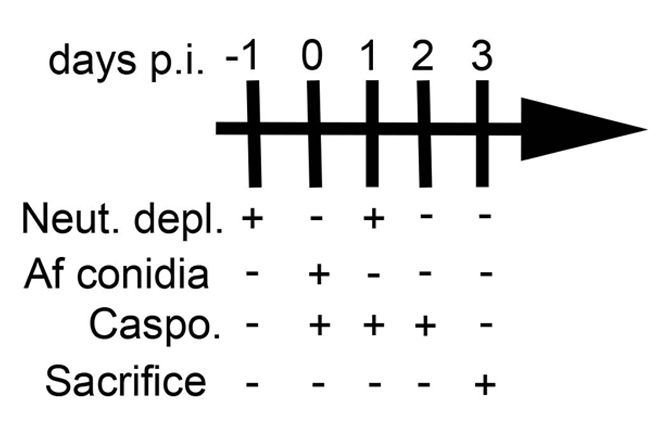
Figura 2: programação Experimental. Esta figura foi modificada de uma anterior publicação8.
3. colheita e preservação dos pulmões de Mouse para análise histológica
- Profundamente anestesia o animal com uma dose fatal de 0,1 ml de 390 mg/ml pentobarbital de sódio solução IP.
- Confirme a eutanásia, observando a falta de respiração espontânea e ausência de resposta à estimulação do membro com uma pinça. Uma vez que a eutanásia, pulverize a carcaça com etanol a 70% para esterilizar.
- Coloque a carcaça em uma placa de espuma coberta com um absorvente.
Nota: A carcaça deve ser colocada em suas costas com pinos de fixação todos os quatro membros para a placa de espuma. - Abra a cavidade superior do peito usando tesouras com cautela. Corte a caixa torácica para expor os pulmões e o coração. Corte a veia cava inferior para permitir a perfusão. Evite cortar os vasos sanguíneos e perfurar órgãos.
- Perfundir lentamente com 5 mL de DPBS frio no ventrículo direito do coração em um ângulo de 45° com uma agulha 25-G. Repita a perfusão com 5 mL de formol a 10%.
- Cuidadosamente, expor a traqueia e separar as almofadas de gordura ao redor. Use cautela e evitar perfurar a traqueia. Garantir a que remoção do excesso de tecido conjuntivo para visualizar totalmente a traqueia antes de prosseguir. Uma vez que a traqueia é exposta, coloque a pinça sob a traqueia para elevá-lo.
- Fazer um buraco pequeno na traqueia superior usando uma agulha 25-G.
Nota: O buraco deve ser posicionado para que a cânula toda se encaixa na traqueia. Tome cuidado para evitar a ruptura da traqueia. - Introduza uma cânula através do buraco e para os pulmões. Fixe a cânula com um fio cirúrgico amarrado frouxamente em torno da traqueia.
Nota: Se a traqueia é rompida, a cânula pode ser inserida além da traqueia na medida do possível, na via aérea. - Usando uma seringa, infle os pulmões com 1 mL de tampão de formalina 10% através da cânula. Certifique-se de que a inflação dos pulmões é visível. Caso contrário, ajustar o cateter e repetir. Uma vez que os pulmões são inflados, rapidamente remover a cânula com cuidado e aperte o fio firmemente para selar a traqueia.
Nota: Se é rompida a traqueia e os pulmões não podem ser inflados, os pulmões ainda podem ser capturados, mas isso pode impedir a fixação adequada. - Remova delicadamente a traqueia e os pulmões do peito desconectando cuidadosamente o tecido conjuntivo da traqueia com pinça enquanto puxando suavemente para cima no thread. Coloque os pulmões e traqueia em um tubo cónico de 50 mL com 15 mL de tampão de formalina 10%. Coloque uma das extremidades do segmento fora do tubo e feche a tampa. Inverta o tubo para submergir completamente a amostra no fixador.
- Armazene as amostras à temperatura ambiente pelo menos 24 h ou até processamento adicional.
Atenção: Formalina é perigosa. Use equipamento de protecção adequado incluindo uma máscara e óculos. Trabalhar sob uma capa de química durante o processamento de amostras.
4. colheita e preservação dos pulmões de Mouse para DNA carga fúngica
- Siga os passos 3.1-3.5 como descrito acima em um mouse separado.
- Perfundir lentamente com 10 mL de DPBS frio no ventrículo direito do coração em um ângulo de 45° com uma agulha 25-G.
- Impostos especiais de consumo os pulmões com uma tesoura e coloque em tubos etiquetados 1,5 mL.
- Armazene os pulmões a-80 ° C até o processamento adicional.
- Use técnicas padrão conforme descrito (incorporação e corte) e de acordo com protocolos do fabricante (ver Tabela de materiais).
5. microscopia e imagem
- Abra o programa da imagem latente da quantificação (ver Tabela de materiais).
- Usando um microscópio de luz, obter pelo menos 4 campos distintos dos GMS manchados slides (objetivo de X 10). Certifique-se de que as imagens são representativas das vias aéreas dentro do pulmão com similar densidade do tecido infectadas.
Nota: Se a densidade e a distribuição dos focos das hifas aparecem visivelmente diferentes entre os grupos experimentais e controle, campos adicionais podem ser tomados, ou a área de GMS da seção de pulmão inteiro pode ser fotografada (objetivo de X 4). Obter imagens das mesmas áreas do pulmão (identificados pela morfologia do tecido equivalente) em uma seção de pulmão serial corada com hematoxilina e eosina, se desejado. - Adicionar barras de escala para as imagens, se necessário e guardar as imagens para ser quantificada. Selecionar, Editar > Adicionar/editar marcas de calibração > Menu: escolher o tamanho de barra de escala, a cor e a espessura de linha > clique na imagem para ver onde a barra de escala é para ser colocado. Fechar o Menu e escolher, Editar > Merge > Mesclar marcas de calibração > escolher arquivo salvar como > nome do arquivo e clique em salvar.
6. usando um programa de processamento de imagem para calcular a carga fúngica (Figura 3)
- Abra um programa de processamento de imagem. Selecione Arquivo > pasta com amostras de quantificar > imagem (Figura 3A). Selecione a imagem > tipo > converter para "Pilha" de RGB (Figura 3B).
- Use a tecla de seta para a direita para selecionar a segunda das três imagens dada (Figura 3B). Bateu "control + shift + T" para que apareça o ajustador de configurações do menu de "Limiar" (Figura 3). Localize a imagem original,. TIFF ou. jpg como referência e abre com uma imagem de visualização do programa (Figura 3).
- Puxar o controle deslizante superior todo o caminho para a esquerda e ajuste o controle deslizante inferior até a área selecionada (em vermelho) é representante da imagem microscopia (normalmente variando de 130-160 como indicado à direita do controle deslizante (Figura 3).
- Uma vez selecionado, pressione "Set" > "Okey" (Figura 3D). Selecione "Analisar" > "Definir medições" > "Limite de área, a fração de área, ao limiar, o rótulo de exibição" e deixar as configurações de fundo (o menu drop-down e decimais) como padrão > "Okey" (Figura 3D).
- Áreas significativas de espaço em branco ou coloração de fundo podem ser excluídas pela seleção do tecido apropriado com uma ferramenta de área ou polígono.
- Finalmente, selecione, "Analisar" > "Medida" (deverá aparecer uma janela com dados, ou uma guia na barra de tarefas da windows aparecerá rotulado, "Resultados") (Figura 3E). Transferir os dados para um programa de análise de dados para gráficos e análise estatística.
- Digite a média das percentagens quatro área para cada amostra de pulmão. 5-8 amostras são geralmente suficientes para detectar diferenças significativas entre os grupos. Se comparar dois grupos experimentais, executar um student não pareado t-teste para determinar o significado.

Figura 3: quantificação de campo representante screenshots de cada etapa de GMS histológicas. (A) Selecionar arquivo > pasta com amostras de quantificar > selecionar imagem. (B) selecione imagem > tipo > converter para "Pilha de RGB". Use a tecla de seta para a direita para selecionar a segunda das três imagens determinadas. (C) Hit "control + shift + T" para que apareça o ajustador de configurações de menu "Limiar". Localize a imagem original,. TIFF ou. jpg como referência e abrir com o programa visualizador de fotos. Puxe o deslizante superior até deixou e ajuste o controle deslizante inferior até a área selecionada (em vermelho) é representante da imagem microscopia (normalmente variando de 130-160 como indicado à direita do controle deslizante. (D) uma vez selecionado pressione "Set" > "Okey". Selecione "Analisar" > "Definir medições" > "Limite de área, a fração de área, ao limiar, o rótulo de exibição" e deixar as configurações de fundo (o menu drop-down e decimais) como padrão > "Okey". (E) finalmente selecione "analisar" > "Medida" (deverá aparecer uma janela com dados, ou uma guia na barra de tarefas da windows aparecerá rotulado "Resultados"). Clique aqui para ver uma versão maior desta figura.
7. DNA carga fúngica
- Remover os pulmões de-80 ° C e lyophilize pelo menos 4 h (durante a noite é o ideal) ou até completamente seco por um sistema de gelo seco.
- Enquanto os pulmões estão secando, prepare o tampão de extração de DNA (NaCl 0,1 M, 10 mM EDTA pH 8.0, 10mm Tris HCl pH 8.0 e 0,5% SDS).
- Coloque o buffer de extração de DNA preparado em um banho de água de 60 ° C para pré-aquecer. Além disso, coloque o fenol: clorofórmio: álcool isoamílico (25:24:1) em um tubo cónico de 50 mL e permitir a separação.
- Coloque os pulmões liofilizados em um tubo de 2 mL de tampão de parafuso com 0,2 mL de esferas de vidro. Usando um batedor do grânulo, moa o tecido de pulmão seco por 15-30 s até formar um pó fino.
- Adicione 0,8 mL de tampão de extração de DNA quente a cada tubo e vórtice bem. Incube cada tubo por 15 min em um banho de grânulo de 65 ° C e em seguida vórtice antes incubando durante um 15 minutos adicionais. Após a incubação, vórtice e, em seguida, centrifugar tubos em 25.000 x g durante 10 minutos.
- Rotular 3 conjuntos de tubos de 1,5 mL para cada uma das amostras e transferir a camada superior do líquido sobrenadante para um conjunto de tubos. Tenha cuidado durante a pipetagem a camada aquosa superior para evitar perturbar a camada média.
- Adicione igual volume de álcool isoamílico: fenol: clorofórmio e misture bem. Centrifugar a 25.000 x g, durante 15 min antes de Pipetar a camada superior para o segundo conjunto de tubos.
- Adicionar um volume igual de clorofórmio clorofórmio: isoamílico, misture bem e centrifugar a 25.000 x g durante 10 min. pipeta com cuidado a camada superior para o terceiro conjunto de tubos.
- Adicionar 500 µ l de isopropanol e 50 µ l NaoAc (pH 5.2), misture bem e permitir a amostras de incubação à temperatura ambiente por 10 min. Centrifugar a 25.000 x g por 30 min e decante o sobrenadante.
- Lavar o sedimento de DNA com 750 µ l de etanol a 70% frio gelo e centrifugar por 5 min em 25.000 x g. decantar o etanol e permitir que as bolinhas de ar seco nos tubos em um exaustores de fumos por 40 min.
- Resuspenda as pelotas secas em 300 µ l de tampão TE.
Nota: O DNA pode ser armazenado a-20 º C até quantificada. - Quantificação de DNA utilizando um espectrofotômetro e prepare-se 100 µ l de 0,2 µ g / µ l de cada amostra de DNA para análise de qPCR.
- Executar um padrão qPCR em triplicado, conforme descrito anteriormente com 1 µ g de amostra de DNA, fúngicas 18S rDNA da primeira demão, e sonda define com um quencher da sonda modificado (5'- / 56-FAM/AGC CAG CGG/ZEN/CCC GCA AAT G/3IABkFQ /-3')12,13.
- Preparar uma curva padrão de DNA genômico da . fumigatus e calcular a concentração de DNA fúngico em pg em cada amostra utilizando o repórter médio tingir valores de Ct.
- Sinopse o pg / µ g de DNA fúngico com erro padrão da média. Executar t de um estudante-teste de análise para determinar o significado.
Nota: como um menos tóxica alternativa para a extração de DNA de fenol-clorofórmio usada neste documento, coluna com base em extração de DNA kits podem ser usados.
Resultados
A Figura 4 inclui um gráfico de sobrevivência do tipo selvagem ou ratos deficientes em eosinófilo com IA tratadocom com caspofungina. Os resultados mostram que camundongos deficientes em eosinófilo exibiram maior sobrevivência quando comparado aos ratos do selvagem-tipo (50% de mortalidade versus mortalidade de 100%, respectivamente). A Figura 5 mostra representante GMS de intermitente a coloração selvagem-tipo e ratos deficientes em eosinófilo com IA trataram ou não tratada com caspofungina. Caspofungina tratamento resultou em relativa folga fúngica em eosinófilo-deficiente, mas não selvagem-tipo ratos (painéis de certo), enquanto os dois grupos que não receberam caspofungina foram semelhantes (painéis à esquerda). Figura 6 mostra a comparação da carga fúngica em tratados caspofungina e controlar ratos selvagem-tipo ou eosinófilo-deficiente não tratados, usando ambos qPCR de DNA fúngico (figura 6A) e representante GMS quantificação de 4 (objetivo de X 10) campos ( Figura 6B). Os resultados gerados a partir de ambas as técnicas mostram que os resultados do tratamento de caspofungina da carga fúngica mais significativos diminuem entre ratos selvagem-tipo e eosinófilo-deficiente (figura 6A). No entanto, em camundongos não tratados, quantificação de GMS só resultou em uma diminuição significativa em ratos que faltam eosinófilos (Figura 6B). Quando a área média das secções de todo-pulmão manchadas de GMS foram calculados (objetivo de X 4), as diferenças foram semelhantes aos resultados obtidos com 4 campos de representante 10 X, embora com menor significância estatística (Figura 6). A Figura 7 mostra a sobrevivência, imagens de coloração representante GMS (campos 4 10 X) e quantificação da carga fúngica por ambos os métodos em γδ ratos deficientes em células T (TCRδKO) que foram tratados com caspofungina em comparação com o controle, não tratado de ratos. Caspofungina tratamento melhorado de sobrevivência (Figura 7A) e fúngico fardo (Figura 7B-D) em ratos TCRδKO. Semelhante aos resultados da Figura 6, os resultados da carga fúngica medida pelo qPCR (Figura 7B) e representante de quantificação de GMS (Figura 7) foram comparáveis.

Figura 4: aumento da sobrevida em camundongos deficientes em eosinófilo (ΔdblGATA) com IA após tratamento com caspofungina. 15-30 ratos/grupo. Resumo das experiências de 3-6. p < 0,0001. Esta figura foi modificada de uma anterior publicação8. Clique aqui para ver uma versão maior desta figura.
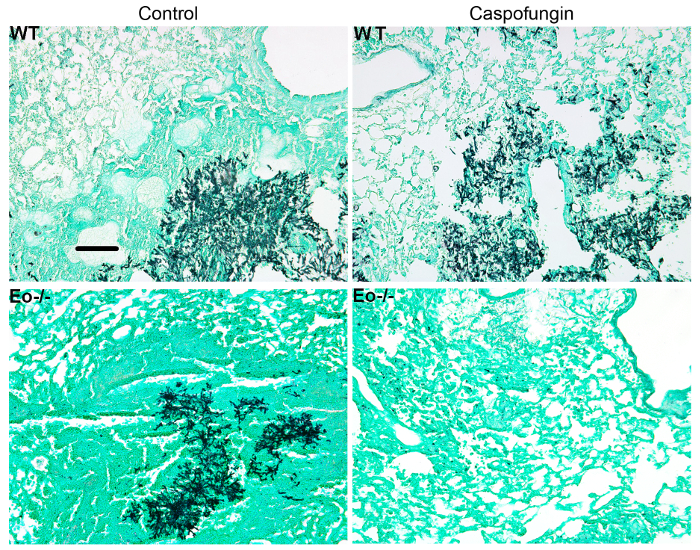
Figura 5: imagens representativas das seções manchadas de GMS pulmão do selvagem-tipo, eosinófilo deficiente e tratada com caspofungina ou controle sem tratamento de ratos com ia Representante de ratos/grupo de 3-4. Barra de escala é equivalente a 100 µm. Esta figura foi modificada de uma anterior publicação8. Clique aqui para ver uma versão maior desta figura.
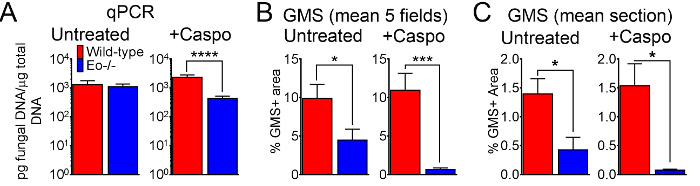
Figura 6: carga fúngica no tipo selvagem, eosinófilo-deficiente ratos com IA tratados ou controle tratadocom com caspofungina. (A) qPCR de DNA fúngico. 15-30 ratos/grupo, resumo das experiências de 3-6. (B) GMS quantificação dos cortes histológicos, média % de GMS coloração de 4 campos (objetivo de x 10). (C) GMS quantificação, média % da seção de pulmão inteiro (objetivo de X 4). B e C são um resumo de 5 ratos/grupo. p < 0,05. p < 0,001. p < 0,0001. Esta figura foi gerada usando dados que foram relatados em um anterior publicação8. Clique aqui para ver uma versão maior desta figura.
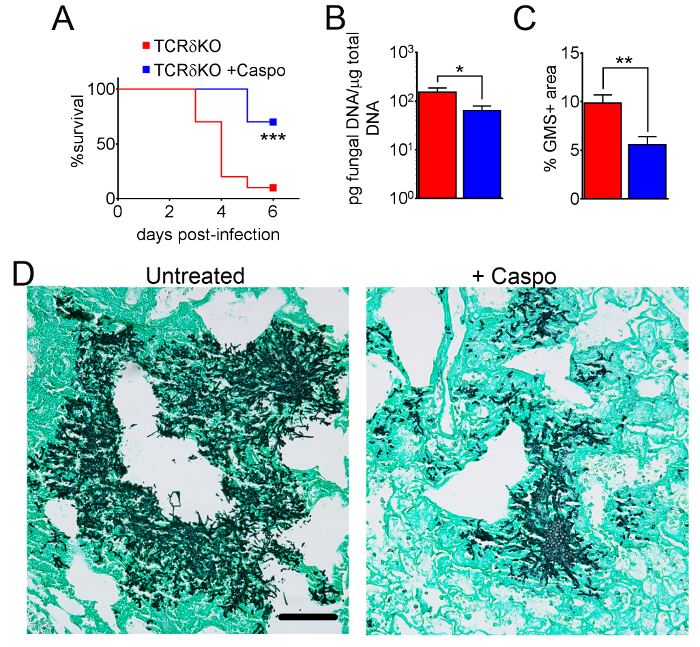
Figura 7: diminuição da severidade do i em ratos de deficientes em células T γδ após tratamento de caspofungina. Sobrevivência do (). (B) qPCR de DNA fúngico. (C) GMS quantificação da histologia. (D) imagens representativas das seções manchadas de GMS de células γδ T com IA, tratada ou não com caspofungina. A e B são um resumo dos dois experimentos com ratos/grupo de 7-10. C e D são um resumo de 4 ratos/grupo. p < 0,05. p < 0,01. p < 0,001. Esta figura foi modificada de uma anterior publicação8. Clique aqui para ver uma versão maior desta figura.
Discussão
O objetivo deste artigo foi apresentar um método para determinação da carga fúngica do pulmão em camundongos com IA utilizando cortes histológicos pulmão manchadas de GMS para análise de imagens e quantificação. Neste estudo, o tratamento com a droga antifungal β-glucan-síntese-direcionamento caspofungina14 não melhorar sobrevivência ou carga fúngica em ratos do selvagem-tipo intermitente com IA8. No entanto, na ausência de eosinófilos ou células γδ T, sobrevivência e carga fúngica melhoraram. Os resultados do nosso estudo demonstraram também que os resultados comparáveis podem ser obtidos por carga fúngica de GMS em comparação com o amplamente utilizado fúngicas DNA qPCR método6.
Existem várias vantagens em utilizando quantificação de carga fúngica GMS. Em primeiro lugar, o processo pode utilizar amostras histológicas existentes, potencialmente reduzindo o número de experimentos necessários para determinar diferenças significativas. Em segundo lugar, neste estudo, menos animais foram necessários para quantificação de carga fúngica GMS alcançar diferenças significativas em comparação com o qPCR de DNA fúngico (Figura 6, Figura 7). Em terceiro lugar, a comparação da carga fúngica em diferentes isolados por qPCR pode ser afetada por diferenças dependentes de isolar em ribosomal DNA cópia número15. Em contraste, quantificação de GMS não é afetada pelo número de cópia, como carga fúngica é determinada pelos níveis relativos de crescimento fúngico de pulmão. Assim, o uso da quantificação de GMS para carga fúngica reduz o uso de animais vertebrados e não exige pre-determinação do número de cópia de rDNA. Finalmente, além de modificar a morfologia de fungosa, caspofungina terapia aumenta a fragmentação de fungosa e assim artificialmente pode aumentar a carga fúngica quando medido pelo isolamento das unidades formadora de colônia de pulmão homogenates12,16 ,17. Assim, a quantificação de GMS da carga fúngica evita várias limitações inerentes com outros métodos comumente usados.
No entanto, as limitações de quantificação de GMS e/ou deste estudo são importantes notar. Em primeiro lugar, os autores assumiram uma distribuição comparável de crescimento hifal em todo os pulmões de cada grupo experimental e assim utilizados quantificação do representante 4 10 x campos objetivos como uma medida representativa para a carga fúngica no pulmão inteiro (Figura 6B). É possível que em alguns casos a distribuição relativa, tamanho e densidade dos focos hifas seriam suficientemente diferentes para que a carga fúngica apareceria diferente com este método e o equivalente pelo método de qPCR. No entanto, nossos resultados adicionais com quantificação de seção de pulmão inteiro usando os 4 campos de objetiva X mostraram semelhantes, embora menos diferenças estatisticamente significativas, entre os grupos (Figura 6). O erro padrão desta quantificação foi aumentado com esta estratégia, provavelmente devido à diminuição da resolução das hifas com o 4 X objetivo e maior experiência em campos de qualidade inferior. Portanto, uma quantificação representativa dos campos menos no maior ampliação é preferencial. Em segundo lugar, utilizou-se apenas uma seção central, única para cada amostra. É possível, com base nos fungos isolados ou cepas de ratos usados, que alguns estudos podem resultar em uma distribuição desigual do crescimento hifal. Nesses casos, as seções adicionais ao longo de cada bloco de parafina devem ser quantificadas para obter um fardo mais representativo. Em terceiro lugar, nas experiências que induzem a produção substancial de mucins (ou seja, crescimento fúngico de quantificação das vias respiratórias em broncopulmonar alérgica (ABPA) de aspergilose18 ou fibrose cística (CF)18), a reatividade de GMS com rico em polissacarídeos mucins19 poderia específico GMS + resultados e assim distorcer algumas amostras em favor de maior carga fúngica. Uma vez que apenas o modelo intermitente do i foi usado neste estudo, é possível que o uso de outros modelos competentes ou supressão imunes poderia resulta em resultados menos comparáveis. Apesar destas advertências, quantificação de GMS fornece uma técnica comparável para determinar a carga fúngica, e seu uso continuado em estudos adicionais mais pode validar a utilidade desse método como consistente, confiável e econômica.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este estudo foi suportado em parte por uma Indiana universidade escola de medicina pesquisa Enhancement Grant e pelo NIAID-NIH 1R03AI122127-01. N.A. foi parcialmente apoiado durante este período por um carreiras em imunologia Fellowship da associação americana de imunologistas.
Materiais
| Name | Company | Catalog Number | Comments |
| Aspergillus fumigatus 293 Stock Solution | Fungal Genetics Stock Center | FGSC #A1100 | |
| HyPure Cell Culture Grade Water | Thermo Fisher Scientific | SH30529.03 | |
| Malt Extract | MP Biomedicals | 2155315 | White Powder |
| BD BBL Acidicase Dehydrated Culture Media: Peptone | Fisher Scientific | L11843 | |
| Dextrose (D-Glucose) Anhydrous (Granular Powder/Certified ACS) | Fisher Scientific | D16-3 | |
| Fisher BioReagents Agar, Powder / Flakes, Fisher BioReagents | Fisher Scientific | BP1423-500 | |
| Auto Dry Cabinet | Shanghai Hasuc Instrument Manufacture Co.,LTD | HSFC160FD | |
| 1300 Series Class II, Type A2 Biological Safety Cabinet | Thermo Fisher Scientific | 1375 | |
| 0.5 mm Glass Beads | BioSpec Products | 11079105 | |
| 15 ml Conical Tubes | Thermo Fisher Scientific | 339650 | |
| Hemacytometer | Fisher Scientific | # 0267110 | |
| Leica Model DME Microscope | Leica | 13595XXX | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8662-500 ml | |
| 1.5 ml tubes | Fisher Scientific | # 05-408-129 | |
| BD Precisionglide syringe needles, gauge 27, L 1/2 in. | Sigma-Aldrich | Z192384 | |
| Anti-mouse-Ly-6G antibody | BioXCell | BP0075-1 | Clone 1A8 |
| Caspofungin diacetate | Sigma-Aldrich | SML0425 | |
| Isoflurane | Henry Schein Animal Health | 1169567762 | |
| Non-Rebreathing Table Top Veterinary Anesthesia Machine | Supera Anesthesia Innovations | M3000 | |
| Pureline Oxygen Concentrator | Supera Anesthesia Innovations | OC8000 | |
| Slant Board Restraint | Indiana State University Facilities Management | Custom made | |
| Gilson PIPETMAN Classic 200 ml Pipets | Fisher Scientific | F123601G | |
| Pentobarbital Sodium (Fatal-Plus) | Vortech Pharmaceuticals | 0298-9373-68 | |
| General-Purpose Broad-Tipped Forceps | Fisher Scientific | 10-300 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | |
| Fisherbrand General-Purpose Curved Forceps | Fisher Scientific | 10-275 | |
| Ethyl Alcohol-200 Proof | PHARMCO-AAPER | 111000200 | |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-63 | |
| BD Precisionglide syringe needles, gauge 25, L 1 in. | Fisher Scientific | Z192406 | |
| All-Plastic Norm-Ject Syringes | Fisher Scientific | 14-817-30 | |
| IV CATH ANGIOCATH 22GX1GIN 50B | Fisher Scientific | NC9742754 | |
| Formalin Solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | |
| 50 ml Conical Tubes | Thermo Fisher Scientific | 339652 | |
| Thermo Scientific Shandon Embedding Cassettes II in Tube Packs | Fisher Scientific | B1000729 | |
| Fisherfinest Histoplast Paraffin Wax | Fisher Scientific | 22-900-700 | |
| Disposable Base Molds | Fisher Scientific | 22-363-554 | |
| Reichert Jung Histocut 820 Microtome | Labequip.com | 31930 | |
| Water Bath | Precision Scientific | 66630-23 | |
| CO2 Incubator | Fisher Scientific | 116875H | |
| Silver Stain (Modified GMS) Kit | Sigma-Aldrich | HT100A-1KT | |
| Fast Green FCF | Fisher Scientific | AC410530250 | |
| Frosted Microscope Slides | Fisher Scientific | 12-550-343 | |
| Fisherfinest Superslip Cover Glass | Fisher Scientific | 12-545-89 | |
| Cytoseal XYL | Fisher Scientific | 22-050-262 | |
| Olympus Provis AX70 Microscope | Olympus | OLYMPUS-AX70 | |
| U-PHOTO Universal Photo System | Olympus | OLYMPUS-U-PHOTO | |
| U-MCB-2 MULTI CONTROL BOX | Olympus | OLYMPUS-U-MCB-2 | |
| U-PS POWER SUPPLY UNIT | Olympus | OLYMPUS-U-PS | |
| FreeZone 1 Liter Benchtop Freeze Dry System | LABCONCO | 7740020 | |
| Maxima C Plus Vacuum Pump | Fisher Scientific | 01-257-80 | Displacement- 6.1 cfm |
| 1-Butanol | Fisher Scientific | A383-4 | |
| AMRESCO PHENOL-CHLORFORM-OSOAMYL 100ML DFS | Fisher Scientific | NC9573988 | |
| Free-Standing Microcentrifuge Tubes with Screw Caps | Fisher Scientific | # 02-682-557 | |
| Mini-Beadbeater-24 | BioSpec Products | 112011 | |
| BioSpec ProductsSupplier Diversity Partner 2.3 MM ZIRCONIA BEADS | Fisher Scientific | NC0451999 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-1 | |
| Hydrochloric Acid, Certified ACS Plus | Fisher Scientific | A144S | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Sodium Dodecyl Sulfate (SDS), White Powder, Electrophoresis | Fisher Scientific | BP166 | |
| Chloroform/isoamyl alcohol 24:1 | Fisher Scientific | AC327155000 | |
| Biotek Epoch Microplate Spectrophotometer | Fisher Scientific | 11-120-570 | |
| Thermo Scientific™ ABsolute Blue qPCR Mixes | Fisher Scientific | AB4137A | |
| Hybridization Probe, 5′-FAM-AGCCAGCGGCCCGCAAATG-TAMRA-3′ | Integrated DNA Technologies | N/A | |
| Sense Amplification Primer, 5′-GGCCCTTAAATAGCCCGGT-3′ | Integrated DNA Technologies | N/A | |
| Antisense Amplification Primer, 5′-TGAGCCGATAGTCCCCCTAA-3′ | Integrated DNA Technologies | N/A | |
| Applied Biosystems™ MicroAmp™ Optical 8-Tube Strip, 0.2mL | Fisher Scientific | 43-165-67 | |
| Thermo Scientific Domed and Flat PCR Cap Strips | Fisher Scientific | AB-0386 | |
| Mx3005P QPCR System, 110 Volt | Agilent | 401443 | Stratagene is now owned by Agilent |
| BALB/c mice | The Jackson Laboratory | 000651 | |
| C57BL/6 (B6) mice | The Jackson Laboratory | 000664 | |
| Eosinophil-deficient (ΔdblGATA, BALB/c background) mice | The Jackson Laboratory | 005653 | |
| γδ T cell-deficient (TCRδ-/-, B6 background) mice | The Jackson Laboratory | 002120 | |
| ImageJ Software | National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| Spot Advanced Software | Spot Imaging | SPOT53A | http://www.spotimaging.com/software/spot-advanced/ |
| GraphPad Prism 6 | GraphPad Software | N/A | https://www.graphpad.com/scientific-software/prism/ |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-62 | |
| Step 4.5 | http://www.bdbiosciences.com/sg/resources/protocols/paraffin_sections.jsp ; http://www.jove.com/science-education/5039 ; http://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/General_Information/1/ht100.pdf |
Referências
- Hohl, T. M., Feldmesser, M. Aspergillus fumigatus: principles of pathogenesis and host defense. Eukaryot Cell. 6 (11), 1953-1963 (2007).
- Kwon-Chung, K. J., Sugui, J. A. Aspergillus fumigatus--what makes the species a ubiquitous human fungal pathogen?. PLoS Pathog. 9 (12), e1003743 (2013).
- Ostrosky-Zeichner, L., Casadevall, A., Galgiani, J. N., Odds, F. C., Rex, J. H. An insight into the antifungal pipeline: selected new molecules and beyond. Nat Rev Drug Discov. 9 (9), 719-727 (2010).
- Desoubeaux, G., Cray, C. Rodent Models of Invasive Aspergillosis due to Aspergillus fumigatus: Still a Long Path toward Standardization. Front Microbiol. 8, 841 (2017).
- Hohl, T. M. Overview of vertebrate animal models of fungal infection. J Immunol Methods. 410, 100-112 (2014).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Patterson, T. F. The future of animal models of invasive aspergillosis. Med Mycol. 43 Suppl 1, S115-S119 (2005).
- Amarsaikhan, N., et al. Caspofungin Increases Fungal Chitin and Eosinophil and gammadelta T Cell-Dependent Pathology in Invasive Aspergillosis. J Immunol. 199 (2), 624-632 (2017).
- Templeton, S. P., Buskirk, A. D., Law, B., Green, B. J., Beezhold, D. H. Role of germination in murine airway CD8+ T-cell responses to Aspergillus conidia. PLoS One. 6 (4), e18777 (2011).
- Brunel, S. F., et al. Live Imaging of Antifungal Activity by Human Primary Neutrophils and Monocytes in Response to A. fumigatus. J Vis Exp. (122), (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Bowman, J. C., et al. Quantitative PCR assay to measure Aspergillus fumigatus burden in a murine model of disseminated aspergillosis: demonstration of efficacy of caspofungin acetate. Antimicrob Agents Chemother. 45 (12), 3474-3481 (2001).
- Li, H., et al. The small GTPase RacA mediates intracellular reactive oxygen species production, polarized growth, and virulence in the human fungal pathogen Aspergillus fumigatus. Eukaryot Cell. 10 (2), 174-186 (2011).
- Sucher, A. J., Chahine, E. B., Balcer, H. E. Echinocandins: the newest class of antifungals. Ann Pharmacother. 43 (10), 1647-1657 (2009).
- Herrera, M. L., Vallor, A. C., Gelfond, J. A., Patterson, T. F., Wickes, B. L. Strain-dependent variation in 18S ribosomal DNA Copy numbers in Aspergillus fumigatus. J Clin Microbiol. 47 (5), 1325-1332 (2009).
- Kirkpatrick, W. R., Perea, S., Coco, B. J., Patterson, T. F. Efficacy of caspofungin alone and in combination with voriconazole in a Guinea pig model of invasive aspergillosis. Antimicrob Agents Chemother. 46 (8), 2564-2568 (2002).
- Petraitiene, R., et al. Antifungal efficacy of caspofungin (MK-0991) in experimental pulmonary aspergillosis in persistently neutropenic rabbits: pharmacokinetics, drug disposition, and relationship to galactomannan antigenemia. Antimicrob Agents Chemother. 46 (1), 12-23 (2002).
- Cowley, A. C., Thornton, D. J., Denning, D. W., Horsley, A. Aspergillosis and the role of mucins in cystic fibrosis. Pediatr Pulmonol. 52 (4), 548-555 (2017).
- Taylor, M. J., et al. Detection of fungal organisms in eosinophilic mucin using a fluorescein-labeled chitin-specific binding protein. Otolaryngol Head Neck Surg. 127 (5), 377-383 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados