É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Laboratório de criação de moscas estáveis e outros Muscoid Diptera
Neste Artigo
Resumo
Um procedimento para a criação de moscas estáveis (Stomoxys calcitrans) é apresentado. O procedimento usa materiais localmente disponíveis para suprimentos, equipamentos e componentes de dieta.
Resumo
Estável de moscas, Stomoxys calcitrans, são pragas sérias de gado, seres humanos, animais de companhia e animais selvagens em todo o mundo. Durante os últimos 20 + anos, mudanças nas práticas agronômicas resultaram em graves surtos de moscas estáveis em vários países. Estes focos interrompeu a produção animal e recreação humana resultando em demandas públicas para aumentar os esforços de pesquisa e de gestão para esta praga. É apresentado um procedimento simples e de baixo custo para a criação de moscas estáveis para estudos de laboratório. O procedimento utiliza suprimentos, equipamentos e componentes da dieta disponíveis localmente. O procedimento pode ser adaptado para a criação de outras moscas de muscoid incluindo a mosca doméstica (Musca domestica), mosca do chifre (Haematobia irritans) e mosca do rosto (Musca autumnalis). O procedimento produz pupários mosca estável, com média de 12,5 mg e ~ 35% ovo para a sobrevivência de adulto. Cerca de 3000 moscas são produzidas em cada panela.
Introdução
Estável de moscas, Stomoxys calcitrans (L.), são hematófagos moscas cujas mordidas dolorosas interrompem o comportamento de pastoreio de gado, causam dor e sofrimento para animais de companhia e interromper atividades recreativas humanas em todo o mundo. Imaturas estáveis moscas desenvolvem-se em fermentação vegetativa passa, muitas vezes contaminada com resíduos animais. Culturas e práticas agronômicas mudanças produziram graves surtos de moscas estáveis em resíduos de culturas, legumes em Austrália1, cana-de-açúcar no Brasil2e abacaxi em Costa Rica3. Embora apenas 14 estáveis moscas por animal são consideradas o limite económico4, foram feitas observações de mais de 2.000 moscas por animal durante recentes surtos5. Esses níveis de infestação reduzem a produtividade de anfitrião para perto de zero e podem causar mortalidade6. Como resultado de surtos associados agronomicamente, moscas estáveis recebendo renovado interesse e demanda por colônias de laboratório tem aumentado dramaticamente.
Quanto a todos os insetos holometamorphic, moscas estáveis obter todos os nutrientes necessários para o crescimento durante o estágio larval ou imaturo. Portanto, um importante componente de um sistema de criação é a dieta larval ou substrato. Foram observadas larvas de mosca estáveis desenvolvimento em uma ampla gama de substratos no campo7 e eles são dependentes da comunidade microbiana do substrato8,9. Substratos larvas naturais são compostos principalmente de decomposição ou fermentação vegetativas materiais frequentemente contaminados com resíduos nitrogenados.
Para a criação de laboratório, substratos larvas moscas estáveis são geralmente compostos por um material vegetativo e uma fonte de nitrogênio adicionado. Vários materiais foram usados para dietas larvas moscas estáveis. As dietas larvas primeiras imitaram substratos naturais e incluíam da fermentação, palha de aveia e de cavalo ou vaca estrume10,11. Fontes de carboidratos incluem trigo farelo12,13,14, alfafa refeição12,13,14 e uma formulação comercial desenvolvido por especialidades químicas Fabricantes Association (CSMA, 33% de farelo de trigo, farinha de alfafa de 27%, levedura de cerveja 40% grânulos)13,14,15,16. Fontes de nitrogênio incluem levedura suspensão12, farinha de peixe e de bicarbonato de amónio17. Volume de materiais inertes são frequentemente incluídos nas dietas, incluindo aveia cascos12, bagaço13, vermiculita16, lascas de madeira13,18 e peletizadas hulls do amendoim14.
Um objetivo principal do laboratório de criação é de produzir um produto que é como fisiologicamente semelhante ao "tipo selvagem" quanto possível, a fim de que experimentos de laboratório produzirá resultados refletindo de populações do campo. Isto requer que na criação e seleção ser minimizados para manter genético diversidade e recursos nutricionais ser comparáveis no campo. Objetivos secundários são para minimizar o trabalho e despesas. Um componente importante de minimizar despesas é o uso de componentes de dieta disponíveis localmente. A mosca de estábulo criação sistema apresentado foi desenvolvida para atender a estes objectivos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. ovo coleção (Figura 1)
- Preparar a incitar a taça, coloque uma das extremidades do pano ~ 500 mL copo cheio de água morna (~ 40 ° C). Sobrepõem-se os lados do copo e fixe com um elástico. Dobre a ponta solta do pano volta por cima da taça.
- Lugar Copa a incitar na gaiola de moscas de 8 – 10 dias de idade para as mulheres Gravid de ~ 2 h. estável voa será ovipositar no pano.
- Remova a incitar a taça de ovos gaiola e enxaguar fora o pano egging em uma panela pequena com lavagem de garrafa.
2. prepare Pan criação Larval
-
Preparar o meio (quantidades para 1 pan de criação)
- Combinar o farelo de trigo (500 g), aparas de madeira (200 g) e farinha de peixe (115 g) em panela de prato plástico 10L e misture bem.
- Adicionar o bicarbonato de amónio (50 g) de água (~ 25 ° C, 1600 mL) e misture até dissolver.
- Adicione a solução de água de ingredientes secos e misture para não garantir nenhum material unwetted. Nível médio em panela mas não comprimir.
-
Adicione os ovos de mosca estáveis
- Faça um sulco raso em média o comprimento da bandeja.
- Depósito de 1 mL de ovos de mosca estáveis (~ 8.000 ovos) no sulco com pipeta de ovo (Figura 2).
Nota: Pipeta de ovo feita por um corte de uma pipeta graduada plástica no ponto desejado, inserir 100 mesh tela e colagem pipeta junta novamente. - Cubra os ovos com uma fina camada do meio para evitar a dessecação.
- Cubra a panela com fronha, fechar com uma faixa de borracha e etiqueta. Colocar panelas no quarto larval (23 ± 2 ° C, 30 – 50% RH e 12:12 [L:D] h fotoperíodo).
Nota: Desenvolvimento Larval leva de 10 a 14 dias do tempo de oviposição.
3. processamento pupa, as larvas se mover para a borda do meio 7 – 9 dias após a oviposição e Pupariate por dias 13 ou 14
- Casulos de colher, localizados principalmente em torno das bordas da panela sob a crosta que se forma na superfície do meio, para fora e colocado em uma panela limpa.
- Encha a panela, com casulos, ½ a ¾ cheio de água. Separar grupos de casulos e médio. Componentes de farelo e proteína de trigo do meio de afundam-se enquanto pupários > 1 dia de idade flutuador19.
- Remova materiais flutuantes, casulos e alguns componentes médios com uma peneira e lavagem através de uma série de peneiras (5 #, 7 #, #12, #20) para remover o restante médio. A peneira #12 recolhe o casulo e a #20 evita que resíduos sólidos entrando pelo ralo. Casulos de lavagem entre peneiras com um pulverizador de pia.
- Casulos de enxágue, em peneira #12, em uma panela limpa. Encha a panela com ½ cheio de água. Despeje pupários flutuante em um coador e deixe escorrer o excesso de água.
- Transferência drenado pupários para tela de secagem com o ventilador e deixar até secar (Figura 3).
4. pupa prateleira, um método alternativo para a coleta de pupários é com uma prateleira Pupal18
Nota: A prateleira é feita de um pedaço de plástico corte da extremidade de uma panela de prato de 10 L (10,2 cm de altura x 10,2 cm de largura x 31,9 cm de comprimento).
- Prepare o suporte conforme descrito no ponto 2.1. Cone médio em panela de ~2.5 cm no fundo uma ponta de ~7.5 cm profundo no outro.
-
Coloque a prateleira no meio na parte rasa da criação pan e fita para evitar larvas se rastejando ao lado da prateleira (Figura 4).
- Saturar a esponja (~14.5 x 9.0 x 4.5 cm3, celulose regenerada) e cobrir com um pano embebido de água (30.5 x 42 cm2, algodão) e lugar na prateleira de cerca de meia polegada do meio.
-
Adicione os ovos, conforme descrito no ponto 2.2 e proceder como anteriormente.
- Verifique panelas diariamente para garantir que a esponja permaneça úmida.
- Casulos de enxaguamento da plataforma, esponja e pano em um prato limpo panela e despeje no coador, 14 dias após a oviposição.
5. controle de qualidade
- Pese todos os casulos produzidos no pan (peso total)..
- Isolar 100 casulos, pesar e colocado em uma placa de Petri de 9 cm.
- Contagem e sexo adultos ~ 5 a 8 dias mais tarde para determinar a taxa de surgimento e proporção sexual. Loja de placas de Petri com adultos surgiu em um freezer para a contagem em uma data posterior, se necessário. Moscas são sexadas pela forma de seus olhos e a largura da placa fronto-orbital20 ou genitália em pequeno aumento.
- Peso total de registro, peso de 100 casulos e número de surgiu adultos machos e fêmeas.
6. preparação de sangue
- Colete o sangue fresco de bovino de um matadouro local em baldes de 19 L contendo 70 g de citrato de sódio tribásico dihidrato em 500 mL de água. Mexa vigorosamente por 5-10 min de sangue e voltou para o laboratório.
- Sangue de tensão através de uma peneira para remover os coágulos e particionado em recipientes de 2 L, etiqueta com a data de colheita e armazenamento em um freezer (-20 ° C).
- Precisava de 2 dias antes do recipiente retire do congelador e coloque na geladeira. Sangue pode ser usado por ~ 2 semanas uma vez descongelados e armazenados no freezer por até 1 ano.
7. adulta manutenção
- Prepare as gaiolas, fundo de gaiola linha com papel pardo para facilitar a limpeza.
- Coloque 50 g de pupas de mosca secas estáveis (~ 3.500) em cada gaiola. Eclose adultos algumas horas a alguns dias após o processamento pupal.
- Lugar um sangue fresco embebido guardanapo feminino em cima de cada gaiola para alimentação. Começam a alimentar-se dentro de 24 h de adulto eclosão e repetir diariamente, até um dia antes da oviposição (9-10 dias após a emergência).
- Após a oviposição (secção 1), coloque a gaiola no congelador para 4 – 8 h e depois limpar, removendo o papel, enxaguando Ivo dos lados e andar com água quente e esfregar todas as superfícies com detergente e cloro. Lave as gaiolas com água quente e deixe para secar.
Access restricted. Please log in or start a trial to view this content.
Resultados
As larvas pupariate 10 a 14 dias e adultos emergem 14 – 16 dias após a oviposição. Tempo de geração, ovo a ovo, é ~ 24 dias. Dados de criação para maio de 2013 para de 2017 de Janeiro com três diferentes agentes de volume e duas colónias são apresentados na Figura 5. Cottonwood deu o melhor rendimento, 3867 ±1442 (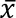 ± desvio padrão) pupas pesando 12,5 mg ±1.6 com 74 ±19% ec...
± desvio padrão) pupas pesando 12,5 mg ±1.6 com 74 ±19% ec...
Access restricted. Please log in or start a trial to view this content.
Discussão
Estável de moscas encontram-se desenvolvendo em uma ampla variedade de substratos na natureza e podem ser criadas em muitos tipos de mídia no laboratório. Nós usamos aparas de madeira e vermiculita como agentes de volume. Vermiculita funcionou bem, mas fez separação pupários de criação meio difícil e era caro (~$0.60/pan). Possivelmente por causa do rigor adicionado de separar pupários do meio, eclosão também foi menor com vermiculita, 57% vs. 75% de aparas de madeira. Aparas de Cottonwood foram comparáveis...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer a Anthony Weinhold e os inúmeros estudantes que trabalharam connosco ao longo dos anos para suporte técnico, bem como sugestões para melhorar nosso procedimentos de criação de inseto.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Diamalt | Premier Malt Products, Inc., Saddle Brook, NJ | 2540 | |
| CSMA Fly media | Purina Animal Nutrition, Arden Hills, MN | 5S6Z | |
| Thin Maxi Pad | The Tranzonic Co., Cleveland, OH, USA | 5001M | |
| Calf Manna | MannaPro, Chesterfield, MO, USA | Manna Pro | |
| Ammonium Bicarbonate | Spectrum Chemical Manufacturing Corp, Gardena, CA | A1125 | |
| Wheat bran, Coarse | Siemer Milling Company, Teutopolis, IL | ||
| Wood shavings | Tractor Supply Company, Brentwood, TN | 502770699 | |
| Fishmeal | Consumer Supply Distributing, North Sioux City, SD | F1550 | |
| Adult cages | All Aluminum Window Company, Lincoln, Ne | Custom | 45 × 45 × 45 cm, 18 × 16 mesh aluminum screen, stockinette access |
| 9 × 28 cm black cotton cloth | Robert Kaufman Fabrics, Los Angeles, CA | K040-114 | Egging cloth |
| 10 L plastic dish pans | Rubbermaid, Saratoga Springs, NY | FG2951ARWHT | Larval pans |
| Stockinette, Cotton, 12 inch x 25 yard roll | Tex-Care Medical Company, Burlington, NC | 91311-225 |
Referências
- Cook, D. F., Dadour, I. R., Keals, N. J. Stable fly, house fly (Diptera: Muscidae), and other nuisance fly development in poultry litter associated with horticultural crop production. J. Econ. Entomol. 92 (6), 1352-1357 (1999).
- Dominghetti, T. F., de Barros, A. T., Soares, C. O., Cançado, P. H. Stomoxys calcitrans (Diptera: Muscidae) outbreaks: current situation and future outlook with emphasis on Brazil. Rev. Bras. Parasitol. Vet. 24 (4), 387-395 (2015).
- Solórzano, J. -A., Guilles, J., Bravo, O., Vargas, C., Gomez-Bonilla, Y., Bingham, G., Taylor, D. B. Biology and trapping of stable flies (Diptera: Muscidae) developing in pineapple residues (Ananas comosus) in Costa Rica. J. Insect Sci. 15 (1), 145(2015).
- Berry, I. L., Stage, D. A., Campbell, J. B. Populations and economic impacts of stable flies on cattle. Trans. Am. Soc. Agric. Eng. 26, 873-877 (1983).
- Taylor, D. B. Area-wide management of stable flies. Area-wide management of insect pests. Vreysen, J., Hendrichs, R., Cardoso Pereira, R. , in press (2017).
- Bishopp, F. C. The stable fly (Stomoxys calcitrans L.), an important live stock pest. J.Econ. Entomol. 6 (1), 112-126 (1913).
- Hogsette, J. A., Ruff, J. P., Jones, C. J. Stable fly biology and control in northwest Florida. J. Agric. Entomol. 4 (1), 1-11 (1987).
- Lysyk, T., Kalischuk-Tymensen, L., Selinger, L., Lancaster, R., Wever, L., Cheng, K. Rearing stable fly larvae (Diptera: Muscidae) on an egg yolk medium. J. Med. Entomol. 38, 382-388 (1999).
- Romero, A., Broce, A., Zurek, L. Role of bacteria in the oviposition behaviour and larval development of stable flies. Med. Vet. Entomol. 20, 115-121 (2006).
- Glaser, R. W. Rearing flies for experimental purposes with biological notes. J. Econ. Entomol. 17 (4), 486-496 (1924).
- Melvin, R. Physiological studies on the effect of flies and fly sprays on cattle. J. Econ. Entomol. 25 (6), 1151-1164 (1932).
- Doty, A. E. Convenient method of rearing the stable fly. J. Econ. Entomol. 30 (2), 367-369 (1937).
- Bridges, A. C., Spates, G. E. Larval medium for the stable fly Stomoxys calcitrans (L.). Southwest. Entomol. 8 (1), 6-10 (1983).
- Hogsette, J. A. New diets for production of house flies and stable flies (Diptera: Muscidae) in the laboratory. J. Econ. Entomol. 85 (6), 2291-2294 (1992).
- McGregor, W. S., Dreiss, J. M. Rearing stable flies in the laboratory. J. Econ. Entomol. 48 (3), 327-328 (1955).
- Goodhue, L. D., Cantrel, K. E. The use of vermiculite in medium for stable fly larvae. J. Econ. Entomol. 51 (2), 250(1958).
- Friesen, K., Berkebile, D. R., Zhu, J. J., Taylor, D. B. Augmenting laboratory rearing of stable fly (Diptera: Muscidae) larvae with ammoniacal salts. J. Insect Sci. 17 (1), 1-6 (2017).
- Berkebile, D. R., Weinhold, A. P., Taylor, D. B. A new method for collecting clean stable fly (Diptera:Muscidae) pupae of known age. Southwest. Entomol. 34 (4), 469-476 (2009).
- Champlain, R. A., Fisk, F. W., Dowdy, A. C. Some improvements in rearing stable flies. J. Econ. Entomol. 47 (5), 940-941 (1954).
- Zumpt, F. The stomoxyine biting flies of the world. , Gustav Fischer Verlag. Stuttgart. (1973).
- Wienhold, B. J., Taylor, D. B. Substrate properties of stable fly (Diptera: Muscidae) developmental sites associated with round bale hay feeding sites in eastern Nebraska. Environ. Entomol. 41 (2), 213-221 (2012).
- Friesen, K., Berkebile, D. R., Wienhold, B. J., Durso, L., Zhu, J., Taylor, D. B. Environmental parameters associated with stable fly (Diptera: Muscidae) development at hay feeding sites. Environ. Entomol. 45 (3), 570-576 (2016).
- Albuquerque, T. A., Zurek, L. Temporal changes in the bacterial community of animal feces and their correlation with stable fly oviposition, larval development, and adult fitness. Front. Microbiol. 5 (590), 1-9 (2014).
- Bailey, D. L., Whitfield, T. L., LaBrecque, G. C. Laboratory biology and techniques for mass producing the stable fly, Stomoxys calcitrans (L.) (Diptera: Muscidae). J. Med. Entomol. 12 (2), 189-193 (1975).
- Smith, J. P., Hall, R. D., Thomas, G. D. Field studies on mortality of the immature stages of the stable fly (Diptera: Muscidae). Environ. Entomol. 14 (6), 881-890 (1985).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados