È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Laboratorio di allevamento di mosche stabili e altri ditteri muscoidi
In questo articolo
Riepilogo
Una procedura per l'allevamento di mosche stabili (Stomoxys calcitrans) è presentata. La procedura utilizza materiali localmente disponibili per dieta componenti, attrezzature e forniture.
Abstract
Mosche stabili, Stomoxys calcitrans, sono parassiti gravi di bestiame, gli esseri umani, animali da compagnia e animali selvatici in tutto il mondo. Durante gli ultimi 20 + anni, cambiamenti nelle pratiche agronomiche ha provocato gravi epidemie di mosche stabili in diversi paesi. Questi focolai perturbato produzione zootecnica e ricreazione umana conseguente richieste pubbliche per aumentare gli sforzi di ricerca e gestione per questo parassita. Una procedura semplice e poco costoso per l'allevamento di mosche stabili per le ricerche di laboratorio è presentata. La procedura utilizza componenti localmente disponibili dieta, attrezzature e forniture. La procedura può essere adattata per l'allevamento di altre mosche muscoidi inclusi viso volare (Musca autumnalis), corno fly (da schistosoma haematobium irritans) e Mosca domestica (Musca domestica). La procedura produce puparia Vola stabile con una media di 12,5 mg e ~ 35% uovo alla sopravvivenza adulto. Circa 3000 mosche sono prodotte in ogni vaschetta.
Introduzione
Mosche stabili, Stomoxys calcitrans (L.), sono ematofagi mosche cui punture dolorose può interferire il comportamento al pascolo del bestiame, causano dolore e sofferenza per animali da compagnia e interferire con attività ricreative umane in tutto il mondo. Mosche stabili immaturi sviluppano nella fermentazione materia vegetativa, spesso contaminato da rifiuti di origine animale. Colture e mutevoli pratiche agronomiche hanno prodotto gravi episodi di mosche stabili in presenza di residui colturali, verdure in Australia1, canna da zucchero in Brasile2e l'ananas in Costa Rica3. Anche se solo 14 mosche stabili per animale sono considerati la soglia economica4, sono state fatte osservazioni di più di 2.000 mosche per animale durante recenti focolai5. Tali livelli di infestazione riducono la produttività di host per vicino allo zero e possono causare mortalità6. A seguito di focolai agronomico associati, mosche stabili stanno ricevendo rinnovato interesse e domanda per colonie di laboratorio è aumentato drammaticamente.
Per quanto riguarda tutti gli insetti holometamorphic, mosche stabili ottenere tutti i nutrienti necessari per la crescita durante la fase larvale o immatura. Pertanto, una componente importante di un sistema di allevamento è la dieta larvale o substrato. Le larve del Mosca stabile sono state osservate lo sviluppo in un'ampia gamma di substrati in campo7 e sono dipendente della comunità microbica del substrato8,9. Substrati naturali larvali sono principalmente composte di decomposizione o vegetativi materiali spesso contaminati con rifiuti azotati di fermentazione.
Per l'allevamento di laboratorio, substrati larvale volare stabile sono di solito composte da un materiale vegetativo e una fonte di azoto aggiunto. Numerosi materiali sono stati usati per le diete larvale volare stabile. Le diete larvale prime ha imitato substrati naturali e incluso di fermentazione paglia di avena e letame di cavallo o mucca10,11. Fonti di carboidrati includono frumento crusca12,13,14, erba medica pasto12,13,14 e una formulazione commerciale sviluppato da specialità chimiche Produttori Association (CSMA, crusca di grano 33%, 27% di farina di erba medica, lievito di birra 40% granuli)13,14,15,16. Fonti di azoto includono lievito sospensione12, farina di pesce e di bicarbonato di ammonio17. Materiali inerti volumizzanti sono spesso inclusi nelle diete tra cui avena scafi12, bagassa13, vermiculite16, trucioli di legno13,18 e gusci di arachidi pellettato14.
Un obiettivo primario di laboratorio allevamento è quello di produrre un prodotto che è come fisiologicamente simile a "wild type" possibile in modo che gli esperimenti del laboratorio produrrà risultati riflettono quelle delle popolazioni di campo. Ciò richiede che essere minimizzato in allevamento e selezione per mantenere genetica diversità e risorse nutritive essere paragonabili a quelle nel campo. Gli obiettivi secondari sono per ridurre al minimo il lavoro e le spese. Una componente importante di minimizzare le spese è l'utilizzo di componenti di alimentazione disponibile localmente. Al volo stabile del sistema presentato di allevamento è stato sviluppato per raggiungere questi obiettivi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. uovo insieme (Figura 1)
- Preparare tazza incita, inserire un'estremità del panno in Becher ~ 500 mL riempita con acqua calda (~ 40 ° C). Si sovrappongono i lati della tazza e fissare con un elastico. Piegare l'estremità libera del panno indietro sopra la parte superiore della Coppa.
- Posto Coppa incita in gabbia di mosche di 8 – 10 giorni vecchio per femmina Gravid h. ~ 2 stabile vola sarà oviposit sul panno.
- Allontana da uova in gabbia e risciacquare fuori il panno egging egging calice in un pentolino con bottiglia di lavaggio a pressione.
2. preparare Pan allevamento larvale
-
Preparare il supporto (quantità per 1 vaschetta di allevamento)
- Unire la crusca di frumento (500 g), trucioli di legno (200 g) e farina di pesce (115g) in vaschetta di plastica piatto di 10 L e mescolare bene.
- Aggiungere bicarbonato di ammonio (50 g) di acqua (~ 25 ° C, 1600 mL) e mescolare fino a completa dissoluzione.
- Aggiungere acqua soluzione gli ingredienti secchi e mescolare affinché nessun materiale unwetted. Livello medio in padella, ma non comprimere.
-
Aggiungere le uova volare stabile
- Fare un solco poco profondo in mezzo la lunghezza della padella.
- Depositare 1 mL di stabile volare uova (~ 8.000 uova) in solco con pipetta di uovo (Figura 2).
Nota: Pipetta uovo fatta tagliando una pipetta graduata in plastica al punto desiderato, inserendo 100 mesh schermo e incollaggio pipetta tornare insieme. - Coprire le uova con un sottile strato di mezzo per prevenire il disseccamento.
- Coprire la pentola con federa, chiudere con un elastico e l'etichetta. Mettere pentole in camera larvale (23 ± 2 ° C, 30 – 50% RH e 12:12 [L:D] h fotoperiodo).
Nota: Lo sviluppo larvale dura 10 – 14 giorni dal momento della deposizione delle uova.
3. pupal elaborazione, larve spostarsi sul margine del mezzo 7 – 9 giorni dopo la deposizione delle uova e Pupariate di giorni 13 o 14
- Paletta puparia, principalmente situato intorno ai bordi della vaschetta sotto la crosta che si forma sulla superficie del mezzo, fuori e messo in una pentola pulita.
- Riempire la pentola, con puparia, ½ a ¾ piena d'acqua. Rompere con ciuffi di puparia e medie. Componenti di crusca e proteine di frumento del mezzo lavandino mentre puparia > 1 giorno vecchio galleggiante19.
- Rimuovere materiale galleggiante, puparia e alcuni componenti medi con un colino e lavare attraverso una serie di setacci (n. 5, #7, #12, #20) per rimuovere il mezzo rimanente. Il setaccio #12 raccoglie il puparia e il #20 mantiene rifiuti solidi di entrare lo scarico. Lavare puparia tra setacci con uno spruzzatore di lavandino.
- Risciacquare il setaccio #12, puparia, in una pentola pulita. Riempire la pentola a ½ pieno di acqua. Versare puparia galleggiante in un colino e lasciare drenare l'acqua in eccesso.
- Trasferimento drenati puparia a schermo di secchezza con ventilatore e lasciare fino a secco (Figura 3).
4. pupal scaffale, un metodo alternativo per la raccolta Puparia è con un ripiano Pupal18
Nota: La mensola fatta da un pezzo di plastica tagliato dalla fine di una padella piatto tipico di 10 L (10,2 cm di altezza x 10,2 cm di larghezza x 31,9 cm di lunghezza).
- Preparare il supporto come descritto al punto 2.1. Cono medio in padella da ~2.5 cm profondo su un'estremità a ~7.5 cm profondo su altro.
-
Inserire ripiano su supporto nella parte bassa di allevamento padella e nastro adesivo per evitare le larve dallo strisciare lungo la mensola (Figura 4).
- Saturare la spugna (~14.5 x 9.0 x 4,5 cm3, cellulosa rigenerata) e avvolgerlo in un panno imbevuto di acqua (30,5 x 42 cm2, cotone) e posto sullo scaffale circa mezzo pollice dal mezzo.
-
Aggiungere le uova, come descritto al punto 2.2 e procedere come prima.
- Verifica padelle ogni giorno per assicurare che la spugna rimanga umida.
- Risciacquo puparia dallo scaffale, spugna e panno in un piatto pulito padella e versare nel colino 14 giorni dopo la deposizione delle uova.
5. controllo di qualità
- Pesare tutti i puparia prodotta in padella (Totale wt.).
- Isolare 100 puparia, pesare e inseriti in una capsula di Petri di 9 cm.
- Conteggio e sesso adulti ~ 5 – 8 giorni più tardi per determinare il tasso di emersione e rapporto del sesso. Conservare capsule di Petri con adulti è emersi in un congelatore per il conteggio in un secondo momento, se necessario. Mosche sono sessuati dalla forma dei loro occhi e larghezza della placca fronto-orbitale20 o genitali sotto ingrandimento basso.
- Peso totale record, peso di 100 puparia e numero di emersi adulti maschi e femmine.
6. preparazione di sangue
- Raccogliere sangue fresco di bovini da un macello locale a secchi 19 L contenenti 70 g di sodio citrato tribasico diidrato in 500 mL di acqua. Mescolare vigorosamente per 5 – 10 min di sangue e restituito al laboratorio.
- Sangue di ceppo attraverso un colino per rimuovere la formazione di coaguli e partizionato in contenitori 2L, etichetta con la data di raccolta e conservare in congelatore (-20 ° C).
- Rimuovere il contenitore dal freezer e posto in frigorifero 2 giorni prima del necessario. Sangue può essere utilizzato per ~ 2 settimane una volta scongelati e conservati nel congelatore per fino a 1 anno.
7. adult Maintenance
- Preparare gabbie, fondo gabbia linea con carta da macellaio per facilitare la pulizia.
- Mettere 50 g di secco pupe volare stabile (~ 3.500) in ogni gabbia. Adulti eclose poche ore a un paio di giorni dopo l'elaborazione pupal.
- Posto un sangue fresco imbevuto femminile tovagliolo sulla cima di ogni gabbia per l'alimentazione. Avviare l'alimentazione entro 24 h dalla eclosion adulto e ripetere ogni giorno fino al giorno prima della deposizione delle uova (9 – 10 giorni dopo la nascita).
- Dopo la deposizione delle uova (sezione 1), posizionare la gabbia in freezer per 4 – 8 h e poi pulire rimuovendo la carta, risciacquo frass dai lati e piano con acqua calda e strofinare tutte le superfici con detersivo e candeggina. Sciacquare le gabbie con acqua calda e lasciare per asciugare.
Access restricted. Please log in or start a trial to view this content.
Risultati
Pupariate 10 – 14 giorni di larve e adulti emergono 14 – 16 giorni dopo la deposizione delle uova. Tempo di generazione, uovo, è ~ 24 giorni. Allevamento dei dati per maggio 2013 al gennaio 2017 con tre diversi agenti volumizzanti e due colonie sono presentati nella Figura 5. Cottonwood ha dato il miglior rendimento, 3867 ±1442 (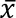 ± deviazione standard) pupe peso 12,5 ± 1,6 mg con 74...
± deviazione standard) pupe peso 12,5 ± 1,6 mg con 74...
Access restricted. Please log in or start a trial to view this content.
Discussione
Mosche stabili possono trovare lo sviluppo in un'ampia varietà di substrati in natura e possono essere allevati in molti tipi di media in laboratorio. Abbiamo usato dei trucioli di legno e vermiculite come agenti volumizzanti. La vermiculite ha funzionato bene, ma fatto puparia separazione da allevamento medio difficile ed era costoso (~$0.60/pan). Forse a causa il rigore aggiunto di separare puparia dal mezzo, eclosion era inoltre più basso con vermiculite, 57% vs 75% per trucioli di legno. Trucioli di Cottonwood eran...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Anthony Weinhold e i numerosi studenti che hanno lavorato con noi nel corso degli anni per il supporto tecnico, nonché suggerimenti per migliorare il nostro insetto procedure di allevamento.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Diamalt | Premier Malt Products, Inc., Saddle Brook, NJ | 2540 | |
| CSMA Fly media | Purina Animal Nutrition, Arden Hills, MN | 5S6Z | |
| Thin Maxi Pad | The Tranzonic Co., Cleveland, OH, USA | 5001M | |
| Calf Manna | MannaPro, Chesterfield, MO, USA | Manna Pro | |
| Ammonium Bicarbonate | Spectrum Chemical Manufacturing Corp, Gardena, CA | A1125 | |
| Wheat bran, Coarse | Siemer Milling Company, Teutopolis, IL | ||
| Wood shavings | Tractor Supply Company, Brentwood, TN | 502770699 | |
| Fishmeal | Consumer Supply Distributing, North Sioux City, SD | F1550 | |
| Adult cages | All Aluminum Window Company, Lincoln, Ne | Custom | 45 × 45 × 45 cm, 18 × 16 mesh aluminum screen, stockinette access |
| 9 × 28 cm black cotton cloth | Robert Kaufman Fabrics, Los Angeles, CA | K040-114 | Egging cloth |
| 10 L plastic dish pans | Rubbermaid, Saratoga Springs, NY | FG2951ARWHT | Larval pans |
| Stockinette, Cotton, 12 inch x 25 yard roll | Tex-Care Medical Company, Burlington, NC | 91311-225 |
Riferimenti
- Cook, D. F., Dadour, I. R., Keals, N. J. Stable fly, house fly (Diptera: Muscidae), and other nuisance fly development in poultry litter associated with horticultural crop production. J. Econ. Entomol. 92 (6), 1352-1357 (1999).
- Dominghetti, T. F., de Barros, A. T., Soares, C. O., Cançado, P. H. Stomoxys calcitrans (Diptera: Muscidae) outbreaks: current situation and future outlook with emphasis on Brazil. Rev. Bras. Parasitol. Vet. 24 (4), 387-395 (2015).
- Solórzano, J. -A., Guilles, J., Bravo, O., Vargas, C., Gomez-Bonilla, Y., Bingham, G., Taylor, D. B. Biology and trapping of stable flies (Diptera: Muscidae) developing in pineapple residues (Ananas comosus) in Costa Rica. J. Insect Sci. 15 (1), 145(2015).
- Berry, I. L., Stage, D. A., Campbell, J. B. Populations and economic impacts of stable flies on cattle. Trans. Am. Soc. Agric. Eng. 26, 873-877 (1983).
- Taylor, D. B. Area-wide management of stable flies. Area-wide management of insect pests. Vreysen, J., Hendrichs, R., Cardoso Pereira, R. , in press (2017).
- Bishopp, F. C. The stable fly (Stomoxys calcitrans L.), an important live stock pest. J.Econ. Entomol. 6 (1), 112-126 (1913).
- Hogsette, J. A., Ruff, J. P., Jones, C. J. Stable fly biology and control in northwest Florida. J. Agric. Entomol. 4 (1), 1-11 (1987).
- Lysyk, T., Kalischuk-Tymensen, L., Selinger, L., Lancaster, R., Wever, L., Cheng, K. Rearing stable fly larvae (Diptera: Muscidae) on an egg yolk medium. J. Med. Entomol. 38, 382-388 (1999).
- Romero, A., Broce, A., Zurek, L. Role of bacteria in the oviposition behaviour and larval development of stable flies. Med. Vet. Entomol. 20, 115-121 (2006).
- Glaser, R. W. Rearing flies for experimental purposes with biological notes. J. Econ. Entomol. 17 (4), 486-496 (1924).
- Melvin, R. Physiological studies on the effect of flies and fly sprays on cattle. J. Econ. Entomol. 25 (6), 1151-1164 (1932).
- Doty, A. E. Convenient method of rearing the stable fly. J. Econ. Entomol. 30 (2), 367-369 (1937).
- Bridges, A. C., Spates, G. E. Larval medium for the stable fly Stomoxys calcitrans (L.). Southwest. Entomol. 8 (1), 6-10 (1983).
- Hogsette, J. A. New diets for production of house flies and stable flies (Diptera: Muscidae) in the laboratory. J. Econ. Entomol. 85 (6), 2291-2294 (1992).
- McGregor, W. S., Dreiss, J. M. Rearing stable flies in the laboratory. J. Econ. Entomol. 48 (3), 327-328 (1955).
- Goodhue, L. D., Cantrel, K. E. The use of vermiculite in medium for stable fly larvae. J. Econ. Entomol. 51 (2), 250(1958).
- Friesen, K., Berkebile, D. R., Zhu, J. J., Taylor, D. B. Augmenting laboratory rearing of stable fly (Diptera: Muscidae) larvae with ammoniacal salts. J. Insect Sci. 17 (1), 1-6 (2017).
- Berkebile, D. R., Weinhold, A. P., Taylor, D. B. A new method for collecting clean stable fly (Diptera:Muscidae) pupae of known age. Southwest. Entomol. 34 (4), 469-476 (2009).
- Champlain, R. A., Fisk, F. W., Dowdy, A. C. Some improvements in rearing stable flies. J. Econ. Entomol. 47 (5), 940-941 (1954).
- Zumpt, F. The stomoxyine biting flies of the world. , Gustav Fischer Verlag. Stuttgart. (1973).
- Wienhold, B. J., Taylor, D. B. Substrate properties of stable fly (Diptera: Muscidae) developmental sites associated with round bale hay feeding sites in eastern Nebraska. Environ. Entomol. 41 (2), 213-221 (2012).
- Friesen, K., Berkebile, D. R., Wienhold, B. J., Durso, L., Zhu, J., Taylor, D. B. Environmental parameters associated with stable fly (Diptera: Muscidae) development at hay feeding sites. Environ. Entomol. 45 (3), 570-576 (2016).
- Albuquerque, T. A., Zurek, L. Temporal changes in the bacterial community of animal feces and their correlation with stable fly oviposition, larval development, and adult fitness. Front. Microbiol. 5 (590), 1-9 (2014).
- Bailey, D. L., Whitfield, T. L., LaBrecque, G. C. Laboratory biology and techniques for mass producing the stable fly, Stomoxys calcitrans (L.) (Diptera: Muscidae). J. Med. Entomol. 12 (2), 189-193 (1975).
- Smith, J. P., Hall, R. D., Thomas, G. D. Field studies on mortality of the immature stages of the stable fly (Diptera: Muscidae). Environ. Entomol. 14 (6), 881-890 (1985).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon