Method Article
A craca Balanus improvisus como modelo Marine - cultivo e expressão gênica
Neste Artigo
Resumo
O barnacle improvisus Balanus (Amphibalanus) é um modelo para o estudo de osmoregulação e anti-incrustantes. No entanto, desova sazonal natural produz um imprevisível suprimento de larvas cyprid. Aqui, um protocolo para o cultivo de todo o ano de b. improvisus é descrito, incluindo a produção de larvas. O uso de cracas cultivadas em estudos de expressão do gene é ilustrado.
Resumo
Cracas são crustáceos marinhos com um adulto séssil e larvas planctônicas, livres. A craca Balanus (Amphibalanus) improvisus é particularmente relevante como um modelo para os estudos dos mecanismos de osmoregulatory por causa de sua extrema tolerância à salinidade baixa. É também amplamente utilizado como um modelo de resolução de biologia, em particular em relação à pesquisa de antifouling. No entanto, desova sazonal natural produz um imprevisível fornecimento de larvas de cyprid para estudos. É descrito um protocolo para o cultivo de todo o ano de b. improvisus desenvolveu-se e uma descrição detalhada de todos os passos na linha de produção (ou seja, o estabelecimento de culturas adultos em painéis, a coleção e a criação de larvas de craca e a administração de alimentos destinados a adultos e larvas). A descrição também fornece orientação sobre resolução de problemas e discute parâmetros críticos (por exemplo, a remoção de contaminação, a produção de alimentos de alta qualidade, os recursos humanos necessários e a importância da água do mar de alta qualidade). Máximo de cada lote do sistema de cultivo produz cerca de 12.000 náuplios e pode entregar quatro lotes em uma semana, então até quase 50.000 larvas por semana pode ser produzido. O método usado para cultura improvisus b. é, provavelmente, em grande medida, também aplicável a outros invertebrados marinhos com free-swimminglarvae. Protocolos são apresentados para a dissecação dos vários tecidos de adultos, bem como a produção de RNA de alta qualidade para estudos de expressão gênica. Também é descritos como cultos adultos e cyprids criados podem ser utilizados em uma ampla gama de projetos experimentais para análise de expressão gênica em relação a fatores externos. O uso de cracas cultivadas na expressão do gene é ilustrado com estudos de possíveis funções osmoregulatory do at+/k+ ATPase e aquaporinas.
Introdução
Cracas são crustáceos marinhos com um adulto séssil e larvas planctônicas, livres. A maioria das 1.200 espécies de cracas habita águas rasas e muitos são frequentemente expostos a baixa salinidade. Pode tolerar uma espécie, o barnacle bay improvisa Balanus (Amphibalanus) (b. improvisus), quase de água doce e Charles Darwin descreveu esta espécie de um pequeno riacho no estuário do Rio de la Plata, no Uruguai1. A salinidade de fazê extrema tolerância faz improvisus b. um modelo particularmente relevante para os estudos dos mecanismos osmoregulatory2,3. Este barnacle prefere condições salobras, mas é capaz de viver em águas com salinidades de cerca de 1,6 psu para tão alta como 40 psu4. É a espécie de craca único encontrada no mar de Báltico salobra. Improvisus b. acredita-se que se originam da costa leste do continente americano, mas hoje é encontrado em todo o mundo devido à dispersão por transporte5. É um grande organismo incrustantes e é comumente encontrada em rochas, molhes e cascos de barcos e é, portanto, de interesse geral para compreender os mecanismos da Bioincrustação sobre construções em águas marinhas e salobras6,7.
Semelhante à maioria dos outras cracas, b. improvisus é hermafrodita com fertilização cruzada; reprodução ocorre através do acasalamento entre indivíduos vizinhos, usando um pênis alongada e fertilização interna. O período reprodutivo é principalmente de maio a setembro. B. improvisus tem sete estágios larvas pelágicos (seis náuplios, seguidos por uma fase de cyprid8). As escotilhas de ovo fertilizado em uma larva náuplio, que é livres e alimenta na coluna d'água por até várias semanas antes de a muda em uma larva de cyprid não-alimentar. O cyprid usa várias pistas para encontrar um local apropriado para resolver e então sofre metamorfose em um sessile barnacle juvenil9. As espécies podem ser cultivadas em laboratório e tem uma vida útil de 1 – 2 anos no mar (2-3 anos na cultura de laboratório). Em média, b. improvisus cresce até 10 mm de diâmetro (com um máximo de cerca de 20 mm) e atinge uma altura máxima de cerca de 6 mm (embora pode crescer mais alto sob condições de superlotação). A espécie pode ser identificada por sua concha até calcária Lisa (branco ou acinzentado), a base de calcária radialmente padronizada da placa da concha e a forma das placas tergal1,10.
O barnacle improvisus b. tem várias características vantajosas como modelo para estudos de osmoregulação, com foco em mecanismos fisiológicos e moleculares, bem como as interações ecológicas e consequências evolutivas. É também amplamente utilizado como um modelo para as investigações de regularizar a biologia, em particular em relação à pesquisa de antifouling e os mecanismos envolvidos7,11,12,13. No entanto, desova sazonal natural produz um imprevisível fornecimento de larvas de cyprid para estudos. A capacidade de cultura esta barnacle através de seu ciclo de vida inteiro durante todo o ano é, portanto, um grande trunfo para permitir vários tipos de estudos moleculares e mecanicistas. Além disso, sua presença em águas salobras/marinhas em todo o mundo permite uma combinação de campo e estudos experimentais. Reprodução controlada pode também produzir famílias de conhecidos pedigrees para cultivo a longo prazo14, e um tempo de geração de poucos meses pode permitir a evolução experimental a longo prazo. Há também um genoma de projecto e transcriptomes vários disponíveis, e esses recursos foram utilizados para a clonagem de vários genes (por exemplo, genes de importância na osmoregulação)2,3.
O objectivo do presente protocolo é descrever como estabelecer e manter uma cultura do barnacle improvisus b. durante todo o ano para realizar estudos de expressão do gene em adultos ou larvas deste organismo. Rittschof et al . 15 brevemente descrito um método para o cultivo de cracas da libertação de náuplios para o assentamento de cyprids para a espécie Balanus amphitrite. O protocolo foi adaptado para o cultivo de todo o ano de b. improvisus no Tjärnö Marine Research Laboratory (Suécia), e uma descrição detalhada de todas as etapas na linha de produção é descrita, incluindo a produção e criação de barnacle as larvas, bem como a administração de alimentos destinados a adultos e larvas. Para uma visão geral de todo o procedimento, consulte a Figura 1. O uso do sistema de cultivo é exemplificado com algumas afinações experimentais comuns e ilustrado em estudos de genômica funcional do at+/k+ ATPase e aquaporinas, elucidar suas possíveis funções na osmoregulação2, 3. Às vezes é essencial para examinar a expressão de gene em tecidos específicos e algumas noções básicas de dissecação barnacle serão cobertas. Com um bom suprimento de água do mar de alta qualidade, o cultivo do barnacle improvisus b.e potencialmente muitas outras espécies, deve ser possível nos laboratórios marinhos em todo o mundo.
Protocolo
1. coleção de cracas adultas no campo para iniciar um novo reprodutores
-
Implante painéis transparentes termoplástico (poli-metil metacrilato) (110 x 110 x 1,5 mm3) no ≈ 1 – 3 m de profundidade em águas calmas para coletar cracas adultas do campo. Quadros de uso que podem tomar vários painéis (Figura 2), furos 2 (com um diâmetro de 6 mm) no canto superior de cada painel e attachthepanelstotherackusingcableties. Assim, thepanelswillhangverticallyin a água.
- Quando o assentamento de cracas ocorreu (identificados como pequenos pontos brancos de difícil nos painéis), deixar os painéis para pelo menos 2-3 semanas certificar-se que as cracas são grandes o suficiente (5 mm) para ser transferido para o laboratório sem ficar seco ou danificado.
- Trazer os painéis para o laboratório, quando eles são cobertos com resolvido improvisus b. que tenham atingido um tamanho de ca. indiameter de 5 mm.
Nota: O tempo para adultos desenvolver a 5mm no campo é altamente dependente da disponibilidade de alimentos e a temperatura. Normalmente, isso leva cerca de 3 semanas no Tjärnö Marine Research Laboratory (58.87 ° N, 11.14 ° E). Mais comumente, painéis para os novos reprodutores geralmente são implantados no final de junho e recolhidos no final de agosto. - Antes de introduzir os painéis para o centro de cultura, limpe outros organismos dos painéis. É muito importante remover outras espécies barnacle. Por favor, note que é importante limpar frequentemente os painéis para se livrar de contaminar espécies durante o cultivo, já que isto irá aumentar significativamente as chances de sobrevivência dos reprodutores.
- Coloque os painéis verticalmente na borda em um stand com sulcos branqueados em uma bandeja de polietileno (400 x 400 x 20 mm3) (figuras 2 e 2E). As ranhuras no stand são afastados de 15 mm.
- A fim de preparar as bandejas, fazer uma porta de entrada na base e uma porta de saída na parte superior do lado oposto de cada bandeja. Conecte a porta de entrada de cada bandeja para um reservatório de 100L, contendo cerca de 30 L de água com uma entrada de água do mar aberta, a 20 ° C para permitir um escoamento a uma taxa de ca. 2 L / min.
Nota: Até 8 bandejas eram conectados a um único reservatório de 100L. - Conecte o reservatório de 100L de água do mar temperatura controlada (20 ° C) (por exemplo, fornecido por uma bomba de calor que troca de calor da água do mar entrada).
Nota: O barnacle improvisus b. pode crescer e reproduzir-se em uma completo Marinha salinidade (30 – 35 psu); no entanto, reduzindo a salinidade para ca. 25 psu, adicionando água doce para o reservatório de 100L aumenta a saída das larvas da cultura.
2. a partir de novas gerações de adultos de culto Cyprids
- Cubos de construção de painéis de termoplásticos abrem no topo por gravação 5 painéis juntos usando uma fita atóxica, resistente à água.
- Coloque o cubo em uma bandeja pequena (em caso de vazamento) e preenchê-lo com água do mar (25 psu). Manter a água em temperatura ambiente (ca. 20 ° C). Adicione cerca de 200 cyprids no topo do cubo.
- Alimentar os juvenis com 100 mL de Skeletonema marinoi todos os dias (Veja passo 5), enquanto no cubo.
Nota: Cracas juvenis podem ter dificuldades com a ingestão de Artemia salina (ver passo 3) desde que eles são grandes e, portanto, difícil de engolir para um recém estabelecida barnacle. - Mude a água 1 x por semana.
- Depois de 2 semanas, quando os painéis contêm juvenis suficientemente estabelecidos de pelo menos 5 mm de diâmetro, desmontar o cubo e mover os painéis com os juvenis para bandejas com fluxo-throughseawater e, posteriormente, alimentar as cracas com náuplios da . salina .
3. cultura de náuplios de Artemia salina como alimentação para adultos cracas
- Criar um sistema de cultivo para a. salina usando uma garrafa de plástico de 1,5 L onde cortar o bottomis e o frasco é colocado em uma posição invertida e iluminado do lado. Ajuste o gargalo de um tubo de silicone com uma pinça e anexá-lo a uma bomba de aeração (Figura 2D).
- Para chocar os ovos, adicione cerca de 15 mL de secos descanso ovos de Artemia para 1 L ofseawater.
Nota: Artemia ovos eclodem em larvas náuplio após 24-48 h. Para atrasar a eclosão dos náuplios da . salina (por exemplo, durante os fins de semana), a luz pode ser desligada para reduzir a temperatura um pouco. - Colher os náuplios de Artemia , desligue a aeração e escurecer a parte superior da garrafa com papel de alumínio (ou similar , por exemplo, uma lata)... Iluminar que a parte inferior da garrafa por 10 min. Hatched Artemia náuplios vai nadar em direção à luz. Cistos não-tracejada vão afundar até o fundo, e conchas de cisto irão flutuar na superfície.
- Abra o grampo na parte inferior. Colete a fração intermediária como uma densa população dos náuplios de natação.
Nota: Todos os dias (exceto nos finais de semana), 1 L de suspensão de náuplios de Artemia densa foi adicionada manualmente para o reservatório de 100L conectando para as bandejas com as cracas adultas. Evite qualquer alimentação com conchas vazias de cisto, desde que eles não fornecem a nutrição e principalmente resultar na necessidade de limpar a cultura em intervalos mais frequentes.
4. recolha e criação de larvas de Barnacle
- Limpar os painéis com cracas adultos pulverizando-los suavemente com água doce e, se necessário, remova qualquer incrustação das conchas barnacle e painéis usando uma escova macia. Além disso, limpar as bandejas (sem cracas) e tubos em quente (75 ° C) de água doce.
- Coloque uma peneira feita de uma rede 90 µm de plâncton colada à extremidade de um tubo de PVC de corte (16 cm de diâmetro, 15 cm de altura) em uma bandeja de polietileno (30 x 20 x 10 cm3) com uma porta de estouro. Colete as larvas de b. improvisus em peneira durante a noite (Figura 2C).
Nota: A peneira foi posicionada logo abaixo a porta de saída da bandeja dos painéis barnacle para receber a água escoada e filtrar os náuplios. As larvas permaneceram em peneira enquanto a água do mar transbordou a bandeja pequena. Esta pequena bandeja garantiu que a peneira nunca driedout. - Coloque um balde 30 L em um banho de água de grandes dimensões onde a temperatura é mantida em 26 ° C, utilizando aquecedores de tanque de peixes de aquário(Figura 2). Aeração e agitação são assegurados por borbulhamento de ar através do sistema.
- Encha o balde com 20 L de água do mar filtrada (0,2 µm; 25 psu). Adicione 1 L para o balde de uma mistura de 60/40 da 2 diatomáceas microalgas, S. marinoi e c. gracilis (Veja passo 5). Isto dará uma densidade inicial de cerca de 5 x 104 diatomáceas / mL no balde.
Nota: As larvas de náuplios de craca são positivamente phototactic. Os baldes eram feitos de plástico branco opaco com tampas que deixa passar um pouco de luz. Durante o inverno, o quarto estava iluminado durante o dia (08:00 – 17:00), mas o escuro durante a noite. Durante o verão, a luz exterior entrou no quarto durante a maior parte do dia. - Transferir o coletados improvisus b. náuplios para um prato de cristalização (90 mm de diâmetro, 300 mL; 50 mm de altura).
- Ilumine o prato do lado, que irá atrair as larvas para a fonte de luz. Recolha os náuplios de craca que se reúnem na luz recebida com uma pipeta e transferi-los para outro prato de cristalização. Remova qualquer restantes larvas de Artemia .
- Transferi as larvas de náuplios de b. improvisus para um copo com 1 L de água do mar filtrada.
- Conte o número de náuplios por mexendo o copo delicadamente para obter uma suspensão mesmo de larvas e então tomar cinco amostras de 1ml de lugares diferentes no copo. Transferi cada amostra em uma microplaca para uma inspeção visual com um estereomicroscópio. Contar o número de náuplios em cada uma das cinco amostras e adicioná-los.
- Multiplique o número contado por 200 (1.000 mL/5 mL) para estimar quantos milhares de larvas são o copo todo. Se houver muitas larvas náuplio no copo, dilua a amostra até que a densidade é, no máximo, 14.000 larvas/L (geralmente na faixa de 11.000-12.000 larvas/L).
- Adicione 1 L de b. improvisus náuplios para um balde, agregando cerca de 11.000-12.000 larvas por balde.
Nota: Certifique-se não adicionar mais náuplios, pois isso resultará em comida muito pouco em relação as larvas e, portanto, aumentar a mortalidade. - Depois de 3 dias, recolha náuplios barnacle sobre uma peneira de 90 µm. Em seguida, limpe o balde (com 75 ° C de água doce), preenchê-lo com água do mar filtrada, adicionar um novo feed de diatomáceas (a mesma quantidade como no início) e finalmente adicionar os náuplios novamente. Cyprids começam a aparecer após cerca de 6 dias (± 1 dia).
- Cyprids primeiro receber com uma peneira de 90 µm (concebida como no ponto 4.2 acima). Então separe náuplios barnacle não-moulted e cyprids com uma peneira µm 320 em cima de uma peneira de 160 µm. Improvisus b. náuplios recolherá no 320 peneira µm e cyprids em peneira 160 µm.
Nota: As larvas de cyprid podem ser armazenadas a 10 ° C, em um prato de cristalização na escuridão para uso posterior, até ca. 6 dias. No entanto, o armazenamento pode afetar a qualidade e o desempenho das larvas barnacle, então experimentos comparando diferentes tratamentos idealmente devem usar larvas do mesmo lote (e tempo de armazenamento similar) para evitar a confusão de efeitos de16.
5. cultura de microalgas como alimento para as larvas náuplio do Barnacle
Nota: As algas foram cultivadas em 3 diferentes tipos de culturas: (i) banco de culturas, que são para a manutenção a longo prazo das variedades que estavam sendo usados para a inoculação do scaling-up; (ii) iniciar culturas, que são o primeiro passo na escala-up; e finalmente (iii) a cultura de produção, que é a escala de produção final de grandes quantidades de algas como barnacle alimenta.
- Espécies de diatomáceas ordem da coleção de cultura de algas e protozoários (CCAP) para ser usado como alimento para as larvas de náuplio barnacle. A 2 espécie Skeletonema marinoi (estirpe CCAP 1077/5) e Chaetoceros simplex var. gracilis (estirpe CCAP 1085/3), ambos dar bons resultados como feed.
- Filtrar toda água do mar para ser usado nas culturas das algas, usando um sistema de filtro de cartucho com um tamanho nominal do poro de 0,2 µm. (a água do mar filtrada é também ser utilizado para a incubação de ovos da . salina e o cultivo de larvas de náuplio barnacle.) Autoclave a água do mar filtrada para as culturas de algas (a 105 ° C por 5 min).
- Prepare um suporte para a cultura de microalgas, usando a água do mar esterilizada enriquecida com solução de f/2 de Guillard contendo nutrientes inorgânicos, metais e vitaminas (veja Guillard 197517 para a receita detalhada). Além disso, preparar uma solução de silicato (ND2SiO3), mas separar isto o enriquecimento de f/2 para evitar a precipitação de sólidos.
Nota: As concentrações da solução-mãe o enriquecimento e a solução-mãe de silicato foram preparadas para ser usado como uma adição de 1 mL de cada para 1L de água do mar. - Autoclave, todo o equipamento utilizado na cultura das algas a 120 ° C por 20 min. Autoclave encimado por um parafuso, tubos de ensaio com 1 mL de enriquecimento f/2 e 1 mL de solução de silicato. Adicione as soluções de enriquecimento e silicato de theseawater quando o vidro esterilizado e líquidos arrefeçam até à temperatura.
-
Crescem ações culturas de microalgas em 40 mL de tubos de ensaio com tampas de rosca.
- Encha os tubos de ensaio com cerca de 30 mL de água da mar enriquecida. Inocule as culturas com uma pipeta Pasteur estéril, usando cerca de 1ml de uma cultura de estoque 2 semana de idade. A tampa de rosca é então montada mas não apertada, para permitir alguma troca de gás. Se disponível, a inoculação deve ser realizada em um fluxo laminar para reduzir o risco de contaminação.
Nota: O objectivo das culturas estoque é manter culturas das algas a longo prazo e para servir como inóculo para iniciar culturas. Culturas-mãe foram re-vacinadas a cada duas semanas. - Expor a nova cultura de estoque para uma luz branca com uma intensidade de ca. 25 – 50 µmole m-2s-1 (com um ciclo claro-escuro de h 16:8). Mova as culturas estoque antigas para uma baixa intensidade de luz como um back-up. Descarte qualquer culturas estoque 2 semanas de idade.
- Encha os tubos de ensaio com cerca de 30 mL de água da mar enriquecida. Inocule as culturas com uma pipeta Pasteur estéril, usando cerca de 1ml de uma cultura de estoque 2 semana de idade. A tampa de rosca é então montada mas não apertada, para permitir alguma troca de gás. Se disponível, a inoculação deve ser realizada em um fluxo laminar para reduzir o risco de contaminação.
-
Para o dimensionamento para a cultura de produção de algas, inocular as culturas de início da cultura estoque e cultivá-las em 500 mL de Erlenmeyerflasks.
- Erlenmeyers de autoclave 4, pipetas e rolhas de algodão com 300 mL de água do mar filtrada de (0,2 µm) e 4 tubos de ensaio com 0,3 mL de enriquecimento f/2 e 4 com soluções de silicato. Arrefecer o enriquecimento de f/2 e o silicato à temperatura ambiente e adicionar as soluções para os frascos Erlenmeyer. Inocule-lhes com ca. 1 mL da cultura estoque 2 - semana de idade.
Nota: Prepare 2 frascos com S. marinoi e 2 com c. simplex. - Colocar os frascos em uma tabela de agitação em uma intensidade de luz de 50 µmole m-2s-1. Quando as culturas de início adquiriram densas populações de algas (na cor amarelo-marrom), eles estão prontos para ser usado como inóculo para as culturas de produção que irão fornecer o barnacle larvas com comida.
- Erlenmeyers de autoclave 4, pipetas e rolhas de algodão com 300 mL de água do mar filtrada de (0,2 µm) e 4 tubos de ensaio com 0,3 mL de enriquecimento f/2 e 4 com soluções de silicato. Arrefecer o enriquecimento de f/2 e o silicato à temperatura ambiente e adicionar as soluções para os frascos Erlenmeyer. Inocule-lhes com ca. 1 mL da cultura estoque 2 - semana de idade.
-
Cultivar culturas de produção em garrafas de policarbonato 4L com rolhas de silicone com 2 portas perfuradas equipadas com tubos de vidro.
- Ligue 1 tubo de vidro, atingindo até o fundo da garrafa para uma bomba de ar através de um tubo de silicone, equipado com um filtro de ar de 0,2 µm. Certifique-se o segundo tubo de vidro termina apenas abaixo da rolha de silicone e é enchido com o algodão para permitir a saída do ar injetado.
- Cada semana, preencher quatro 4 L garrafas com autoclave e a água do mar filtrada-los juntamente com as rolhas. Além disso, o teste de autoclave 4 tubos com 4 mL de soluções de enriquecimento e silicato de f/2.
- Após arrefecimento, adicionar as soluções de silicato e enriquecimento de f/2 para as garrafas e depois inocular-lhes metade do volume das culturas de arranque nos Erlenmeyers.
- Coloque as quatro garrafas de 4L em uma intensidade de luz de 50 – 100 µmole m-2s-1.
- Colheita das culturas de produção após ca. 1 semana; em seguida são suficientemente densas para ser usado para alimentar o barnacle larvas náuplio.
Nota: Produção culturas têm uma vida útil de cerca de 2 semanas, o que significa que existem 8 garrafas de produção ativo a qualquer momento.
6. projetar estudos experimentais usando cracas
-
Coloque os painéis com cracas juvenis ou adultos em aquários controlados, onde eles podem ser crescidos sob identicalconditions. Isto é chamado uma experiência comum-jardim, que, por exemplo, pode ser usada para entender a adaptações locais ou plasticidade fenotípica18, ou para estudar as mudanças de expressão de gene em relação a fatores externos (por exemplo, salinidade, temperatura ou pH).
Nota: Também é possível usar cracas coletadas diretamente do campo nos painéis. Uma vantagem de usar o laboratório raça indivíduos é que efeitos maternos podem ser evitados quando se utiliza a próxima geração de prole.- Expor as cracas das condições ambientais específicas durante um intervalo de chosentime, seguido pela colheita de adultos (por exemplo, para estudos de expressão gênica)2.
-
Para experimentos com larvas de cyprid para estudar a expressão de gene3, coloque o cyprids em aquários controlados, onde as larvas podem ser cultivadas em condições idênticas.
- Recolher o cyprids após períodos de tempo especificado por filtragem com peneiras (conforme descrito na etapa 4.7) e extraia o RNA de acordo com os protocolos abaixo (passo 8).
7. dissecação de cracas
- Limpar o espaço do laboratório onde a dissecção e amostragem de DNA são executadas, bem... e entre os indivíduos, incluindo todas as ferramentas de dissecação. Isso é feito usando o cloro para o banco (ou etanol a 96% para a pinça).
Nota: Rotulados tubos contendo meios de fixação (etanol ou uma solução de estabilização de RNA) são preparados com antecedência. - Selecione a curto prazo e grandes indivíduos esfomeados (não alimentá-los durante 2 dias antes a dissecação). Limpe o shell barnacle com uma escova de dentes para minimizar o risco de contaminação de outras espécies (por exemplo, bactérias, algas) e lave-lo com água.
Nota: A razão para a fome a curto prazo dos particulares perante a dissecação é para evitar qualquer contaminação de DNA (por exemplo, de cistos de Artemia no intestino). -
Coloque as cracas individuais sobre uma superfície plana, ou anexada a um painel ou solta em um prato. Disse os respectivos tecidos de adulto. Existem várias maneiras para dissecar cracas, dependendo da finalidade do estudo.
- Método de dissecação r: fixação do barnacle todo tão rapidamente quanto possível.
- Remova o barnacle todo o painel usando um bisturi, inseri-lo sob o barnacle e perto da superfície do painel.
Nota: Na maioria dos casos, esta manipulação deixa a placa basal quase intactos, não afectando o barnacle dentro. - Rachadura cuidadosamente o escudo exterior de um lado, inserindo a pinça (Figura 3). Isso é feito para facilitar a intrusão de um meio fixando dentro do shell.
Nota: Se o shell não é quebrado em tudo antes de colocar o barnacle num tubo de ensaio, pode levar a um processo de fixação mais lento e uma qualidade inferior de DNA mais tarde. - Colocar o barnacle quebrado no tubo de ensaio contendo uma solução de armazenamento de RNA ou etanol. Deixe o barnacle na solução pelo menos 24 h para sua fixação. Quando o barnacle é fixo, o animal pode ser retirado do suporte de fixação e colocado em uma bandeja de dissecação. Os cirros, manto e soma (corpo) podem ser separados uns dos outros e colocados em tubos separados para novas extrações de DNA ou RNA.
Nota: É importante observar se o ovo lamelas com ovos fertilizados estão presentes no interior do barnacle. Se estiver presente, estas devem ser removidas antes de prosseguir com as extrações de DNA para evitar encontrar vários genótipos na amostra.
- Remova o barnacle todo o painel usando um bisturi, inseri-lo sob o barnacle e perto da superfície do painel.
- Método de dissecação b: removendo o barnacle do shell antes de sua fixação.
Nota: Este método não pode sempre resultar no manto sendo amostrado desde que está ligado ao interior da calcareousshell. Mas pode ser um método rápido para amostragem de DNA de um indivíduo.- Remova com cuidado, usando pinça de dissecação, as placas de tergal e scutal (Figura 3) inserir a ponta da pinça entre as placas scutal e tergal, agarrando a espera de um prato, e puxando suavemente para removê-los.
- Pegue as mãos os cirros com a pinça e puxe o barnacle para fora e colocá-lo diretamente em etanol a 96% ou RNA estabilizando a solução para a fixação...
Nota: Às vezes, o manto vai também ser amostrado ao mesmo tempo, como pode ser visto como um epitélio fino com pigmentação escura (em b. improvisus). Caso contrário, o manto pode ser removido de dentro da concha com um bisturi e, posteriormente, colocado em etanol ou RNA estabilizar a solução.
Nota: As placas de tergal e scutal (se intacto) podem ser secas e salvou uma vez que são úteis para identificação10 a espécie. Uma recomendação geral, se houver qualquer dúvida de espécies, é também fotografar o barnacle todo antes de inicializar a dissecação.
- Método de dissecação r: fixação do barnacle todo tão rapidamente quanto possível.
8. RNA extração por PCR quantitativo
- Coloque adultos deve ser usado para extração de RNA em uma solução de estabilização de RNA, incube-los durante a noite (até 24 h) a 4 ° C e armazená-los em seguida a-80 ° C.
Nota: As larvas de Cyprid são preferencialmente seco-congelado, sem RNA mais tarde diretamente na-80 ° C, por colocá-los em cryotubes e em seguida, mergulhando os tubos brevemente (30 s) em nitrogênio líquido antes de armazená-los a-80 ° C. - No momento da extração do RNA, descongelar as cracas no gelo e usá-los intactos ou dissecar para fora os tecidos a utilizar (consulte a etapa 7).
Nota: devido à alta diversidade genética entre os indivíduos (≈ 3 – 5% de variação na codificação de regiões; Alm Rosenblad et al., dados não publicados) é aconselhável Michelle número de indivíduos adultos, o que minimiza o efeito da variação da sequência entre indivíduos na etapa posterior de qPCR. - Para o RNAextraction, adicione 350 µ l de tampão de Lise fornecido com um kit de preparação do RNA em tubos de homogeneização contendo 2,8 mm de grânulos cerâmicos.
Nota: Grânulos cerâmicos oferecem um melhor rendimento do RNA em relação ao sonication (Representante resultados). - Levar um adulto barnacle (totalidade ou tecidos) ou recolher um mínimo de 20 larvas de cyprid, usando a pinça e colocá-los em tubos de homogeneização.
- Proceda diretamente para o rompimento e homogeneização com um moinho do grânulo.
- Colocar os tubos de homogeneização com a amostra e grânulos no suporte do moinho do grânulo. Agitá-los com uma frequência de 4,0 m/s para 20 s. fresco da amostra por 1 min no gelo. Repita 2x.
- Prepare o RNA de acordo com o protocolo do kit de isolamento de RNA comercialmente disponível.
Nota: Uma avaliação de risco (incluindo uma leitura das folhas de dados de segurança) deve ser realizada antes usando métodos de extração de RNA, para identificar produtos químicos perigosos que exigem o uso de uma coifa e outro vestuário de protecção, incluindo luvas (por exemplo, a adição de β-Mercaptoetanol para a Lise durante a extração do RNA deve ser executada em uma coifa). - Quantificar o RNA. Preparar uma solução de trabalho e adicionar um padrão e as amostras para um volume total de 200 µ l. Vortex-os por 2 – 3 s e incube-os 2 min. inserir os tubos em um dados e fazer as leituras.
- Verifique as amostras de RNA para qualquer contaminação de proteína com um espectrofotômetro e sua integridade de RNA com um sistema automatizado de eletroforese (Representante resultados).
Nota: Para as preparações de boa qualidade, RNA é recomendável ter uma relação de 260/280 nm 2-2.2 e um DNA de cerca de 1,8. Valores mais baixos indicam contaminações de proteína e que o procedimento de extração deve ser otimizado.
9. Gene Expression: síntese de cDNA e qPCR
-
Trate o RNAwith DNase obtidos para remover qualquer remainingDNA antes de fazer o cDNA para qPCR.
- Verifique se contaminando o DNA genômico, adicionando uma amostra de RNA mas não transcriptase reversa ao preparar o cDNA. Se houver uma amplificação por PCR do gene selecionado no cDNA feito sem transcriptase reversa, há contaminação de DNA no ARN.
Nota: Para amostras a ser usado para RNA-seq (RNA-em sequência usando tecnologia de sequenciamento de próxima geração), a etapa de DNase é menos crítica. Em particular, para as amostras com baixos níveis de RNA, a etapa de DNase pode ser omitida em ordem para não perder muito do RNA no processo.
- Verifique se contaminando o DNA genômico, adicionando uma amostra de RNA mas não transcriptase reversa ao preparar o cDNA. Se houver uma amplificação por PCR do gene selecionado no cDNA feito sem transcriptase reversa, há contaminação de DNA no ARN.
- Realize a síntese do cDNA em RNA DNase-tratada usando uma quantidade de RNA dentro do intervalo especificado no kit de síntese do cDNA comercial, mas geralmente, uso de pelo menos 50 ng.
- Projeto qPCR cartilhas para que eles recozem a partes do gene de interesse onde a identidade de sequência entre indivíduos é tão alta quanto possível, mas a identidade de sequência entre gene paralogs é tão baixa quanto possível. Por favor consulte as publicações correspondentes para os pares de cartilha específicos utilizados para estudos de expressão do gene do at+/k+ ATPase3 e aquaporinas2 (Figura 5).
Nota: Para este efeito, dados de sequência de RNA-seq de centenas de cyprids ou vários adultos podem ser usados. - Desenho de primers para um gene a ser usado para a normalização dos níveis de expressão (por exemplo, actina). Os primers utilizados com sucesso para actina são, para a frente: 5'-CATCAAGATCAAGATCATCGC-3' e o inverso: 5'-ATCTGCTGGAAGGTGGAC-3'.
Nota: O actínio é um gene de controle comumente usados. No entanto, outros também foram sugeridos como uma referência e testados em cracas19. Além de actina, o uso de RPL8, 36B4, EF1 e NADHd1 como uma referência tem sido testado3. Concluiu-se que não existem sem grandes diferenças nos níveis de expressão dos genes respectivos referência entre soma, cirros, adulto ou cyprids. - Otimize a temperatura do recozimento para os primers projetados pela adição de quantidades crescentes de cDNA (tipicamente na faixa de 0,25 a 50 ng) a uma mistura contendo SYBR Green, dNTP, polimerase e 0,3 µM de primer para diante e reverso.
- Execute o qPCR protocolos em diferentes temperaturas de recozimento, como segue: uma temperatura inicial de desnaturação de 95 ° C por 3 min, um passo de desnaturação a 95 ° C por 20 s, recozendo temperaturas de 55 a 63 ° C por 20 s e um alongamento a 72 ° C por 30 s. No total, execute 40 ciclos PCR.
Nota: As eficiências de primeira demão deve estar no intervalo de 90 – 105% e são calculadas como E = (10^(-1/slope)-1) x 100 onde o declive é a inclinação da curva obtida ao plotar o valor de log das concentrações do cDNA contra seus valores de limiar (Ct) do ciclo. - Execute qPCR usando uma quantidade adequada de cDNA, geralmente de 1 – 10 ng, usando o protocolo PCR descrito na etapa 3, com a temperatura do recozimento ideal encontrada.
Nota: A maior quantidade de cDNA é usada somente para os genes que são expressos em quantidades extremamente reduzidas.
Resultados
Com o procedimento descrito para o cultivo de cracas adultas de b. improvisus, até quatro lotes de náuplio larvas podem ser produzidas por semana. Seria possível coletar larvas náuplio quase todas as noites, mas isso requer mais pessoas e infra-estrutura (com muitas cracas nos reprodutores, uma cultura irá lançar larvas continuamente). Um fator limitante adicional para a produção de larvas parece ser a disponibilidade de alimentos de alta qualidade, em particular em relação a diatomácea Skeletonema. Màxima, cada lote do sistema de cultivo consiste em aproximadamente 12.000 náuplios, então até 50.000 náuplios por semana podem ser cultivadas. No entanto, algumas semanas pode haver até dez vezes menos larvas produzidas. Um único adulto pode produzir até 7.000 larvas por dia14, que significa que 1 – 2 adultos estão liberando larvas para cada lote. Dentro de uma semana, cerca de 70-90% dos náuplios coletados desenvolverá em cyprids (produzindo cerca de 30.000 cyprids semanais, màxima) que pode ser usado para assentamento de ensaios e estudos moleculares.
Convém salientar que existem variações nas características cyprid entre lotes, e em geral, existem grandes variações entre lotes do que dentro de lotes. Por exemplo, o sucesso de assentamento em ensaios de assentamento varia entre 30 e 70% para lotes diferentes. O mais provável, isso é causado pela variação genética individual entre os pares específicos de adultos liberando larvas durante os períodos de amostragem diferentes. É, claro, recomendável que experiências repetidas (Replica biológica) devem incluir cyprids de um número de lotes se declarações mais gerais sobre os resultados devem ser feitas. A variação de lotes para coloca exigências sobre o delineamento experimental, onde devem ser aplicadas controles adequados e normalizações em estudos de expressão do gene. No entanto, mesmo depois de vários procedimentos de normalização estatística têm sido implementados que reduzem consideravelmente a variação entre lotes, alguns efeitos do lote são geralmente ainda aparentes (dados não publicados).
Seguindo o protocolo fornecido, é possível obter, em média, 500 ng do RNA de alta qualidade de tão pouco como 20 cyprids, independentemente da fase de liquidação barnacle (tabela 1). A qualidade do RNA é geralmente medida como a razão entre os picos de 18S e 28S (a posição esperada dos dois picos são indicadas na Figura 4). No entanto, no caso de cracas e muitos outros artrópodes, o rRNA 28S decompõe-se quando aquecido (como parte do método de análise) e migra junto com o pico de 18 anos20. Eis porque há, em princípio, um único pico de rRNA neste tipo de análise para cracas. É evidente a partir deste teste (Figura 4) que uma homogeneização por grânulos cerâmicos fornece o RNA com maior integridade e é, portanto, o método de escolha. O RNA é suficiente em quantidade e qualidade para gerar bibliotecas de sequenciamento de alta qualidade para sequenciamento, resultando em uma média de 70 milhões de leituras por exemplo (o número de leituras, claro, depende do nível de multiplexação durante o sequenciamento). A quantidade de RNA é também suficiente para análise de expressão síntese e qPCR do cDNA de um grande número de genes.
A Figura 5 mostra o resultado das análises de qPCR de aquaporinas e do at+/k+ ATPase (NAK1) splice variantes, onde as mudanças de expressão foram investigadas em resposta a alterações em pistas ambientais2,3. Uma comparação da expressão relativa de longo e curto splice variantes de NAK1 mostra um duplo aumento para o longa NAK1 mRNA em baixa salinidade em relação a NAK curto (Figura 5A). Assim, os dados indicam que o splicing alternativo faz a forma longa predominante em condições de baixa salinidade. No caso de aquaporinas, é evidente que o paralogs de água-transportando dois AQP1 e AQP2 exibir expressão diferencial (Figura 5B). Em particular, no tecido do manto, é evidente que o AQP1 é substancialmente para baixo-regulado em salinidades inferiores, que não é visto por AQP2. Em vez disso, AQP2 mostra uma expressão ligeiramente aumentada em salinidades inferiores, mas no soma. Estes resultados fornecem uma base para as investigações dos papéis funcionais dos diferentes improvisus b. transportadores de íons e aquaporinas na osmoregulação barnacle.
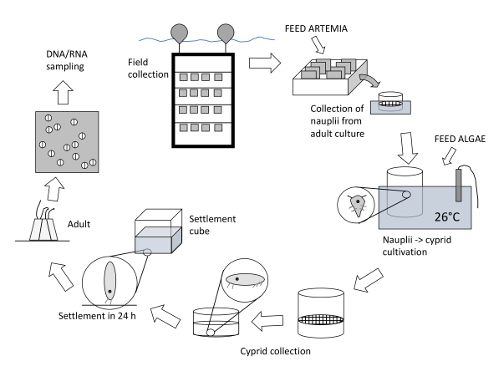
Figura 1 : Visão geral de todo o procedimento e a extração de RNA para estudos de expressão do gene em adultos de cultivo. Para iniciar uma nova cultura, painéis são anexados a um quadro e implantados no mar em 1-3 m de profundidade. Após várias semanas, os painéis com adultos/jovens são colocados verticalmente em racks em bandejas no laboratório. Cada bandeja detém cerca de 40 painéis com adultos. Com cerca de 100 adultos por painel, em total ≈ 4.000 indivíduos adultos são cultivados por bandeja. As cracas adultas são alimentadas com Artemia e pode ser mantidas ano-por aí. As larvas náuplio são recolhidas várias vezes por semana a partir de bandejas através de uma filtragem através de uma peneira. Os náuplios coletados são transferidos para baldes mantidos a 26 ° C em banho-maria e alimentados com microalgas. Náuplios são criados até que eles muda em cyprids não-alimentação, que são coletados por filtragem. Novos painéis podem ser estabelecidos no laboratório através da sedimentação de cyprids nos painéis, ou para fornecer novos painéis para o ano-em torno de cultura ou para ser usado para afinações experimentais específicas com diferentes condições externas. RNA é então extraído de juvenis/adultos no final do experimento, ou nos pontos de tempo específicos. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Imagens de alguns passos importantes no processo de cultivo. (A), esta imagem mostra os quadros com painéis para coletar novas populações do campo. (B) esta imagem mostra os painéis com cracas adultos de b. improvisus em racks que são colocados em bandejas. Os painéis são colocados cerca de 2 cm afastados. (C), esta imagem mostra as bandejas com o barnacle, painéis e o tanque de alimentação para a esquerda. De cada bandeja, há uma tomada onde as peneiras são colocadas para a coleta de larvas náuplio. (D) esta imagem mostra que a produção de Artemia alimenta para as cracas adultas. (E) esta imagem mostra a criação de náuplios em baldes num banho de água situado a 26 ° C. Clique aqui para ver uma versão maior desta figura.
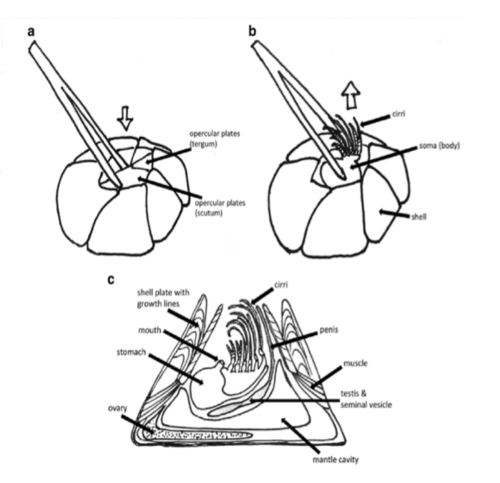
Figura 3 : Descrição das etapas de cracas adultas dissecação inicial: remover o corpo do seu shell. (A) agarrar uma das chapas odontódios inserindo fórceps suavemente através da abertura. Puxe suavemente para remover a placa e expor o animal. (B) retirar o animal, agarrando a parte soma logo abaixo os cirros. (C), este painel mostra a anatomia geral de cracas de bolota. O manto e potencialmente fertilizados ovos (no ovário) permanecer na cavidade de escudo quando o corpo é puxado para fora. Uma nota sobre anatomia barnacle (para uma conta mais detalhada, consulte Anderson)9: as placas de parede de uma craca inclinam-se para dentro, e juntos, eles formam um cone de vulcão-como. Uma abertura, a abertura, é coberta pelas duas placas odontódios, que formam uma porta, ou opérculo, para fechar a abertura. Cracas bolota geralmente têm uma placa basal calcária que está colada firmemente o substrato; no entanto, algumas espécies de cracas faltam esta placa calcária (por exemplo, S. balanoides). Cracas secretam exoesqueleto do manto Escuramente pigmentado (carapaça). A superfície externa do manto duas camadas está calcificada para tornar-se rígida, enquanto a superfície interna do manto não está calcificada e, portanto, flexível. Dentro da abertura, os cirros estão presentes em uma posição retraída. Estes são os apêndices torácicos que cracas usam para a alimentação de suspensão. Os ovários estão localizados perto da base do barnacle, enquanto os testículos mentem no soma. Esta figura foi adoptada pelo Panova et al 21 e foi publicado com a permissão de Springer. Clique aqui para ver uma versão maior desta figura.
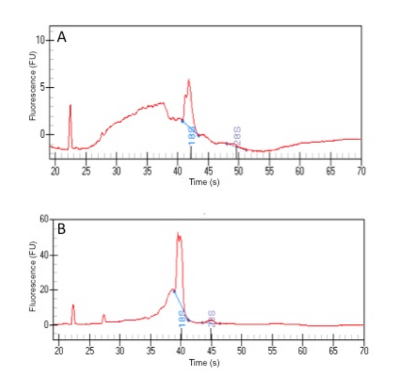
Figura 4 : Determinação da integridade de rRNA por eletroforese em gel capilar. RNA foi preparado por dois métodos diferentes de homogeneização: sonication (A) e (B) grânulos cerâmicos. A unidade no eixo y, FU, defende-se unidades de fluorescência. Clique aqui para ver uma versão maior desta figura.
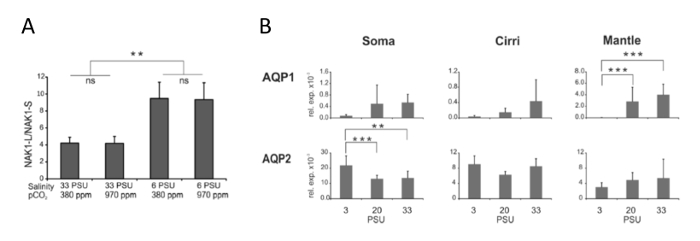
Figura 5 : Expressão gênica resulta de dois estudos diferentes de genes importantes para osmoregulação em b. improvisus. (A), este painel mostra a expressão diferencial, medido por qPCR das variantes da tala do at+/k+ ATPase NAK1 em resposta a diferentes salinidades e pCO2 níveis3. O tratamento de baixa salinidade, a expressão da isoforma longa (NAK1-L) é aumentada em relação a curto (ANOVA, P < 0,001). (B), este painel mostra a expressão das aquaporinas em adultos de b. improvisus durante sua exposição a diferentes salinidades2. qPCR foi usada para determinar os níveis de expressão de aquaporina em relação a actina. Indivíduos adultos foram incubados em 3 diferentes salinidades (3, 20 e 33 PSU) durante 14 dias. Para a preparação de RNA, a soma, cirros e manto dos adultos foram separados. Em ambas as figuras, as barras de erro indicam o desvio padrão. O * * e * * * indicam o nível de significância (ANOVA), 0,01 e 0,001, respectivamente. Estes números foram modificados de Lind et al 2 , 3. ambas as figuras são publicadas com permissão da PLoS ONE. Clique aqui para ver uma versão maior desta figura.
| Fase de liquidação | Montante total do RNA (ng) |
| Natação livre | 512 |
| Exploração: Pesquisa perto | 518 |
| Anexo cyprid | 550 |
| Recentemente metamorfoseados juvenil | 832 |
Tabela 1: rendimento do RNA. Esta tabela mostra a quantidade de RNA extraída com um kit de preparação do RNA das piscinas de 20 cyprid indivíduos coletados em diferentes fases durante o processo de resolução.
Discussão
A cultura de craca no Tjärnö Marine Research Laboratory (Suécia) tem sido executado mais de 20 anos e tem sido usada para estudos em muitas áreas diferentes de pesquisa. Mais de 30 trabalhos científicos têm sido publicados que utilizaram o sistema de cultivo durante os últimos anos, incluindo estudos em antifouling13,22, hidrodinâmica23, ecologia química24, mudanças climáticas16 , biologia evolutiva,5e de biologia molecular2.
Para evitar a seleção de certos indivíduos que são mais adaptados para o ambiente de laboratório (indivíduos que pode não ser representativa da população selvagem), recomenda-se coletar um novos reprodutores do campo a cada ano. Além disso, também é recomendável para rejuvenescer a cultura anualmente, desde há aproximadamente 50-80% de mortalidade em adultos durante um ano normal. No entanto, se o objectivo é produzir linhas puras ou configurar estudos da evolução experimental, famílias de laboratório criados somente devem ser utilizados.
Uma boa hora para coletar improvisus b. em painéis no Tjärnö Marine Research Laboratory é em Junho-agosto... porque naquela época, há um bom suprimento de larvas de cyprid no mar. Verificar os painéis semanalmente para ver quando começa o assentamento barnacle e remover manualmente outro estabeleceu-se espécies do que b. improvisus (por exemplo, mexilhões, tunicados, Briozoários, hidroides, Nemertinos/umaespetacular e outras espécies de craca) a partir do painéis (por exemplo, com uma escova de dentes). Em torno de Tjärnö, há três águas rasas barnacle espécies presentes (b. improvisus Semibalanus balanoidese Balanus crenatus). No entanto, b. improvisus é o dominante imundas de superfícies duras suaves durante julho-agosto. S. balanoides tem seu período de liquidação, durante o início da primavera e prefere principalmente naturais substratos (por exemplo, pedras). B. crenatus pode ocorrer em baixos números dos painéis durante o verão.
Também é possível iniciar novas gerações de adultos barnacle de culto cyprids, que seria essencial se estabeleceram-se certos linages com traços específicos, ou em estudos de evolução experimental. A maneira mais conveniente para iniciar novas gerações de adultos é para resolver cyprids em painéis termoplásticos em laboratório. Estes painéis com cyprids recentemente se estabeleceram também poderiam ser usados em tratamentos experimentais ou para exposição no campo. Em casos de emergência, também pode utilizar um adultos em pedregulhos de um local nas proximidades (por exemplo, Idefjorden no caso do Tjärnö Marine Research Laboratory) onde improvisus b. é comum. Estes adultos já estabelecidos são tratados da mesma forma que os adultos sobre os painéis, assim sendo colocados em bandejas e alimentados através da passagem do sistema. Células de fluxo também podem ser usadas para estabelecer painéis com cracas,25. Estas são câmaras de escoamento com rede nos lados em que o cyprids não resolver, com painéis como a superfície de assentamento único para as larvas de plâncton.
Há várias etapas que são fundamentais para a criação de uma cultura de barnacle de funcionamento a longo prazo incluindo todas as fases da vida. Os métodos usados para cultura b. improvisus são provavelmente, em grande medida, também aplicável a outros invertebrados marinhos com livres, larvas de planktotrophic. Procedimentos de cultivo para algumas espécies já estão bem descritos (por exemplo, para diferentes espécies de ostras e mexilhões azuis)26, enquanto que para outros invertebrados marinhos, são apenas alguns exemplos das culturas a longo prazo, abrangendo toda a sua vida ciclo. Uma das primeiras tentativas bem sucedidas de cracas cultura (B. amphitrite) foi feita por Rittschof et al . 15. recursos pessoais e financeiros a longo prazo deverão estar no local antes de considerar a criação de uma craca facilidade de cultivo. A manutenção deste tipo de ano-em torno de barnacle cultura requer pelo menos uma pessoa meia tempo de trabalho. Pode haver algum potencial para a futura automação de algumas etapas na linha de produção, principalmente o cultivo de microalgas27. Além disso, para ter sucesso, é essencial ter acesso a grandes quantidades de água salgada de alta qualidade. O cultivo de microalgas, Artemia e cracas não envolve quaisquer procedimentos de segurança particular. No entanto, testes de alguns produtos antivegetativos substâncias ou produtos químicos tóxicos podem precisar de precauções especiais.
Os painéis foram verificados várias vezes por semana para contaminações. A água do mar usada na cultura foi bombeada para cima de uma profundidade de 40 m, no Fiorde de Koster, fora do laboratório de investigação marinha de Tjärnö e foi passada através de dois filtros de areia, antes de entrar no sistema de água de laboratório. Se tivesse sido feito sem filtragem da água, haveria muito mais contaminação na cultura. É essencial limpar regularmente os painéis na cultura de detritos e outros invertebrados (por exemplo, Estolho-edifício hidroides e Nemertinos predatórios) que entram no sistema através do fornecimento de água do mar, do campo. Por exemplo, se não há larvas são produzidas apesar o fato de que a cultura tem sido bem alimentados e caso contrário parece estar em boas condições, o problema pode ser a presença de Nemertinos que parecem inibir o acasalamento. Naturalmente, muitos dos organismos contaminantes na cultura no Tjärnö Marine Research Laboratory eram específicos para a costa oeste sueca, e outros tipos de contaminar organismos serão predominantes e ser mais um desafio em outras áreas geográficas. Na costa oeste da Suécia, é incomum encontrar contaminação por outras espécies de barnacle dos painéis. Ocasionalmente, o estabelecimento de S. balanoides foi encontrado, mas este é um problema muito marginal (no máximo, um s. balanoides contaminante para 10.000 amostras improvisus b. ). A falta de contaminar espécies dependia muito provável o regime a estabelecer novas culturas durante o verão, quando o larvaefrom b. improvisus foram altamente dominante. Além disso, houve também um claro enriquecimento de b. improvisus nos painéis já que esta espécie é seletiva para superfícies lisas,13.
É essencial para remover cracas morto adultas. Se as conchas vazias são deixadas nos painéis, eles podem se tornar um abrigo tanto para náuplios de Artemia , bem como para diversas espécies de contaminantes. Além disso, foi notado que os indivíduos mortos influenciam o bem-estar dos indivíduos, provavelmente com o lançamento de compostos tóxicos durante a decomposição de vizinhos. Uma consequência adicional da mortalidade adulta é que alguns indivíduos serão deixados sozinho e longe de quaisquer outros adultos para permitir o acasalamento (apesar de cracas têm o pênis mais longo no mundo animal em relação ao seu tamanho)28. Estes indivíduos sobreviverão, mas são não-produtivos para as larvas. No entanto, estes indivíduos adultos solitários suavemente podem ser removidos sem danificar a placa-base e ser colocados horizontalmente perto outros para permitir o acasalamento. Cracas também podem ser acopladas ao colocar painéis com um adulto em cada um, mas perto o suficiente para que a fertilização cruzada pode ocorrer. Desta forma, linhas genéticas podem ser produzidos14.
É fundamental para produzir um feed de alta qualidade e para alimentar as culturas quase todos os dias. Mesmo alguns dias sem comida podem resultar em um lançamento decrescente de larvas. Testes anteriores de composição da dieta têm mostrado que as diatomáceas são essenciais para o crescimento e sobrevivência dos náuplios barnacle. Várias espécies de diatomáceas parecem adequados como alimentar, apesar de células pequenas ou solitárias (inferior a 10 µm de diâmetro) podem ser necessárias para ingestão dos náuplios. As espécies S. marinoi, c. simplexe T. pseudonana todos provaram para ser alimentação adequada para improvisus b. náuplios, bem como, fácil de cultivar. Além disso, a qualidade alimentar é geralmente maior para o crescimento exponencial das algas. Também foi relatado que diatomáceas são essenciais para o estabelecimento de culturas produtivas de amphitrite B.15. Uma teoria da importância das diatomáceas é que eles têm um perfil exclusivo de ácidos gordos e são particularmente ricos em ácidos graxos poliinsaturados altamente 20:529. Ficou demonstrado que certos ácidos graxos são importantes para o desenvolvimento bem sucedido de larvas de ostras30.
Ao longo dos anos, não tem havido nenhuma incidência de doenças prejudiciais na cultura barnacle. Em muitos comerciais aquicultura invertebradas, como ostras e mexilhões, doenças são bastante comuns em podem ser muito prejudiciais. Efeitos nocivos da vírus também foram relatados a partir de populações selvagens. A ostra nativa em França foi substituída pela ostra portuguesa Crassostrea angulata em 1925, mas esta espécie foi dizimada por uma iridovirus em torno de 197031. Mais recentemente, tem havido eventos de mortalidade maciça na ostra do Pacífico Crassostrea gigas em culturas em todo o mundo, que parece ser associado com o ostreid herpesvirus 132. Não há relatórios sobre agentes patogénicos, bactérias ou vírus em cracas foram publicados até agora. No entanto, no genoma-projeto em andamento na b. improvisus, sequências de vírus foram encontradas (Alm Rosenblad et al., dados não publicados), mas com nenhuma ligação aparente com os sintomas de doenças. Misturas de antibióticos anteriormente foram aplicadas às culturas para minimizar o risco de infecções bacterianas; no entanto, este procedimento está atualmente abandonado... e até agora, isso não causou quaisquer problemas de contaminação.
Se a água do mar é aquecida (como descrito acima), superaquecimento pode ser o mais grave risco na linha de produção de cultura. É, claro, difícil de protecção contra sobreaquecimento, apesar de sensores e sistemas de alerta apropriados podem ser usado (por exemplo, enviar e-mail ou mensagens de texto para pessoas responsáveis). Incidência deste tipo no passado resultaram na morte substancial de adultos na cultura. Claro, isso pode ser devastador e arruinar investimentos a longo prazo de tempo e dinheiro. Em particular, isso seria catastrófico se estabeleceram-se linhas genéticas puras. Para garantir a longevidade de tais linhas e fixá-los de perda acidental, seria desejável desenvolver uma metodologia de criopreservação para cracas. Foi relatado que as larvas da ostra podem ser congeladas para baixo e revividas com sucesso parcial33. Cryobanking também tem sido uma ferramenta valiosa para preservar os recursos genéticos de uma vasta gama de espécies34. Até mesmo náuplios de B. amphitrite são relatados para sobreviver congelamento35, e verificou-se que 20% dos indivíduos congelados para baixo com êxito metamorfoseados em cyprids36. No entanto, aplicação de congelamento para a sustentabilidade a longo prazo das culturas até agora não foi aprovada, mas este fato seria necessário para a manutenção de linhas selecionadas; Isso seria um passo essencial para estabelecer firmemente improvisus b. em um potente modelsystem marinho.
Aqui, um protocolo foi apresentado para a dissecação dos vários tecidos dos adultos de b. improvisus (i.e., cirros, soma e cornija de lareira). No entanto, convém salientar que outros tecidos também podem ser extraídos. Por exemplo, o tecido macio entre o manto exterior e interno da espécie membranosa-base Tetraclita japonica formosana foi cuidadosamente isolado e utilizado para uma extração de RNA e RNA-seq análise da expressão de gene37. O protocolo de extração otimizado esboçado descrito aqui fornece quantidades suficientes de RNA de alta qualidade para o sequenciamento de uma quantidade mínima de material começar. Primeiro, a coleção de larvas individuais diretamente para os tubos de homogeneização minimiza qualquer perda durante a transferência de um tubo para outro. Além disso, entre os diferentes métodos testados, a homogeneização com grânulos cerâmicos provou para ser o mais eficiente em termos de RNA rendimento e integridade, comparado a homogeneização sonication ou pilão. Durante o planejamento de expressão gênica ou experimentos de genómica, um tem que ter em mente o desafio da alta variação genética em cracas, pelo menos para improvisus b.. Barnacle tem uma diversidade genética na faixa de 3 a 5%, mesmo em regiões (Alm Rosenblad et al., dados não publicados) de codificação. Isso, claro, coloca demandas específicas sobre o desenho de primers para análise de qPCR, onde mais conservadas regiões devem ser identificadas e utilizadas como modelos para as primeiras demão para obter a expressão consistentes resultados betweenbatches. As regiões conservadas de genes-alvo, como aquaporinas e at + / K + ATPase, podem ser identificados através do estudo da variabilidade de sequência destes genes em RNA-seq dados obtidos de populações de cyprids contendo centenas de indivíduos. Para uma análise do genoma, DNA vai ser amostrado. No entanto, a obtenção de DNA de alta qualidade do improvisus b. pode ser um desafio21.
Em conclusão, a cultura estabelecida barnacle provou para ser instrumental em diferentes tipos de estudos experimentais. Em particular, a todo-ano-em torno de produção larval nos permite conduzir experimentos sem se limitar ao período de desova ocorre naturalmente (para b. improvisus, isto é durante o verão). As larvas obtidas podem ser usadas para executar um amplo conjunto de estudos experimentais, incluindo ensaios de liquidação, ensaios de comportamento, estudos de expressão de genes específicos, bem como estudos de transcriptoma de todo o genoma.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Esta pesquisa foi apoiada por grant 2017-04559 do Conselho Sueco de pesquisa (VR) e o projecto com suporte da UE à beira-mar de Anders Blomberg. Em particular, a criação da facilidade de cultivo, ao longo dos anos, apoiada por subsídios para por R. Jonsson de agências de fomento seguintes: SSF (Fundação sueca para a investigação estratégica) através do programa de ciência Marinha e tecnologia e MISTRA através do programa Paint marinho. Kent Berntsson foi fundamental nas fases iniciais de criação do culturingfacility. Adicionais de financiamento para estabelecer a facilidade de cultivo chegou do centro de biologia marinha evolutiva (www.cemeb.science.gu.se), que é suportado por um fundo de Linnaeus das FORMAS de conselhos de pesquisa Sueco e VR.
Materiais
| Name | Company | Catalog Number | Comments |
| Plexiglas (poly-methyl methacrylate) panels | Plastic produkter, Bromma, Sweden | transparent glas | |
| 1.5 L PET bottle | |||
| Artemia | INVE Aquaculture, Belgium | We have tested different companies; this is really the best one | |
| Skeletonema marinoi (CCAP strain 1077/5) | CCAP (Culture Collection of Algae and Protozoa); Scotland | strain 1077/5 | |
| Chaetoceros simplex var. gracilis (CCAP strain 1085/3) | CCAP (Culture Collection of Algae and Protozoa); Scotland | strain 1085/3 | |
| Millipore cartridge filter system | Millipore | ||
| cartridge with a nominal pore size of 0.2 µm | Millipore | cartridge CWSS01S03 | High capacity for large volumes |
| polycarbonate bottle | Nalgene | autoclavable | |
| RNA later | Qiagen | 76106 | Fixation solution to preserve RNA |
| TURBO DNA-free Kit | Invitrogen/Thermofisher Scientific | AM1907 | DNAse kit to remove DNA from prepared RNA |
| iScript cDNA Synthesis Kit | Biorad | 1708890 | cDNA synthesis kit |
| SYBR Green supermix | Biorad | 1708880 | Dye for QPCR |
| RNeasy minikit | Qiagen | 74104 | RNA extraction of adults or many cyprids |
| Soft tissue homogenising CK 14, 2 ml tubes | Precellys | KT03961-1-003.2 | Ceramic beads for homogenisation |
| RNeasy micro kit | Qiagen | 74004 | RNA extraction of few cyprids |
Referências
- Darwin, C. . A monograph of the sub-class Cirripedia, with figures of all species. The Balanidae (or sessile cirripedes); the Verrucidae, etc., etc., etc. , (1854).
- Lind, U., et al. Analysis of aquaporins from the euryhaline barnacle Balanus improvisus reveals differential expression in response to changes in salinity. PLoS ONE. 12 (7), 0181192 (2017).
- Lind, U., et al. Molecular characterization of the alpha-subunit of Na+/K+ ATPase from the euryhaline barnacle Balanus improvisus reveals multiple genes and differential expression of alternative splice variants. PLoS ONE. 8, 77069 (2013).
- Fyhn, H. J. Holeuryhalinity and its mechanisms in a cirriped crustacean, Balanus improvisus. Comparative Biochemistry and Physiology - Part A: Comparative Physiology. 53 (1), 19-30 (1976).
- Wrange, A. L., et al. The story of a hitchhiker: population genetic patterns in the invasive barnacle Balanus (Amphibalanus) improvisus Darwin 1854. PLoS ONE. 11 (1), 0147082 (2016).
- Berntsson, K. M., Jonsson, P. R. Temporal and spatial patterns in recruitment and succession of a temperate marine fouling assemblage: a comparison of static panels and boat hulls during the boating season. Biofouling. 19 (3), 187-195 (2003).
- Lind, U., et al. Octopamine receptors from the barnacle Balanus improvisus. are activated by the alpha2-adrenoceptor agonist medetomidine. Molecular Pharmacology. 78 (2), 237-248 (2010).
- Semmler, H., Hoeg, J. T., Scholtz, G., Wanninger, A. Three-dimensional reconstruction of the naupliar musculature and a scanning electron microscopy atlas of nauplius development of Balanus improvisus (Crustacea: Cirripedia: Thoracica). Arthropod Structure & Development. 38 (2), 135-145 (2009).
- Anderson, D. T. . Barnacles - structure, function, development and evolution. , (1994).
- Kennedy, V. S., DiCosimo, J. Subtidal distribution of barnacles in Chesapeake Bay, Maryland. Estuaries. 6, 95-101 (1983).
- Dreanno, C., Kirby, R. R., Clare, A. S. Locating the barnacle settlement pheromone: spatial and ontogenetic expression of the settlement-inducing protein complex of Balanus amphitrite. Proceedings of the National Academy of Sciences. 273, 2721-2728 (2006).
- Rittschoff, D., et al. Cues and context: larval responses to physical and chemical cues. Biofouling. 12 (1-3), 31-44 (1998).
- Berntsson, K. M., Jonsson, P. R., Lejhall, M., Gatenholm, P. Analysis of behavioural rejection of micro-textured surfaces and implications for recruitment by the barnacle Balanus improvisus. Journal of Experimental Marine BIology and Ecology. 251 (1), 59-83 (2000).
- Gamfeldt, L., Wallén, J., Jonsson, P. R., Berntsson, K. M., Havenhand, J. N. Increasing intraspecific diversity enhances settling success in a marine invertebrate. Ecology. 86, 3219-3224 (2005).
- Rittschof, D., Clare, A. S., Gerhart, D. J., Sister Avelin, M., Bonaventura, J. Barnacle in vitro assays for biologically active substances: toxicity and settlement inhibition assays using mass cultured Balanus amphitrite amphitrite Darwin. Biofouling. 6 (2), 115-122 (1992).
- Pansch, C., Schaub, I., Havenhand, J., Wahl, M. Habitat traits and food availability determine the response of marine invertebrates to ocean acidification. Global Change Biology. 20 (3), 765-777 (2014).
- Guillard, R. R. L., Smith, W. L., Chanley, M. H. Culture of phytoplankton for feeding marine invertebrates. Culture of marine invertebrate animals. , 22-60 (1975).
- Wrange, A. L., et al. Importance of plasticity and local adaptation for coping with changing salinity in coastal areas: a test case with barnacles in the Baltic Sea. BMC Evolutionary Biology. 14, 156 (2014).
- Bacchetti De Gregoris, T., et al. Construction of an adult barnacle (Balanus amphitrite) cDNA library and selection of reference genes for quantitative RT-PCR studies. BMC Molecular Biology. 10, 62 (2009).
- Winnebeck, E. C., Millar, C. D., Warman, G. R. Why does insect RNA look degraded. Journal of Insect Science. 10, 159 (2010).
- Panova, M., et al. DNA extraction protocols for whole-genome sequencing in marine organisms. Methods in Molecular BIology. 1452, 13-44 (2016).
- Berglin, M., Larsson, A., Jonsson, P., Paul Gatenholm, P. The adhesion of the barnacle, Balanus improvisus, to poly(dimethylsiloxane) fouling-release coatings and poly(methyl methacrylate) panels: the effect of barnacle size on strength and failure mode. Journal of Adhesion Science and Technology. 15, 1485-1502 (2001).
- Larsson, A. I., Granhag, L. M., Jonsson, P. R. Instantaneous flow structures and opportunities for larval settlement: barnacle larvae swim to settle. PLoS ONE. 11, 0158957 (2016).
- Toth, G. B., Lindeborg, M. Water-soluble compounds from the breadcrumb sponge Halichondria panicea. deter attachment of the barnacle Balanus improvisus. Marine Ecology Progress Series. 354, 125-132 (2008).
- Pansch, C., Jonsson, P. R., Berglin, M., Pinori, E., Wrange, A. L. A new flow-through bioassay for testing low-emission antifouling coatings. Biofouling. 33 (8), 613-623 (2017).
- Walne, P. Observation of food value of 7 species of algae to larvae of Ostrea edulis 1. Feeding experiments. Journal of the Marine Biological Associateion of the UK. 43, 767-784 (1963).
- Sandnes, J. M., et al. Real-time monitoring and automatic density control of large-scale microalgal cultures using near infrared (NIR) optical density sensors. Journal of Biotechnology. 122 (2), 209-215 (2006).
- Neufeldt, C. J., Palmer, A. R. Precisely proportioned: intertidal barnacles alter penis form to suit coastal wave action. Proceedings of the Royal Society B Biological Sciences. 275, 1081-1087 (2008).
- Dunstan, G., Volkman, J., Barrett, S., Leroi, J., Jeffrey, S. Essential polyunsaturated fatty acids from 14 species of diatom (Bacillariophyceae). Phytochemistry. 35, 155-161 (1994).
- Jonsson, P. R., Berntsson, K., André, C., Wängberg, S. -. &. #. 1. 9. 7. ;. Larval growth and settlement of the European oyster (Ostrea edulis) as a function of food quality measured as fatty acid composition. Marine Biology. 134 (3), 559-570 (1999).
- Comps, M., Bonami, J. R., Vago, C. Virus-disease of Portuguese oyster (Crassostrea angulata. lmk). Comptes rendus hebdomadaires des séances de l'Académie des Sciences. Série D, Sciences naturelles. 282, 1991-1993 (1976).
- Segarra, A., et al. Detection and description of a particular Ostreid herpesvirus. 1 genotype associated with massive mortality outbreaks of Pacific oysters, Crassostrea gigas, in France in 2008. Virus Research. 153 (1), 92-99 (2010).
- Suquet, M., et al. Survival, growth and reproduction of cryopreserved larvae from a marine invertebrate, the Pacific oyster (Crassostrea gigas). PLoS ONE. 9 (4), 93486 (2014).
- Martínez-Páramo, S., et al. Cryobanking of aquatic species. Aquaculture. 472, 156-177 (2017).
- Anil, A. C., Tulaskar, A. S., Khandeparkar, D. C., Wagh, A. B. Cryopreservation of Balanus amphitrite nauplii. Cryobiology. 34, 131-140 (1997).
- Oo, K., et al. Cryopreservation of nauplius larvae of the barnacle, Balanus amphitrite Darwin. Fisheries Science. 64, 857-860 (1998).
- Lin, H. C., et al. First study on gene expression of cement proteins and potential adhesion-related genes of a membranous-based barnacle as revealed from next-generation sequencing technology. Biofouling. 30 (2), 169-181 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados