Method Article
Isolamento das Células Endocárdicas e Coronárias da Parede Livre Ventricular do Coração de Rato
Neste Artigo
Resumo
Apresentamos um protocolo para o isolamento de células endocárdicas e coronárias de corações de ratos através da digestão sequencial de tecidos em um tampão de digestão, coleta celular de ciclos de centrífuga recorrentes e purificação celular usando microesferas CD31 anti-ratos.
Resumo
Foi demonstrado que as células endoteleliais endocárdicas (CEE) e as células endoteliais coronárias (CECs) diferem na origem, desenvolvimento, marcadores e funções. Consequentemente, essas duas populações celulares desempenham papéis únicos em doenças cardíacas. Estudos atuais envolvendo células endoteliais isoladas investigam populações celulares constituídas por CEE e CECs. Este protocolo descreve um método para isolar independentemente essas duas populações celulares para caracterização específica da célula. Após a coleta da parede livre ventricular esquerda e direita, as células endoteliais da superfície externa e da superfície interna são separadamente liberadas usando uma solução de tampão de digestão. A digestão sequencial da superfície externa e da camada endocárdica interna mantiveram a separação das duas populações de células endoteliais. O isolamento separado das CEE e CECs é verificado ainda através da identificação de marcadores específicos para cada população. Com base no perfil de RNA de célula única publicado anteriormente no coração do mouse, a expressão genética Npr3, Hapln1e Cdh11 é exclusiva das EECs; enquanto a expressão genética Fabp4, Mglle Cd36 é exclusiva dos CECs. os dados de qPCR revelaram expressão enriquecida desses marcadores característicos em suas respectivas amostras, indicando o bem-sucedido isolamento da CEE e cec, bem como a manutenção do fenótipo celular, possibilitando uma análise funcional específica das células.
Introdução
Este artigo fornece um protocolo detalhado (modificado de Gladka et al.1) para a dissecção e posterior isolamento de células endotélicas endotélicas (CEE) e células endoteliais coronárias (CECs) de corações de ratos. A capacidade de investigar essas populações celulares de forma independente permitiria a exploração de mecanismos específicos do tipo celular subjacentes a uma variedade de doenças cardíacas que poderiam servir como alvos terapêuticos potenciais. Um método bem-sucedido para a coleta dessas populações celulares de forma independente ainda não foi publicado, no entanto.
Os CECs diferem dos CEEem em relação à sua origem, marcadores e funções durante o desenvolvimento cardíaco e a doença1,,2,,3,,4,,5,,6,,7. Os CEE sumam da superfície ventral do mesoderme cardíaco3. Elas surgem de células flk1+ progenitoras em resposta à sinalização VEGF e HIF e formam a camada mais interna das três regiões discretas do coração em desenvolvimento: o átrio, o ventrículo e o venoso sinuso3,6. O rastreamento da linhagem genética sugere que as células endocárdicas pluripotentes das células venosas sinusas derivam células venosas, que migram para formar a camada subepicárdica3. Posteriormente, a camada subepicárdica se diferencia em artérias coronárias e veias, incluindo os CECs, que permanecem através da parede livre ventricular periférica3,4. Esta via endocárdica para endotelial é regulada pela sinalização VEGFC, ELA/APJ e SOX173,4,,6,8,9. O endocárdio ventricular deriva menos CECs do septo interventricular por um mecanismo desconhecido3. Posteriormente, a diferenciação localizada entre CEE e CECs é sugerida por marcadores específicos dessas duas populações celulares, incluindo a expressão mgll , Fabp4 e Cd36 em CECs, ou NPR3, Cdh11 e expressão Hapln1 em CEE33,5,10.
CEE e CECs desempenham papéis diferentes na função cardíaca. Transição endocárdica para mesenquimal, formação de válvulas, maturação da câmara, regulação do trato de saída e desenvolvimento do canal atrioventricular estão condicionadas às CEE6. Alternativamente, os CECs contribuem para o tom vasomotor e inflamação das artérias coronárias11. Essas variâncias na função resultam em papéis individualizados no desenvolvimento da doença4,12. Por exemplo, evidências sugerem que o mau funcionamento das CEE pode levar à doença da válvula congênita6, miocárdio de não compactação6, efeito septo atrioventricular6, fibroelastose endocárdica13, síndrome do coração esquerdo hipoplásico13,hipoplasia ventricular13e hipertrofia cardíaca12. Da mesma forma, estudos descobriram que os CECs anormais contribuem para a doença arterial coronariana14 e trombose11.
O isolamento bem-sucedido das CEE e CECs é necessário para alcançar o conhecimento abrangente dessas duas populações celulares, que poderiam ser utilizados tanto na pesquisa quanto nos cenários clínicos. Determinar os fatores de crescimento e diferenciação dessas populações celulares seria uma referência para a diferenciação de subtipos endoteliais de células-tronco pluripotentes induzidas (iPSCs). Além disso, a identificação completa das variâncias no desenvolvimento, regulação e função das CEE e CECs é vital para a compreensão dos fatores genômicos e epidêmicos responsáveis por inúmeras doenças cardíacas de forma específica do tipo celular. Este artigo descreve etapas para a coleta bem-sucedida de CEE secs e CECs de forma independente, e fornece evidências de separação, avaliando os níveis de expressão genética de marcadores específicos do tipo celular.
Protocolo
Todos os procedimentos de animais foram aprovados pelo Painel Administrativo de Cuidados Com Animais Laboratoriais (APLAC31608) da Universidade de Stanford.
1. Preparação de buffers
- Prepare o buffer de digestão usando os reagentes listados na Tabela 1.
- Prepare a solução de estoque de DNase I: Dissolva o DNase I em água sem RNase para uma solução de estoque de 2.000 unidades/mL (1 mg/mL). Alíquota e armazene a solução de estoque a -20 °C.
- Prepare a solução liberase: Dissolva a liberação com água livre de RNase para uma solução de estoque de 5 mg/mL. Gire-o em um banco de rolos a 4 °C por 30 min. Alíquota e armazene a solução de estoque a -20 °C.
- Prepare o tampão de classificação diluindo 0,5 M de ácido etilenodiaminetetraacético (EDTA) e 10% de solução de albumina de soro bovino (BSA) com 1x de solução de solução de soro tampão fosfato (PBS) para uma concentração final de 2 mM de EDTA e 0,5% de BSA.
2. Coleção de coração
NOTA: Seis ratos Sprague Dawley pesando 50-100 g foram usados neste protocolo. Não foi observada diferença de gênero.
- Eutanize o rato com CO2 e coloque-o em uma posição supina em uma plataforma de dissecação. Fixar as extremidades para baixo e esterilizar o abdômen e o peito com 70% de etanol.
- Abra o abdômen com uma tesoura e insira uma agulha de 21 G na porção da veia cava posterior localizada atrás do intestino. Puxe o êmbolo de seringa para trás, retirando o sangue da veia até que o fígado pareça mais leve e não possa retirar mais sangue, indicando remoção de sangue suficiente.
- Com uma tesoura, abra o peito cuidadosamente para evitar danificar o pulmão e o coração. Levante o arco/átrio de aorta com os fórceps e corte a aorta, artéria pulmonar, veias pulmonares e veia cava para liberar e remover o coração.
- Lave o coração com 50 mL de solução de sal balanceada de 1x de Hanks (HBSS) tampão 3x para remover o sangue excessivo.
- Sob um microscópio de microdissecção, remova a parede livre ventricular direita em um tubo de 5 mL contendo o meio águia modificado de Dulbecco (DMEM) (Figura 1A,B).
- Coloque o coração em seu rosto liso e posterior para identificar o lado esquerdo e direito.
- Localize a artéria pulmonar, a mais anterior das veias e artérias que se ramificam do topo do coração e corte a artéria pulmonar até a câmara ventricular direita. Na face anterior do coração, corte ao longo do septo até atingir o ápice. Continue cortando do ápice até o lado posterior do coração ao longo do septo até a artéria pulmonar e o ponto de junção da câmara ventricular direita(Figura 1A).
- A partir da artéria pulmonar e do ponto de junção ventricular direito, corte o lado anterior e posterior do coração perpendicularmente à dissecção anterior e longe do septo, até que a parede livre ventricular direita seja liberada do resto do coração(Figura 1B).
- Sob o microscópio de microdissecção, remova a parede livre ventricular esquerda em um tubo de 5 mL contendo DMEM (Figura 1C,D).
- Localize a aorta, ramificando-se do topo do coração atrás da artéria pulmonar, e repita o método descrito na etapa 2.5 para cortar a parede livre ventricular esquerda.
3. Digestão CEI
- Coloque os tecidos de parede livre ventricular direito e esquerdo em um prato de cultura de 60 cm com a superfície interna deitada plana, voltada para baixo(Figura 2).
NOTA: A superfície interna é a face interna do ventrículo em forma de côncavo, conforme mostrado na Figura 2A,C. - Adicione 0,5-1 mL de tampão de digestão ao prato, colocando a ponta da pipeta diretamente sob o tecido. Continue até que apenas a superfície interna esteja imersa.
- Incubar o prato em uma incubadora de 5% de CO2, 37 °C por 5 min.
- Adicione o meio EC ao prato de cultura para parar a digestão.
NOTA: Mantenha a quantidade de tampão de digestão no meio CE como uma razão 1:5. - Use uma pipeta de 1 mL para lavar a superfície interna dos ventrículos com o meio EC e transferir o escoamento para um tubo de coleta de 50 mL através de um coador de 40 mm(Figura 2E). Mantenha as coleções no gelo para purificação a jusante.
4. Digestão cec
- Corte ao longo da superfície externa do ventrículo esquerdo sem contaminação da camada interna(Figura 2B,D) e coloque cada um em um tubo separado de 5 mL contendo 1 mL do tampão de digestão.
NOTA: O ventrículo esquerdo pode ser identificado como o ventrículo mais espesso, e a superfície externa pode ser determinada como a face exterior do ventrículo ligeiramente côncavo. - Usando uma tesoura de dissecção, pique a parede ventricular em pequenas, 1 mm3 pedaços.
- Incubar o tubo em um banho de água de 37 °C por cerca de 15-20 min. Vórtice a cada 2-3 min.
- Pipeta 4 mL de meio Ce no tubo de 5 mL para terminar a digestão.
- Transfira a solução com uma pipeta sorológica de 5 mL para um tubo de 50 mL através de um coador de 40 mm(Figura 2E). Mantenha as coleções no gelo para purificação a jusante.
5. Coleta de células
- Centrifugar os tubos a 300 x g por 10 min à temperatura ambiente (RT) e, em seguida, aspirar o sobrenadante.
- Se a pelota aparecer vermelha, resuspenda a pelota em 1-2 mL de 1x tampão de lontoa de glóbulos vermelhos (RBC)(Figura 2F).
NOTA: Se não houver RBCs, prossiga para a etapa 6. - Incubar os tubos em um banho de água de 37 °C por 5 min.
- Pipeta de 10 mL de PBS nos tubos de 50 mL para parar a lésia.
- Centrifugar os tubos a 300 x g por 10 min em RT, e depois aspirar o sobrenadante.
6. Classificação CE
- Adicione 90 μL de tampão de classificação e 10 μL de anticorpo anti-CD31 PE nos tubos de 50 mL.
- Vórtice os tubos e, em seguida, incuba-los por 10 min em uma geladeira de 4 °C.
- Adicione 10 mL de tampão de classificação nos tubos, misture completamente e, em seguida, centrífuga a 300 x g por 10 min em RT.
- Apiratee o sobrenadante e resuspenda a pelota em 80 μL de tampão de classificação e 20 μL de microesferas anti-PE.
- Vórtice os tubos e incubar a 4 °C por 15 min.
- Lave as células adicionando 10 mL de tampão de classificação nos tubos, misture-as completamente e, em seguida, centrifuga-as a 300 x g por 10 min no RT.
- Apiratee o sobrenadante e resuspenda a pelota em 500 μL de tampão de classificação.
- Coloque uma coluna contendo esferas superparamagnéticas em um separador magnético e enxágue a coluna com 3 mL de tampão de classificação.
- Depois que a coluna for "pare de fluxo", pipeta 500 μL da suspensão celular nas colunas e, em seguida, lavar as colunas com tampão de classificação. Repita a lavagem 3x, cada uma com 3 mL de tampão de classificação(Figura 2G).
- Remova as colunas do separador e coloque-as em cima de um novo tubo de coleta de 15 mL.
- Com uma pipeta, adicione 5 mL de meio CE às colunas e impulsione a solução usando um êmbolo de coluna.
- Centrifugar os tubos de coleta a 300 x g por 10 min em RT e, em seguida, aspirar o sobrenadante.
- Extrair o RNA da pelota celular das amostras CEE e CEC utilizando um kit, seguindo as instruções do fabricante. Um mínimo de 500 ng de RNA pode ser obtido.
NOTA: Após a extração do RNA, a amostra pode ser armazenada a -80 °C. - Transcreva inversamente 500 ng de RNA para obter cDNA usando um primer aleatório e um kit, seguindo as instruções do fabricante.
- Realizar pcr quantitativo para validação de populações endocárdicas e endoteliais (Figura 2H). As seqüências do primer estão listadas na Tabela 2.
- Adicione 5 μL de CEE ou CEC cDNA (1 ng/μL) nos poços de uma placa de 384 qPCR. Adicione o cedeao ou cec cDNA em poços suficientes para que haja três poços por número de primers.
- Misture 6 μL de tampão verde 2x qPCR SYBR com 0,5 μL de cada primer de 10 μM, incluindo primers dianteiros e reversos, e adicione-os em um único poço correspondente a cada gene candidato.
- Sele a placa com filme plástico e centrífuga por 1 min a 300 x g no RT.
- Coloque a placa em uma máquina qPCR e, em seguida, inicie o programa a 95 °C por 3 min, seguido por 95 °C para 15 s e, em seguida, 55 °C para 60 s. Repita os dois passos subseqüentes para 45 ciclos.
Resultados
O processo de isolamento CEE e CEC está descrito na Figura 2. O isolamento bem-sucedido das CEE e CECs foi determinado pela avaliação da presença de marcadores de células pan-endoteliais, bem como aqueles distintos às duas populações de subtipos. Como previsto, a qPCR βrevelou que, em relação àβ-actina,as CEE expressaram níveis mais elevados de marcadores endocárdicos Npr3, Hapln1 e Cdh11 em comparação com os CECs(Figura 3A). Da mesma forma, os CECs expressaram níveis mais elevados de marcadores coronários Fabp4, Mglle Cd36 em comparação com os CEE(Figura 3B). Além disso, tanto a CEE quanto a CEC expressaram o gene do marcador pan-CE Cdh5, com níveis ligeiramente mais elevados na CEC (Figura 3C).
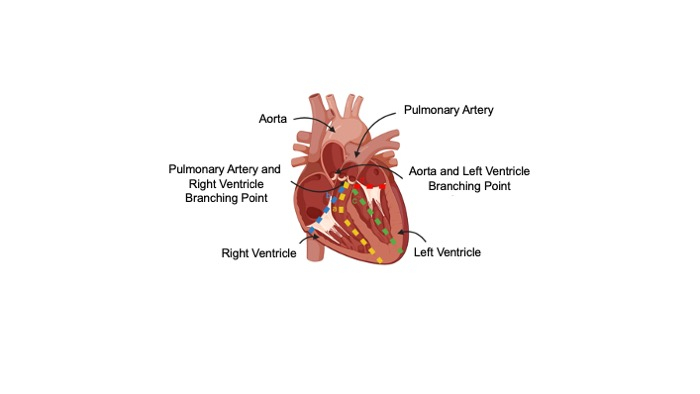
Figura 1: Diagrama da dissecção cardíaca. (A)Primeiro corte feito para separar a parede livre do ventrículo direito do septo. (B) Segundo corte feito para liberar completamente o ventrículo direito. (C) Primeiro corte feito para separar a parede livre do ventrículo esquerdo do septo. (D)Segundo corte feito para liberar completamente o ventrículo esquerdo. Clique aqui para ver uma versão maior desta figura.
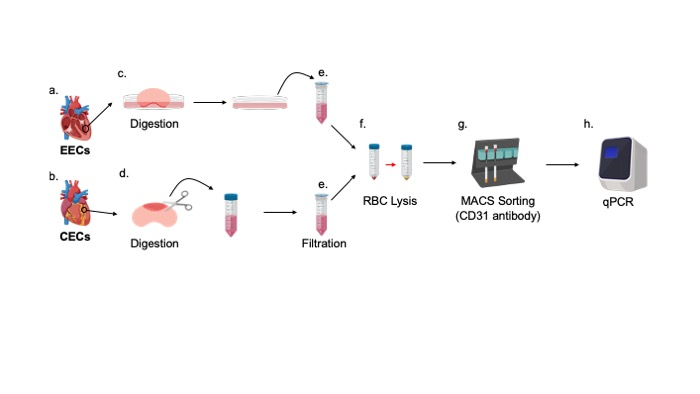
Figura 2: Diagrama da configuração de digestão dos CECs e CEEcs e o seguinte arranjo para a classificação celular. (A)A Parede ventricular mais livre e(B)parede livre ventricular mais externa foram (C) imersas em tampão de digestão ou(D) digeridos em tampão de digestão, respectivamente. (E) Coleta e filtração de soluções celulares seguidas por (F) glóbulos vermelhos (RBC) e (G) classificação celular ativada magnética (MACS) utilizando o anticorpo CD31. (h) As CE es purificadas foram processadas para verificação de expressão genética utilizando qPCR. Clique aqui para ver uma versão maior desta figura.
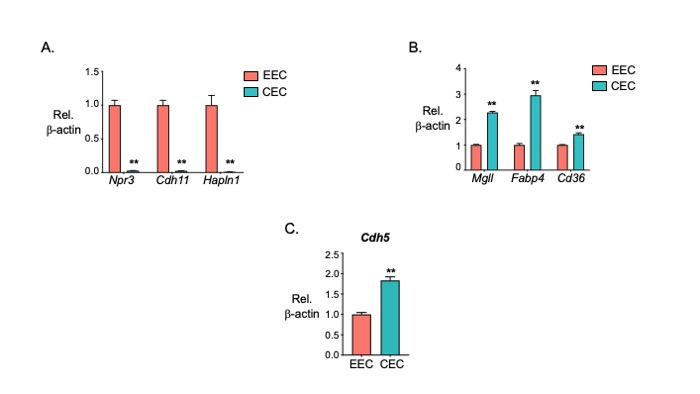
Figura 3: dados qPCR verificando o isolamento de CECs e CEECs. ( A) Os níveis de expressão genética dos marcadores CEE Npr3, Cdh11e Hapln1 em CEE e CECs foram quantificados por PCR em tempo real. (B) Os níveis de expressão genética dos marcadores CEC Mgll, Fabp4e Cd36 em CEEe e CECs foram quantificados por PCR em tempo real. (C) O marcador pan-CE Cdh5 foi quantificado em CEE e CECs por PCR em tempo real. (n = 3 em cada grupo). As barras representam a média ± SEM. *p < 0,05, **p < 0,01 vs. EEC, t-test sem pares. Clique aqui para ver uma versão maior desta figura.
| Tabela 1. Tampão de digestão (1,5ml) | |||
| Stock Con. | Último Golpe. | Volume | |
| Liberase TM | 5 mg/ml | 0,5 mg/ml | 150 ul |
| Dnase I | 1 mg/ml | 20 ug/ml | 30 ul |
| HEPES | 1 M | 10 mM | 15 ul |
| DMEM | - | - | 1305 ul |
Tabela 1: Receita para o tampão de digestão.
| Tabela 2. Seqüências de cartilha | ||
| Nome do Gene | Frente | Reverter |
| Npr3 | TCCTGCAAATCATGTGGCCTA | GGAATCTTCCCGCTCTCTC |
| Cdh11 | GTGAATGGGGGGACTGG | GTAATTTGGGGCCTTGC |
| Hapln1 | CCAGCTAAGTGACTCGAAG | GGGCCATTTTCTTGGATG |
| Mgll | CCCGGGGAAAGaC | GAAGATGAGGGCTTGGGTG |
| Fabp4 | AGAAGTGGTTTTTTCG | ACTCTCTGACCGGATGACGA |
| Cd36 | GCAAAAAAACGGGCAGGTCAA | CCCGGTCACTTTTTCtCTGA |
| Cdh5 | CCATTGAGACAGACCCCGAC | TGTGGAACGTACTGCTGG |
| B-actina | TCTGTGGATTGGTCTC | CGGACTCATCGTACTCCTGC |
Tabela 2: Seqüências de primer
Discussão
CeCs e CEE diferem em origem, marcadores e funções, podendo, portanto, desempenhar papéis únicos no desenvolvimento e na doença. Os protocolos existentes para o isolamento celular endotelial limitam-se aos tecidos macrovasculares, negligenciando a coleta de CEE, restringindo assim o estudo das funções específicas da CEC e da CEE. É essencial isolar e estudar essas duas populações de forma independente, pois esse conhecimento seria referência para a diferenciação dos iPSCs em CECs e CEEparam estudos futuros e facilitariam o exame dessas populações celulares para potenciais alvos terapêuticos para diversas doenças cardíacas. Este novo protocolo descreve um método para o isolamento de CEEs da superfície interna e CECs da superfície externa da parede livre ventricular de ratos adultos.
É fundamental controlar o tempo para cada etapa com muita precisão neste protocolo. Como o número de CEE é muito limitado no tecido cardíaco de ratos, minimizamos o tempo de digestão da camada interna do coração para evitar danos celulares e, mais importante, a contaminação do CEC. A adição imediata da solução média CE para encerrar a reação enzimática também é muito importante para manter a alta viabilidade celular. Uma pelota vermelha após a coleta de células sugere a presença de um grande número de RBCs. Dependendo da quantidade de contaminação de RBC, 1-2 mL de tampão de lyse RBC pode ser adicionado para degradar os RBCs. A incubação deve ser cuidadosamente cronometrada para evitar danos significativos às células, e pbs é prontamente adicionado para encerrar a reação. Usando o protocolo atual, fomos capazes de isolar 105 CEE de seis corações de ratos. Essas células poderiam ser semeadas em um prato de cultura celular para maior expansão e caracterização.
Ao preparar o tecido para coleta livre de parede, o coração foi lavado com HBSS para remover a maioria dos RBCs restantes. HBSS é o meio recomendado devido à sua aparência clara, o que permite a visualização de células sanguíneas, em contraste com DMED contendo fenol vermelho. A composição do tampão de digestão garante a liberação suficiente de células endoteliais, onde a enzima de digestão libera tira o tecido das células expostas, o DNase I elimina o DNA das células mortas para promover o desprendimento celular que pode ser inibido pela qualidade do DNA, o tampão HEPES equilibra o pH, e o DMEM é um meio basal modificado com maior concentração de aminoácidos e vitaminas para melhor manutenção celular e contém o cálcio necessário para ativar a liberação.
De acordo com o sequenciamento de RNA de célula única (scRNA-seq) obtido tanto do coração humano15 quanto do coração do rato10, vários marcadores atribuídos a populações específicas da CE foram relatados. Selecionamos alguns dos genes mais enriquecidos para examinar a pureza das CEEs isoladas (i.e., Npr3, Cdh11, e Hapln1) e CEE (i.e., Mgll, Fabp4e Cd36). Em relação aos marcadores β-Actin, Npr3, Cdh11e Hapln1 demonstraram maior expressão em CEE em comparação com os CECs. Da mesma forma, a expressão dos marcadores Mgll, Fabp4e Cd36 foi maior nos CECs em comparação com os CEE. Os marcadores exclusivamente expressos para cada amostra estão de acordo com marcadores característicos das CEE e CECs, respectivamente, indicando um isolamento bem-sucedido.
No entanto, o protocolo atual não pode descartar a contaminação cruzada entre as duas populações da CE durante o isolamento, mesmo com digestão seqüencial cuidadosamente controlada. Portanto, alguns marcadores de superfície celular podem ser aplicados para maior purificação. Por exemplo, o NPR3 geralmente rotula o endocárdio10,enquanto o APJ pode rastrear a maioria dos CECs16. Como esses dois marcadores são expressos na superfície celular, eles podem ser usados para a triagem celular ativada por fluorescência (FACS), e anticorpos usados para purificar ainda mais as distintas populações da CE. Além disso, o coração humano15 e o rato10 coração scRNA-seq podem confirmar o enriquecimento de Npr3 em CEE, e Cd36 pode ser potencialmente usado para purificação cec.
Em conclusão, o protocolo apresentado descreve o isolamento independente das CEE e CECs do coração do rato. A identificação abrangente das propriedades celulares, possibilitada pelo isolamento celular, pode ser utilizada para aplicações significativas a jusante.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Os autores apreciam muito a Dra. Este trabalho foi apoiado pelo NIH/NHLBI K99 HL135258 (para M.G.).
Materiais
| Name | Company | Catalog Number | Comments |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Gibco | 15630080 | 1M |
| 15ml Tubes | Eppendorf | 0030122151 | |
| 50ml Tubes | Nunc | 339652 | |
| 5ml Tubes | Eppendorf | 30119401 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Anti-CD31 PE | Miltenyi Biotec | 130-115-505 | |
| Anti-PE microbeads | Miltenyi Biotec | 130-048-801 | |
| Bovine serum albumin (BSA) | Miltenyi Biotec | 130-091-376 | 10% |
| CFX384 Touch Real-Time PCR Detection System | Bio-rad | 1855485 | For qPCR |
| DNAse I | Worthington | LK 003172 | 1 mg/mL in water |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 10313021 | |
| Endothelial Cell Growth Medium-2 (EGM-2) | Lonza | CC-3162 | EC Medium |
| Ethylendiaminetetraacetic Acid (EDTA) | Invitrogen | 15575020 | 0.5 M |
| Hank's Balanced Salt Solution (HBSS) X1 | Gibco | 14025092 | |
| Hard-Shell 384-Well PCR Plates, thin wall, skirted, clear/white | Bio-rad | HSP3805 | For qPCR |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystems | 4368813 | |
| Liberase TM | Sigma Aldrich | 5401119001 | 5 mg/mL |
| MACS LS Column | Miltenyi Biotec | 130-042-401 | For EC isolation |
| MACS MultiStand | Miltenyi Biotec | 130-042-302 | For EC isolation |
| Microseal 'B' PCR Plate Sealing Film, adhesive, optical | Bio-rad | MSB1001 | For qPCR |
| Narrow Pattern Forceps | F.S.T | 11002-12 | For heart harvest |
| Nylon Sterile Strainer | Falcon | 352340 | 40 mm |
| Phosphate Buffered Saline (PBS) X1 | Gibco | 1001023 | |
| PowerUp SYBR Green Master Mix | Applied Biosystems | A25780 | For qPCR |
| Quick-RNA Microprep Kit | Zymo Research | R1050 | For RNA extraction |
| S&T Forceps - SuperGrip Tips | F.S.T | 00632-11 | For heart harvest |
| Strabismus Scissors - Tungsten Carbide | F.S.T | 14574-11 | For heart harvest |
| Vannas Spring Scissors - Microserrated | F.S.T | 15007-08 | For heart harvest |
Referências
- Gladka, M. M., et al. Single-Cell Sequencing of the Healthy and Diseased Heart Reveals Cytoskeleton-Associated Protein 4 as a New Modulator of Fibroblasts Activation. Circulation. 138 (2), 166-180 (2018).
- Koren, C. W., Sveinbjornsson, B., Smedsrod, B. Isolation and culture of endocardial endothelial cells from Atlantic salmon (Salmo salar) and Atlantic cod (Gadus morhua). Cell and Tissue Research. 290 (1), 89-99 (1997).
- Tian, X., et al. Subepicardial endothelial cells invade the embryonic ventricle wall to form coronary arteries. Cell Research. 23 (9), 1075-1090 (2013).
- Wu, B., et al. Endocardial cells form the coronary arteries by angiogenesis through myocardial-endocardial VEGF signaling. Cell. 151 (5), 1083-1096 (2012).
- Li, Y., Lui, K. O., Zhou, B. Reassessing endothelial-to-mesenchymal transition in cardiovascular diseases. Nature Reviews in Cardiology. 15 (8), 445-456 (2018).
- Zhang, H., Lui, K. O., Zhou, B. Endocardial Cell Plasticity in Cardiac Development, Diseases and Regeneration. Circulation Research. 122 (5), 774-789 (2018).
- Yu, S. Y., et al. Isolation and characterization of human coronary artery-derived endothelial cells in vivo from patients undergoing percutaneous coronary interventions. Journal of Vascular Research. 46 (5), 487-494 (2009).
- Red-Horse, K., Ueno, H., Weissman, I. L., Krasnow, M. A. Coronary arteries form by developmental reprogramming of venous cells. Nature. 464 (7288), 549-553 (2010).
- Kamimura, T., Yamagishi, T., Nakajima, Y. Avian coronary endothelium is a mosaic of sinus venosus- and ventricle-derived endothelial cells in a region-specific manner. Development, Growth and Differentiation. 60 (2), 97-111 (2018).
- Zhang, H., et al. Endocardium Minimally Contributes to Coronary Endothelium in the Embryonic Ventricular Free Walls. Circulation Research. 118 (12), 1880-1893 (2016).
- Kinlay, S., Libby, P., Ganz, P. Endothelial function and coronary artery disease. Current Opinion in Lipidology. 12 (4), 383-389 (2001).
- Jacques, D., Bkaily, G. Endocardial endothelial cell hypertrophy takes place during the development of hereditary cardiomyopathy. Molecular and Cell Biochemistry. 453 (1-2), 157-161 (2019).
- Grossfeld, P., Nie, S., Lin, L., Wang, L., Anderson, R. H. Hypoplastic Left Heart Syndrome: A New Paradigm for an Old Disease. Journal of Cardiovascular Development and Disease. 6 (1), (2019).
- Li, Y., et al. Down-regulated RGS5 by genetic variants impairs endothelial cell function and contributes to coronary artery disease. Cardiovascular Research. , (2019).
- Miao, Y., et al. Single-Cell RNA-Seq Reveals Endocardial Defect in Hypoplastic Left Heart Syndrome. bioRxiv. , (2019).
- Chen, H. I., et al. The sinus venosus contributes to coronary vasculature through VEGFC-stimulated angiogenesis. Development. 141 (23), 4500-4512 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados