É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Amostragem e processamento de escovação nasal usando videomicroscopia ciliar digital de alta velocidade – adaptação para a pandemia de COVID-19
Neste Artigo
Resumo
Para garantir uma análise funcional ciliar bem-sucedida e de alta qualidade para o diagnóstico da DCP, um método preciso e cuidadoso para amostragem e processamento do epitélio respiratório é essencial. Para continuar prestando serviço de diagnóstico de PCD durante a pandemia de COVID-19, o protocolo de videomicroscopia ciliar foi atualizado para incluir medidas adequadas de controle de infecção.
Resumo
A discinesia ciliar primária (DCP) é uma ciliopatia móvel genética, levando a doença otosinopulmonar significativa. O diagnóstico de DCP é frequentemente perdido ou atrasado devido a desafios com diferentes modalidades diagnósticas. A videomicroscopia ciliar, utilizando a Videomicroscopia Digital de Alta Velocidade (DHSV), uma das ferramentas diagnósticas para a DCP, é considerada o método ideal para a realização da análise funcional ciliar (AFC), compreendendo a análise da frequência dos batimentos ciliares (FSC) e do padrão dos batimentos (CBP). No entanto, o DHSV carece de procedimento operacional padronizado e publicado para processamento e análise de amostras. Ele também usa epitélio respiratório vivo, um problema significativo de controle de infecção durante a pandemia COVID-19. Para continuar prestando um serviço de diagnóstico durante esta crise sanitária, o protocolo de videomicroscopia ciliar foi adaptado para incluir medidas adequadas de controle de infecção.
Aqui, descrevemos um protocolo revisado para amostragem e processamento laboratorial de amostras respiratórias ciliadas, destacando as adaptações feitas para cumprir as medidas de controle de infecção por COVID-19. Resultados representativos da AFC de amostras de escovação nasal obtidas de 16 indivíduos saudáveis, processados e analisados de acordo com este protocolo, são descritos. Também ilustramos a importância da obtenção e processamento de tiras epiteliais ciliadas de ótima qualidade, uma vez que amostras que não atendem aos critérios de seleção de qualidade permitem agora a AFC, potencialmente diminuindo a confiabilidade diagnóstica e a eficiência dessa técnica.
Introdução
A discinesia ciliar primária (DCP) é uma ciliopatia móvel heterogênea hereditária, na qual os cílios respiratórios são estacionários, lentos ou discinéticos, levando ao comprometimento do clearance mucociliar e doença oto-sino-pulmonar crônica1,2,3,4. As manifestações clínicas da DCP são tosse úmida crônica e congestão nasal crônica com início na primeira infância, infecções recorrentes ou crônicas do trato respiratório superior e inferior levando a bronquiectasias, otite média e sinusite recorrentes oucrônicas5,6,7. Aproximadamente metade dos pacientes com DCP apresenta defeitos de lateralidade de órgãos, como situs inversus ou situs ambiguus. Alguns pacientes também apresentam problemas de infertilidade devido à imobilidade de espermatozoides em homens e cílios imóveis nas tubas uterinas em mulheres 1,2,8. A DCP é rara, mas a prevalência é difícil de definir, variando de 1:10.000 a 1:20.000 9,10. No entanto, acredita-se que a prevalência real de DCP seja maior devido às dificuldades no diagnóstico e à falta de suspeita clínica. Os sintomas da DCP mimetizam manifestações respiratórias comuns de outras condições respiratórias agudas ou crônicas, e os desafios diagnósticos da confirmação diagnóstica são bem conhecidos, levando a tratamento e seguimento inadequados 2,5,9,11.
A videomicroscopia ciliar, utilizando Videomicroscopia Digital de Alta Velocidade (DHSV), é uma das ferramentas diagnósticas para a DCP4,8,12,13. O DHSV é considerado o método ideal para a realização da análise funcional ciliar (AFC), compreendendo a análise da frequência dos batimentos ciliares (FSC) e do padrão dos batimentos (CBP)2,14,15,16. O DHSV utiliza epitélio respiratório vivo, geralmente obtido a partir de escovaçãonasal13.
Em vista do surto COVID-19 atual, a confirmação de um diagnóstico de PCD é agora ainda mais importante, pois as evidências sugerem que a doença respiratória subjacente pode levar a piores resultados após a infecção por COVID-1917,18. Um serviço de diagnóstico de PCD seguro e eficiente durante a pandemia atual também permitirá que pacientes confirmados com PCD se beneficiem de medidas de proteção adicionais, em comparação com a população em geral19.
A transmissão da COVID-19 ocorre principalmente através da disseminação de gotículas20. O alto potencial de transmissão a partir de pacientes assintomáticos (ou minimamente sintomáticos) é sugerido pela alta carga viral em amostranasal20. Além disso, se as partículas virais se tornarem aerossolizadas, elas permanecerão no ar por pelo menos 3 horas21. Portanto, os profissionais de saúde respiratória são expostos a um alto reservatório de carga viral durante a realização de cuidados clínicos e coleta de amostras para técnicasdiagnósticas22. Além disso, a manipulação de amostras respiratórias vivas expõe o técnico à contaminação por COVID-19. Enquanto as recomendações de melhores práticas para médicos respiratórios e cirurgiões otorrinolaringologistas que cuidam de pacientes COVID-19 estão sendo implementadas23, há uma falta de recomendações para a realização de DHSV durante a pandemia COVID-19.
Para continuar prestando um serviço de diagnóstico PCD, garantindo a segurança do profissional de saúde (realizando a coleta de amostras) e do técnico (realizando o processamento de amostras), o protocolo de videomicroscopia ciliar teve que ser adaptado durante a pandemia da COVID-19. A técnica de videomicroscopia ciliar atualmente é limitada a serviços de pesquisa e centros de diagnóstico especializados, uma vez que a AFC requer amplo treinamento e experiência. Além disso, atualmente, há uma falta de padronização e procedimento operacional preciso para o processamento e análise de amostras utilizando DHSV 4,13.
O objetivo deste trabalho é descrever os procedimentos operacionais padrão para DHSV, com particular referência às medidas de controle de infecção e segurança na amostragem e processamento do epitélio nasal vivo. Isso permitirá que o diagnóstico e o cuidado de PCD de alta qualidade continuem, apesar do atual surto de COVID-19.
Protocolo
A aprovação foi obtida do comitê de ética do hospital-faculdade de Liège e do Departamento de Higiene e Proteção à Saúde no Trabalho da Universidade.
1. Amostragem do epitélio respiratório ciliado
- Certifique-se de que os indivíduos estejam livres de infecção por pelo menos 4-6 semanas, e livres de medicação nasal e inalatória, antes da amostragem.
- Preparar preparação M199 suplementada: Suplemento Meio de Cultura Celular 199 (M199) (500 mL) com solução antibiótica (5 mL de estreptomicina/penicilina (50 μg/mL)) e solução antifúngica (5 mL de anfotericina B (2,5μg/mL)).
- Preparar 2 (um para cada narina) tubos cônicos de 15 mL com tampas e preencher cada um deles com 3 mL de M199 suplementado.
- Preparar uma escova de broncocitologia (espessura: 2 mm e comprimento: 11 mm). Corte a extremidade do fio para garantir que a escova tenha cerca de 15 cm de comprimento (Figura 1A,B). Para segurar a escova ao realizar a escovação nasal, utilize uma pinça nasal de Weil-Blakesley (Figura 1B).
- Adaptação COVID-19: Evite processar uma amostra viva de epitélio nasal de status desconhecido para COVID-19, teste o paciente para COVID-19 48 a 72 horas antes da escovação nasal para videomicroscopia ciliar. Este teste COVID-19 consiste na reação em cadeia da polimerase de uma amostra de swab nasofaríngeo24,25. Como o status do paciente para COVID-19 é desconhecido neste momento, o médico e os membros da equipe devem ser adequadamente protegidos23,26, incluindo máscara FFP2, luvas, protetor facial ou óculos e avental resistente à água de manga comprida. Em caso de indisponibilidade, impossibilidade ou dúvida do teste de PCR, efetua-se todo o processamento da escovação nasal em laboratório de biossegurança L2. Em caso de status positivo de COVID-19, adie o teste de diagnóstico de PCD e considere abordagens alternativas para gerenciar o paciente.
CUIDADO: Esta amostra do swab nasofaríngeo para o teste de COVID-19 pode induzir discinesia ciliar secundária por danificar o epitélio ciliar respiratório nasal27,28. Para evitar isso, introduzir um fino cotonete na cavidade nasal até a nasofaringe sob rígido controle endoscópico, evitando lesar os cornetos ou o septo. A amostra é então retirada da nasofaringe e retirada do cotonete sob o controle do endoscópio rígido. Com equipamento adequado, a endoscopia rígida de 0° é facilmente realizada em adultos e crianças sem trauma.
2. Obtenção de espécimes de epitélio ciliado respiratório
Adaptação COVID-19: Mesmo que o estado COVID-19 do paciente seja negativo, devido à taxa de falso-negativos, o paciente é solicitado a manter uma máscara cirúrgica em sua boca durante o procedimento, e luvas, máscara FFP2 e face shield são usados pelo médico.
- Preparo para escovação nasal
- Peça ao paciente para assoar o nariz.
- Realizar escovação nasal sob endoscopia nasal ou cega. Se estiver usando uma endoscopia nasal, examine as 2 narinas antes da escovação nasal (não repita se feito 48-72 anteriormente para COVID-19 swab nasal). O exame permite verificar a condição da mucosa (um alto grau de inflamação pode causar sangramento quando a escovação nasal é realizada, ...), a condição de cornetos inferiores (para excluir a presença de telangiectasias, por exemplo) e se o septo nasal é reto (Figura 1C).
- Peça ao paciente para se deitar, ou para sentar confortavelmente, a cabeça apoiada para trás na cadeira (porque a escovação nasal faz com que um reflexo mova a cabeça para trás). Um segundo cuidador segura a cabeça durante a escovação nasal, particularmente em crianças.
- Agite a escova no M199 suplementado antes da escovação nasal (umedecer a escova reduz a irritação da escovação).
NOTA: A escova pode estar umedecida dentro do M199 suplementado; Se o paciente for alérgico a antibióticos (penicilina e estreptomicina estão presentes no meio de cultura celular suplementado), umedeça a escova em soro fisiológico.
- Escovação nasal
- Inserir suavemente a escovação nasal, sem anestesia local ou geral13. Se estiver usando endoscopia nasal, coloque o endoscópio na entrada do nariz para visualizar o corneto nasal inferior e, em seguida, insira a escova de citologia no nariz. Se estiver realizando uma escovação nasal "cega", inserir a escova no nariz, seguindo o assoalho nasal (Figura 1D).
OBS: Alguns centros diagnósticos utilizam anestesia local com tampão de nafazolina para realizar a escovação nasal. - Mover a escova posterior e anteriormente várias vezes sobre a parte posterior do corneto nasal inferior e, em seguida, retirar. O operador deve sentir que a escova esfrega o epitélio, e o paciente pode sentir olho lacrimejante unilateral no lado da escovação.
OBS: Se a escovação nasal for realizada muito anteriormente, não serão obtidas células ciliadas, pois a cavidade nasal anterior é revestida por um epitélio transicional não ciliado. - Após a amostragem, colocar imediatamente os espécimes de escovação nasal dentro do meio de cultura. As tiras epiteliais respiratórias obtidas são deslocadas agitando-se a escova no tubo contendo o M199 suplementado e, em seguida, fecha-se o tubo (Figura 1E).
- Adaptação COVID-19: Não deslocar as tiras epiteliais agitando a escova no M199 suplementado imediatamente após a amostragem. Coloque a escova no tubo, corte o fio para que ele possa caber completamente dentro do tubo e feche o tubo imediatamente. Coloque a amostra num saco duplo hermético.
- Inserir suavemente a escovação nasal, sem anestesia local ou geral13. Se estiver usando endoscopia nasal, coloque o endoscópio na entrada do nariz para visualizar o corneto nasal inferior e, em seguida, insira a escova de citologia no nariz. Se estiver realizando uma escovação nasal "cega", inserir a escova no nariz, seguindo o assoalho nasal (Figura 1D).
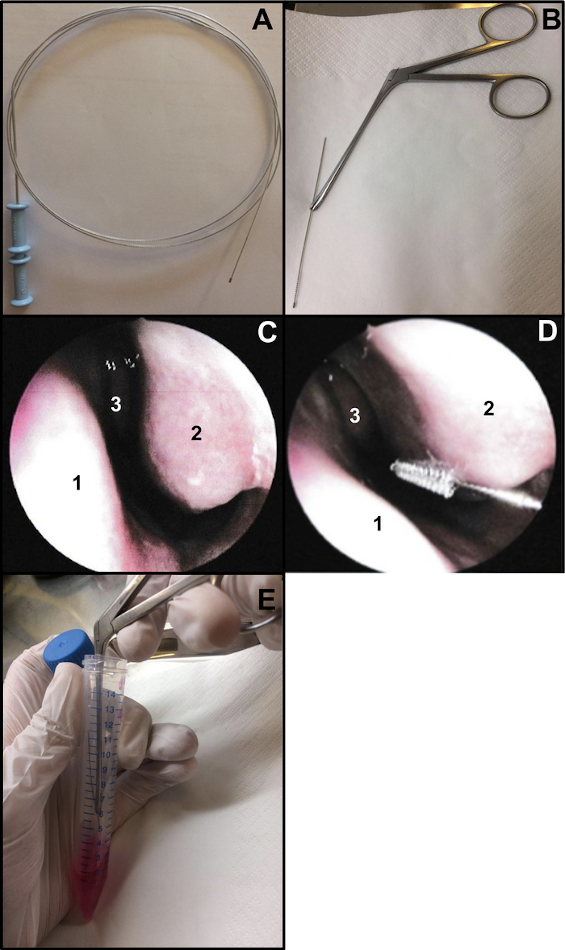
Figura 1: Técnica de escovação nasal. (A) Escova de broncocitologia completa (B) Pronta para escovar: a extremidade de escovação do fio é cortada (cerca de 15 cm de comprimento) e mantida por uma pinça nasal de Weil-Blakesley (C) Visão endoscópica da cavidade nasal: septo (1) corneto inferior (2) e corneto médio (3) (D) A escovação nasal é realizada na parte posterior do corneto inferior (2). Septo nasal (1) Concha média (3). (E) As tiras epiteliais respiratórias são deslocadas agitando-se a escova no meio de cultura celular M199 suplementado. Clique aqui para ver uma versão maior desta figura.
3. Processamento do epitélio ciliado respiratório
- Analisar amostras de escovação nasal ao microscópio dentro de 9 horas após a amostragem, pois tanto o FSC quanto a CEC estão estáveis dentro deste período de tempo (dados não publicados).
- Use um microscópio de luz vertical ou invertido, com um contraste de fase de imersão em óleo x100 ou uma lente de contraste de interferência. O ideal é colocar o microscópio em uma mesa antivibratória, pois o batimento ciliar pode estar sujeito a artefatos devido a vibrações externas (por exemplo, da bancada do laboratório)13.
Adaptação COVID-19: O operador usa equipamentos de proteção individual para realizar o processamento nasal, incluindo máscara FFP2, luvas e avental resistente à água de mangas compridas.
- Prepare a câmara de visualização.
- Suspender as tiras epiteliais ciliadas em uma câmara de visualização aberta construída em laboratório, permitindo que os cílios batam livremente enquanto são analisados ao microscópio. Esta câmara é criada pela separação de uma lamínula de cobertura (22 mm x 40 mm) e uma lâmina de vidro por duas lamínulas quadradas adjacentes (20 mm x 20 mm), separadas por uma distância de 15 mm, e coladas na lâmina de vidro12 (Figura 2, Figura 4A).
Adaptação COVID-19: A câmara construída em laboratório descrita acima é aberta e permite a troca de gases e umidade entre a amostra e o ambiente13. No contexto da pandemia de COVID-19, é possível utilizar uma câmara de visualização fechada utilizando um espaçador de dupla face presa, com 0,25 mm de profundidade (Figura 3, Figura 4B). O espaçador é preso na lâmina de vidro e, em seguida, uma tampa (22 mm x 40 mm) é presa em cima do espaçador.

Figura 2: Montagem da câmara aberta construída em laboratório. (A) As 2 lamínulas quadradas (20 mm x 20 mm) são colocadas sobre a lâmina de vidro. (B) As lamínulas de cobertura quadrada são separadas por uma distância de cerca de 15 mm, e coladas na lâmina de vidro. (C) A câmara é preenchida entre as duas lamínulas de cobertura quadrada adjacentes com uma pequena amostra (aproximadamente 60 μL) de epitélio ciliado em M199 suplementado. (D) Uma longa lamínula retangular (22 mm x 40 mm) é colocada nas duas lamínulas quadradas adjacentes e cobre a câmara. Clique aqui para ver uma versão maior desta figura.

Figura 3: Montagem da câmara fechada com espaçador de dupla face. (A) A corrediça de vidro e o espaçador de dupla face presa. (B) A proteção é removida em um dos lados do espaçador, e o espaçador é então preso na lâmina de vidro. (C) A proteção é removida do outro lado do espaçador preso de dupla face e, em seguida, o espaçador é preenchido com uma pequena amostra (aproximadamente 60 μL) de epitélio ciliado em M199 suplementado. (D) Uma longa lamínula retangular (22 mm x 40 mm) é presa no espaçador e fecha a câmara. Clique aqui para ver uma versão maior desta figura.
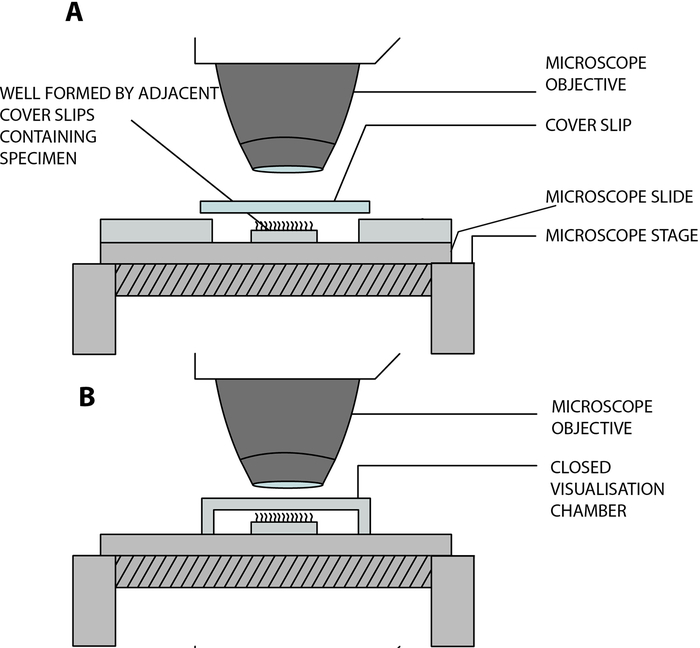
Figura 4: Diagrama esquemático mostrando as principais câmaras de visualização utilizadas para a realização da videomicroscopia ciliar por videomicroscopia digital de alta velocidade (DHSV). (A) A técnica de gota suspensa aberta: a amostra ciliada é suspensa em uma gota de meio de cultura celular em uma câmara aberta criada pela separação de uma lamínula e uma lâmina de vidro por duas lamínulas adjacentes. (B) Técnica da gota suspensa fechada: a amostra ciliada é suspensa em uma gota de meio de cultura celular em uma câmara fechada criada por um espaçador prensado entre um lado de vidro e uma lamínula. O espaçador adere firmemente na lâmina de vidro e no deslizamento da tampa. Reproduzido e modificado de Kempeneers et al.13. Clique aqui para ver uma versão maior desta figura.
- Controle de temperatura
- Envolver o microscópio com plástico bolha (Figura 5A,B).
- Conecte o aquecedor da lente ao redor da objetiva usando uma correia Velcro (Figura 5C)
- Ligue o controlador do aquecedor da lente 1 hora antes de realizar a verificação de temperatura do controle.
- Ligue o microscópio e verifique se a configuração do microscópio está feita, pois a quantidade de luz através da amostra pode alterar a temperatura na lâmina.
- Ligue o controlador da caixa aquecida (Figura 5D).
- Verifique se o teste de referência funciona corretamente antes de iniciar. Segure a ponta da sonda de referência entre os dedos; Deve medir a temperatura corporal.
- Coloque mídia livre no meio do slide, entre as duas lamínulas quadradas adjacentes (20 mm x 20 mm) coladas nele.
- Coloque a ponta da sonda de referência no M199 suplementado. Tampa com lamínula retangular (22 mm x 40 mm). Certifique-se de que a sonda esteja completamente rodeada por meios (caso contrário, a temperatura pode cair).
- Adaptação COVID-19: Para realizar o controle de temperatura na câmara fechada utilizando um espaçador, corte um dos lados do espaçador (este orifício deve ter o mesmo tamanho da sonda de referência). Coloque o espaçador na lâmina de vidro, coloque a mídia livre no meio do espaçador. Coloque a ponta da sonda de referência na solução, através do orifício do espaçador, e depois cole uma tampa retangular (22 mm x 40 mm) no espaçador.
- Coloque a lâmina na placa da caixa aquecida. Feche a caixa aquecida com a tampa.
- Adicione óleo na objetiva de imersão em óleo.
- Coloque a caixa aquecida no palco do microscópio.
- Ajustar a temperatura da placa e da tampa (a temperatura da tampa deve ser 2 °C superior à temperatura da placa para evitar condensação) para medir 37 °C com a sonda de referência dentro do meio.
- Aguarde 5 minutos (tempo necessário para elevar a temperatura da amostra para 37 °C).
- Ajuste a objetiva, aproximando-a da lâmina até tocar a tampa com a ponta da lente.
- Mova a objetiva para ver o meio da sonda no microscópio.
NOTA: Certifique-se de que a sonda é vista na tela do computador (para verificar se o sistema de câmera funciona antes de olhar para a amostra ciliada). Ao visualizar o meio da sonda, a tela fica completamente preta. - Ajuste a temperatura do aquecedor da lente (para compensar a perda de temperatura quando a lente de imersão em óleo está em contato com a tampa). Certifique-se de medir 37 °C com a sonda de referência dentro do meio quando a objetiva tocar a tampa.
OBS: O ideal é trabalhar em uma sala com temperatura controlada, para que essas temperaturas configuradas não mudem. Se a temperatura da sala não for controlada, você deve realizar essa verificação de controle de temperatura todos os dias antes de realizar a videomicroscopia ciliar. - Depois de verificar a temperatura, retire a lâmina da caixa aquecida.
- Limpe a lâmina e a ponta da sonda de referência com álcool e guarde.
- Limpe a lente com isopropanol e limpe os tecidos com movimentos circulares.

Figura 5: Equipamento utilizado no laboratório DHSV. (A) O microscópio equipado com uma lente de contraste de fase de imersão em óleo de 100x é colocado em uma mesa antivibratória para evitar que vibrações externas causem artefatos para análise funcional ciliar (B) O microscópio é cercado por plástico bolha para evitar a perda de calor do ar ambiente. (C) A objetiva de imersão em óleo gera perda de calor. Isso pode ser evitado usando um aquecedor de lente (setas). (D) A amostra é aquecida usando uma caixa de aquecimento. Clique aqui para ver uma versão maior desta figura.
4. Preparo das amostras epiteliais ciliadas respiratórias
- Agite o tubo suavemente para permitir que os cílios se espalhem por todo o tubo (para evitar que os cílios fiquem presos em outras tiras ciliadas, muco ou detritos, que impedem que batam livremente).
OBS: Esta etapa é essencial para a obtenção das "bordas ótimas" do epitélio ciliado (Figura 12). - Retirar aproximadamente 50 μL de epitélio ciliado em M199 suplementado no meio do tubo com uma pipeta.
- Coloque a amostra na câmara construída em laboratório (entre as duas lamínulas quadradas adjacentes (20 mm x 20 mm)) e cubra com uma lamínula retangular (22 mm x 40 mm). Tenha cuidado para não adicionar bolhas.
- Adaptação COVID-19: Executar as etapas 4.1-4.3 em um gabinete de segurança microbiológica. Procedimento no gabinete de segurança microbiológica.
- Ligue o armário de segurança microbiológica 10 minutos antes de preparar a amostra (para se certificar de que o ambiente é estéril).
- Antes de qualquer manuseio, desinfete todo o gabinete de segurança microbiológica com etanol 70%.
- Desinfetar todo o material necessário com etanol 70% antes de colocar no armário de segurança microbiológica.
- Abrir os tubos cônicos de 15 mL contendo as amostras apenas uma vez sob o gabinete de segurança microbiológica e, em seguida, deslocar as tiras epiteliais agitando a escova (usando pinça nasal de Weil-Blakesley) em M199 suplementado.
- Coloque o espaçador na lâmina de vidro e remova a proteção do espaçador de dupla face preso.
- Agite o tubo suavemente para permitir que os cílios se espalhem por todo o tubo.
- Retirar uma pequena amostra de epitélio ciliado em M199 suplementado do meio do tubo com uma pipeta (aproximadamente 60 μL) e preencher o espaçador.
- Cole a tampa retangular (22 mm x 40 mm) no espaçador para fechar a câmara.
- Desinfete a lâmina antes de sair do armário de segurança microbiológica.
- Retire a lâmina do armário de segurança microbiológica.
- Troque as luvas ao sair do armário de segurança microbiológica.
- Aguarde 10 minutos antes de desligar o armário de segurança microbiológica após o uso (para certificar-se de que o ambiente do armário de segurança microbiológica está estéril antes de fechar a porta).
- Coloque a lâmina na placa da caixa aquecida. Feche a caixa aquecida com a tampa.
- Adicione óleo na objetiva de imersão em óleo.
- Coloque a caixa aquecida no palco do microscópio.
- Ligue a caixa aquecida e o aquecedor da lente.
NOTA: O aquecedor de lentes deve ser ligado 1 hora antes do uso. - Ajustar as definições de temperatura da caixa aquecida e dos controladores do aquecedor de lentes de acordo com os valores obtidos no passo 3.4.
- Aguarde 5 minutos (tempo necessário para elevar a temperatura da amostra até 37 °C ao utilizar regulações predeterminadas tanto para a caixa aquecida como para o aquecedor objetivo).
- Aproxime a objetiva da lâmina até tocar a tampa com a ponta da lente.
5. Visualização das bordas ciliadas respiratórias
- Fixe a câmera de vídeo de alta velocidade no microscópio, conecte a câmera ao computador e ligue a câmera.
- Ligue o computador.
- Conecte a câmera de videomicroscopia digital de alta velocidade ao computador (para que a imagem visualizada através das lentes oculares seja projetada no monitor) através do software.
- Abra o software e, em seguida, o menu principal será aberto automaticamente (Figura 6A).
OBS: O software é o programa utilizado no laboratório para aquisição e processamento das imagens. O sistema permite que as sequências de vídeo sejam gravadas e reproduzidas a uma taxa de quadros reduzida ou quadro a quadro. Ele pode ser baixado gratuitamente. - Abra a câmera (Figura 6A).
- Quando Camera enumeration filter (Filtro de enumeração da câmera ) for exibido, escolha OK (Figura 6B).
- Selecione Atualizar lista; selecione o nome da câmera; escolha Interface: Expert e selecione Open (Figura 6C).
- Na linha de controle da câmera na parte superior do menu de diálogo encaixado, selecione Ao vivo (Figura 6D).
- Escolha Reproduzir para exibir a imagem e Parar para concluir a visualização (Figura 6D).
- Abra o software e, em seguida, o menu principal será aberto automaticamente (Figura 6A).

Figura 6: Descrição do uso do software: visualização das bordas ciliadas respiratórias no monitor. (A) O menu principal aparece diretamente ao abrir o software. (b) Feche o filtro de enumeração da câmera. (C) Escolha a câmera e selecione Interface: Expert. (D) O modo ao vivo permite visualizar no monitor a imagem vista através do microscópio. Clique aqui para ver uma versão maior desta figura.
- Ajuste a configuração de aquisição da câmera (no canto superior direito) (Figura 7).
- Em Configurações de aquisição , escolha Câmera e ajuste a taxa de quadros: Taxa (Hz): 500 (veja abaixo) (Figura 7A).
- Em Configurações de aquisição , escolha Câmera e ajuste a região de interesse (ROI) (Figura 7A).
NOTA: O ROI é calculado usando uma escala graduada visualizada com a objetiva de imersão em óleo x100 e projetada no monitor, para definir o número de pixels correspondente a 50 μm (como você deseja registrar bordas ciliadas medindo aproximadamente 50 μm (veja abaixo)). - Em Configurações de aquisição , escolha Gravar e ajuste a duração do vídeo e o número total de quadros gravados (uma duração de 2 segundos, corresponde a 1000 quadros se a taxa de quadros escolhida for 5OO Hz) (Figura 7B).
NOTA: Em nossa experiência, um mínimo de 2 segundos de duração do vídeo é necessário para permitir uma análise completa tanto da CBF quanto da CBP. - Escolha Arquivo e Salvar Cfg da câmera para salvar a nova configuração de aquisição (insira um nome e, se necessário, um comentário para essa nova configuração) (Figura 7C,D).
- Para abrir essa nova configuração de câmera, abra File and Load Camera Cfg (Figura 7C).
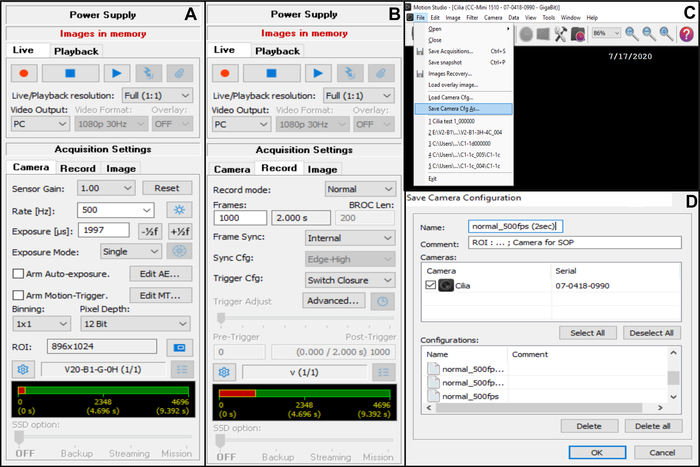
Figura 7: Descrição do uso do software: ajuste das configurações de aquisição da câmera para gravação em vídeo das bordas ciliadas batedoras. (A) Na configuração de aquisição Câmera, ajuste a região de interesse (ROI) e a taxa de quadros para gravação de vídeo (Taxa). (B) Na configuração de aquisição Record, ajuste a duração da gravação de vídeo (número de quadros necessários para a duração de gravação escolhida, de acordo com a taxa de quadros escolhida anteriormente). (C) Esta nova configuração da câmera pode ser salva usando a função Salvar câmera Cfg . Load Camera Cfg permite reabrir as definições de configuração salvas para uso posterior. (D) As novas definições de configuração da câmera podem ser nomeadas e um comentário pode ser adicionado, se necessário. Clique aqui para ver uma versão maior desta figura.
- Veja através de lentes oculares e procure células ou detritos dentro da amostra, em seguida, concentre-se.
- Verifique se a imagem está visível no monitor e melhore a qualidade da imagem ajustando o condensador (e o prisma DIC se estiver usando uma lente de contraste de interferência) e ajuste o foco, se necessário.
- Pesquisa de tiras de epitélio ciliado.
6. Seleção das bordas ciliadas respiratórias
OBS: O sistema experimental permite visualizar os cílios batidos em três planos distintos: perfil lateral, batendo diretamente em direção ao observador, e diretamente acima (Figura 8).
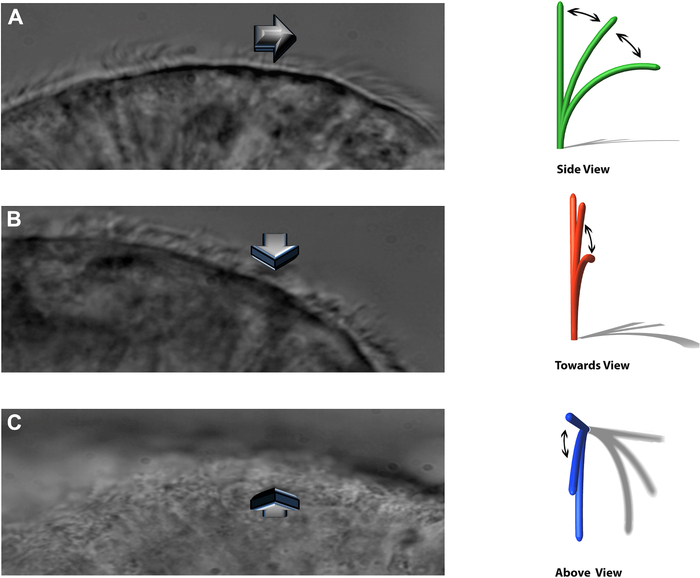
Figura 8: A técnica DHSV permite que os cílios batidos sejam visualizados em três planos distintos. (A) no perfil lateral. (B) bater diretamente em direção ao observador e. (C) diretamente de cima. Reproduzido de Kempeneers et al.16. Clique aqui para ver uma versão maior desta figura.
- Registre apenas bordas epiteliais ciliadas intactas e ininterruptas que meçam pelo menos 50 μm de comprimento.
- Para registros feitos no perfil lateral, determinar a qualidade da borda de acordo com o sistema de pontuação Thomas et al.29 (Figura 9). Utilizar apenas bordas normais (Figura 9A) ou bordas com pequenas projeções (Figura 9B) para análise funcional ciliar. Excluir células isoladas (Figura 9E).

Figura 9: Imagem representativa do sistema de pontuação de Thomas et al29 para as diferentes qualidades das bordas epiteliais ciliadas. (A) Rebordo normal: definido como uma faixa de epitélio ciliada uniforme intacta > 50 μm de comprimento (B) Rebordo ciliado com pequenas projeções: definido como uma borda >50 μm de comprimento, com células se projetando para fora da linha da borda epitelial, mas sem ponto da membrana celular apical projetando-se acima das pontas dos cílios nas células adjacentes (C) Rebordo ciliado com projeções maiores: definida como uma borda >50 μm de comprimento, com células projetando-se para fora da linha da borda epitelial, com pelo menos um ponto da membrana celular apical projetando-se acima das pontas dos cílios nas células adjacentes (D) Célula ciliada isolada: definida como a única célula ciliada em uma borda epitelial >50 μm de comprimento (E) Células únicas: definidas como células ciliadas que não têm contato entre si ou com qualquer outro tipo celular. Barra de escala: 5,5 μm. Reproduzido de Thomas et al.29Clique aqui para visualizar uma versão ampliada desta figura.
- Realizar AFC utilizando apenas cílios livres de muco e detritos, e batendo no perfil escolhido para a borda registrada. Selecione apenas bordas ciliadas que permitam um mínimo de 2 avaliações de FSC e PBC (veja abaixo) ao longo da borda.
- Utilizar para CFA apenas amostras que produzam um mínimo de 6 arestas batendo no perfil lateral e atendendo aos critérios acima; Analise no máximo 20 arestas no perfil lateral.
- Use um mínimo de 1 borda adicional de cílios batendo acima do perfil do observador para caracterizar a CEC.
7. Registro da borda ciliada
- Grave a borda dos cílios batendo usando uma taxa de quadros da câmera de 500 quadros por segundo e projete em um monitor de alta resolução. Uma taxa de quadros mínima de 400 Hz é necessária para permitir a análise tanto da CBF quanto da CBP13. Registre uma aresta a uma taxa de quadros de 30 quadros por segundo para avaliar a eficiência da folga de partículas.
- Selecione Live, na linha de controle da câmera na parte superior do menu de diálogo encaixado (Figura 6D)
- Escolha Reproduzir para exibir a imagem e Parar para concluir a visualização (Figura 6D)
- Para gravar uma borda, pressione Record (Figura 6D). Para visualizar a gravação antes de salvar, vá na linha de controle da câmera na parte superior do menu de diálogo encaixado e selecione Reprodução. Escolha Reproduzir para visualizar o vídeo gravado e Parar para concluir a visualização (Figura 10A).
Observação : pare de exibir a borda gravada antes de salvar.
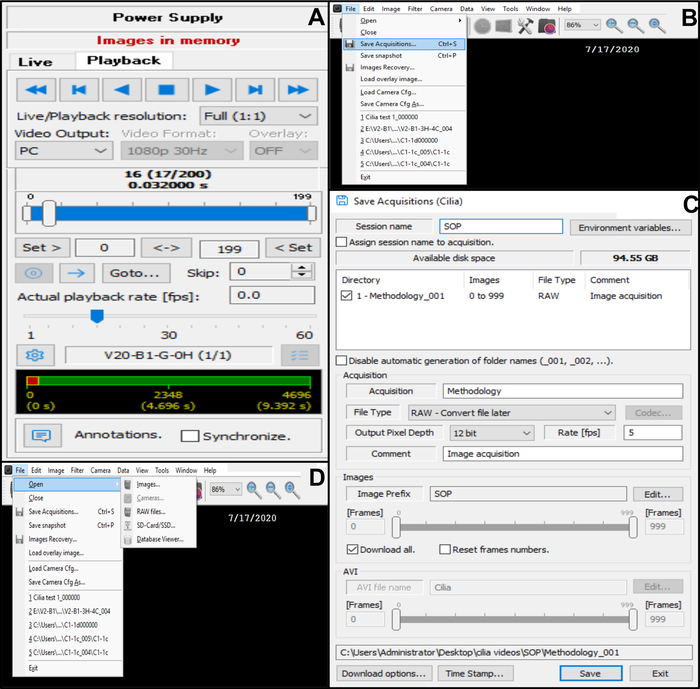
Figura 10: Descrição do uso do software. (A) modo de reprodução. Para rever uma sequência de vídeo gravada de batida ciliada de borda, escolha o Modo de Reprodução. Escolha Reproduzir para exibir a imagem e Parar para concluir a visualização. A taxa de fama pode ser ajustada para melhorar a análise da função ciliar (B, C) Salvando as gravações de vídeo das bordas ciliadas batidas (B) Para salvar o vídeo, escolha Arquivo e Salvar aquisições. (C) Digite o nome do vídeo gravado e escolha o local onde o vídeo é gravado. Certifique-se de que a gravação é salva como um arquivo . Arquivo RAW (D) escolha de uma gravação de bordas ciliadas a serem analisadas: Para abrir uma gravação de vídeo, escolha Arquivo, depois Abrir e, em seguida, Imagens. Clique aqui para ver uma versão maior desta figura.
- Salve o vídeo no banco de dados (Figura 10B,C).
- Abra Arquivo no canto superior esquerdo e salve as aquisições (Figura 10B).
- Em Salvar aquisições, insira o nome do vídeo gravado e verifique se a gravação foi salva como um formato de tipo de arquivo RAW (Figura 10C).
- Quando o vídeo for salvo, retorne ao modo ao vivo (volte para a linha de controle da câmera na parte superior do menu de diálogo encaixado e selecione ao vivo) (Figura 6D).
- Repita o procedimento para registrar o número de arestas que atendem aos critérios de seleção exigidos para CFA.
OBS: É possível registrar várias bordas ciliadas batendo atendendo aos critérios de seleção a partir de uma lâmina, no prazo máximo de 20 minutos após o preparo da lâmina (para evitar a dessecação). Após 20 minutos, se não for possível obter arestas suficientes que atendam aos critérios de seleção, prepare um novo slide. - Retire a lâmina da caixa aquecida.
- Remova a tampa retangular e jogue-a no recipiente específico de resíduos médicos perigosos.
- Limpe a lâmina (com as duas tampas quadradas coladas nela) com etanol 70% e papel absorvente. Uma vez que o slide está limpo, ele pode ser usado novamente.
- Adaptação COVID-19: Coloque o escorregador com a tampa e o espaçador em um saco hermético, retire luvas e máscara e coloque-as no saco hermético. Coloque o saco hermético no recipiente específico para resíduos médicos perigosos.
8. Análise funcional ciliar
- Preparação preliminar para realização do manual de avaliação CBF e CBP
- Abra o software.
- Abra Arquivo no canto superior esquerdo, Abrir e Imagens (Figura 10D).
- Escolha o vídeo a ser analisado.
- Vá na linha de controle da câmera na parte superior do menu de diálogo encaixado e selecione Reprodução (Figura 10A). Escolha Reproduzir para visualizar o vídeo gravado e Parar para concluir a visualização.
- Análise manual da frequência de batimento ciliar (FSC)
- Realizar a avaliação da FBC utilizando apenas as bordas laterais.
- Divida as bordas ciliadas em aproximadamente 5 áreas adjacentes, cada uma medindo aproximadamente 10 μm (Figura 11).
- Identificar e visualizar cílios ou grupos de cílios em uma taxa de quadros reduzida, e um máximo de 2 medições de FSC são feitas em cada área, resultando em um máximo de 10 medidas de FSC ao longo de cada borda (Figura 11).
- Registre o número de quadros necessários para que um grupo de cílios complete 5 ciclos de batida.
- Converter para CBF por um cálculo simples: (CBF= taxa de quadros de gravação (Hz)/(número de quadros para 5 batimentos) x 5)13,16,30. Cílios imóveis são relatados como tendo FSC de 0 Hz13.
NOTA: ajuste a taxa de quadros ao reproduzir os vídeos gravados (Figura 10A). Isso é especialmente útil quando os cílios analisados batem muito lentamente. Aumentar a taxa de quadros ajuda a definir se os cílios batem muito lentamente ou são imóveis. - Para cada amostra, calcular a média do FSC como a média (DP) ou (IC 95%) de todos os FSC registrados no perfil lateral, incluindo os cílios estáticos.
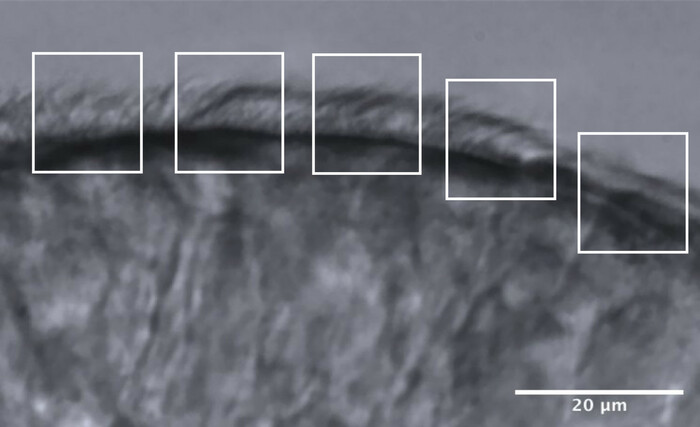
Figura 11: Imagem representativa de uma borda de ótima qualidade e a divisão em 5 áreas para permitir a análise da AFC. Uma borda epitelial ciliada de ótima qualidade é fragmentada em 5 áreas adjacentes, cada uma medindo 10 μm. Um máximo de 2 medidas de FSC (e 2 avaliações de CEC) são feitas em cada área, resultando em um máximo de 10 medidas de FSC (e avaliações de CEC) ao longo de cada borda. Barra de escala = 20 μm. Clique aqui para ver uma versão maior desta figura.
- Análise do padrão de batimento ciliar manual (CBP)
- Para avaliar os marcadores de discinesia, utilizar apenas o perfil lateral; utilizar os planos em direção ao observador e de cima para caracterizar o tipo de CEC13. Existem diferentes métodos e escores para avaliação da DLC. A seguir é descrito o método utilizado em laboratório com a definição dos marcadores de discinesia.
- A porcentagem de cada PBC distinta dentro da amostra
- Para cada cílio ou grupo de cílios identificado e utilizado para a mensuração do FSC (Figura 11), realizar uma análise da CEC a uma taxa de quadros reduzida: comparar o trajeto preciso percorrido pelos cílios durante um ciclo de batimento completo com a CEC normal observada na análise do DHSV12,30.
- Atribuir uma CEC distinta (normal, imóvel, rígida, circular, assíncrona (batimento ciliar incoordenado) oudiscinética13) a cada cílio ou grupo de cílios analisado.
- Para cada amostra, calcular a porcentagem de cada CEC distinta dentro da amostra; a DLC atribuída à amostra é a predominante observada na CEC.
- Calcular os 3 marcadores de discinesia.
- Calcular o índice de imotilidade (IMI): a porcentagem de cílios imóveis dentro da amostra (número de CBF=0/número total de leituras de FSC na amostra X 100). Expresse o IMI como média (DP) ou (IC 95%)1,16,31.
- Calcular o escore de discinesia (DKS). Divida cada borda ciliada em quadrantes, e o número de quadrantes com cílios discinéticos (ou anormalmente batendo) é determinado. Isso permite calcular uma DKS entre 0 e 4 (0: CEC normal em toda a borda; 1: CEC anormal em ≤ 25% dos cílios; 2: CEC anormal em ≤ 50% dos cílios; 3: padrão de batimento anormal em ≤ 75% dos cílios; e 4: CEC anormal em todos os cílios). A mediana da DKS (intervalo interquartil) é calculada para a amostra16,29.
- Calcular a porcentagem de batimento normal: definida como a porcentagem de cílios com CEC normal dentro da amostra (número de leituras normais de CEC/número total de leituras de CEC para a amostra x100).
Resultados
Para ilustrar a eficiência da técnica, apresentamos os resultados da AFC em uma série de 16 voluntários adultos saudáveis (5 homens, faixa etária de 22-54 anos).
Amostras de escovação nasal de 14 (4 homens, faixa etária de 24-54 anos) do total de 16 voluntários forneceram bordas epiteliais adequadas suficientes que satisfizeram os critérios de seleção necessários para a realização da AFC. Destas 14 amostras de escovação nasal, um total de 242 bordas ciliadas foram registradas...
Discussão
Este artigo visa fornecer um procedimento operacional padrão para CFA usando amostras de escovação nasal, com ajustes feitos para considerações apropriadas de controle de infecção durante a pandemia COVID-19. O diagnóstico da DCP é desafiador e, atualmente, requer um painel de diferentes testes diagnósticos, de acordo com a recomendação internacional, incluindo dosagem nasal de óxido nítrico, CFA por DHSV, análise ultraestrutural ciliar por microscopia eletrônica de transmissão (TEM), marcação de prote...
Divulgações
Esses autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer a Jean-François Papon, Bruno Louis, Estelle Escudier e a todos os membros da equipe do centro de diagnóstico PCD de Paris-Est por sua disponibilidade e calorosa recepção durante a visita ao seu centro de diagnóstico PCD, e os inúmeros intercâmbios. Também agradecemos a Robert Hirst e a todos os membros da equipe do centro PCD de Leicester por sua recepção e tempo, conselhos e experiência.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Referências
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados