Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Отбор проб и обработка носовых зубов с помощью цифровой высокоскоростной цилиарной видеомикроскопии – адаптация к пандемии COVID-19
В этой статье
Резюме
Чтобы гарантировать успешный и высококачественный цилиарный функциональный анализ для диагностики ПМД, необходим точный и тщательный метод отбора проб и обработки респираторного эпителия. Для продолжения оказания услуг по диагностике ПМС во время пандемии COVID-19 протокол цилиарной видеомикроскопии был обновлен с учетом соответствующих мер инфекционного контроля.
Аннотация
Первичная цилиарная дискинезия (ПЦД) представляет собой генетическую подвижную цилиопатию, приводящую к значительному отозинолегочному заболеванию. Диагноз PCD часто пропускается или задерживается из-за проблем с различными методами диагностики. Цилиарная видеомикроскопия с использованием цифровой высокоскоростной видеомикроскопии (DHSV), одного из диагностических инструментов для ПМД, считается оптимальным методом для выполнения цилиарного функционального анализа (CFA), включающего анализ частоты цилиарных биений (CBF) и паттерна биения (CBP). Однако в DHSV отсутствует стандартизированная, опубликованная рабочая процедура обработки и анализа образцов. Он также использует живой респираторный эпителий, что является серьезной проблемой инфекционного контроля во время пандемии COVID-19. Для продолжения предоставления диагностических услуг во время этого кризиса в области здравоохранения протокол цилиарной видеомикроскопии был адаптирован для включения адекватных мер инфекционного контроля.
Здесь мы описываем пересмотренный протокол отбора проб и лабораторной обработки мерцательных респираторных образцов, в котором освещаются адаптации, внесенные в соответствии с мерами инфекционного контроля COVID-19. Описаны репрезентативные результаты CFA из образцов чистки носа, полученных от 16 здоровых испытуемых, обработанных и проанализированных в соответствии с этим протоколом. Мы также иллюстрируем важность получения и обработки эпителиальных реснитчатых полосок оптимального качества, поскольку образцы, не соответствующие критериям отбора качества, теперь допускают CFA, что потенциально снижает диагностическую надежность и эффективность этого метода.
Введение
Первичная цилиарная дискинезия (ПКД) представляет собой наследственную гетерогенную гетерогенную подвижную цилиопатию, при которой дыхательные реснички являются стационарными, медленными или дискинетическими, что приводит к нарушению мукоцилиарного клиренса и хроническому ото-сино-легочному заболеванию 1,2,3,4. Клиническими проявлениями ПМД являются хронический влажный кашель и хроническая заложенность носа, начинающаяся в раннем младенчестве, рецидивирующие или хронические инфекции верхних и нижних дыхательных путей, приводящие к бронхоэктазам, а также рецидивирующий или хронический средний отит и синусит 5,6,7. Примерно у половины пациентов с ПМД наблюдаются дефекты латеральности органов, такие как situs inversus или situs ambiguus. У некоторых пациентов также наблюдаются проблемы с бесплодием из-за неподвижных сперматозоидов у мужчин и неподвижных ресничек в фаллопиевых трубах у женщин 1,2,8. PCD встречается редко, но распространенность трудно определить и колеблется от 1:10 000 до 1:20 000 9,10. Тем не менее, считается, что реальная распространенность PCD выше из-за трудностей в диагностике и отсутствия клинических подозрений. Симптомы PCD имитируют общие респираторные проявления других острых или хронических респираторных заболеваний, и диагностические проблемы подтверждения диагноза хорошо известны, что приводит к неадекватному лечению и последующему наблюдению 2,5,9,11.
Цилиарная видеомикроскопия с использованием цифровой высокоскоростной видеомикроскопии (DHSV) является одним из диагностических инструментов для PCD 4,8,12,13. DHSV считается оптимальным методом для выполнения цилиарного функционального анализа (CFA), включающего анализ частоты цилиарных ударов (CBF) и паттерна биений (CBP) 2,14,15,16. DHSV использует живой респираторный эпителий, обычно получаемый при чистке носа13.
В связи с нынешней вспышкой COVID-19 подтверждение диагноза ПМД в настоящее время становится еще более важным, поскольку фактические данные свидетельствуют о том, что основное респираторное заболевание может привести к худшим исходам после зараженияCOVID-19 17,18. Безопасная и эффективная диагностическая служба PCD во время нынешней пандемии также позволит пациентам с подтвержденным PCD воспользоваться дополнительными защитными мерами по сравнению с населением в целом19.
Передача COVID-19 происходит в основном воздушно-капельнымпутем20. О высокой потенциальной передаче инфекции от бессимптомных (или минимально симптоматических) пациентов свидетельствует высокая вирусная нагрузка в образце20 носа. Кроме того, если вирусные частицы становятся аэрозольными, они остаются в воздухе не менее 3 часов21. Таким образом, работники респираторной медицины подвергаются воздействию высокого резервуара вирусной нагрузки при оказании клинической помощи и сборе образцов для диагностических методов22. Кроме того, манипуляции с живыми образцами дыхательных путей подвергают техника риску заражения COVID-19. В то время как рекомендации передовой практики для респираторных врачей и ЛОР-хирургов, ухаживающих за пациентами с COVID-19, выполняются23, отсутствуют рекомендации по выполнению DHSV во время пандемии COVID-19.
Чтобы продолжать предоставлять услуги по диагностике PCD, обеспечивая при этом безопасность медицинского работника (выполняющего сбор образцов) и лаборанта (выполняющего обработку образца), протокол цилиарной видеомикроскопии должен был быть адаптирован во время пандемии COVID-19. Методика цилиарной видеомикроскопии в настоящее время ограничена исследовательской службой и специализированными диагностическими центрами, так как CFA требует обширной подготовки и опыта. Кроме того, в настоящее время отсутствует стандартизация и точная операционная процедура обработки и анализа образцов с использованием DHSV 4,13.
Целью данной статьи является описание стандартных операционных процедур для DHSV с особым акцентом на меры инфекционного контроля и безопасность при отборе проб и обработке живого эпителия носа. Это позволит продолжить высококачественную диагностику и лечение PCD, несмотря на текущую вспышку COVID-19.
протокол
Одобрение было получено от комитета по этике больницы и факультета Льежа и Департамента гигиены и охраны здоровья на рабочем месте университета.
1. Забор проб дыхательного мерцательного эпителия
- Перед отбором проб убедитесь, что субъекты не заражены инфекцией в течение как минимум 4-6 недель и не имеют назальных и ингаляционных лекарств.
- Приготовьте дополненный препарат M199: добавьте среду для культивирования клеток 199 (M199) (500 мл) раствором антибиотика (5 мл стрептомицина/пенициллина (50 мкг/мл)) и противогрибковым раствором (5 мл амфотерицина B (2,5 мкг/мл)).
- Подготовьте 2 (по одной на каждую ноздрю) конических пробирок объемом 15 мл с крышками и заполните каждую из них 3 мл дополненного M199.
- Подготовьте кисть для цитологического исследования бронхов (толщина: 2 мм и длина: 11 мм). Отрежьте конец проволоки, чтобы убедиться, что длина щетки составляет около 15 см (рис. 1A, B). Чтобы удерживать щетку при чистке носа, используйте носовые щипцы Weil-Blakesley (рис. 1B).
- Адаптация к COVID-19: Избегайте обработки живого образца эпителия носа с неизвестным статусом на COVID-19, проверьте пациента на COVID-19 за 48–72 часа до чистки носа для цилиарной видеомикроскопии. Этот тест на COVID-19 состоит из полимеразной цепной реакции из образца мазка из носоглотки24,25. Поскольку статус пациента на COVID-19 на данный момент неизвестен, врач и персонал должны быть надлежащим образом защищены23,26, включая маску FFP2, перчатки, лицевую маску или очки, а также водостойкий халат с длинными рукавами. В случае недоступного, невозможного или сомнительного ПЦР-тестирования, производится вся обработка чистки носа в лаборатории биобезопасности L2. В случае положительного статуса COVID-19 отложите диагностику PCD и рассмотрите альтернативные подходы к ведению пациента.
ОСТОРОЖНОСТЬ: Этот забор мазка из носоглотки для тестирования на COVID-19 может вызвать вторичную цилиарную дискинезию, повреждая носовой дыхательный цилиарный эпителий27,28. Чтобы этого избежать, вводят тонкий ватный тампон в полость носа вплоть до носоглотки под жестким эндоскопическим контролем, избегая травмирования носовых раковин или перегородки. Затем образец берется из носоглотки и удаляется ватный тампон под контролем жесткого эндоскопа. При соответствующем оборудовании жесткая эндоскопия 0° легко выполняется взрослым и детям без травм.
2. Получение образцов мерцательного эпителия дыхательных путей
Адаптация к COVID-19: Даже если статус пациента на COVID-19 отрицательный, из-за ложноотрицательного результата пациента просят держать хирургическую маску во рту во время процедуры, а врач носит перчатки, маску FFP2 и лицевой щиток.
- Подготовка к чистке носа
- Попросите пациента высморкаться.
- Выполняют чистку носа под эндоскопию носа или вслепую. Если вы используете эндоскопию носа, осмотрите 2 ноздри перед чисткой носа (не повторяйте, если ранее это было сделано 48-72 для мазка из носа COVID-19). Обследование позволяет проверить состояние слизистой оболочки (высокая степень воспаления может вызвать кровотечение при чистке носа, ...), состояние нижней носовой раковины (например, чтобы исключить наличие телеангиэктазии) и наличие носовой перегородки прямой (рис. 1В).
- Попросите пациента лечь или удобно сесть, положив голову назад на стул (потому что чистка носа вызывает рефлекс откидывать голову назад). Второй воспитатель держит голову во время чистки носа, особенно у детей.
- Встряхните щетку в дополненном M199 перед чисткой носа (увлажнение щетки уменьшает раздражение от чистки).
ПРИМЕЧАНИЕ: Щетку можно смочить в дополнении M199; Если у пациента аллергия на антибиотики (пенициллин и стрептомицин присутствуют в дополненной среде для культивирования клеток), смочите кисть в физиологическом растворе.
- Чистка носа
- Аккуратно вставьте носовую щетку без местной или общей анестезии13. Если вы используете эндоскопию носа, поместите эндоскоп у входа в нос, чтобы визуализировать нижнюю носовую раковину, затем вставьте цитологическую щетку в нос. Если вы выполняете «слепую» чистку носа, вставьте щетку в нос, следуя за дном носа (рис. 1D).
ПРИМЕЧАНИЕ: Некоторые диагностические центры используют местную анестезию тампоном нафазолина для чистки носа. - Переместите кисть кзади и кпереди несколько раз над задней частью нижней носовой раковины, а затем отойдите. Оператор должен чувствовать, что щетка натирает эпителий, и пациент может почувствовать одностороннее слезотечение на стороне щетки.
ПРИМЕЧАНИЕ: Если чистка носа выполняется слишком передне, реснитчатые клетки не будут получены, так как передняя полость носа выстлана переходным нереснитчатым эпителием. - После отбора проб немедленно поместите образцы для чистки носа в питательную среду. Полученные полоски респираторного эпителия вытесняют путем перемешивания щетки в пробирке, содержащей дополненный М199, затем закрывают пробирку (рис. 1Е).
- Адаптация к COVID-19: Не смещайте эпителиальные полоски, перемешивая кисть в дополненном M199 сразу после отбора проб. Поместите щетку в трубку, отрежьте проволоку так, чтобы она могла полностью поместиться внутри трубки, и немедленно закройте трубку. Поместите образец в герметичный двойной пакет.
- Аккуратно вставьте носовую щетку без местной или общей анестезии13. Если вы используете эндоскопию носа, поместите эндоскоп у входа в нос, чтобы визуализировать нижнюю носовую раковину, затем вставьте цитологическую щетку в нос. Если вы выполняете «слепую» чистку носа, вставьте щетку в нос, следуя за дном носа (рис. 1D).
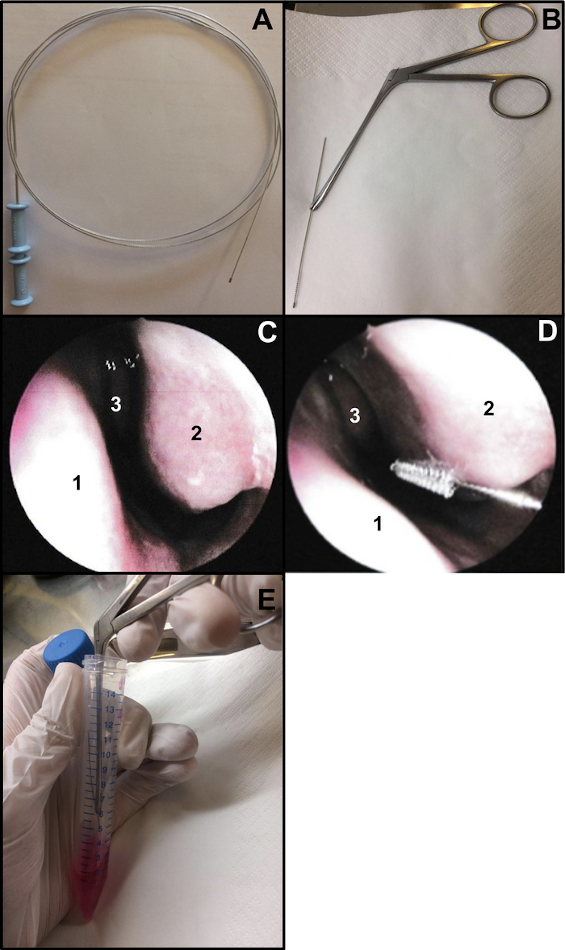
Рисунок 1: Техника чистки носа. (A) Вся щетка для цитологической очистки бронхов (B) Готовая к чистке: чистящий конец проволоки отрезается (длиной около 15 см) и удерживается носовыми щипцами Вейля-Блейксли (C) Эндоскопический вид полости носа: перегородка (1), нижняя носовая раковина (2) и средняя носовая раковина (3) (D) Чистка носа выполняется на задней части нижней носовой раковины (2). Носовая перегородка (1) Средняя носовая раковина (3). (E) Полоски респираторного эпителия смещают путем встряхивания щетки в добавленной среде для культивирования клеток M199. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Обработка дыхательного мерцательного эпителия
- Проанализируйте образцы для чистки носа под микроскопом в течение 9 часов после отбора проб, так как и CBF, и CBP стабильны в течение этого периода времени (неопубликованные данные).
- Используйте вертикальный или инвертированный световой микроскоп с масляным фазовым контрастом x100 или интерференционно-контрастной линзой. В идеале поместите микроскоп на антивибрационный стол, потому что ресничное биение может быть подвержено артефактам из-за внешних вибраций (например, от лабораторного стола)13.
Адаптация к COVID-19: Оператор использует средства индивидуальной защиты для обработки носа, включая маску FFP2, перчатки и водостойкий халат с длинными рукавами.
- Подготовьте камеру визуализации.
- Подвешивайте реснитчатые эпителиальные полоски в лабораторной открытой камере визуализации, позволяя ресничкам свободно биться во время анализа под микроскопом. Эта камера создается путем разделения покровного стекла (22 мм х 40 мм) и предметного стекла двумя соседними квадратными покровными стеклами (20 мм х 20 мм), разделенными расстоянием 15 мм, и наклеивается на предметное стекло12 (рисунок 2, рисунок 4А).
Адаптация к COVID-19: Лабораторная камера, описанная выше, открыта и обеспечивает газо- и влагообмен между образцом и окружающей средой13. В условиях пандемии COVID-19 возможно использование закрытой камеры визуализации с использованием двусторонней застрявшей прокладки глубиной 0,25 мм (рис. 3, рис. 4B). Прокладка наклеивается на предметное стекло, а затем поверх прокладки наклеивается крышка (22 мм х 40 мм).

Рисунок 2: Монтаж открытой камеры, построенной в лаборатории. (A) 2 квадратных покровных стекла (20 мм x 20 мм) помещаются на предметное стекло. (B) Квадратные крышки отделяются друг от друга на расстоянии около 15 мм и приклеиваются к предметному стеклу. (C) Камера заполняется между двумя соседними квадратными покровными шликерами небольшим образцом (приблизительно 60 мкл) мерцательного эпителия в дополненном M199. (D) Длинное прямоугольное защитное стекло (22 мм х 40 мм) помещается на два соседних квадратных защитного стекла и закрывает камеру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Монтаж закрытой камеры с помощью двусторонней застрявшей распорки. (A) Стеклянное стекло и двухсторонняя застрявшая прокладка. (B) Защита снимается с одной стороны прокладки, а затем прокладка застревает на предметном стекле. (C) Защита снимается с другой стороны двусторонней застрявшей прокладки, а затем прокладка заполняется небольшим образцом (приблизительно 60 мкл) мерцательного эпителия в дополненном M199. (D) Длинное прямоугольное защитное стекло (22 мм x 40 мм) наклеивается на распорку и закрывает камеру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
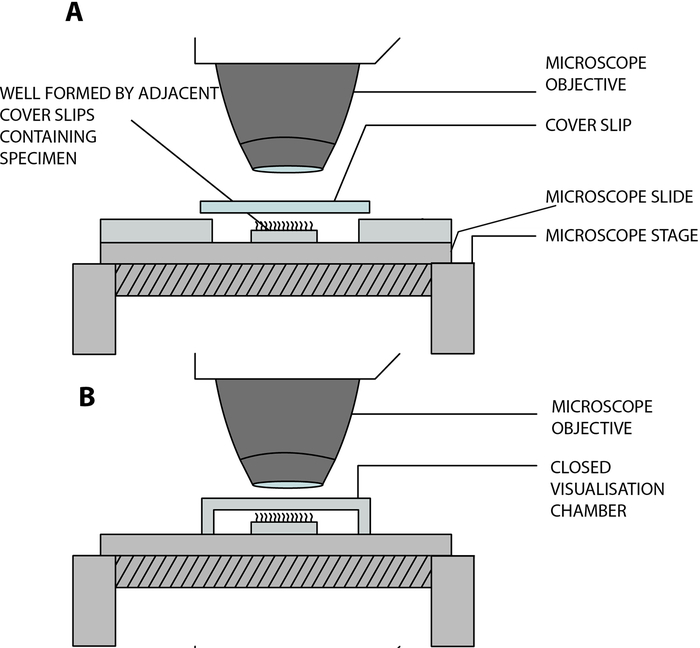
Рисунок 4: Принципиальная схема, показывающая основные камеры визуализации, используемые для выполнения цилиарной видеомикроскопии с использованием цифровой высокоскоростной видеомикроскопии (DHSV). (A) Метод открытой подвесной капли: реснитчатый образец суспендирован в капле среды для культивирования клеток в открытой камере, созданной путем разделения покровного стекла и предметного стекла двумя соседними покровными стеклами. (B) Метод закрытой подвесной капли: реснитчатый образец суспендирован в капле среды для культивирования клеток в закрытой камере, созданной прокладкой, зажатой между стеклянной стороной и покровным стеклом. Прокладка прочно прилегает как к предметному стеклу, так и к крышке. Воспроизведено и изменено из Kempeneers et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Контроль температуры
- Окружите микроскоп пузырчатой пленкой (рис. 5A, B).
- Прикрепите нагреватель объектива к объективу с помощью Velcro ремешка (рис. 5C)
- Включите контроллер нагревателя объектива за 1 час до выполнения контрольной проверки температуры.
- Включите микроскоп и убедитесь, что настройка микроскопа завершена, так как количество света, проходящего через образец, может изменить температуру на предметном стекле.
- Включите контроллер нагревательной коробки (рис. 5D).
- Перед запуском убедитесь, что эталонный пробник работает правильно. Зажмите наконечник эталонного зонда между пальцами; Следует измерять температуру тела.
- Положите свободный носитель в середину предметного стекла, между двумя соседними квадратными накладками (20 мм х 20 мм), приклеенными к нему.
- Поместите наконечник эталонного зонда в дополненный M199. Обложка прямоугольным покровным стеклом (22 мм x 40 мм). Убедитесь, что зонд полностью окружен средой (иначе температура может упасть).
- Адаптация к COVID-19: Чтобы выполнить контроль температуры в закрытой камере с помощью прокладки, отрежьте одну сторону прокладки (это отверстие должно быть того же размера, что и эталонный щуп). Наклейте прокладку на предметное стекло, поместите свободный носитель в середину прокладки. Поместите наконечник эталонного зонда в раствор через отверстие прокладки, затем наклейте на прокладку прямоугольное защитное стекло (22 мм x 40 мм).
- Поместите горку в пластину обогреваемой коробки. Закройте нагретую коробку крышкой.
- Добавьте масло на масляный погружной объектив.
- Поместите нагретый ящик на столик микроскопа.
- Отрегулируйте температуру пластины и крышки (температура крышки должна быть на 2 °C выше, чем температура пластины, чтобы избежать образования конденсата), чтобы измерить 37 °C эталонным зондом в среде.
- Подождите 5 минут (время, необходимое для повышения температуры образца до 37 °C).
- Отрегулируйте объектив, перемещая его ближе к слайду до касания покровного стекла кончиком объектива.
- Переместите объектив так, чтобы увидеть середину зонда в микроскопе.
ПРИМЕЧАНИЕ: Убедитесь, что зонд виден на экране компьютера (чтобы убедиться, что система камер работает, прежде чем смотреть на реснитчатый образец). При просмотре середины зонда экран полностью черный. - Отрегулируйте температуру нагревателя объектива (чтобы компенсировать потерю температуры при контакте масляной линзы с покровным стеклом). Обязательно измерьте 37 °C эталонным зондом в среде, когда объектив касается защитного стекла.
ПРИМЕЧАНИЕ: В идеале работайте в помещении с контролируемой температурой, чтобы эти установленные температуры не менялись. Если температура в помещении не контролируется, вы должны выполнять эту контрольную проверку температуры каждый день перед выполнением цилиарной видеомикроскопии. - Проверив температуру, снимите предметное стекло с нагреваемой коробки.
- Очистите предметное стекло и наконечник эталонного зонда спиртом и уберите.
- Очистите линзу изопропанолом и очистите линзы салфетками круговыми движениями.

Рисунок 5: Оборудование, используемое в лаборатории DHSV. (A) Микроскоп, оснащенный 100-кратной масляной фазово-контрастной линзой, помещается на антивибрационный стол, чтобы избежать того, чтобы внешние вибрации вызывали артефакты для анализа цилиарного функционала (B) Микроскоп окружен пузырчатой пленкой для предотвращения потери тепла из окружающего воздуха. (C) Цель погружения в масло создает потери тепла. Предотвратить это можно с помощью обогревателя объектива (стрелки). (D) Образец нагревается с помощью нагревательной камеры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Подготовка образцов дыхательного мерцательного эпителия
- Осторожно встряхните трубку, чтобы реснички распространились по всей трубке (чтобы реснички не застряли на других реснитчатых полосках, слизи или мусоре, которые мешают им свободно биться).
ПРИМЕЧАНИЕ: Этот шаг необходим для получения «оптимальных краев» мерцательного эпителия (рис. 12). - Извлеките примерно 50 мкл мерцательного эпителия в дополненном M199 в середине трубки с помощью пипетки.
- Поместите образец в лабораторную камеру (между двумя соседними квадратными покровными шликерами (20 мм x 20 мм)) и накройте прямоугольным покровным стеклом (22 мм x 40 мм). Будьте осторожны, чтобы не добавить пузырьки.
- Адаптация к COVID-19: Выполните шаги 4.1-4.3 в шкафу микробиологической безопасности. Процедура в кабинете микробиологической безопасности.
- Включите шкаф микробиологической безопасности за 10 минут до подготовки образца (чтобы убедиться, что среда стерильна).
- Перед любым обращением продезинфицируйте весь шкаф микробиологической безопасности 70% этанолом.
- Продезинфицируйте весь необходимый материал 70% этанолом перед помещением в шкаф микробиологической безопасности.
- Откройте конические пробирки объемом 15 мл, содержащие образцы, только один раз под шкафом микробиологической безопасности, затем вытесните эпителиальные полоски, перемешивая щетку (с помощью назальных щипцов Вейла-Блейксли) в дополненном M199.
- Наклейте проставку на предметное стекло и снимите защиту с двусторонней застрявшей прокладки.
- Осторожно встряхните трубку, чтобы реснички распространились по всей трубке.
- Извлеките небольшой образец мерцательного эпителия в дополненном M199 из середины пробирки с помощью пипетки (примерно 60 мкл) и заполните спейсер.
- Наклейте прямоугольное покровное стекло (22 мм x 40 мм) на распорку, чтобы закрыть камеру.
- Продезинфицируйте предметное стекло перед выходом из шкафа микробиологической безопасности.
- Извлеките затвор из шкафа микробиологической безопасности.
- Меняйте перчатки при выходе из шкафа микробиологической безопасности.
- Подождите 10 минут, прежде чем выключать шкаф микробиологической безопасности после использования (чтобы убедиться, что среда шкафа микробиологической безопасности стерильна, прежде чем закрывать дверцу).
- Поместите горку в пластину обогреваемой коробки. Закройте нагретую коробку крышкой.
- Добавьте масло на масляный погружной объектив.
- Поместите нагретый ящик на столик микроскопа.
- Включите коробку с подогревом и обогреватель объектива.
ПРИМЕЧАНИЕ: Обогреватель объектива необходимо включить за 1 час до использования. - Отрегулируйте настройки температуры нагревательной камеры и контроллеров нагревателя объектива в соответствии со значениями, полученными на шаге 3.4.
- Подождите 5 минут (время, необходимое для повышения температуры образца до 37 °C при использовании заданных настроек как для нагреваемой камеры, так и для нагревателя объектива).
- Подойдите объектив к предметному стеклу до тех пор, пока не коснетесь кончиком объектива покровного стекла.
5. Визуализация дыхательных реснитчатых краев
- Закрепите высокоскоростную видеокамеру на микроскопе, подключите камеру к компьютеру и включите камеру.
- Включите компьютер.
- Подключите цифровую высокоскоростную видеомикроскопическую камеру к компьютеру (чтобы изображение, просматриваемое через окулярные линзы, проецировалось на монитор) с помощью программного обеспечения.
- Откройте программное обеспечение, после чего автоматически откроется главное меню (рисунок 6A).
ПРИМЕЧАНИЕ: Программное обеспечение представляет собой программу, используемую в лаборатории для получения и обработки изображений. Система позволяет записывать и воспроизводить видеопоследовательности с пониженной частотой кадров или кадр за кадром. Его можно скачать бесплатно. - Откройте камеру (рис. 6A).
- Когда появится фильтр перечисления камер, выберите OK (рисунок 6B).
- Выберите Обновить список; выбрать название камеры; выберите Interface: Expert, затем выберите Open (Открыть (рисунок 6C).
- В строке управления камерой в верхней части пристыкованного диалогового меню выберите Live ( Прямой эфир ) (рис. 6D).
- Выберите Play для просмотра изображения и Stop для завершения просмотра (рисунок 6D).
- Откройте программное обеспечение, после чего автоматически откроется главное меню (рисунок 6A).

Рисунок 6: Описание использования программного обеспечения: визуализация дыхательных реснитчатых краев на мониторе. (A) Главное меню появляется непосредственно при открытии программного обеспечения. (B) Закройте фильтр перечисления камеры. (C) Выберите камеру и выберите Интерфейс: Эксперт. (D) Режим реального времени позволяет визуализировать на мониторе изображение, увиденное через микроскоп. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Отрегулируйте настройку захвата камеры (в правом верхнем углу) (рис. 7).
- В разделе «Настройки съемки » выберите «Камера», затем отрегулируйте частоту кадров: Частота (Гц): 500 (см. ниже) (рис. 7A).
- В разделе «Настройки съемки» выберите «Камера», затем отрегулируйте интересующую область (ROI) (рис. 7A).
ПРИМЕЧАНИЕ: Рентабельность инвестиций рассчитывается с использованием градуированной шкалы, просматриваемой с помощью объектива x100 для погружения в масло и проецируемой на монитор, чтобы определить количество пикселей, соответствующее 50 мкм (так как вы хотите записать реснитчатые края размером примерно 50 мкм (см. ниже)). - В настройках захвата выберите «Запись», затем отрегулируйте продолжительность видео и общее количество записанных кадров (продолжительность 2 секунды, соответствует 1000 кадров, если выбрана частота кадров 5OO Гц) (рис. 7B).
ПРИМЕЧАНИЕ: По нашему опыту, для полного анализа как CBF, так и CBP необходима продолжительность видео не менее 2 секунд. - Выберите «Файл», затем «Сохранить камеру Cfg», чтобы сохранить новую настройку сбора данных (введите имя и, при необходимости, комментарий для этой новой конфигурации) (рис. 7, C, D).
- Чтобы открыть эту новую конфигурацию камеры, откройте File and Load Camera Cfg (рисунок 7C).
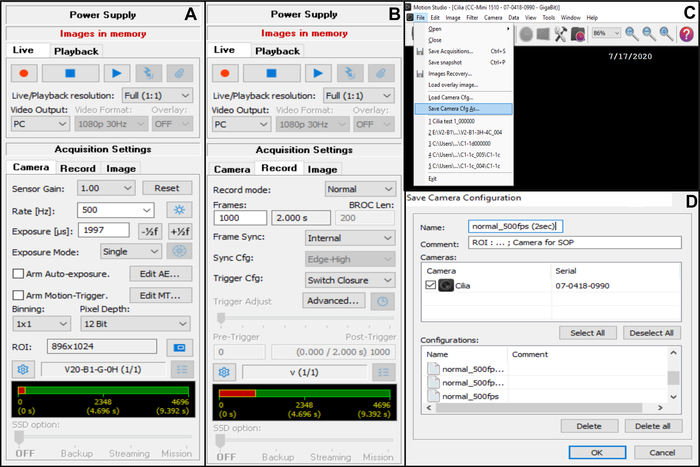
Рисунок 7: Описание использования программного обеспечения: настройка параметров съемки камеры для видеозаписи бьющих реснитчатых краев. (A) В настройках захвата Камера отрегулируйте интересующую область (ROI) и частоту кадров для видеозаписи (Скорость). (B) В настройках захвата «Запись» отрегулируйте продолжительность видеозаписи (количество кадров, необходимое для выбранной продолжительности записи, в соответствии с частотой кадров, выбранной ранее). (C) Эти новые настройки конфигурации камеры можно сохранить с помощью функции Save camera Cfg . Load Camera Cfg позволяет повторно открыть сохраненные настройки конфигурации для дальнейшего использования. (D) Новые параметры конфигурации камеры могут быть названы, и при необходимости может быть добавлен комментарий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Смотрите через окулярные линзы и ищите клетки или мусор в образце, а затем фокусируйтесь.
- Убедитесь, что изображение видно на мониторе, и улучшите качество изображения, отрегулировав конденсатор (и призму DIC при использовании интерференционно-контрастной линзы) и при необходимости отрегулируйте фокусировку.
- Поиск полосок мерцательного эпителия.
6. Выбор дыхательных реснитчатых краев
ПРИМЕЧАНИЕ: Экспериментальная система позволяет рассматривать бьющиеся реснички в трех различных плоскостях: боковой профиль, бьющийся прямо в сторону наблюдателя, и прямо сверху (рис. 8).
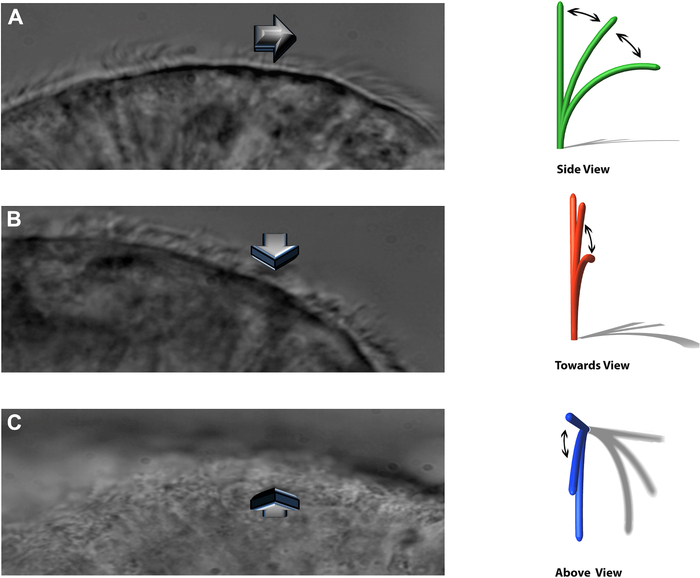
Рисунок 8: Техника DHSV позволяет рассматривать взбивание ресничек в трех различных плоскостях. (А) в боковом профиле. (B) удар прямо в сторону наблюдателя и. (C) прямо сверху. Воспроизведено по Kempeneers et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Записывайте только неповрежденные неповрежденные реснитчатые края эпителия длиной не менее 50 мкм.
- Для записей, сделанных на боковом профиле, определите качество кромки в соответствии с системой подсчета баллов Thomas et al.29 (рис. 9). Используйте только нормальные ребра (рис. 9А) или ребра с незначительными выступами (рис. 9Б) для цилиарного функционального анализа. Исключите изолированные клетки (рис. 9E).

Рисунок 9: Репрезентативное изображение системы подсчета баллов Томаса идр. 29 для различного качества реснитчатых краев эпителия. (A) Нормальный край: определяется как неповрежденная однородная полоска реснитчатого эпителия > длиной 50 мкм (B) Реснитчатый край с незначительными выступами: определяется как край длиной >50 мкм, с клетками, выступающими из линии эпителиального края, но без точки апикальной клеточной мембраны, выступающей над кончиками ресничек на соседние клетки (C) Реснитчатый край с крупными выступами: определяется как край длиной >50 мкм, с клетками, выступающими из линии эпителиального края, по крайней мере, с одной точкой апикальной клеточной мембраны, выступающей над кончиками ресничек на соседние клетки (D) Изолированная реснитчатая клетка: определяется как единственная реснитчатая клетка на эпителиальном краю длиной >50 мкм (E) Одиночные клетки: определяются как реснитчатые клетки, которые не имеют контакта между собой или любым другим типом клеток. Масштабная линейка: 5,5 мкм. Воспроизведено из Thomas et al.29Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выполняйте CFA, используя только реснички, свободные от слизи и мусора, и взбивая в профиль, выбранный для записанного края. Выбирайте только реснитчатые края, которые позволяют оценить не менее 2 CBF и CBP (см. Ниже) по краю.
- Используйте для CFA только те образцы, которые дают не менее 6 ребер, бьющихся в боковом профиле и отвечающих вышеуказанным критериям; Проанализируйте не более 20 ребер в боковом профиле.
- Используйте как минимум 1 дополнительный край ресничек, бьющих над профилем наблюдателя, чтобы охарактеризовать CBP.
7. Запись реснитчатого края
- Запишите бьющийся край ресничек, используя частоту кадров камеры 500 кадров в секунду, и проецируйте их на монитор с высоким разрешением. Минимальная частота кадров 400 Гц необходима для анализа как CBF, так и CBP13. Запишите один край с частотой кадров 30 кадров в секунду, чтобы оценить эффективность зазора от твердых частиц.
- Выберите Live на линии управления камерой в верхней части пристыкованного диалогового меню (рис. 6D)
- Выберите Play для просмотра изображения и Stop для завершения просмотра (рисунок 6D)
- Чтобы записать ребро, нажмите кнопку Record (рисунок 6D). Чтобы просмотреть запись перед сохранением, перейдите на строку управления камерой в верхней части закрепленного диалогового меню и выберите « Воспроизведение». Выберите «Воспроизвести », чтобы просмотреть записанное видео, и «Стоп», чтобы завершить просмотр (рисунок 10A).
ПРИМЕЧАНИЕ: Прекратите просмотр записанного края перед сохранением.
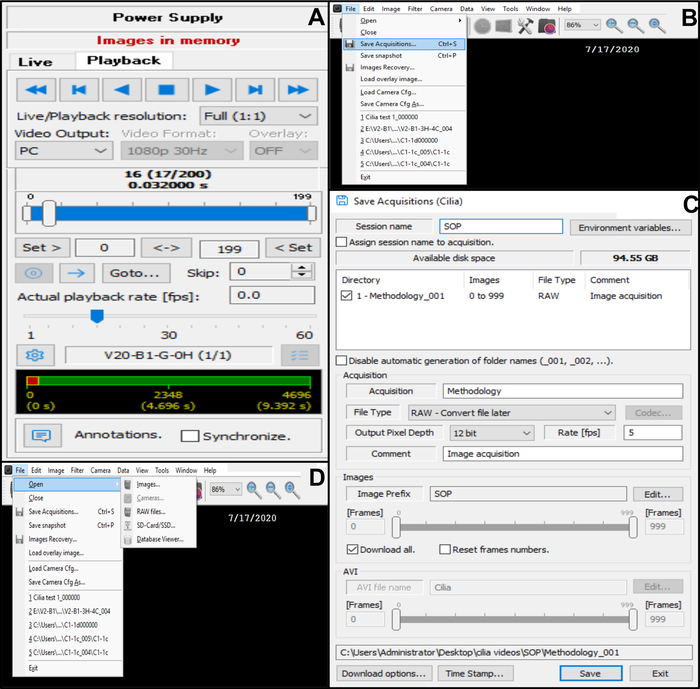
Рисунок 10: Описание использования программного обеспечения. (A) режим воспроизведения. Чтобы просмотреть записанный видеоряд ударов по реснитчатому краю, выберите Режим воспроизведения. Выберите «Воспроизвести», чтобы просмотреть изображение, и «Стоп», чтобы завершить просмотр. Скорость известности может быть скорректирована для улучшения анализа цилиарной функции (B, C) Сохранение видеозаписей биения реснитчатых краев (B) Чтобы сохранить видео, выберите «Файл», затем «Сохранить приобретения». (C) Введите название записанного видео и выберите место, где записывается видео. Убедитесь, что запись сохранена в формате . RAW-файл (D) Выбор записи бьющихся реснитчатых краев, подлежащих анализу: Чтобы открыть видеозапись, выберите «Файл», затем «Открыть», затем «Изображения». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Сохраните видео в базе данных (рис. 10B,C).
- Откройте «Файл» в левом верхнем углу и сохраните полученные данные (рисунок 10B).
- В поле Save acquisitions введите имя записанного видео и убедитесь, что запись сохранена в формате RAW (рис. 10C).
- Когда видео будет сохранено, вернитесь в режим прямой трансляции (вернитесь к строке управления камерой в верхней части закрепленного диалогового меню и выберите прямую трансляцию) (рисунок 6D).
- Повторите процедуру, чтобы записать количество ребер, отвечающих критериям выбора, необходимым для CFA.
ПРИМЕЧАНИЕ: Можно записать несколько бьющихся реснитчатых краев, отвечающих критериям отбора, с одного предметного стекла в течение максимум 20 минут после приготовления предметного стекла (чтобы избежать высыхания). Через 20 минут, если нет возможности получить достаточное количество краев, соответствующих критериям выбора, подготовьте новый слайд. - Снимите горку с нагреваемой коробки.
- Снимите прямоугольное покровное стекло и бросьте его в специальный контейнер для опасных медицинских отходов.
- Очистите предметное стекло (с приклеенными на него двумя квадратными покровными листами) 70% этанолом и впитывающей бумагой. Как только слайд очистится, его можно использовать снова.
- Адаптация к COVID-19: Поместите предметное стекло с защитным стеклом и прокладкой в герметичный пакет, снимите перчатки и маску и поместите их в герметичный пакет. Поместите герметичный пакет в специальный контейнер для опасных медицинских отходов.
8. Цилиарный функциональный анализ
- Предварительная подготовка к проведению ручной оценки CBF и CBP
- Откройте программное обеспечение.
- Откройте « Файл » в левом верхнем углу, затем « Открыть », а затем «Изображения» (рисунок 10D).
- Выберите видео для анализа.
- Перейдите на строку управления камерой в верхней части закрепленного диалогового меню и выберите «Воспроизведение» (рис. 10A). Выберите « Воспроизвести », чтобы просмотреть записанное видео, и «Стоп», чтобы завершить просмотр.
- Ручной анализ частоты цилиарных ударов (CBF)
- Выполняйте оценку CBF, используя только боковые края.
- Разделите реснитчатые края примерно на 5 смежных областей, каждая из которых имеет приблизительный размер 10 мкм (рис. 11).
- Идентифицируйте и визуализируйте реснички или группы ресничек с пониженной частотой кадров, и в каждой области выполняется не более 2 измерений CBF, в результате чего получается не более 10 измерений CBF вдоль каждого края (рис. 11).
- Запишите количество кадров, необходимое группе ресничек для завершения 5 циклов ударов.
- Преобразуйте в CBF простым расчетом: (CBF = частота кадров записи (Гц)/(количество кадров за 5 ударов) x 5)13,16,30. Сообщается, что неподвижные реснички имеют CBF 0 Гц13.
ПРИМЕЧАНИЕ: Отрегулируйте частоту кадров при воспроизведении записанных видео (Рисунок 10A). Это особенно полезно, когда анализируемые реснички бьются очень медленно. Увеличение частоты кадров помогает определить, бьются ли реснички очень медленно или неподвижны. - Для каждого образца рассчитайте среднее значение CBF как среднее значение (SD) или (95% ДИ) всех CBF, зарегистрированных в боковом профиле, включая статические реснички.
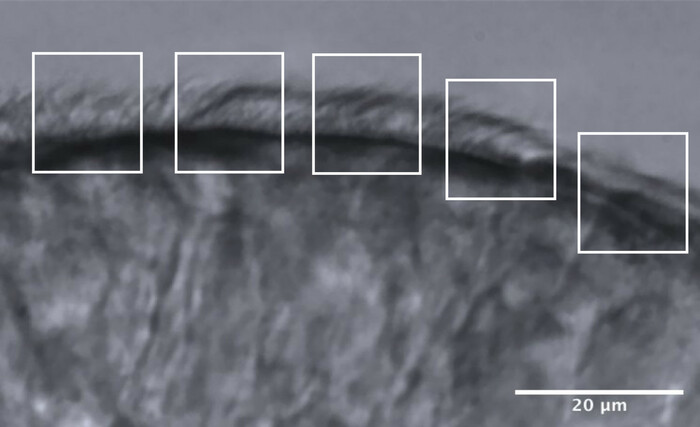
Рисунок 11: Репрезентативное изображение оптимального качества края и разделение на 5 областей для анализа CFA. Оптимального качества реснитчатый эпителиальный край фрагментирован на 5 смежных областей размером 10 мкм, каждая размером 10 мкм. В каждой области проводится не более 2 измерений CBF (и 2 оценки CBP), в результате чего получается не более 10 измерений CBF (и оценок CBP) вдоль каждого края. Масштабная линейка = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Ручной анализ цилиарного ритма (CBP)
- Для оценки маркеров дискинезии используйте только боковой профиль; использовать плоскости по направлению к наблюдателю и сверху, чтобы охарактеризовать тип CBP13. Существуют различные методы и баллы для оценки CBP. Ниже описан применяемый в лаборатории метод с определением маркеров дискинезии.
- Процент каждого отдельного CBP в выборке
- Для каждой реснички или группы ресничек, идентифицированных и использованных для измерения CBF (рис. 11), выполните анализ CBP с пониженной частотой кадров: сравните точный путь, пройденный ресничками во время полного цикла ударов, с нормальным CBP, наблюдаемым при анализе DHSV12,30.
- Приписывайте отчетливую CBP (нормальная, неподвижная, жесткая, круговая, асинхронная (некоординированное цилиарное биение) или дискинетическая13) каждой ресничкам или группе ресничек.
- Для каждого образца рассчитайте процентное содержание каждого отдельного CBP в образце; CBP, приписываемый образцу, является преобладающим наблюдаемым CBP.
- Рассчитайте 3 маркера дискинезии.
- Рассчитайте индекс иммоторности (IMI): процент неподвижных ресничек в выборке (количество CBF = 0 / общее количество показаний CBF в образце X 100). Выразите IMI как среднее (SD) или (95% ДИ)1,16,31.
- Рассчитайте показатель дискинезии (DKS). Разделите каждый реснитчатый край на квадранты, и будет определено количество квадрантов с дискинетическими (или аномально бьющимися) ресничками. Это позволяет рассчитать DKS от 0 до 4 (0: нормальный CBP по всему краю; 1: аномальный CBP у ≤ 25% ресничек; 2: аномальный CBP у ≤ 50% ресничек; 3: аномальный характер биения у ≤ 75% ресничек; и 4: аномальный CBP во всех ресничках). Медиана ДКС (межквартильный диапазон) рассчитана для выборки16,29.
- Рассчитайте процент нормального биения: определяется как процентное содержание ресничек с нормальным CBP в образце (количество нормальных показаний CBP / общее количество показаний CBP для образца x100).
Результаты
Чтобы проиллюстрировать эффективность методики, мы представляем результаты CFA в серии из 16 здоровых взрослых добровольцев (5 мужчин, возрастной диапазон 22-54 года).
Образцы для чистки носа от 14 (4 мужчин, возрастной диапазон 24-54 года) из общего числа 16 добровольцев обеспечил?...
Обсуждение
Этот документ направлен на то, чтобы предоставить стандартную операционную процедуру для CFA с использованием образцов для чистки носа с поправками, внесенными с учетом соответствующих соображений инфекционного контроля во время пандемии COVID-19. Диагностика ПМД является сложной задаче?...
Раскрытие информации
Этим авторам раскрывать нечего.
Благодарности
Мы хотели бы поблагодарить Жана-Франсуа Папона, Бруно Луи, Эстель Эскудье и всех членов команды диагностического центра PCD в Париже за их доступность и сердечный прием во время посещения их диагностического центра PCD, а также за многочисленные обмены мнениями. Мы также благодарим Роберта Херста и всех членов команды центра PCD в Лестере за их прием и время, советы и опыт.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Ссылки
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены