È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Campionamento ed elaborazione della spazzolatura nasale mediante videomicroscopia ciliare digitale ad alta velocità – Adattamento alla pandemia COVID-19
In questo articolo
Riepilogo
Per garantire un'analisi funzionale ciliare di successo e di alta qualità per la diagnosi di PCD, è essenziale un metodo preciso e attento per il campionamento e il trattamento dell'epitelio respiratorio. Per continuare a fornire un servizio diagnostico PCD durante la pandemia COVID-19, il protocollo di videomicroscopia ciliare è stato aggiornato per includere adeguate misure di controllo delle infezioni.
Abstract
La discinesia ciliare primitiva (PCD) è una ciliopatia genetica mobile, che porta a una significativa malattia otosinopolmonare. La diagnosi di PCD è spesso mancata o ritardata a causa di sfide con diverse modalità diagnostiche. La videomicroscopia ciliare, che utilizza la videomicroscopia digitale ad alta velocità (DHSV), uno degli strumenti diagnostici per la PCD, è considerata il metodo ottimale per eseguire l'analisi funzionale ciliare (CFA), che comprende l'analisi della frequenza del battito ciliare (CBF) e del pattern di battito (CBP). Tuttavia, il DHSV manca di una procedura operativa standardizzata e pubblicata per l'elaborazione e l'analisi dei campioni. Utilizza anche l'epitelio respiratorio vivente, un significativo problema di controllo delle infezioni durante la pandemia di COVID-19. Per continuare a fornire un servizio diagnostico durante questa crisi sanitaria, il protocollo di videomicroscopia ciliare è stato adattato per includere adeguate misure di controllo delle infezioni.
Qui, descriviamo un protocollo rivisto per il campionamento e l'elaborazione di laboratorio di campioni respiratori ciliati, evidenziando gli adattamenti apportati per conformarsi alle misure di controllo delle infezioni COVID-19. Vengono descritti i risultati rappresentativi del CFA da campioni di spazzolatura nasale ottenuti da 16 soggetti sani, elaborati e analizzati secondo questo protocollo. Illustriamo anche l'importanza di ottenere e trattare strisce ciliate epiteliali di qualità ottimale, poiché i campioni che non soddisfano i criteri di selezione della qualità ora consentono CFA, riducendo potenzialmente l'affidabilità diagnostica e l'efficienza di questa tecnica.
Introduzione
La discinesia ciliare primitiva (PCD) è una ciliopatia mobile eterogenea ereditaria, in cui le ciglia respiratorie sono stazionarie, lente o discineetiche, portando a compromissione della clearance mucociliare e malattia cronica oto-sino-polmonare 1,2,3,4. Le manifestazioni cliniche della PCD sono tosse umida cronica e congestione nasale cronica che inizia nella prima infanzia, infezioni ricorrenti o croniche del tratto respiratorio superiore e inferiore che portano a bronchiectasie e otite media e sinusite ricorrenti o croniche 5,6,7. Circa la metà dei pazienti con PCD presenta difetti di lateralità d'organo come situs inversus o situs ambiguus. Alcuni pazienti presentano anche problemi di infertilità dovuti allo sperma immobile negli uomini e alle ciglia immobili nelle tube di Falloppio nelle donne 1,2,8. La PCD è rara, ma la prevalenza è difficile da definire e varia da 1:10.000 a 1:20.000 9,10. Tuttavia, si ritiene che la reale prevalenza della PCD sia più elevata a causa delle difficoltà nella diagnosi e della mancanza di sospetto clinico. I sintomi della PCD imitano le manifestazioni respiratorie comuni di altre condizioni respiratorie acute o croniche e le sfide diagnostiche nel confermare la diagnosi sono ben note, portando a un trattamento e a un follow-up inadeguati 2,5,9,11.
La videomicroscopia ciliare, che utilizza la videomicroscopia digitale ad alta velocità (DHSV), è uno degli strumenti diagnostici per PCD 4,8,12,13. Il DHSV è considerato il metodo ottimale per eseguire l'analisi funzionale ciliare (CFA), comprendente l'analisi della frequenza del battito ciliare (CBF) e del pattern di battito (CBP) 2,14,15,16. DHSV utilizza epitelio respiratorio vivente, di solito ottenuto dalla spazzolatura nasale13.
Alla luce dell'attuale epidemia di COVID-19, la conferma di una diagnosi di PCD è ora ancora più importante in quanto l'evidenza suggerisce che la malattia respiratoria sottostante può portare a esiti peggiori dopo l'infezione da COVID-1917,18. Un servizio diagnostico di PCD sicuro ed efficiente durante l'attuale pandemia consentirà inoltre ai pazienti PCD confermati di beneficiare di misure protettive aggiuntive, rispetto alla popolazione generale19.
La trasmissione di COVID-19 avviene principalmente attraverso la diffusione delle goccioline20. L'alto potenziale di trasmissione da pazienti asintomatici (o minimamente sintomatici) è suggerito dall'elevata carica virale nel campione nasale20. Inoltre, se le particelle virali vengono aerosolizzate, rimangono nell'aria per almeno 3 ore21. Pertanto, gli operatori sanitari respiratori sono esposti a un elevato serbatoio di carica virale durante l'esecuzione di cure cliniche e raccolta di campioni per le tecniche diagnostiche22. Inoltre, la manipolazione di campioni respiratori viventi espone il tecnico alla contaminazione da COVID-19. Mentre le raccomandazioni sulle migliori pratiche per i medici respiratori e i chirurghi ORL che si prendono cura dei pazienti COVID-19 vengono implementate23, mancano raccomandazioni per l'esecuzione del DHSV durante la pandemia di COVID-19.
Al fine di continuare a fornire un servizio diagnostico PCD, garantendo al contempo la sicurezza dell'operatore sanitario (esecuzione della raccolta dei campioni) e del tecnico (esecuzione dell'elaborazione dei campioni), il protocollo di videomicroscopia ciliare ha dovuto essere adattato durante la pandemia di COVID-19. La tecnica della videomicroscopia ciliare è attualmente limitata ai servizi di ricerca e ai centri diagnostici specializzati, in quanto la CFA richiede una vasta formazione ed esperienza. Inoltre, attualmente, vi è una mancanza di standardizzazione e di una procedura operativa precisa per l'elaborazione e l'analisi dei campioni utilizzando DHSV 4,13.
Lo scopo di questo lavoro è quello di descrivere le procedure operative standard per il DHSV, con particolare riferimento alle misure di controllo delle infezioni e alla sicurezza durante il campionamento e il trattamento dell'epitelio nasale vivente. Ciò consentirà di continuare la diagnosi e l'assistenza alla PCD di alta qualità, nonostante l'attuale epidemia di COVID-19.
Protocollo
L'approvazione è stata ottenuta dal comitato etico dell'ospedale di Liegi e dal Dipartimento universitario per l'igiene e la protezione della salute sul lavoro.
1. Campionamento dell'epitelio ciliato respiratorio
- Assicurarsi che i soggetti siano privi di infezione per almeno 4-6 settimane e privi di farmaci nasali e inalati, prima del campionamento.
- Preparare la preparazione integrata di M199: Integrare il terreno di coltura cellulare 199 (M199) (500 ml) con soluzione antibiotica (5 ml di streptomicina/penicillina (50 μg/ml)) e soluzione antifungina (5 ml di amfotericina B (2,5μg/ml)).
- Preparare 2 (uno per ogni narice) tubi conici da 15 ml con coperchi e riempire ciascuno di essi con 3 ml di M199 integrato.
- Preparare un pennello per citologia bronchiale (spessore: 2 mm e lunghezza: 11 mm). Tagliare l'estremità del filo per assicurarsi che il pennello sia lungo circa 15 cm (Figura 1A,B). Per tenere il pennello quando si esegue la spazzolatura nasale, utilizzare una pinza nasale Weil-Blakesley (Figura 1B).
- Adattamento COVID-19: Evitare di elaborare un campione di epitelio nasale vivente di stato sconosciuto per COVID-19, testare il paziente per COVID-19 da 48 a 72 ore prima della spazzolatura nasale per la videomicroscopia ciliare. Questo test COVID-19 consiste in una reazione a catena della polimerasi da un campione di tampone nasofaringeo24,25. Poiché lo stato del paziente per COVID-19 è sconosciuto a questo punto, il medico e i membri del personale devono essere adeguatamente protetti23,26, compresa maschera FFP2, guanti, visiera o occhiali e camice resistente all'acqua a maniche lunghe. In caso di test PCR non disponibili, impossibili o dubbi, effettuate tutte le lavorazioni di spazzolatura nasale nel laboratorio di bio-sicurezza L2. In caso di stato positivo COVID-19, posticipare il test di diagnosi PCD e prendere in considerazione approcci alternativi per gestire il paziente.
CAUTELA: Questo prelievo di tampone nasofaringeo per il test COVID-19 potrebbe indurre discinesia ciliare secondaria danneggiando l'epitelio ciliare respiratorio nasale27,28. Per evitare ciò, introdurre un sottile batuffolo di cotone nella cavità nasale fino al rinofaringe sotto rigido controllo endoscopico, evitando di ferire i turbinati o il setto. Il campione viene quindi prelevato dal rinofaringe e rimuovere il batuffolo di cotone sotto il controllo dell'endoscopio rigido. Con un'attrezzatura adeguata, un'endoscopia rigida a 0° può essere facilmente eseguita in adulti e bambini senza traumi.
2. Ottenere campioni di epitelio ciliato respiratorio
Adattamento COVID-19: anche se lo stato COVID-19 del paziente è negativo, a causa del tasso di falsi negativi, al paziente viene chiesto di tenere una maschera chirurgica sulla bocca durante la procedura e guanti, maschera FFP2 e visiera sono indossati dal medico.
- Preparazione spazzolatura nasale
- Chiedere al paziente di soffiarsi il naso.
- Eseguire la spazzolatura nasale sotto endoscopia nasale o in cieco. Se si utilizza un'endoscopia nasale, esaminare le 2 narici prima della spazzolatura nasale (non ripetere se eseguita 48-72 in precedenza per il tampone nasale COVID-19). L'esame consente di verificare le condizioni della mucosa (un alto grado di infiammazione potrebbe causare sanguinamento quando viene eseguita la spazzolatura nasale, ...), la condizione del turbinato inferiore (per escludere la presenza di teleangectasie per esempio) e se il setto nasale è dritto (Figura 1C).
- Chiedere al paziente di sdraiarsi, o di sedersi comodamente, con la testa appoggiata all'indietro sulla sedia (perché la spazzolatura nasale provoca un riflesso per spostare la testa indietro). Un secondo caregiver tiene la testa durante la spazzolatura nasale, in particolare nei bambini.
- Agitare la spazzola nella M199 integrata prima della spazzolatura nasale (inumidire la spazzola riduce l'irritazione dovuta alla spazzolatura).
NOTA: il pennello potrebbe essere inumidito all'interno dell'M199 integrato; Se il paziente è allergico agli antibiotici (penicillina e streptomicina sono presenti nel terreno di coltura cellulare integrato), inumidire il pennello in soluzione salina.
- Spazzolatura nasale
- Inserire delicatamente la spazzolatura nasale senza anestesia locale o generale13. Se si utilizza l'endoscopia nasale, posizionare l'endoscopio all'ingresso del naso per visualizzare il turbinato nasale inferiore, quindi inserire il pennello citologico nel naso. Se si esegue una spazzolatura nasale "cieca", inserire il pennello nel naso, seguendo il pavimento nasale (Figura 1D).
NOTA: Alcuni centri diagnostici utilizzano l'anestesia locale con un tampone di nafazolina per eseguire la spazzolatura nasale. - Spostare il pennello posteriormente e anteriormente più volte sulla parte posteriore del turbinato nasale inferiore e quindi ritirarsi. L'operatore dovrebbe sentire che il pennello strofina l'epitelio e il paziente potrebbe sentire un occhio acquoso unilaterale sul lato della spazzolatura.
NOTA: Se la spazzolatura nasale viene eseguita troppo anteriormente, non si otterranno cellule ciliate, poiché la cavità nasale anteriore è rivestita da un epitelio transizionale non ciliato. - Dopo il campionamento, posizionare immediatamente i campioni di spazzolatura nasale all'interno del terreno di coltura. Le strisce epiteliali respiratorie ottenute vengono rimosse agitando il pennello nel tubo contenente l'M199 integrato, quindi chiudere il tubo (Figura 1E).
- Adattamento COVID-19: Non rimuovere le strisce epiteliali agitando il pennello nell'M199 integrato immediatamente dopo il campionamento. Posizionare il pennello nel tubo, tagliare il filo in modo che possa adattarsi completamente all'interno del tubo e chiudere immediatamente il tubo. Posizionare il campione in un doppio sacchetto ermetico.
- Inserire delicatamente la spazzolatura nasale senza anestesia locale o generale13. Se si utilizza l'endoscopia nasale, posizionare l'endoscopio all'ingresso del naso per visualizzare il turbinato nasale inferiore, quindi inserire il pennello citologico nel naso. Se si esegue una spazzolatura nasale "cieca", inserire il pennello nel naso, seguendo il pavimento nasale (Figura 1D).
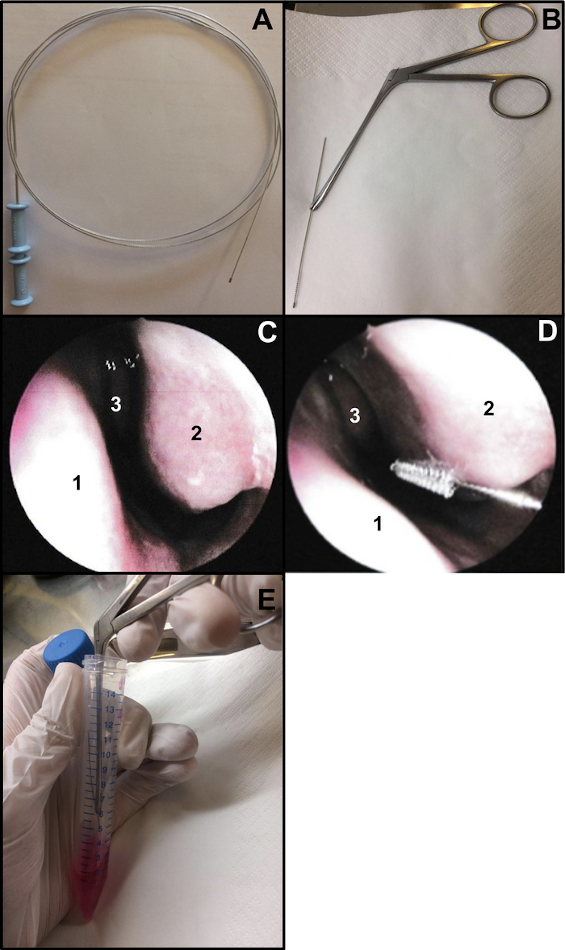
Figura 1: Tecnica di spazzolatura nasale. (A) Spazzola citologica bronchiale intera (B) Spazzolatura pronta: l'estremità spazzolante del filo viene tagliata (lunga circa 15 cm) e trattenuta da una pinza nasale Weil-Blakesley(C) Vista endoscopica della cavità nasale: setto (1) turbinato inferiore (2) e turbinato medio (3) (D) La spazzolatura nasale viene eseguita sulla parte posteriore del turbinato inferiore (2). Setto nasale (1) Turbinato medio (3). (E) Le strisce epiteliali respiratorie vengono rimosse agitando il pennello nel terreno di coltura cellulare M199 integrato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Elaborazione dell'epitelio ciliato respiratorio
- Analizzare i campioni di spazzolamento nasale al microscopio entro 9 ore dal campionamento, poiché sia il CBF che il CBP sono stabili entro questo lasso di tempo (dati non pubblicati).
- Utilizzare un microscopio a luce verticale o invertita, con un contrasto di fase x100 ad immersione d'olio o una lente a contrasto di interferenza. Idealmente, posizionare il microscopio su un tavolo antivibrante perché il battito ciliare può essere soggetto a artefatti dovuti a vibrazioni esterne (ad esempio dal banco di laboratorio)13.
Adattamento COVID-19: L'operatore utilizza dispositivi di protezione individuale per eseguire la lavorazione nasale, tra cui maschera FFP2, guanti e camice resistente all'acqua a maniche lunghe.
- Preparare la camera di visualizzazione.
- Sospendi le strisce epiteliali ciliate in una camera di visualizzazione aperta costruita in laboratorio, consentendo alle ciglia di battere liberamente mentre vengono analizzate al microscopio. Questa camera è creata dalla separazione di un vetrino di copertura (22 mm x 40 mm) e di un vetrino da due vetrini quadrati adiacenti (20 mm x 20 mm), separati da una distanza di 15 mm e incollati sul vetrino12 (Figura 2, Figura 4A).
Adattamento COVID-19: La camera costruita in laboratorio sopra descritta è aperta e consente lo scambio di gas e umidità tra il campione e l'ambiente13. Nel contesto della pandemia COVID-19, è possibile utilizzare una camera di visualizzazione chiusa utilizzando un distanziale bloccato a doppia faccia, profondità 0,25 mm (Figura 3, Figura 4B). Il distanziatore è bloccato sul vetrino e quindi una sottoveste di copertura (22 mm x 40 mm) viene bloccata sulla parte superiore del distanziatore.

Figura 2: Montaggio della camera aperta costruita in laboratorio. (A) I 2 vetrini quadrati (20 mm x 20 mm) sono posizionati sul vetrino. (B) Le diapositive quadrate di copertura sono separate da una distanza di circa 15 mm e incollate sul vetrino. (C) La camera viene riempita tra i due vetrini quadrati adiacenti con un piccolo campione (circa 60 μL) di epitelio ciliato in M199 integrato. (D) Un lungo coprislip rettangolare (22 mm x 40 mm) è posto sui due vetrini quadrati adiacenti e copre la camera. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Montaggio della camera chiusa utilizzando un distanziatore bloccato su due lati. (A) Il vetrino e il distanziatore bloccato su due lati. (B) La protezione viene rimossa su un lato del distanziatore e il distanziatore viene quindi incollato sul vetrino. (C) La protezione viene rimossa dall'altro lato del distanziatore bloccato a doppia faccia, quindi il distanziatore viene riempito con un piccolo campione (circa 60 μL) di epitelio ciliato in M199 integrato. (D) Un lungo coprislip rettangolare (22 mm x 40 mm) è incollato sul distanziatore e chiude la camera. Fare clic qui per visualizzare una versione ingrandita di questa figura.
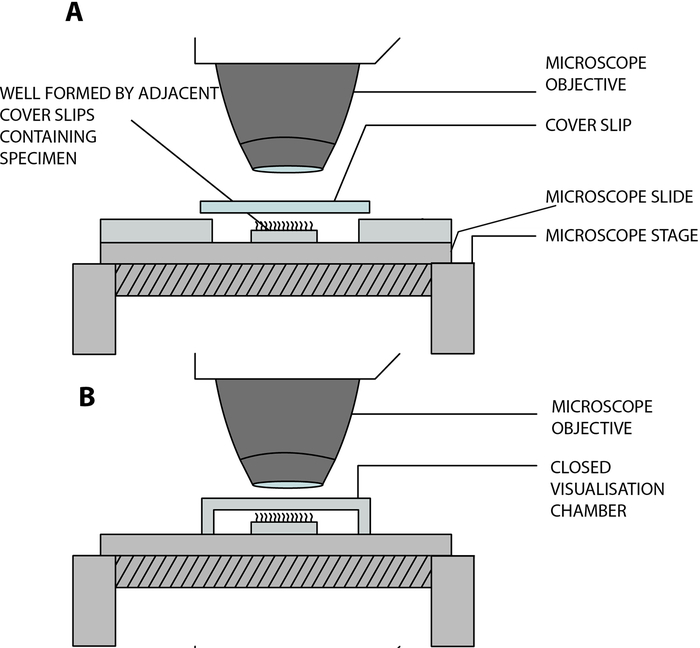
Figura 4: Diagramma schematico che mostra le principali camere di visualizzazione utilizzate per eseguire la videomicroscopia ciliare utilizzando la videomicroscopia digitale ad alta velocità (DHSV). (A) La tecnica della goccia sospesa aperta: il campione ciliato è sospeso in una goccia di terreno di coltura cellulare in una camera aperta creata dalla separazione di un vetrino e di un vetrino da due vetrini adiacenti. (B) La tecnica della goccia sospesa chiusa: il campione ciliato è sospeso in una goccia di terreno di coltura cellulare in una camera chiusa creata da un distanziatore inserito tra un lato di vetro e un vetrino di copertura. Il distanziatore si attacca saldamente sia al vetrino che alla sottoveste di copertura. Riprodotto e modificato da Kempeneers et al.13. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Controllo della temperatura
- Circondare il microscopio con pluriball (Figura 5A,B).
- Fissare il riscaldatore dell'obiettivo attorno all'obiettivo utilizzando una cinghia Velcro (Figura 5C)
- Accendere il controller del riscaldatore dell'obiettivo 1 ora prima di eseguire il controllo della temperatura di controllo.
- Accendere il microscopio e verificare che la configurazione del microscopio sia stata completata, poiché la quantità di luce attraverso il campione può modificare la temperatura sul vetrino.
- Accendere il controller della scatola riscaldata (Figura 5D).
- Verificare che la sonda di riferimento funzioni correttamente prima di iniziare. Tenere la punta della sonda di riferimento tra le dita; Dovrebbe misurare la temperatura corporea.
- Metti il supporto libero al centro della diapositiva, tra i due vetrini quadrati adiacenti (20 mm x 20 mm) incollati su di esso.
- Posizionare la punta della sonda di riferimento nell'M199 integrato. Coperchio con coprislip rettangolare (22 mm x 40 mm). Assicurarsi che la sonda sia completamente circondata da supporti (altrimenti la temperatura potrebbe scendere).
- Adattamento COVID-19: Per eseguire il controllo della temperatura nella camera chiusa utilizzando un distanziatore, tagliare un lato del distanziatore (questo foro deve avere le stesse dimensioni della sonda di riferimento). Attaccare il distanziatore sul vetrino, posizionare i supporti liberi al centro del distanziatore. Posizionare la punta della sonda di riferimento nella soluzione, attraverso il foro del distanziatore, quindi incollare un coprislip rettangolare (22 mm x 40 mm) sul distanziatore.
- Posizionare il vetrino nella piastra della scatola riscaldata. Chiudere la scatola riscaldata con il coperchio.
- Aggiungere olio sull'obiettivo di immersione in olio.
- Posizionare la scatola riscaldata sul palco del microscopio.
- Regolare la temperatura della piastra e del coperchio (la temperatura del coperchio deve essere superiore di 2 °C rispetto alla temperatura della piastra per evitare la condensa) per misurare 37 °C con la sonda di riferimento all'interno del fluido.
- Attendere 5 minuti (tempo necessario per portare la temperatura del campione a 37 °C).
- Regolare l'obiettivo, avvicinandolo alla diapositiva fino a toccare la copertina con la punta dell'obiettivo.
- Spostare l'obiettivo per vedere il centro della sonda al microscopio.
NOTA: assicurarsi che la sonda sia visibile sullo schermo del computer (per verificare che il sistema di telecamere funzioni prima di guardare il campione ciliato). Quando si visualizza il centro della sonda, lo schermo è completamente nero. - Regolare la temperatura del riscaldatore della lente (per compensare la perdita di temperatura quando la lente ad immersione d'olio è a contatto con il vetrino). Assicurarsi di misurare 37 °C con la sonda di riferimento all'interno del mezzo quando l'obiettivo tocca il vetrino del coperchio.
NOTA: Idealmente, lavorare in una stanza con una temperatura controllata, in modo che queste temperature impostate non cambino. Se la temperatura della stanza non è controllata, è necessario eseguire questo controllo della temperatura ogni giorno prima di eseguire la videomicroscopia ciliare. - Dopo aver controllato la temperatura, rimuovere il vetrino dalla scatola riscaldata.
- Pulire il vetrino e la punta della sonda di riferimento con alcool e riporre.
- Pulire la lente con isopropanolo e i tessuti per la pulizia delle lenti con movimenti circolari.

Figura 5: Apparecchiature utilizzate nel laboratorio DHSV. (A) Il microscopio dotato di una lente a contrasto di fase ad immersione d'olio 100x, è posto su un tavolo antivibrante per evitare che le vibrazioni esterne causino artefatti per l'analisi funzionale ciliare (B) Il microscopio è circondato da pluriball per prevenire la perdita di calore dall'aria ambiente. (C) L'obiettivo di immersione in olio crea una perdita di calore. Questo può essere evitato utilizzando un riscaldatore per lenti (frecce). (D) Il campione viene riscaldato utilizzando una scatola riscaldante. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Preparazione dei campioni epiteliali ciliati respiratori
- Agitare delicatamente il tubo per consentire alle ciglia di diffondersi in tutto il tubo (per evitare che le ciglia si blocchino su altre strisce ciliate, muco o detriti, che impediscono loro di battere liberamente).
NOTA: Questo passaggio è essenziale per ottenere "bordi ottimali" dell'epitelio ciliato (Figura 12). - Prelevare circa 50 μL di epitelio ciliato in M199 integrato al centro della provetta con una pipetta.
- Posizionare il campione sulla camera costruita in laboratorio (tra i due vetrini quadrati adiacenti (20 mm x 20 mm)) e coprire con un coprivetrino rettangolare (22 mm x 40 mm). Fai attenzione a non aggiungere bolle.
- Adattamento COVID-19: Eseguire i passaggi 4.1-4.3 in un armadio di sicurezza microbiologica. Procedura nell'armadio di sicurezza microbiologica.
- Accendere l'armadio di sicurezza microbiologica 10 minuti prima di preparare il campione (per assicurarsi che l'ambiente sia sterile).
- Prima di qualsiasi manipolazione, disinfettare l'intero armadio di sicurezza microbiologica con etanolo al 70%.
- Disinfettare tutto il materiale necessario con etanolo al 70% prima di metterlo nell'armadio di sicurezza microbiologica.
- Aprire i tubi conici da 15 mL contenenti i campioni una sola volta sotto l'armadio di sicurezza microbiologica, quindi rimuovere le strisce epiteliali agitando il pennello (usando una pinza nasale Weil-Blakesley) in M199 integrato.
- Attaccare il distanziatore sul vetrino e rimuovere la protezione dal distanziatore bloccato a doppia faccia.
- Agitare delicatamente il tubo per consentire alle ciglia di diffondersi in tutto il tubo.
- Prelevare un piccolo campione di epitelio ciliato in M199 integrato dal centro del tubo con una pipetta (circa 60 μL) e riempire il distanziatore.
- Incollare il coprislip rettangolare (22 mm x 40 mm) sul distanziatore per chiudere la camera.
- Disinfettare il vetrino prima di uscire dall'armadio di sicurezza microbiologica.
- Rimuovere il vetrino dall'armadio di sicurezza microbiologica.
- Cambiare i guanti quando si esce dall'armadio di sicurezza microbiologica.
- Attendere 10 minuti prima di spegnere l'armadio di sicurezza microbiologica dopo l'uso (per assicurarsi che l'ambiente dell'armadio di sicurezza microbiologica sia sterile prima di chiudere la porta).
- Posizionare il vetrino nella piastra della scatola riscaldata. Chiudere la scatola riscaldata con il coperchio.
- Aggiungere olio sull'obiettivo di immersione in olio.
- Posizionare la scatola riscaldata sul palco del microscopio.
- Accendere la scatola riscaldata e il riscaldatore dell'obiettivo.
NOTA: il riscaldatore dell'obiettivo deve essere acceso 1 ora prima dell'uso. - Regolare le impostazioni di temperatura della scatola riscaldata e dei regolatori del riscaldatore dell'obiettivo in base ai valori ottenuti al punto 3.4.
- Attendere 5 minuti (tempo necessario per aumentare la temperatura del campione fino a 37 °C quando si utilizzano impostazioni predeterminate sia per la scatola riscaldata che per il riscaldatore obiettivo).
- Avvicina l'obiettivo alla diapositiva fino a toccare il vetrino con la punta dell'obiettivo.
5. Visualizzazione dei bordi ciliati respiratori
- Fissare la videocamera ad alta velocità sul microscopio, collegare la fotocamera al computer e accendere la fotocamera.
- Accendere il computer.
- Collegare la telecamera digitale per videomicroscopia ad alta velocità al computer (in modo che l'immagine visualizzata attraverso le lenti oculari venga proiettata sul monitor) tramite il software.
- Aprire il software, quindi il menu principale si apre automaticamente (Figura 6A).
NOTA: Il software è il programma utilizzato in laboratorio per l'acquisizione e l'elaborazione delle immagini. Il sistema consente di registrare e riprodurre sequenze video a frame rate ridotto o fotogramma per fotogramma. Può essere scaricato gratuitamente. - Aprire la fotocamera (Figura 6A).
- Quando viene visualizzato il filtro di enumerazione Fotocamera , scegliere OK (Figura 6B).
- Selezionare Aggiorna elenco; selezionare il nome della fotocamera; scegliere Interfaccia: Esperto, quindi selezionare Apri (Figura 6C).
- Nella linea di controllo della telecamera nella parte superiore del menu della finestra di dialogo ancorata, selezionare Live (Figura 6D).
- Scegliere Riproduci per visualizzare l'immagine e Interrompi per terminare la visualizzazione (Figura 6D).
- Aprire il software, quindi il menu principale si apre automaticamente (Figura 6A).

Figura 6: Descrizione dell'uso del software: visualizzazione dei bordi ciliati respiratori sul monitor. (A) Il menu principale appare direttamente all'apertura del software. (b) Chiudere il filtro di enumerazione della fotocamera. (C) Scegliere la fotocamera e selezionare Interfaccia: Esperto. (D) La modalità live permette di visualizzare sul monitor l'immagine vista attraverso il microscopio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Regolare l'impostazione di acquisizione della telecamera (nell'angolo in alto a destra) (Figura 7).
- In Impostazioni di acquisizione scegliere Fotocamera, quindi regolare la frequenza fotogrammi: Frequenza (Hz): 500 (vedi sotto) (Figura 7A).
- In Impostazioni di acquisizione scegliere Fotocamera, quindi regolare la regione di interesse (ROI) (Figura 7A).
NOTA: Il ROI viene calcolato utilizzando una scala graduata visualizzata con l'obiettivo x100 oil-immersion e proiettata sul monitor, per definire il numero di pixel corrispondenti a 50 μm (come si desidera registrare bordi ciliati che misurano circa 50 μm (vedi sotto)). - In Impostazioni di acquisizione scegliere Registra, quindi regolare la durata del video e il numero totale di fotogrammi registrati (una durata di 2 secondi, corrisponde a 1000 fotogrammi se il frame rate scelto è 5OO Hz) (Figura 7B).
NOTA: Nella nostra esperienza, è necessaria una durata minima di 2 secondi per consentire un'analisi completa sia del CBF che del CBP. - Selezionate File, quindi Save Camera Cfg (Save Camera Cfg) per salvare la nuova impostazione di acquisizione (inserire un nome e, se necessario, un commento per questa nuova configurazione) (Figura 7C,D).
- Per aprire questa nuova configurazione della telecamera, aprire File and Load Camera Cfg (Figura 7C).
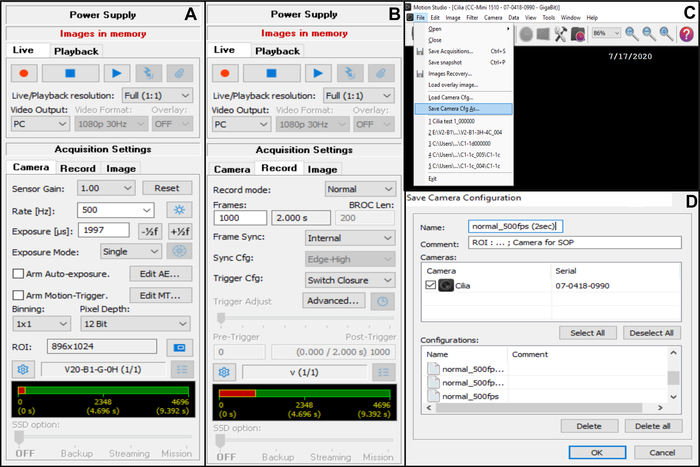
Figura 7: Descrizione dell'uso del software: regolazione delle impostazioni di acquisizione della telecamera per la registrazione video dei bordi ciliati battenti. (A) Nell'impostazione di acquisizione Fotocamera, regolare la regione di interesse (ROI) e la frequenza dei fotogrammi per la registrazione video (Tariffa). (B) Nell'impostazione di acquisizione Record, regolare la durata della registrazione video (numero di fotogrammi necessari per la durata di registrazione scelta, in base alla frequenza fotogrammi scelta in precedenza). (C) Queste nuove impostazioni di configurazione della telecamera possono essere salvate utilizzando la funzione Save camera Cfg . Load Camera Cfg permette di riaprire le impostazioni di configurazione salvate per ulteriori utilizzi. (D) È possibile assegnare un nome alle nuove impostazioni di configurazione della telecamera e, se necessario, aggiungere un commento. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Guarda attraverso le lenti oculari e cerca cellule o detriti all'interno del campione, quindi metti a fuoco.
- Verificare che l'immagine sia visibile sul monitor e migliorare la qualità dell'immagine regolando il condensatore (e il prisma DIC se si utilizza una lente a contrasto di interferenza) e regolare la messa a fuoco se necessario.
- Cerca strisce di epitelio ciliato.
6. Selezione dei bordi ciliati respiratori
NOTA: Il sistema sperimentale consente di vedere le ciglia battenti su tre piani distinti: un profilo laterale, che batte direttamente verso l'osservatore, e direttamente dall'alto (Figura 8).
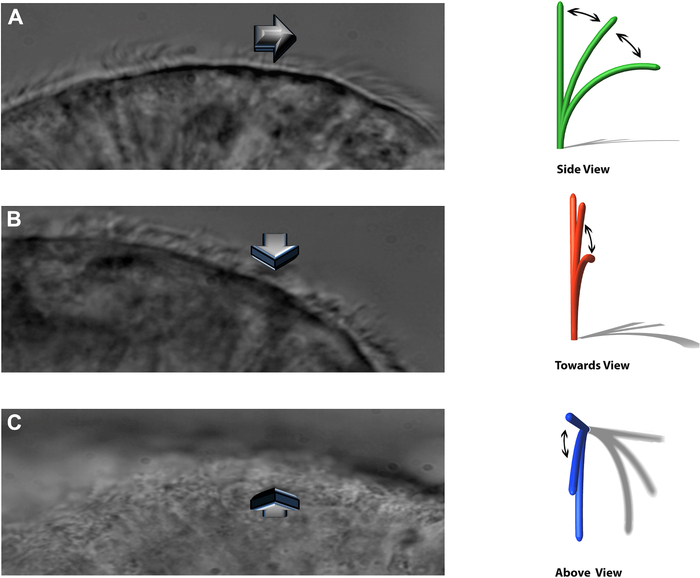
Figura 8: La tecnica DHSV consente di vedere le ciglia battute su tre piani distinti. (A) nel profilo laterale. (B) battere direttamente verso l'osservatore e. (C) direttamente dall'alto. Riprodotto da Kempeneers et al.16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Registra solo i bordi epiteliali ciliati intatti e ininterrotti che misurano almeno 50 μm di lunghezza.
- Per le registrazioni effettuate sul profilo laterale, determinare la qualità del bordo secondo il sistema di punteggio Thomas et al.29 (Figura 9). Utilizzare solo spigoli normali (Figura 9A) o spigoli con proiezioni minori (Figura 9B) per l'analisi funzionale ciliare. Escludere le celle isolate (Figura 9E).

Figura 9: Immagine rappresentativa del sistema di punteggio di Thomas et al29 per la diversa qualità dei bordi epiteliali ciliati. (A) Bordo normale: definito come una striscia di epiteli ciliati uniforme intatta > 50 μm di lunghezza (B) Bordo ciliato con sporgenze minori: definito come un bordo lungo >50 μm, con cellule sporgenti fuori dalla linea del bordo epiteliale, ma senza punto della membrana cellulare apicale che sporge sopra le punte delle ciglia sulle cellule adiacenti (C) Bordo ciliato con proiezioni maggiori: definito come un bordo >50 μm di lunghezza, con cellule che sporgono dalla linea di bordo epiteliale, con almeno un punto della membrana cellulare apicale proiettato sopra le punte delle ciglia sulle cellule adiacenti (D) Cellula ciliata isolata: definita come l'unica cellula ciliata su un bordo epiteliale >50 μm di lunghezza (E) Cellule singole: definite come cellule ciliate che non hanno alcun contatto tra loro o qualsiasi altro tipo di cellula. Barra scala: 5,5 μm. Riprodotto da Thomas et al.29Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Eseguire CFA utilizzando solo ciglia prive di muco e detriti e battendo nel profilo scelto per il bordo registrato. Selezionare solo i bordi ciliati che consentono un minimo di 2 valutazioni CBF e CBP (vedi sotto) lungo il bordo.
- Utilizzare per CFA solo campioni che producono un minimo di 6 bordi che battono nel profilo laterale e soddisfano i criteri di cui sopra; Analizza un massimo di 20 spigoli nel profilo laterale.
- Utilizzare almeno 1 bordo aggiuntivo di ciglia che batte da sopra il profilo dell'osservatore per caratterizzare il CBP.
7. Registrazione del bordo ciliato
- Registra il bordo delle ciglia battenti utilizzando un frame rate della telecamera di 500 fotogrammi al secondo e proietta su un monitor ad alta risoluzione. È richiesto un frame rate minimo di 400 Hz per consentire l'analisi sia di CBF che di CBP13. Registra un bordo a una frequenza fotogrammi di 30 fotogrammi al secondo per valutare l'efficienza del gioco del particolato.
- Selezionare Live, sulla linea di controllo della telecamera nella parte superiore del menu della finestra di dialogo ancorata (Figura 6D)
- Scegliere Riproduci per visualizzare l'immagine e Interrompi per terminare la visualizzazione (Figura 6D)
- Per registrare un bordo, premere Record (Figura 6D). Per visualizzare la registrazione prima di salvare, vai sulla linea di controllo della telecamera nella parte superiore del menu di dialogo ancorato e seleziona Riproduzione. Scegliere Riproduci per visualizzare il video registrato e Interrompi per terminare la visualizzazione (Figura 10A).
NOTA: interrompere la visualizzazione del bordo registrato prima di salvare.
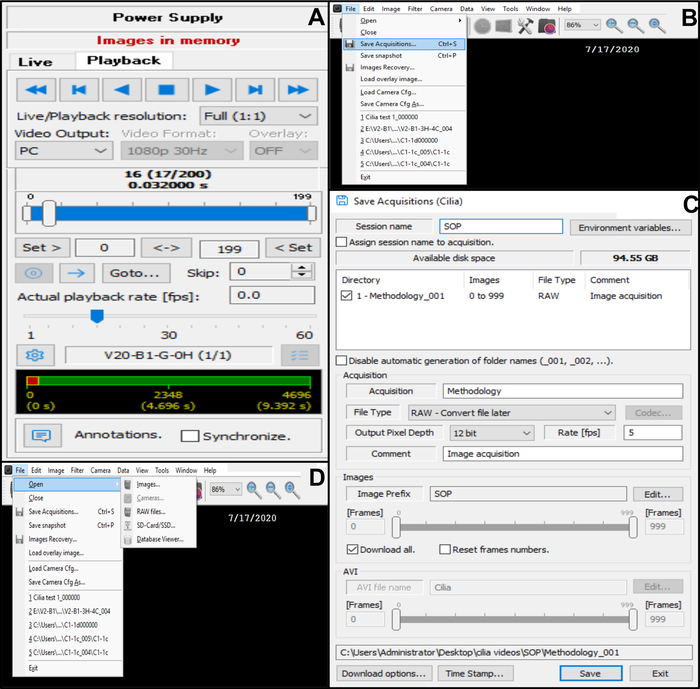
Figura 10: Descrizione dell'uso del software. (A) modalità di riproduzione. Per rivedere una sequenza video registrata di battito del bordo ciliato, scegliete la modalità di riproduzione. Scegliere Riproduci per visualizzare l'immagine e Interrompi per terminare la visualizzazione. Il tasso di fama può essere regolato per migliorare l'analisi della funzione ciliare (B, C) Salvataggio delle registrazioni video dei bordi ciliati battuti (B) Per salvare il video, scegli File, quindi Salva acquisizioni. (C) Inserisci il nome del video registrato e scegli la postazione in cui viene registrato il video. Assicurarsi che la registrazione sia salvata come file . File RAW (D) scelta di una registrazione di bordi ciliati battenti da analizzare: Per aprire una registrazione video, scegliere File, quindi Apri, quindi Immagini. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Salvare il video nel database (Figura 10B,C).
- Aprire File nell'angolo in alto a sinistra, quindi salvare le acquisizioni (Figura 10B).
- In Salva acquisizioni, immettere il nome del video registrato e assicurarsi che la registrazione venga salvata come formato di tipo file RAW (Figura 10C).
- Quando il video viene salvato, tornare alla modalità live (tornare alla linea di controllo della telecamera nella parte superiore del menu della finestra di dialogo ancorata e selezionare live) (Figura 6D).
- Ripetere la procedura per registrare il numero di bordi che soddisfano i criteri di selezione richiesti per CFA.
NOTA: È possibile registrare diversi bordi ciliati che soddisfano i criteri di selezione da un vetrino, entro un massimo di 20 minuti dopo la preparazione del vetrino (per evitare l'essiccazione). Dopo 20 minuti, se non è possibile ottenere abbastanza bordi che soddisfino i criteri di selezione, preparare una nuova diapositiva. - Rimuovere il vetrino dalla scatola riscaldata.
- Rimuovere il coprislip rettangolare e gettarlo nell'apposito contenitore dei rifiuti sanitari pericolosi.
- Pulire il vetrino (con i due vetrini quadrati incollati su di esso) con etanolo al 70% e carta assorbente. Una volta che il vetrino è pulito, può essere riutilizzato.
- Adattamento COVID-19: Posizionare il vetrino con il coprivetrino e il distanziatore in un sacchetto ermetico, rimuovere guanti e maschera e metterli nella borsa ermetica. Posizionare il sacchetto ermetico nell'apposito contenitore per rifiuti sanitari pericolosi.
8. Analisi funzionale ciliare
- Preparazione preliminare per eseguire la valutazione manuale CBF e CBP
- Aprire il software.
- Aprire File nell'angolo superiore sinistro, quindi Apri e infine Immagini (Figura 10D).
- Scegli il video da analizzare.
- Andare sulla linea di controllo della telecamera nella parte superiore del menu della finestra di dialogo ancorata e selezionare Riproduzione (Figura 10A). Scegliere Riproduci per visualizzare il video registrato e Stop per terminare la visualizzazione.
- Analisi manuale della frequenza del battito ciliare (CBF)
- Eseguire la valutazione del CBF utilizzando solo i bordi laterali.
- Dividere i bordi ciliati in circa 5 aree adiacenti, ciascuna delle quali misura approssimativamente 10 μm (Figura 11).
- Identificare e visualizzare ciglia o gruppi di ciglia a una frequenza di fotogrammi ridotta e vengono effettuate un massimo di 2 misurazioni CBF in ciascuna area, con un massimo di 10 misurazioni CBF lungo ciascun bordo (Figura 11).
- Registra il numero di fotogrammi necessari per un gruppo di ciglia per completare 5 cicli di battuta.
- Converti in CBF con un semplice calcolo: (CBF = frequenza fotogrammi di registrazione (Hz) / (numero di fotogrammi per 5 battute) x 5) 13,16,30. Le ciglia immobili sono segnalate come aventi un CBF di 0 Hz13.
NOTA: regolare la frequenza dei fotogrammi durante la riproduzione dei video registrati (Figura 10A). Ciò è particolarmente utile quando le ciglia analizzate battono molto lentamente. Aumentare il frame rate aiuta a definire se le ciglia battono molto lentamente o sono immobili. - Per ciascun campione, calcolare il CBF medio come media (SD) o (IC 95%) di tutto il CBF registrato nel profilo laterale, comprese le ciglia statiche.
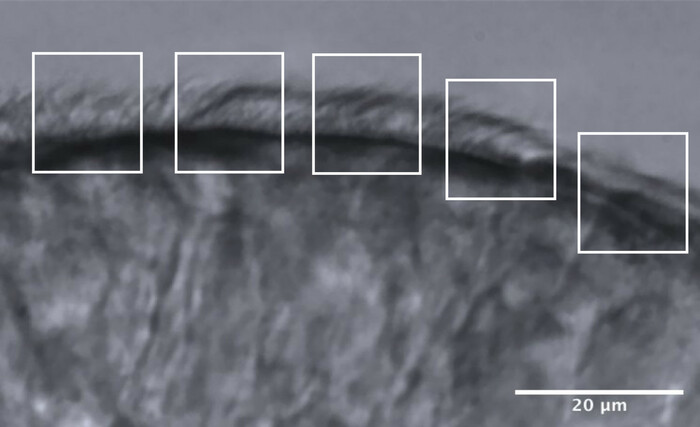
Figura 11: Immagine rappresentativa di un bordo di qualità ottimale e la divisione in 5 aree per consentire l'analisi CFA. Un bordo epiteliale ciliato di qualità ottimale è frammentato in 5 aree adiacenti ciascuna delle quali misura 10 μm. In ogni area vengono effettuate un massimo di 2 misurazioni CBF (e 2 valutazioni CBP), con un massimo di 10 misurazioni CBF (e valutazioni CBP) lungo ciascun bordo. Barra della scala = 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Analisi manuale del pattern di battito ciliare (CBP)
- Per valutare i marcatori della discinesia, utilizzare solo il profilo laterale; utilizzare i piani verso l'osservatore e dall'alto per caratterizzare il tipo di CBP13. Esistono diversi metodi e punteggi per la valutazione CBP. Di seguito viene descritto il metodo utilizzato in laboratorio con la definizione dei marcatori della discinesia.
- La percentuale di ciascun CBP distinto all'interno del campione
- Per ogni ciglia o gruppo di ciglia identificato e utilizzato per una misurazione CBF (Figura 11), eseguire un'analisi CBP a frame rate ridotto: confrontare il percorso preciso intrapreso dalle ciglia durante un ciclo di battito completo con il normale CBP osservato sull'analisi DHSV12,30.
- Attribuire un CBP distinto (normale, immobile, rigido, circolare, asincrono (battito ciliare non coordinato) o discinetico13) a ciascuna ciglia o gruppo di ciglia analizzate.
- Per ciascun campione, calcolare la percentuale di ciascun CBP distinto all'interno del campione; il CBP attribuito al campione è il CBP predominante osservato.
- Calcola i 3 marcatori della discinesia.
- Calcolare l'indice di immotilità (IMI): la percentuale di ciglia immobili all'interno del campione (numero di CBF = 0 / numero totale di letture CBF nel campione X 100). Esprimere l'IMI come media (DS) o (IC 95%)1,16,31.
- Calcola il punteggio di discinesia (DKS). Dividere ciascun bordo ciliato in quadranti e determinare il numero di quadranti con ciglia discinetiche (o anormalmente battenti). Ciò consente di calcolare un DKS compreso tra 0 e 4 (0: CBP normale lungo tutto il bordo; 1: CBP anormale in ≤ 25% delle ciglia; 2: CBP anormale in ≤ 50% delle ciglia; 3: pattern di battito anormale in ≤ 75% delle ciglia; e 4: CBP anormale in tutte le ciglia). La mediana DKS (intervallo interquartile) è calcolata per il campione 16,29.
- Calcolare la percentuale di battitura normale: definita come la percentuale di ciglia con un CBP normale all'interno del campione (numero di letture CBP normali / numero totale di letture CBP per il campione x100).
Risultati
Per illustrare l'efficacia della tecnica, presentiamo i risultati del CFA in una serie di 16 volontari adulti sani (5 maschi, fascia di età 22-54 anni).
I campioni di spazzolatura nasale di 14 (4 maschi, fascia di età 24-54 anni) su un totale di 16 volontari hanno fornito bordi epiteliali appropriati sufficienti che soddisfacevano i criteri di selezione necessari per eseguire la CFA. Da questi 14 campioni di spazzolatura nasale, sono stati registrati un totale di 242 bordi ciliati e 212 bord...
Discussione
Questo documento mira a fornire una procedura operativa standard per CFA utilizzando campioni di spazzolatura nasale, con modifiche apportate per appropriate considerazioni sul controllo delle infezioni durante la pandemia COVID-19. La diagnosi di PCD è impegnativa e attualmente richiede un pannello di diversi test diagnostici, secondo le raccomandazioni internazionali, tra cui la misurazione dell'ossido nitrico nasale, CFA utilizzando DHSV, analisi ultrastrutturale ciliare mediante microscopia elettronica a trasmission...
Divulgazioni
Questi autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare Jean-François Papon, Bruno Louis, Estelle Escudier e tutti i membri del team del centro diagnostico PCD di Paris-Est per la loro disponibilità e calorosa accoglienza durante la visita al loro centro diagnostico PCD e i numerosi scambi. Ringraziamo anche Robert Hirst e tutti i membri del team del centro PCD di Leicester per la loro accoglienza, il loro tempo, i consigli e la competenza.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
Riferimenti
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon