Method Article
O implante DREAM: um sistema de implante leve, modular e econômico para eletrofisiologia crônica em camundongos com cabeça fixa e comportamento livre
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um sistema de implante de sonda leve e econômico para eletrofisiologia crônica em roedores otimizado para facilidade de uso, recuperação de sonda, versatilidade experimental e compatibilidade com o comportamento.
Resumo
Registros eletrofisiológicos crônicos em roedores melhoraram significativamente nossa compreensão da dinâmica neuronal e sua relevância comportamental. No entanto, os métodos atuais para implantar sondas cronicamente apresentam grandes compensações entre custo, facilidade de uso, tamanho, adaptabilidade e estabilidade a longo prazo.
Este protocolo apresenta um novo sistema de implante de sonda crônica para camundongos chamado DREAM (Dynamic, Recoverable, Economical, Adaptable e Modular), projetado para superar as compensações associadas às opções atualmente disponíveis. O sistema fornece uma solução leve, modular e econômica com elementos de hardware padronizados que podem ser combinados e implantados em etapas simples e explantados com segurança para recuperação e reutilização múltipla de sondas, reduzindo significativamente os custos experimentais.
O sistema de implantes DREAM integra três módulos de hardware: (1) um microdrive que pode transportar todas as sondas de silício padrão, permitindo que os experimentadores ajustem a profundidade de gravação em uma distância de deslocamento de até 7 mm; (2) um design tridimensional (3D) imprimível e de código aberto para uma gaiola de Faraday vestível coberta com malha de cobre para blindagem elétrica, proteção contra impactos e colocação de conectores, e (3) um sistema de fixação de cabeça miniaturizado para melhorar o bem-estar animal e a facilidade de uso. O protocolo de cirurgia correspondente foi otimizado para velocidade (duração total: 2 h), segurança da sonda e bem-estar animal.
Os implantes tiveram impacto mínimo no repertório comportamental dos animais, foram facilmente aplicáveis em contextos de movimento livre e cabeça fixa e forneceram formas de onda de pico claramente identificáveis e respostas neuronais saudáveis por semanas de coleta de dados pós-implante. Infecções e outras complicações cirúrgicas foram extremamente raras.
Como tal, o sistema de implantes DREAM é uma solução versátil e económica para a electrofisiologia crónica em ratinhos, melhorando o bem-estar animal e permitindo experiências mais etologicamente sólidas. Seu design simplifica os procedimentos experimentais em várias necessidades de pesquisa, aumentando a acessibilidade da eletrofisiologia crônica em roedores a uma ampla gama de laboratórios de pesquisa.
Introdução
A eletrofisiologia com sondas de silício implantadas cronicamente emergiu como uma técnica poderosa para investigar a atividade neural e a conectividade em animais que se comportam, particularmente em camundongos, devido à sua tratabilidade genética e experimental1. As sondas laminares de silício, em particular, provaram ser uma ferramenta inestimável para identificar relações funcionais dentro das colunas corticais2 e para relacionar a dinâmica de grandes populações neuronais ao comportamento de uma forma que era impossível anteriormente3.
Duas abordagens complementares são os atuais padrões-ouro para registro da atividade neural in vivo: microscopia de dois fótons 4,5 e eletrofisiologia extracelular6. A escolha da metodologia de registro restringe a natureza das leituras que podem ser obtidas: a microscopia de dois fótons é particularmente adequada para estudos longitudinais de neurônios individualmente identificáveis em grandes populações ao longo do tempo, mas sofre de altos custos de equipamento e é limitada a camadas superficiais do córtex em cérebros intactos. Além disso, a resolução temporal típica de ~ 30 Hz limita sua capacidade de capturar a dinâmica neuronal em andamento 7,8.
Em contraste, os registros eletrofisiológicos oferecem alta resolução temporal (até 40 kHz) para rastrear a atividade neuronal momento a momento, podem ser aplicados amplamente em espécies, bem como em profundidades corticais, e têm configurações de custo relativamente baixo em comparação com a microscopia de dois fótons. No entanto, a identificação de neurônios individuais, bem como o rastreamento longitudinal de populações neuronais, são difíceis de alcançar. Isso se aplica especialmente a eletrodos de fio, por exemplo, tetrodos, e a inserções agudas de eletrodos. Além de não ter a capacidade de rastrear neurônios durante as sessões de gravação9, inserções agudas repetidas causam trauma local10 que monta uma resposta imune11, aumentando a chance de infecção e gliose. Em última análise, isso reduz a estabilidade da atividade neuronal registrada e a expectativa de vida dos animais experimentais, limitando o escopo dos estudos longitudinais com registros eletrofisiológicos agudos a apenas alguns dias12.
Os registros crônicos de sondas de silício de alta densidade visam combinar alguns dos melhores atributos da eletrofisiologia aguda e imagens de dois fótons. Eles podem rastrear a dinâmica da população neural em sessões com apenas uma capacidade um pouco reduzida de identificar neurônios individuais em comparação com imagens de dois fótons13. Essas gravações fornecem alta flexibilidade no posicionamento espacial e resolução temporal precisa dos sinais registrados, bem como maior longevidade e bem-estar dos animais experimentais em comparação com as gravações agudas14. Além disso, em contraste com os registros agudos, a eletrofisiologia crônica requer apenas um único evento de implantação, reduzindo efetivamente o risco de infecção e dano tecidual e minimizando o estresse nos animais15. Coletivamente, essas vantagens tornam a eletrofisiologia crônica uma ferramenta poderosa para investigar a organização e a função do sistema nervoso.
No entanto, as técnicas de implantação crônica comumente usadas para camundongos restringem os pesquisadores a fazer compensações significativas entre compatibilidade com registros comportamentais, peso do implante, replicabilidade dos implantes, custos financeiros e facilidade geral de uso. Muitos protocolos de implantes não são projetados para facilitar a reutilização de sondas16, aumentando drasticamente o custo efetivo de experimentos individuais e, portanto, dificultando financeiramente o uso de eletrofisiologia crônica por alguns laboratórios. Eles também costumam exigir um extenso trabalho interno de prototipagem e design, para o qual a experiência e os recursos podem não estar presentes.
Por outro lado, os sistemas integrados de implantes17 oferecem uma solução mais amplamente acessível para eletrofisiologia crônica em roedores. Esses sistemas são projetados para integrar um microdrive que segura a sonda com o restante do implante para simplificar o manuseio do implante e os procedimentos cirúrgicos. No entanto, uma vez implantados, esses sistemas podem ser pesados e limitar a capacidade do experimentador de adaptar de forma flexível um experimento a diferentes coordenadas-alvo. Muitas vezes, seu peso impede implantes em animais menores, potencialmente prejudica o movimento do animal e induz estresse18. Isso pode afetar desproporcionalmente a pesquisa em coortes juvenis e femininas, pois as limitações de peso têm maior probabilidade de afetar esses grupos.
Além disso, nem todos os sistemas integrados permitem o ajuste das posições dos eletrodos após o implante. Isso é relevante, pois gliose ou cicatrização devido à inserção da sonda19, especialmente nas 48 h iniciais após o implante20, podem reduzir a qualidade da atividade neuronal registrada. Microajustes na profundidade de inserção da sonda podem limitar esses efeitos negativos na integridade do sinal. Portanto, os mecanismos de microposicionamento, comumente chamados de microdrives, podem ser benéficos mesmo em sondas com um grande número de eletrodos distribuídos em seu comprimento.
Para superar essas compensações, apresentamos um novo sistema de implante de eletrofisiologia crônica para camundongos que aborda as limitações dos projetos anteriores, oferecendo uma solução leve, econômica e modular. O sistema de implantes DREAM foi concebido para pesar menos de 10% (~2,1 g) do peso corporal típico de um rato, garantindo o bem-estar animal e um impacto mínimo no comportamento. A validação do design do implante DREAM mostra um impacto mínimo nas principais métricas comportamentais, como a locomoção - que pode ser significativamente afetada em roedores quando as cargas são colocadas no crânio. Isso pode beneficiar paradigmas experimentais que utilizam animais que se movem livremente, bem como animais com a cabeça fixa, aumentando o bem-estar animal e permitindo experimentos mais etologicamente sólidos.
O sistema inclui um microdrive para ajuste flexível da profundidade de gravação de até 7 mm e pode ser adaptado a diferentes tipos de sondas e dispositivos de gravação, fornecendo aos pesquisadores uma ferramenta econômica e versátil para várias aplicações experimentais. O sistema é rotineiramente combinado com um microdrivemetálico 21, que oferece recuperação consistente da sonda em comparação com outros sistemas (taxa média de recuperação esperada: aprox. três reutilizações confiáveis por sonda) e reduz drasticamente o custo de experimentos individuais.
O design apresenta uma gaiola protetora de Faraday impressa em 3D, permitindo proteção barata e robusta contra ruídos eletrofisiológicos, impactos mecânicos e materiais infecciosos, permitindo gravações estáveis e sem ruído que sofrem com taxas mínimas de infecção. Esta gaiola implantável consiste na chamada 'coroa', projetada para proteção contra impactos e para fornecer estrutura para o revestimento de malha metálica condutora da gaiola de Faraday, e o anel da coroa, que serve como suporte para um amplificador implantável e/ou conector de sonda (ver Figura 1).
Finalmente, as placas de cabeça incluídas no sistema de implante modular são projetadas para serem compatíveis com um sistema de fixação de cabeça novo e eficiente sem adicionar volume extra ao implante. Ao contrário de outros sistemas existentes, não requer o aperto de pequenos parafusos próximos ao implante, acelerando a fixação de camundongos na configuração experimental e melhorando a relação experimentador-animal, bem como a aderência comportamental. Ao mesmo tempo, a placa de cabeça é utilizada como base para construir os outros módulos do sistema de eletrofisiologia crónica DREAM.
Os ficheiros de design para o implante DREAM são publicados como hardware de código aberto na https://github.com/zero-noise-lab/dream-implant/. Nas secções seguintes, será descrito o desenho e o fabrico do sistema de implantes DREAM, será demonstrada a sua implementação bem sucedida num modelo de ratinho e serão discutidas as suas potenciais aplicações e vantagens em comparação com os sistemas existentes.
Protocolo
Todos os procedimentos experimentais foram conduzidos de acordo com as diretrizes institucionais da Sociedade Max Planck e aprovados pelo comitê de ética do governo local (Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, Código de aprovação do projeto: F149-2000).
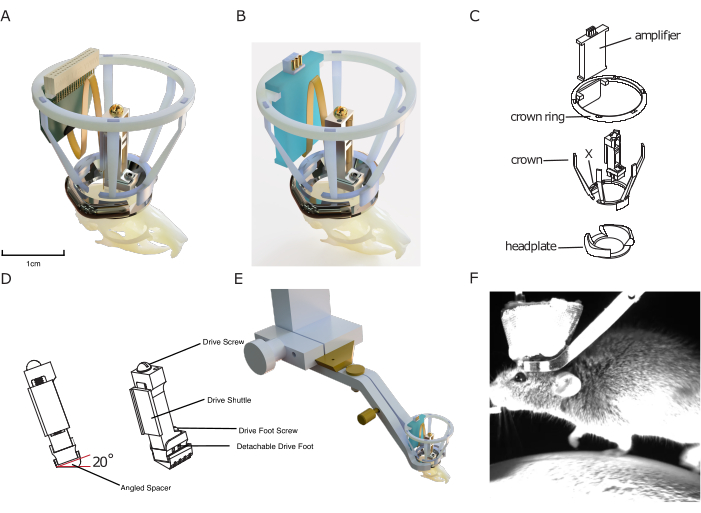
Figura 1: Projeto do implante. (A) Renderização 3D do implante sobreposto a um crânio de camundongo com uma sonda de silício conectada a um conector de sonda. A abertura central da placa de cabeça é de aproximadamente 10 mm para escala. A altura da unidade é de aproximadamente 17 mm. A malha de cobre que forma a parte externa da coroa de Faraday, bem como os fios terra/ref, não são mostrados. (B) O mesmo que (A) com uma conexão a um amplificador placa em vez de um conector de sonda. (C) Desenho técnico explodido do implante, mostrando seus componentes. (D) Renderização de um espaçador angular que pode ser implantado sob um microdrive, permitindo implantar consistentemente o microdrive em um ângulo predefinido (aqui: 20°). (E) Renderização do mecanismo integrado de fixação da cabeça, mostrando a placa de cabeça implantada com a coroa de Faraday com a braçadeira de fixação da cabeça circundante e a conexão em cauda de andorinha para configuração. (F) Imagem da cabeça do rato fixada em uma esteira usando o mecanismo de fixação da cabeça integrado do implante. Clique aqui para ver uma versão maior desta figura.
NOTA: As seções 1 e 2 discutem os preparativos pré-cirúrgicos
1. Preparação da sonda de silício
- Em caso de reutilização da sonda, limpe a sonda de silicone de acordo com as recomendações do fornecedor da sonda. Mergulhe a sonda em limpador enzimático (consulte a Tabela de Materiais) por 5-10 min e depois enxágue em água desmineralizada. Faça isso o mais rápido possível após o explante. Um dia antes do (re)implante, mergulhe a sonda em etanol a 70% por pelo menos 30 minutos para desinfecção.
- Meça as impedâncias do canal para garantir que estejam dentro das especificações do sinal gravado. Siga o protocolo para testar os níveis de ruído do manual do usuário Neuropixels22, meça a impedância por meio do software de gravação desejado (por exemplo, https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing) e siga as impedâncias do canal alvo do fabricante da sonda de silício ou folha de dados. Se as impedâncias forem muito altas, considere revestir os locais dos eletrodos23.
- Solde um soquete de cauda de solda de 0.05" (consulte a Tabela de Materiais) ao fio terra (GND) da sonda. Conecte o soquete ao pino GND (próximo passo) durante a cirurgia.
NOTA: Neste protocolo, um pino de referência separado (REF) não é usado, pois GND e REF estão em curto no headstage usado. Portanto, apenas o pino GND será mencionado no restante do protocolo. Se um REF separado for usado, repita a etapa a seguir para o pino REF. - Para preparar o pino GND, insira repetidamente o lado do pino de um soquete traseiro de solda de 0.05" (consulte a Tabela de Materiais) no soquete traseiro de solda GND 0.05" até que a inserção seja praticamente sem esforço. O uso de alfinetes banhados a ouro pode reduzir a necessidade dessa etapa de suavização. Isso garante que o pino e o soquete GND possam ser facilmente conectados durante a cirurgia sem a necessidade de aplicar pressão excessiva, reduzindo o risco de ferimentos ao animal e danos à sonda.
- Se for usado um pré-amplificador implantável para a sonda de silicone, prepare-os para implantação crônica seguindo os procedimentos do fornecedor. Em seguida, conecte o amplificador/conector ao anel da gaiola de Faraday usando gesso de silicone para colá-lo na área do anel de Faraday projetado para segurar o amplificador (consulte a Figura 1).
NOTA: A preparação do pré-amplificador implantável para a sonda de silício para implantação crônica seguindo os procedimentos do fornecedor pode incluir revesti-los com silicone ou epóxi para evitar que a umidade danifique os componentes eletrônicos, bem como acoplar repetidamente o conector do amplificador para reduzir a força de acoplamento ao conectar o amplificador ao sistema de gravação durante as gravações. Isso é especialmente útil para usuários do Omnetics.
2. Preparação do microdrive e do capacete
- Gire o parafuso no corpo do microdrive de modo que o vaivém do microdrive fique quase totalmente retraído para cima.
- Opcionalmente, conecte um espaçador angular (consulte a Figura 1D) à parte inferior do microdrive com cola de cianoacrilato ou cimento dentário, que pode ser usado para permitir que um grau específico de inclinação seja usado, por exemplo, ao gravar através de camadas corticais em uma região dentro do sulco central ou dentro de estruturas profundas que podem exigir uma abordagem não perpendicular (para espaçador angular, ver Tabela de Materiais).
- Coloque o microdrive horizontalmente no suporte do microdrive (Figura Suplementar 1).
- Coloque um pequeno pedaço de massa adesiva (consulte a Tabela de Materiais) no suporte do microdrive a uma distância acima do microdrive no qual o conector do estágio principal será colocado. Essa distância depende do comprimento do cabo flexível que conecta a sonda de silício ao conector do headstage.
- Coloque uma pequena gota de gesso de silicone (consulte a Tabela de Materiais) na lançadeira.
- Retire a sonda de silicone de sua embalagem com a ajuda de uma pinça de ponta macia e romba. Faça-os revestindo pinças de ponta fina padrão com tubos termorretráteis de 3 mm de diâmetro (consulte a Tabela de Materiais). Coloque a sonda com o cabo flexível primeiro no vaivém do microdrive de modo que a borda inferior do cabo flexível fique ligeiramente pendurada sobre a borda inferior do vaivém do microdrive.
- Puxe suavemente o cabo flexível em direção à parte superior do microdrive até que a borda inferior do cabo flexível encontre a borda inferior do shuttle do microdrive. Certifique-se de empurrar o cabo flexível contra a borda esquerda do inversor do microdrive durante esta etapa para que ele seja colocado exatamente verticalmente no microdrive na extremidade. Neste ponto, certifique-se de que as hastes da sonda de silicone não se projetem (ou apenas minimamente) além da borda inferior do microdrive (dependendo do comprimento exato das hastes da sonda e da profundidade da área do cérebro alvo).
- Coloque o conector do estágio principal da sonda na massa adesiva na parte superior do suporte para proteger a sonda de cair.
- Use uma agulha de seringa de 27 G para aplicar uma pequena gota de cola de cianoacrilato (consulte a Tabela de Materiais) entre o cabo flexível e o vaivém para prender a sonda no lugar. Certifique-se de que a cola não escorra para o microdrive ou ao longo do cabo flexível além do ônibus (isso é muito importante)
- Assim que o cabo flexível estiver colado na posição, conecte o amplifier ao anel da coroa (consulte a Tabela de Materiais) usando gesso de silicone. Em seguida, conecte o cabo flexível ao amplificador e cubra a conexão e o cabo com uma fina camada de gesso de silicone.
- Após 5 min, quando o gesso estiver endurecido, guarde o microdrive e a sonda com segurança até o uso posterior.
- Corte pedaços de malha de cobre (consulte a Tabela de Materiais) em uma forma de rosquinha aberta (consulte o padrão de corte na Figura Suplementar 2) para cobrir a gaiola de Faraday.
- Prenda o recorte da malha de cobre na gaiola de Faraday com pequenas gotas de resina epóxi (consulte a Tabela de Materiais). Para esta etapa, pode-se também substituir o epóxi por cimento dentário.
NOTA: A gaiola de Faraday contém um espaço para abrigar um conector de sonda ou amplificador. Este espaço é marcado por um X no arquivo de design e contém uma base de suporte para o amplificador/conector, bem como uma distância maior entre os dois raios adjacentes da gaiola. Para criar espaço suficiente ao redor do amplificador/conector, fixe uma pequena quantidade de malha extra entre os dois raios adjacentes, criando uma saliência. Isso garante que o amplificador/conector possa ser posicionado posteriormente neste 'bolso' sem tocar na gaiola de Faraday. Para garantir uma adesão segura com o mínimo de empenamento, use o anel da coroa colocado diretamente na coroa para manter a forma e apoiar os raios finos da coroa. Além disso, use mãos de ajuda de solda para prender a coroa e a malha durante a secagem. Se alguém se esforçar para manter a forma da coroa ao se submeter ao procedimento, tente epóxi apenas dois dos braços da coroa de cada vez para evitar empenamento. - Se desejar o aterramento separado da gaiola de Faraday, solde um pequeno pino coletor em um fio de aterramento de 30 mm (consulte a Tabela de Materiais) e, em seguida, use epóxi condutor para aderir o fio ao recorte da malha de cobre.
NOTA: Esta etapa não é seguida no laboratório. - Neste ponto, armazene as peças preparadas com segurança e realize a cirurgia em um estágio posterior.
NOTA: As seções 3-6 discutem a implantação do microdrive e do arnês.
3. Cirurgia: Preparação da sonda e do espaço de trabalho
- Esterilize e coloque instrumentos cirúrgicos no espaço de trabalho cirúrgico após um procedimento aprovado.
NOTA: Isso pode incluir o uso de um esterilizador de esferas, instrumentos de autoclavagem ou enxágue com peróxido a 30% ou etanol a 90%, dependendo do protocolo experimental aprovado. - Coloque o prato de cerâmica usado para preparar o cimento dental em uma caixa de gelo, geladeira ou freezer, seguindo as instruções do kit de cimento dental (consulte a Tabela de Materiais). Use o prato de cerâmica resfriado durante a mistura do cimento para aumentar o tempo em que o cimento é maleável. Use um prato resfriado sempre que forem necessárias etapas de cimentação mais longas.
- Se a verificação histológica da colocação da sonda no final do experimento for desejada, estenda a sonda de silicone logo antes da cirurgia girando o parafuso no microdrive no sentido anti-horário e aplique um corante lipofílico (consulte a Tabela de Materiais) na sonda mergulhando-a em uma pequena gota do corante. Prepare o corante lipofílico a partir de uma solução de estoque diluída de dimetilsulfóxido (DMSO) ou etanol (EtOH) comprada comercialmente (consulte a Tabela de Materiais) diluindo-o em um tampão adequado, como PBS, a uma concentração de 1-5 μM.
4. Cirurgia: Preparação do animal
- Siga um protocolo de anestesia aprovado para uma cirurgia de roedores de 2 a 4 horas em condições assépticas. Isso pode incluir anestesia geral e local, analgesia, aplicação de pomadas para os olhos e injeções de solução salina. Aqui, use anestesia injetável (cetamina 100 [mg / kg] / medetomidina 0,5 [mg / kg]) junto com creme de analgesia local e pomada para os olhos (consulte a Tabela de Materiais) e coloque o animal em uma almofada de aquecimento para regular a temperatura corporal.
- Quando o animal estiver totalmente anestesiado, mova-o para uma área de barbear não estéril separada.
- Certifique-se de que o animal seja aquecido o suficiente; Por exemplo, coloque-o em uma almofada de aquecimento. Remova os pelos na parte superior do crânio. Faça isso com um barbeador elétrico ou creme de depilação (consulte a Tabela de Materiais) ou raspando repetidamente o topo da cabeça com um bisturi coberto com etanol 70%.
- Remova cuidadosamente os pelos soltos para garantir que eles não entrem em contato com o tecido exposto posteriormente. Para remover os pelos, use, por exemplo, lenços umedecidos com etanol 70% e/ou uma bomba de esferas de compressão. Se estiver usando creme de depilação, certifique-se de que ele seja removido com cotonetes e soro fisiológico.
- Desinfete a área raspada várias vezes com um desinfetante à base de iodo (consulte a Tabela de Materiais) e álcool usando cotonetes, movendo-se do centro da cabeça para os lados para afastar os pelos soltos restantes do local da incisão.
- Desinfete o pelo na cabeça e ao redor da cabeça usando betadine. Isso garante uma área de trabalho estéril e protege os instrumentos e materiais cirúrgicos de entrar em contato com peles não esterilizadas.
- Coloque o animal em uma estrutura estereotáxica usando barras auriculares e suporte de nariz (consulte a Tabela de Materiais).
- Usando uma pequena tesoura cirúrgica (ver Tabela de Materiais), corte uma abertura em forma de amêndoa na pele no topo do crânio, alcançando apenas a parte posterior da sutura lambda até entre os olhos.
- Remova a membrana subcutânea e o periósteo cortando ainda úmido e, em seguida, coce o crânio com uma lâmina de bisturi para remover o tecido macio da superfície do crânio que pode impedir a adesão do cimento dentário.
- Opcional: Uma vez que o crânio tenha sido limpo do tecido da membrana, aplique brevemente uma fina camada de peróxido a 0,5% e lave-o com desinfetante de iodo à base de água (por exemplo, Betadine) antes de tornar a superfície do crânio áspera para melhorar a adesão do primer ao crânio.
- Torne cuidadosamente áspera a superfície do crânio arranhando um padrão cruzado com a ponta do bisturi virada de cabeça para baixo. Isso ajuda o cimento dentário a aderir ao crânio mais tarde.
NOTA: Não coce com muita força em cima das suturas, pois isso pode causar a ruptura das suturas e vazamento de fluido intracraniano, o que prejudica a adesão do cimento dentário. - Alterne entre lâmina de bisturi e cotonetes estéreis para arranhar / empurrar suavemente os músculos do pescoço presos às laterais da sutura lambda até que os músculos tenham sido empurrados de volta para a 'borda' do crânio no topo do cerebelo. Isso ajuda a minimizar o ruído muscular nas gravações neuronais.
- Encha uma seringa de 1 mL com uma agulha de 27 G (consulte a Tabela de Materiais) com pequenas quantidades de cola cirúrgica de cianoacrilato (consulte a Tabela de Materiais). Em seguida, cole a pele nas bordas do crânio usando a seringa para espalhar pequenas gotas de supercola sobre ela. Cole o tecido o mais plano possível no crânio para deixar espaço para implantes. Esse procedimento garante que a pele e os músculos não entrem em contato direto com partes do implante, o que evita ruídos musculares nos registros e melhora a adesão do cimento dentário.
- Aplique primer de cimento dental em todo o crânio para adesão extra e endureça com luz ultravioleta (consulte a Tabela de Materiais). Isso melhora a adesão do cimento dentário e evita que as suturas cranianas vazem e enfraqueçam a ligação crânio-cimento ao longo do tempo.
- Encontre o local de destino para o implante da sonda em relação ao bregma ou lambda e contorne a craniotomia ao redor dele com um marcador cirúrgico. Coloque a placa de cabeça no crânio de forma que a craniotomia fique dentro dela, com espaço para o microdrive em um lado da craniotomia, bem como para 1-2 pinos de aterramento.
- Implante a placa de cabeça usando cimento dentário. Misture o cimento dental no prato de cerâmica resfriado designado (consulte a etapa 3.2). Certifique-se de que a placa de cabeça adere ao crânio por todos os lados, formando um 'poço' estanque.
- Com uma broca odontológica (tamanho US 1/2 HP), faça um pequeno orifício de rebarba da largura dos pinos do cabeçalho preparados na etapa 1.4 sobre a(s) área(s) do cérebro a ser usada como GND/REF. Se desejar aterrar a gaiola de Faraday, faça outro pequeno orifício próximo à borda da gaiola de Faraday para o pino coletor Faraday-GND.
NOTA: Para o(s) pino(s) do cabeçalho GND/REF, coloque a craniotomia a uma distância suficiente da borda da gaiola para que o próprio pino do cabeçalho possa ser colocado dentro dela posteriormente sem tocar na gaiola de Faraday. - Limpe a craniotomia pingando suavemente solução salina estéril sobre ela com uma seringa e removendo-a com lenços umedecidos que não derramam (consulte a Tabela de Materiais). Repita até que todo o sangue e tecido solto sejam removidos.
- Prepare uma solução de ágar 0,7% (ver Tabela de Materiais) em solução salina, resfrie-a levemente e introduza-a na craniotomia usando uma agulha 27 G em uma seringa de 1 mL.
- Insira suavemente um pino GND (consulte a etapa 1.3) em cada craniotomia perfurada na etapa anterior. O(s) pino(s) será(ão) cercado(s) por ágar em todos os lados (consulte a etapa 4.17). Aplique cimento ao redor dos pinos do cabeçote para prendê-los e fornecer isolamento elétrico.
- Limpe o prato de cerâmica e coloque-o de volta na geladeira / freezer.
- Com uma broca dentária, perfure o contorno de uma craniotomia maior (circular ou quadrada) movendo-se ao redor da borda em movimentos constantes. Certifique-se de que a craniotomia seja de 1 mm x 1 mm a 2 mm x 2 mm para permitir pequenos ajustes no posicionamento da sonda para evitar vasos sanguíneos sem expor muito do córtex. Se possível, evite colocar craniotomias sobre suturas. Perfure em rodadas de 20 a 30 s e resfrie o crânio com solução salina entre as rodadas de perfuração.
NOTA: Ao iniciar a perfuração, é útil marcar a borda de ataque do microdrive com um marcador, garantindo assim que, ao perfurar, uma borda reta possa ser formada em paralelo à borda de ataque do microdrive. Isso melhora as chances de evitar cimento na craniotomia ao fixar o microdrive no lugar, além de melhorar a aderência, evitando a saliência do microdrive sobre a craniotomia e permitindo maior manobrabilidade lateral ao colocar o microdrive em relação à posição final do local de gravação. - Após algumas rodadas iniciais de perfuração, teste a resistência da parte perfurada do osso empurrando-a suavemente com uma pinça fina (tamanho 5 ou mais fino; consulte a Tabela de Materiais).
- Continue testando entre as rodadas de perfuração até que o osso comece a 'saltar' sob a pinça quando empurrado. Quando for esse o caso, adicione uma gota de solução salina em cima da craniotomia para amolecer o osso e, em seguida, use a pinça para remover suavemente o pedaço de osso perfurado.
- Se o osso não puder ser removido suavemente, faça outra rodada de perfuração, concentrando-se nos pontos onde o osso ainda está preso com mais força. Em geral, tente remover o crânio com uma leve pressão da pinça antes de ser totalmente perfurado, pois isso normalmente minimiza os danos aos tecidos.
NOTA: Certifique-se de que a superfície da dura-máter seja umedecida regularmente, tanto durante a perfuração para reduzir as temperaturas quanto após a remoção do retalho ósseo. Isso aumenta as chances de fácil inserção da sonda, evitando que a dura-máter seque e se torne mais difícil de penetrar. Se a dura-máter for muito difícil de penetrar, ou se sondas rombas ou de múltiplas hastes estiverem sendo usadas, uma durotomia é realizada levantando a dura-máter com uma agulha de 27 G e realizando uma pequena incisão sob imersão em solução salina para evitar que a dura-máter grude na superfície do cérebro.
- Cubra a craniotomia com uma esponja hemostática (ver Tabela de Materiais) embebida em solução salina fria e estéril para proteger a dura-máter e o cérebro.
5. Cirurgia: Implantação da sonda
- Conecte o suporte de microdrive personalizado (consulte Tabela de materiais) ao braço do aparelho estereotáxico. Se o microdrive foi removido do suporte do microdrive após a preparação da sonda, coloque o microdrive com a sonda de silicone conectada no suporte do microdrive. Incline o braço de estereotaxa, conforme necessário, para alcançar a área desejada do cérebro. Coloque o anel da coroa com o amplificador conectado nos três pinos verticais na parte traseira do suporte do microdrive (consulte a Figura Suplementar 1).
- Abaixe o microdrive até ~0.5 mm da craniotomia e, em seguida, use uma pinça para conectar o(s) pino(s) do cabeçalho GND/REF conectado(s) à sonda ao(s) pino(s) GND/REF correspondente(s) implantado(s) no crânio (consulte as etapas 4.14-4.15). Consulte a Figura Suplementar 3 e a Figura Suplementar 4 para obter exemplos de acionamento, craniotomia e colocação de pinos GND/REF.
- Uma vez no lugar, opcionalmente prenda o(s) pino(s) com uma gota de epóxi de prata condutor (consulte a Tabela de Materiais) para uma conexão mais robusta. Uma vez curado o epóxi de prata, cubra os pinos conectados com uma pequena quantidade de cimento dentário (consulte a Tabela de Materiais) para garantir que a conexão permaneça estável por longos períodos e que não haja conexão elétrica com os tecidos circundantes e/ou elementos do implante.
- Remova a esponja hemostática da craniotomia (consulte a etapa 4.22).
- Posicione o braço estereotáxico com o microdrive sobre a craniotomia.
NOTA: Se a sonda estiver retraída, certifique-se de que o microdrive seja colocado de forma que a sonda toque em uma parte da craniotomia que não contenha grandes vasos sanguíneos. - Abaixe o microdrive, se necessário, ajustando a localização e o ângulo até que a haste da sonda toque a dura-máter ou a superfície do cérebro (consulte a etapa 4.21) na área alvo.
- Misture o cimento dental no prato de cerâmica designado (consulte a etapa 3.2) e cimente a base do microdrive no lugar, concentrando-se nos três lados da base do microdrive que não estão voltados para o eletrodo. Certifique-se de que o cimento não toque no microdrive acima da 'base' removível (consulte a Figura 1D).
- Certifique-se de que qualquer espaço entre a base e o crânio esteja totalmente coberto com cimento dental. Limpe o prato de cerâmica e coloque-o de volta na geladeira / freezer. Aguarde a cura do cimento, aproximadamente 10-15 min.
NOTA: Um pequeno espaço é deixado entre a base do microdrive e o crânio, e o cimento é usado em sua forma mais fluida para preenchê-lo. Uma vez que o cimento tenha engrossado ligeiramente, o cimento entre as paredes da base do microdrive e o crânio é construído. Quantidades muito pequenas de cimento são sempre usadas, pois o fluxo da substância pode ser imprevisível e volumes maiores podem fluir para regiões indesejadas. Pequenas quantidades de esponja hemostática embebidas em solução salina podem ser usadas para cobrir partes da craniotomia. Se o cimento fluir acidentalmente para a craniotomia, remova o cimento com uma pinça assim que ele entrar em uma consistência semelhante a um filme.
- Certifique-se de que qualquer espaço entre a base e o crânio esteja totalmente coberto com cimento dental. Limpe o prato de cerâmica e coloque-o de volta na geladeira / freezer. Aguarde a cura do cimento, aproximadamente 10-15 min.
- Abaixe a sonda de silício no cérebro, monitorando cuidadosamente a posição da sonda por meio de um microscópio. Quando as hastes da sonda tocarem o cérebro, abaixe a sonda rapidamente em ~ 250 μm (uma volta completa do parafuso é de 282 μm) para garantir que a sonda rompa a resistência da dura-máter/superfície cortical.
- Verifique isso visualmente. Se a sonda não tiver quebrado o córtex, aguarde 5 minutos e, em seguida, tente gravar a dura-máter com a ponta da haste, levantando e abaixando repetidamente a sonda em algumas dezenas de micrômetros enquanto a dura-máter/córtex está sob tensão da ponta da sonda.
- Uma vez que a sonda tenha rompido a superfície do córtex, abaixe-a gradualmente em um ritmo mais lento (100-200 μm / min) até que as coordenadas alvo sejam alcançadas ou a sonda tenha se movido mais de 1000 μm. Se o alvo exigir que a sonda se mova mais de 1000 μm, avance a sonda em etapas de no máximo 1000 μm/sessão nas sessões de gravação seguintes até que as coordenadas do alvo sejam alcançadas.
NOTA: Pule esta etapa se preferir monitorar sinais neuronais enquanto abaixa a sonda de silício. As etapas para isso são descritas na seção 7. - Prepare o elastômero de silicone de acordo com as instruções (consulte a Tabela de Materiais) e dispense uma pequena gota na craniotomia usando uma seringa de 1 mL (consulte a Tabela de Materiais).
- Depois de seco, cubra o elastômero de silicone com uma mistura 50/50 de cera óssea e óleo mineral. Esta etapa protege ainda mais a sonda e evita o acúmulo de detritos e plasma seco sobre a craniotomia, tornando a extração mais simples e segura. Tenha cuidado, pois trabalhar ao redor da sonda enquanto ela está abaixada pode causar quebra.
6. Cirurgia: Implantação da gaiola de Faraday
- Quando o cimento dentário estiver totalmente solidificado, afrouxe o suporte do microdrive afrouxando o parafuso lateral que fixa o acionamento com uma chave Allen (consulte a Figura 1 suplementar). Retraia suavemente o suporte em ~1 cm para que o microdrive fique independente, mas o amplificador/conector da sonda permaneça fixo ao suporte do implante sem esticar o cabo flexível.
- Coloque a coroa pré-fabricada e a malha de Faraday ao redor da placa de cabeça esticando a gaiola na abertura e encaixando-a sobre o microdrive e o cabo flexível horizontalmente e, em seguida, fixe-a na placa de cabeça com cimento dental.
NOTA: Certifique-se de fechar todos os espaços entre a gaiola de Faraday e o crânio com cimento dental para proteger o implante contra contaminação. - Coloque o anel da coroa de Faraday (consulte a Tabela de Materiais) com o conector da sonda/headstage sobre a coroa, alinhando o suporte integrado para a sonda ampmais vivo/conector com a área marcada por um 'X' recuado na coroa de Faraday (consulte a etapa 2.13).
- Prenda o anel à gaiola de Faraday com uma pequena gota de cola de cianoacrilato ou cimento dental em cada junção do anel do raio.
- Uma vez que o anel de Faraday com sonda integrada amplifier/conector estiver preso no lugar, retraia totalmente o braço estereotáxico com o suporte do microdrive. Consulte a Figura 3 suplementar para obter um guia passo a passo sobre a montagem desses componentes.
7. Gravação de teste pós-operatório
- Conecte o amplificador/conector da sonda ao hardware de gravação e inicie uma gravação.
- Se a sonda ainda não tiver atingido seu local de destino durante a inserção inicial (consulte a etapa 5.9), gire lentamente o parafuso do microdrive no sentido anti-horário para abaixar a sonda enquanto monitora os sinais neuronais.
NOTA: Os sinais devem mudar a) quando os eletrodos tocam a camada de elastômero de silicone acima da craniotomia e b) quando os eletrodos começam a se mover para o cérebro (consulte a etapa 7.2). A atividade neuronal de alta frequência será registrada por eletrodos totalmente inseridos no cérebro, enquanto os eletrodos que estão em contato com o LCR na superfície do cérebro normalmente mostrarão um sinal de população neuronal filtrado de baixa passagem sem atividade de pico (semelhante a um traço de EEG), e os locais de registro no ar registrarão aumento do ruído elétrico. É possível verificar adicionalmente a profundidade de inserção da sonda medindo a impedância de canais individuais após a gravação do teste. Os canais em contato com o ar devem apresentar alta impedância (indicando um circuito aberto) e impedâncias como as medidas antes da cirurgia para os canais que tocam o LCR ou já estão no cérebro. Avance a sonda de silício a uma distância total máxima de aproximadamente 1000 μm por sessão, com uma velocidade máxima de aproximadamente 75 μm/min (consulte a etapa 5.5). - Quando os potenciais de campo local neural forem visíveis na sonda e/ou a sonda estiver avançada em no máximo 1000 μm, termine a gravação de teste e desconecte o conector head-stage.
8. Recuperação
- Cubra a gaiola de Faraday com envoltório veterinário autoaderente (consulte a Tabela de Materiais).
- Finalize a anestesia e deixe o animal se recuperar por alguns dias seguindo as diretrizes experimentais aprovadas.
- Se os eletrodos na sonda de silício ainda não estiverem no local desejado, gire o parafuso do microdrive em pequenos passos com um máximo de quatro voltas completas (ou ~1000 μm) por sessão. Se necessário, repita este procedimento por vários dias até que o alvo seja alcançado. Recomenda-se combinar o movimento da sonda com registros simultâneos para avaliar a atividade eletrofisiológica em áreas transversalizadas.
9. Experimentos comportamentais e gravações crônicas
- Para gravações crônicas fixas na cabeça durante a execução da tarefa, prenda a placa de cabeça na base da gaiola de Faraday ao grampo de fixação da cabeça abrindo manualmente o grampo e prendendo a placa de cabeça implantada (consulte a Figura 1C, E, F).
NOTA: Se a fixação da cabeça não for necessária, este sistema de implante também pode ser usado para gravações em movimento livre. Para gravações em movimento livre, pule as etapas 9.1 e 9.7. - Remova o envoltório veterinário autoaderente do implante.
NOTA: Para minimizar o desconforto para o animal, sugere-se que uma tarefa comportamental simples e gratificante seja iniciada antes desta etapa como uma distração enquanto o experimentador trabalha com o implante. - Conecte o amplificador/conector ao equipamento de gravação.
- Realize gravações neuronais enquanto o animal executa a tarefa.
NOTA: Se o objetivo é maximizar o número de unidades extracelulares registradas, mova o ônibus espacial em algumas dezenas de micrômetros sempre que o rendimento neural em um local diminuir. Observe que, depois de mover a sonda, o sinal pode levar de minutos a horas para se estabilizar. Portanto, pode ser benéfico mover a sonda no final de uma sessão para que o sinal possa se recuperar até o início da próxima sessão. - Desconecte o equipamento de gravação e cubra o implante com um novo envoltório veterinário no final da gravação comportamental.
- Abra o grampo de fixação da cabeça para separar o animal da fixação da cabeça.
10. Recuperação da sonda
- No final da gravação final, retraia a sonda de silício o máximo possível no microdrive girando o parafuso no sentido horário. Faça isso enquanto o animal está com a cabeça fixa e se comportando ou com o animal anestesiado na configuração cirúrgica. Mapeie a saída da sonda do cérebro monitorando os sinais neuronais simultaneamente e verificando a assinatura dos eletrodos imersos no cérebro, tocando a superfície do cérebro ou em contato com o ar (consulte a etapa 7.3).
NOTA: Dependendo do protocolo histológico e da sonda, as lesões eletrolíticas são realizadas antes de retrair a sonda para determinar a localização exata de alguns eletrodos na sonda. Se não for necessário monitorar a saída da sonda por meio de registro neuronal, também é possível retrair a sonda assim que o animal for terminado. - Terminar o animal seguindo as diretrizes aprovadas (isso inclui perfundir o animal se estiver planejada a fixação do cérebro para histologia subsequente).
- Aguarde ~ 10 min após a morte do animal. Em seguida, fixe a cabeça do animal na estereotaxa, certificando-se de que a cabeça do animal não possa se mover durante o explante para evitar a quebra da sonda.
- Aplique uma gota de solução salina em cima da craniotomia e deixe de molho por alguns minutos para amolecer o tecido biológico seco na haste da sonda e diminuir a chance de quebra da haste.
- Coloque o suporte estereotáxico aproximadamente 0.5 cm acima do microdrive. Em seguida, corte a extremidade superior dos raios da gaiola de Faraday com uma pequena tesoura cirúrgica (consulte a Tabela de Materiais) para liberar o anel de Faraday que segura o amplificador/conector e transfira o anel de volta para os pinos verticais na parte superior do suporte estereotáxico (consulte a etapa 5.1 e a Figura Suplementar 1).
- Corte cuidadosamente a malha de cobre com a mesma tesoura cirúrgica, cortando áreas de malha em forma de U entre os raios da coroa de Faraday. Em seguida, corte os raios de plástico da coroa na base.
NOTA: Evite dobrar os raios de plástico impressos enquanto eles estão sendo cortados, pois eles podem quebrar e enviar detritos de plástico voando em direção à sonda. - Abaixe o suporte estereotáxico até que o microdrive possa ser fixado no suporte usando o parafuso lateral do suporte, fixe o microdrive e, em seguida, solte o parafuso T1 que conecta o corpo do microdrive à base do microdrive.
- Retraia lentamente o braço estereotáxico com o suporte do implante para levantar o microdrive de sua base. Certifique-se de que o microdrive se separe da base em um ângulo perpendicular (ou seja, 'verticalmente' da base).
NOTA: Se o corpo e a base do microdrive não se separarem facilmente, verifique se o movimento do braço estereotáxico não está em um ângulo em comparação com a orientação do microdrive. Se necessário, o suporte e o microdrive são realinhados um ao outro, afrouxando levemente a fixação da cabeça do animal e reposicionando-a de acordo. O alinhamento correto é um dos aspectos cruciais para facilitar a recuperação do microdrive. Além disso, verifique se há algum cimento dentário residual conectando o microdrive e a base do microdrive (consulte a etapa 5.5). Nesse caso, o cimento é cuidadosamente raspado com bisturi e/ou broca dentária, dependendo da quantidade de cimento utilizada. - Levante o braço estereotáxico com a sonda acoplada para criar espaço suficiente abaixo dele.
- Remova o animal da estereotaxa e prepare o cérebro seguindo um protocolo de histologia aprovado, se desejar. Recupere a base do microdrive implantada e limpe-a mergulhando-a em acetona por várias horas para reutilização posterior.
- Coloque uma base de microdrive limpa na massa adesiva (consulte a Tabela de Materiais), depois abaixe o microdrive na base e aperte o parafuso. Para evitar quebras, monitore a posição da sonda sob um microscópio durante todo o processo. Esta etapa pode ser concluída posteriormente se a base do microdrive implantado precisar ser limpa para reutilização primeiro.
NOTA: Este protocolo exige o uso de massa adesiva como plataforma para a base, o que é vital, pois protege a base e, ao mesmo tempo, tem um grau de elasticidade, garantindo que a base não escorregue e colida com a sonda. A massa deve ser moldada em uma 'face de penhasco' vertical na lateral da base do microdrive onde a sonda será abaixada. Isso garante que, se a sonda for abaixada além da base, ela não entre em contato com a massa por baixo. A 'torre' da massa também deve ser alta o suficiente para que, se for abaixada além da base do microdrive, a sonda não entre em contato com a superfície da mesa na qual a massa é colocada. Por fim, prenda bem a massa na superfície para evitar que escorregue ou caia. Ao abaixar o microdrive na base do microdrive presa pela massa, certifique-se de um perfil lateral view do microscópio para monitorar o progresso para que, à medida que a sonda é abaixada, ela não colida com a base ou com a massa. - Limpe e esterilize a sonda seguindo as instruções do fabricante. Para as sondas mais comumente disponíveis, mergulhe-as em um limpador enzimático (consulte a Tabela de Materiais) por 12 h, depois enxágue em água desmineralizada e higienize em álcool. Faça isso abaixando a sonda em um béquer grande contendo o limpador enzimático enquanto ainda estiver conectado ao suporte do microdrive no braço estereotáxico.
NOTA: Se desejar, meça as impedâncias dos eletrodos na sonda após a limpeza para monitorar a degradação potencial de eletrodos individuais. - Armazene o microdrive com a sonda limpa com segurança até o próximo experimento.
Resultados
Este protocolo apresenta um sistema de implantação crônica que permite aos pesquisadores implementar registros de eletrofisiologia crônica leves, econômicos e seguros em camundongos que se comportam (Figura 1). Os principais fatores que determinam a aplicação bem-sucedida dessa abordagem incluem: cobertura completa de cimento do crânio, uma craniotomia minimamente invasiva e devidamente protegida, fixação segura do microdrive e da fiação ao crânio e continuidade completa do material protetor de Faraday. Quando esses pontos são contabilizados, gravações de alta qualidade podem ser alcançadas de forma consistente. Aqui são mostrados resultados representativos relativos aos seguintes aspectos principais do sucesso da cirurgia:
1) O implante está interferindo no comportamento ou no bem-estar animal?
2) A qualidade do sinal é alta e os sinais podem ser mantidos por longos períodos de tempo?
3) As gravações podem ser combinadas facilmente com o desempenho da tarefa?
Para avaliar o impacto do implante no comportamento animal, analisamos padrões de locomoção rastreados em cinco animais implantados. A Figura 2A mostra um exemplo de um animal se movendo livremente dentro de uma gaiola de brincar por 10 minutos antes e 1 semana após o implante. Pode-se ver que os padrões de movimento permanecem inalterados. Esta observação é confirmada pela Figura 2B, C mostrando as distribuições das velocidades de movimento e direções da cabeça entre os animais. Tanto a velocidade de corrida quanto as direções da cabeça permaneceram praticamente inalteradas antes e depois da implantação e, no mínimo, as velocidades de corrida pareciam ligeiramente elevadas após a cirurgia. O Vídeo Suplementar 1 mostra uma pequena gravação de vídeo de um animal 6 dias após a cirurgia de implantação. Comportamentos típicos de gaiolas domésticas, como locomoção, higiene, criação e forrageamento no ambiente doméstico, são visíveis e indicam uma recuperação bem-sucedida da cirurgia, bem como a saúde geral. O baixo impacto comportamental do implante é provavelmente devido ao seu baixo peso e altura gerenciável.
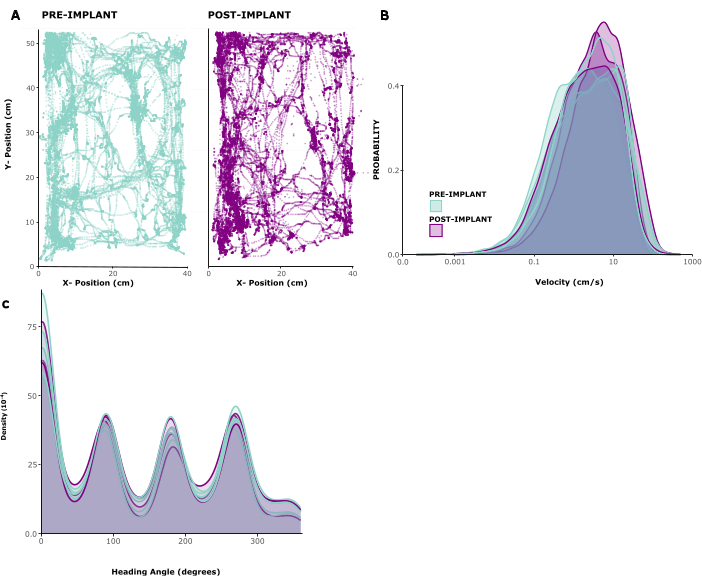
Figura 2: Locomoção antes e após a cirurgia. (A) Exemplo de locomoção de um animal antes (painel esquerdo) e após a implantação (painel direito). As coordenadas x/y estão em centímetros, os pontos mostram a posição do animal em cada ponto de tempo durante um período de 10 min. (B) Distribuição das velocidades de movimento em cm/s por 5 sessões antes e 3 sessões após a implantação em 5 animais. (C) Densidade de kernel para probabilidade de movimento em diferentes direções, para as mesmas sessões analisadas em (B). Clique aqui para ver uma versão maior desta figura.
Em seguida, a qualidade do sinal no Potencial de Campo Local (LFP) e a atividade de pico nos locais de gravação são avaliadas. Aqui, mostramos dados representativos de gravações corticais no córtex visual primário (V1). Para validação, a atividade putativa de unidade única foi extraída de sinais neuronais de banda larga registrados em V1 de um camundongo acordado usando Kilosort 3 (ver Figura 3). A Figura 3A mostra a localização das unidades únicas extraídas na haste da sonda, a Figura 3B mostra as formas de onda de pico correspondentes e a Figura 3C mostra as respostas de pico dos mesmos neurônios a um protocolo de densidade de fonte de corrente (CSD). Nesse paradigma, flashes de campo amplo foram apresentados com uma duração de 300 ms a uma frequência de 1 Hz (ou seja, 300 ms ligado, 700 ms desligado) em 200 tentativas. Finalmente, a Figura 3D mostra as respostas das mesmas unidades a um protocolo de mapeamento de campo receptivo visual, consistindo em 2000 quadros de quadrados pretos e brancos selecionados aleatoriamente em um fundo cinza, e cada um apresentado por 16,6 ms. Os quadrados cobriam 12 graus de ângulo visual cada e foram selecionados a partir de um campo de 15 x 5 locais possíveis para que o paradigma de mapeamento cobrisse um espaço visual de -90 a +90 graus de azimute e -30 a +40 graus de elevação no total. As respostas da taxa de disparo a cada quadro de estímulo foram extraídas analisando a taxa máxima de disparo em uma janela de 16,6 ms, sujeita a um atraso entre 40-140 ms, identificada como ideal por canal com base na atividade máxima em cada janela. Esse tipo de registro pode ser usado para orientar o ajuste da profundidade de inserção de cada eletrodo e avaliar a qualidade do sinal após a cirurgia de implante.
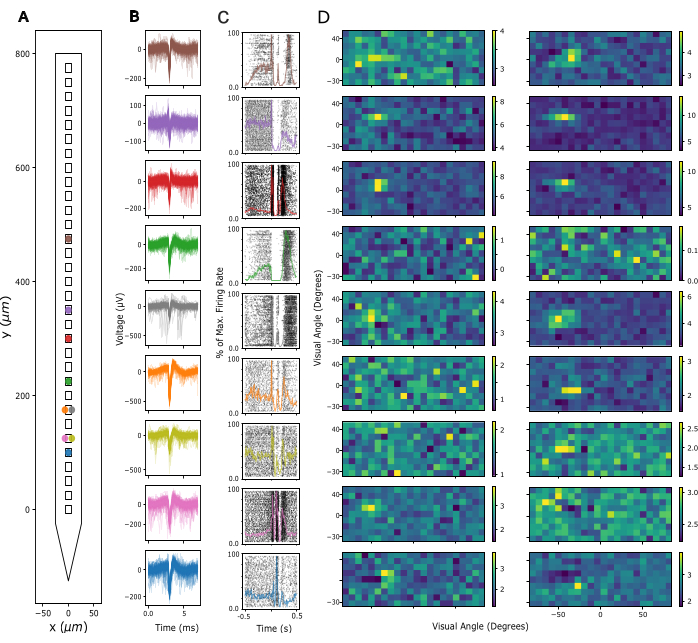
Figura 3: Sinais neuronais registrados. (A) Localização inferida de unidades únicas classificadas pelo pacote de classificação de pico Kilosort 3 ao longo dos contatos do eletrodo da sonda. (B) Formas de onda de pico para as mesmas unidades mostradas em A em 5 ms de tempo. Linhas finas: Formas de onda de pico individuais. Linhas grossas: Forma de onda média de pico. (C) Gráfico raster de picos em resposta a um paradigma de densidade de fonte de corrente (CSD) apresentando flashes de campo amplo de 300 ms seguidos por uma tela preta de 700 ms. As respostas são mostradas para as mesmas unidades que em A e B. Linhas coloridas sobrepostas representam histogramas de tempo peri-estímulo (PSTHs) das mesmas respostas. As taxas de disparo para os PSTHs foram calculadas em compartimentos de 10 ms e depois normalizadas pela taxa máxima de disparo em todo o PSTH. O tempo 0 é centrado em torno do estímulo do flash de campo amplo. (D) Campos receptivos estimados das mesmas unidades que em AC, medidos por um paradigma de Mapeamento de Campo Receptivo de Ruído Esparso. Cada gráfico mostra a atividade média da taxa de disparo em uma janela de análise de 16,6 ms em resposta ao início (painel esquerdo) ou deslocamento (painel direito) de estímulos quadrados brancos e pretos. Os estímulos foram apresentados com duração de 16,6 ms, localizados aleatoriamente em uma grade quadrada de 5 x 15 abrangendo 180 graus de ângulo visual horizontalmente e 70 graus de ângulo visual verticalmente. A atividade da taxa de disparo foi marcada em z em toda a grade do campo receptivo (veja a barra de cores). Clique aqui para ver uma versão maior desta figura.
A qualidade da gravação permaneceu alta em gravações repetidas por semanas a meses. A Figura 4A mostra registros longitudinais de LFP de um animal ao longo de 15 semanas. LFPs foram registrados em resposta ao paradigma CSD descrito acima (ver Figura 3A-C). A Figura 4A mostra as respostas LFP médias de 500 ms após o início do flash. Neste exemplo, usamos uma sonda linear com 32 canais, com uma distância entre eletrodos de 25 μm. Observe que, no dia 18, a profundidade da sonda foi ajustada, deslocando-a para baixo em 600 μm. Antes e depois desse ajuste, os sinais LFP permaneceram estáveis ao longo dos dias de gravação.
Consistente com isso, formas de onda de pico de unidades únicas putativas eram discerníveis em muitas gravações. A Figura 4B mostra exemplos representativos de formas de onda de pico de três sessões de gravação ao longo de um mês de gravações, demonstrando que a atividade de uma única unidade pode ser identificada com sucesso ao longo do tempo. A Figura 4C mostra o número total de unidades individuais putativas extraídas de registros crônicos em seis animais, abrangendo uma janela de até 100 dias. As unidades individuais foram definidas de acordo com os critérios padrão do kilosort 3.0 (ver Tabela Suplementar 1). Como se pode ver, o número de unidades únicas claramente definidas normalmente chegava a ~ 40 na primeira semana após o implante e, em seguida, caiu gradualmente, movendo-se em direção a uma assíntota aparentemente estável de ~ 20 unidades. Dado que essas gravações foram conduzidas usando sondas lineares de 32 canais, isso equivale a um rendimento esperado de cerca de 1,25 unidades únicas por eletrodo diretamente após o implante, diminuindo para aprox. 0,65 unidades únicas por eletrodo em gravações de longo prazo. A conexão repetida ao amplificador/conector do implante durante as sessões não pareceu afetar a qualidade da gravação ou a estabilidade do implante, uma vez que a coroa de Faraday que segura o amplificador/conector pode suportar forças repetidas de mais de 10 Newton, uma ordem de magnitude maior do que até mesmo as forças máximas de acoplamento exigidas pelos conectores padrão (consulte o Vídeo Suplementar 2).
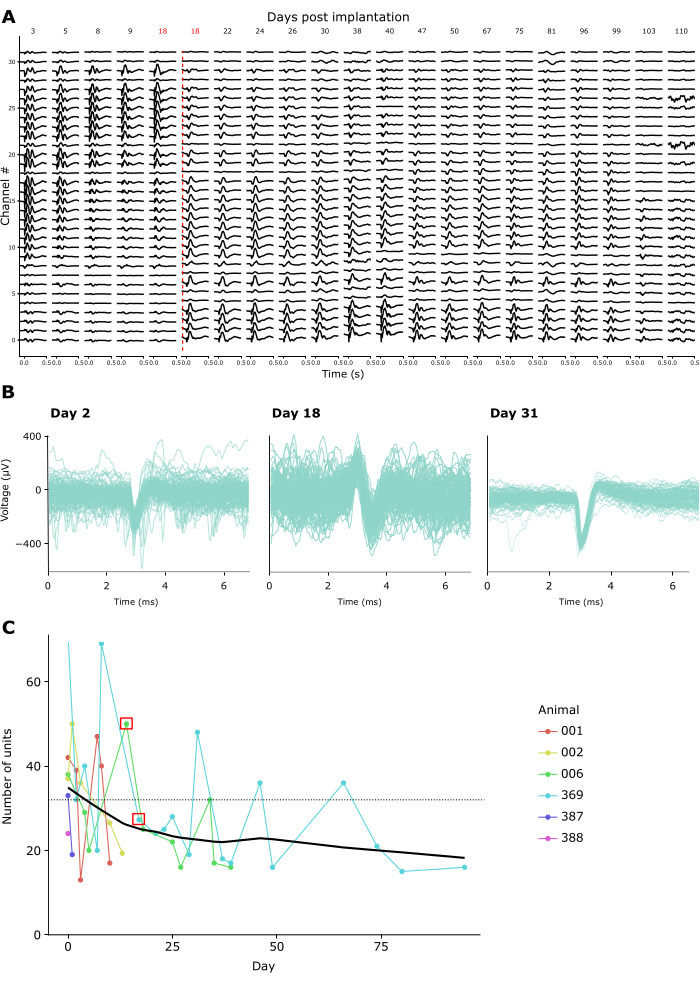
Figura 4: Estabilidade das gravações neuronais ao longo do tempo. (A) Atividade média de LFP em resposta a um estímulo CSD flash de campo amplo, mostrado em todos os 32 canais de uma sonda cronicamente implantada de 3 a 110 dias após o implante. A linha vertical vermelha denota a sonda sendo abaixada para um novo local devido à gravação dos canais 0-8 de fora do cérebro no dia 18 após a cirurgia. (B) Formas de onda de pico de três unidades de exemplo do mesmo implante crônico registradas repetidamente ao longo de quatro semanas. Linhas finas: Formas de onda de pico individuais. Linha sobreposta grossa: forma de onda média de pico. (C) O número de unidades individuais putativas detectadas pelo Kilosort 3 ao longo dos dias de registro para 6 animais (ver legenda inserida). O quadrado vermelho denota os dias em que a sonda foi movida. A linha pontilhada denota o número de eletrodos por implante usados nessas gravações (32). Clique aqui para ver uma versão maior desta figura.
Finalmente, ao fornecer um sistema modular, incluindo um microdrive, bem como uma gaiola de Faraday vestível e uma placa de cabeça que funciona como uma base de implante e um dispositivo para fixação da cabeça, este protocolo permite a integração da eletrofisiologia crônica com o comportamento de fixação da cabeça. Aqui, são mostrados dados de exemplo de mouses atravessando um ambiente virtual em uma esteira esférica. A Figura 5A mostra a atividade de pico relacionada à corrida de 20 unidades em um teste de exemplo. A Figura 5B mostra as relações diversas, mas robustas, entre a velocidade de corrida e a atividade de pico de unidades individuais classificadas por picos, bem como uma média populacional para o mesmo efeito na Figura 5C, confirmando o efeito bem estabelecido da atividade locomotora na atividade neuronal em roedores V124.
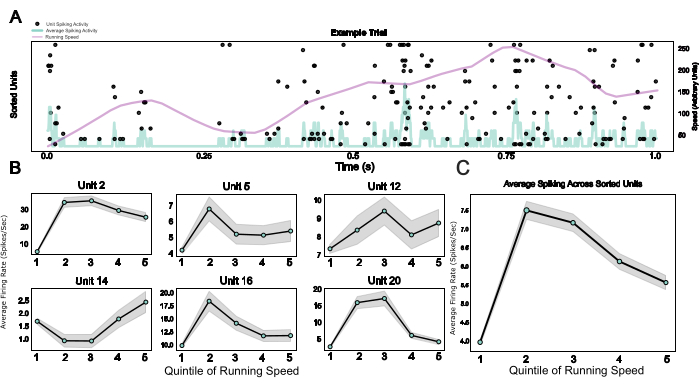
Figura 5: Respostas neuronais durante o comportamento de cabeça fixa. (A) Gráfico raster de respostas de unidade única em um teste de exemplo, com velocidade de corrida (linha roxa) e taxas médias de disparo em todas as unidades únicas (linha azul clara) sobrepostas. (B) Atividade de unidade única durante diferentes categorias de velocidade de corrida, mostrada para seis unidades de exemplo. (C) Atividade média de pico em todas as unidades individuais em uma sessão de exemplo, plotada nos cinco quintis da distribuição de velocidade de corrida. As velocidades de corrida nesta sessão variaram de 0 a 0,88 metros/segundo. Clique aqui para ver uma versão maior desta figura.
Tabela suplementar 1: Tabela mostrando os parâmetros padrão usados pelo Kilosort 3 ao identificar unidades únicas nas gravações mostradas na Figura 3, Figura 4 e Figura 5. Clique aqui para baixar este arquivo.
Vídeo Suplementar 1: Vídeo mostrando a atividade locomotora animal pós-implante. O vídeo feito após 5 dias de fase de recuperação está completo, mostrando o comportamento locomotor normal, bem como a adaptação ao tamanho e peso do implante. O animal pode ser visto normalmente explorando uma gaiola de brincar contendo enriquecimento ambiental. Clique aqui para baixar este arquivo.
Vídeo suplementar 2: Vídeo mostrando a força sendo aplicada na coroa de Faraday montada. As forças suportadas pela coroa de Faraday são aproximadamente uma ordem de magnitude maior do que a força de conexão necessária para conectores padrão, como conectores nano polarizados de 4 pinos. Clique aqui para baixar este arquivo.
Figura suplementar 1: Figura mostrando imagens do suporte da unidade. Os arquivos de design imprimíveis podem ser encontrados no repositório Github correspondente (https://github.com/zero-noise-lab/dream-implant/). Clique aqui para baixar este arquivo.
Figura suplementar 2: Modelo para malha de cobre. Imprima o modelo com a escala original e use o estêncil para cortar a malha de cobre (etapa 2.12). Use a barra de escala para verificar e, se necessário, ajustar a escala da impressão. Clique aqui para baixar este arquivo.
Figura 3 suplementar: Série de fotos mostrando as etapas de montagem do implante durante a cirurgia. Dois microdrives, bem como dois amplificadores, estão instalados neste caso. Clique aqui para baixar este arquivo.
Figura suplementar 4: Desenho do crânio do rato com exemplo de colocação de unidades, craniotomias (em verde) e pino GND/REF (em vermelho). A localização do pino é sugerida devido à colocação no cerebelo, o que provavelmente não interfere nos registros corticais. Clique aqui para baixar este arquivo.
Discussão
Este manuscrito apresenta um protocolo para a implantação rápida, segura e padronizada de sondas, que também permite a recuperação e reutilização da sonda ao final do experimento. A abordagem faz uso de um sistema modular de componentes de implante, especificamente um microdrive, que é compatível com todas as sondas de silício comuns e sistemas de gravação, uma placa de cabeça que pode ser usada para experimentos comportamentais fixos na cabeça e uma gaiola de Faraday vestível para proteger o implante. Essa constelação permite que os usuários adaptem de forma flexível seu implante a diferentes paradigmas experimentais, como comportamento de cabeça fixa versus comportamento de movimento livre ou miniaturização do implante (sem gaiola de Faraday) versus maior robustez de sinal de longo prazo (com gaiola de Faraday) - sem ter que sacrificar a padronização do implante no processo.
Essa abordagem torna os registros eletrofisiológicos crônicos mais padronizados (por meio de elementos pré-fabricados que não requerem montagem manual), menos dispendiosos (por meio da recuperação da sonda), menos demorados (simplificando as etapas da cirurgia) e mais facilmente compatíveis com o bem-estar e o comportamento animal (por meio da diminuição do tamanho do implante e da fixação da cabeça sem estresse). Como tal, este protocolo visa tornar os implantes eletrofisiológicos em roedores comportados acessíveis a uma gama mais ampla de pesquisadores além dos laboratórios pioneiros na vanguarda do campo.
Para atingir esse objetivo, o protocolo apresentado aqui minimiza o trade-off entre vários aspectos igualmente cruciais dos implantes de microdrive, ou seja, flexibilidade, modularidade, facilidade de implantação, estabilidade, custo geral, compatibilidade com o comportamento e reutilização da sonda. Atualmente, as abordagens disponíveis geralmente se destacam em alguns desses aspectos, mas a um custo alto para outros recursos. Por exemplo, para casos de uso que exigem estabilidade absoluta do implante por longos períodos de tempo, a melhor abordagem do implante pode ser cimentar diretamente a sonda no crânio25. No entanto, isso também evita a reutilização da sonda, bem como o reposicionamento dos locais de gravação em caso de má qualidade de gravação, e é incompatível com a colocação padronizada do implante. Da mesma forma, embora o acionamento AMIE forneça uma solução leve e de baixo custo para implantação recuperável de sondas, ele é limitado a sondas únicas e restrito na colocação das coordenadas alvo17. No extremo oposto do espectro, alguns nano-drives disponíveis comercialmente (ver Tabela 1 16,17,21,26,27,28,29,30) são extremamente pequenos, podem ser colocados livremente no crânio e maximizam o número de sondas que podem ser implantadas em um único animal 16. No entanto, eles são caros em comparação com outras soluções, exigem que os experimentadores sejam altamente qualificados para cirurgias de implantes bem-sucedidas e proíbem a reutilização da sonda. O microdrive desenvolvido por Vöröslakos et al.21, uma versão leve do qual também faz parte deste protocolo, sacrifica o tamanho pequeno do implante para melhor facilidade de uso, menor preço e reutilização da sonda
Tabela 1: Comparação de estratégias populares para implantes de sonda crônica em roedores. Disponibilidade: se o microdrive é de código aberto (para os pesquisadores construírem por conta própria), disponível comercialmente ou ambos. Modularidade: Os sistemas integrados consistem em um ou poucos componentes que estão em uma relação fixa entre si, enquanto os sistemas modulares permitem a colocação livre da sonda/microdrive em relação à proteção (engrenagem de cabeça/gaiola de Faraday) após a produção do implante (por exemplo, no momento da cirurgia). A modularidade foi determinada a partir de informações publicadas ou protocolos de implantação dos implantes listados. Fixação da cabeça: Sim: O implante possui mecanismos de fixação da cabeça integrados em seu design, X: O implante deixa o espaço para adicionar uma placa de cabeça extra para fixação sem grandes problemas, Não: O design do implante provavelmente cria problemas de espaço ou requer modificações substanciais no design para uso com a fixação da cabeça. Colocação da sonda: Restrito: A localização da sonda é limitada no estágio de projeto do implante. Flexível: A localização da sonda pode ser ajustada mesmo durante a cirurgia. Número de sondas: o número de sondas que podem ser implantadas. Observe que a implantação de sondas >2 em um camundongo representa um desafio significativo, independentemente do sistema de implante escolhido. Reutilização da sonda: sim, se as sondas puderem, em teoria, ser reutilizadas. Peso/tamanho: peso e volume do implante. Clique aqui para baixar esta tabela.
Para criar um sistema que concilie mais facilmente estes diferentes requisitos, o implante DREAM foi concebido com base no implante Vöröslakos21, mas com várias modificações fundamentais. Primeiro, para reduzir o peso total do implante, o microdrive usado aqui é produzido em alumínio usinado em vez de aço inoxidável impresso em 3D, e a coroa de Faraday é miniaturizada, alcançando uma redução de peso geral de 1,2-1,4 g, dependendo da escolha do material da placa de cabeça (consulte a Tabela 2). Em segundo lugar, a placa de cabeça ao redor do microdrive foi projetada para permitir um mecanismo de fixação de cabeça integrado que permite uma fixação de cabeça rápida e sem estresse, ao mesmo tempo em que funciona como base para a gaiola de Faraday, dando acesso à maioria das áreas-alvo potenciais para gravações neuronais e adicionando apenas um peso mínimo ao implante. A forma plana do mecanismo de fixação e a falta de saliências também garantem um comprometimento mínimo do campo visual ou da locomoção dos animais (ver Figura 2A-C), uma clara melhoria em relação aos sistemas anteriores31,32. A coroa e o anel de Faraday fixados na placa de cabeça também foram substancialmente alterados em comparação com os designs anteriores. Eles agora não exigem nenhuma adaptação ad-hoc (por exemplo, em termos de colocação do conector) ou soldagem durante a cirurgia, removendo possíveis causas de danos ao implante e variação imprevisível na qualidade do implante. Em vez disso, o implante DREAM fornece várias variações padronizadas do anel coroa que permitem colocar cada conector em uma das quatro posições predefinidas, minimizando a variabilidade e o esforço durante a cirurgia. Finalmente, ao otimizar o sistema de implantes para recuperação de sondas, o implante DREAM permite que os experimentadores reduzam drasticamente o custo e o tempo de preparação por implante, uma vez que o microdrive e a sonda normalmente podem ser recuperados, limpos e reutilizados juntos.
Para uma visão geral mais exaustiva das compensações apresentadas por diferentes sistemas de implantes, consulte a Tabela 1. Embora a abordagem apresentada aqui geralmente não forneça desempenho máximo em comparação com todas as outras estratégias, por exemplo, em termos de tamanho, estabilidade ou custo, ela opera na faixa superior em todos esses parâmetros, tornando-a mais facilmente aplicável a uma ampla gama de experimentos.
Três aspectos do protocolo são particularmente cruciais para se adaptar a cada caso de uso específico: a constelação de terra e referência, a técnica para cimentar o microdrive e a validação do implante por meio de gravação neuronal. Primeiro, ao implantar os pinos de aterramento e referência, o objetivo era identificar o ponto ideal entre estabilidade mecânica/elétrica e invasividade. Embora, por exemplo, os fios de prata flutuantes embutidos em ágar sejam menos invasivos do que os parafusos ósseos33, eles provavelmente são mais propensos a se desalojar com o tempo. O uso de pinos, acoplado ao ágar, garante uma conexão elétrica estável, além de ter a vantagem de ser mais fácil de controlar durante a inserção, evitando traumas teciduais. É improvável que os pinos de aterramento cimentados no crânio se desloquem e, no caso de o fio se separar do pino, a recolocação geralmente é simples devido à maior área de superfície e estabilidade do pino implantado.
Tabela 2: Comparação dos pesos dos componentes entre o implante DREAM e o implante descrito por Vöröslakos et al.21. Clique aqui para baixar esta tabela.
Em segundo lugar, a cimentação do microdrive geralmente deve ocorrer antes da inserção da sonda no cérebro. Isso evita o movimento lateral da sonda dentro do cérebro se o microdrive não estiver perfeitamente fixado no suporte estereotáxico durante a inserção. Para verificar o posicionamento da sonda antes de cimentar o microdrive no lugar, pode-se abaixar brevemente a ponta da haste da sonda para verificar onde ela entrará em contato com o cérebro, pois extrapolar a posição de pouso pode ser difícil devido ao deslocamento de paralaxe do microscópio. Uma vez estabelecida a posição do microdrive, pode-se opcionalmente proteger a craniotomia com elastômero de silicone antes de cimentar o microdrive para garantir que o cimento não entre em contato acidental com a craniotomia; No entanto, não é recomendado abaixar a sonda através do elastômero de silicone, pois os resíduos de elastômero de silicone podem ser puxados para o cérebro e causar inflamação e gliose.
Terceiro, dependendo do protocolo experimental utilizado, um registro de teste logo após a cirurgia pode ou não ser útil. Em grande parte, a atividade neuronal registrada logo após a inserção da sonda não será diretamente representativa da atividade registrada cronicamente, devido a fatores como inchaço cerebral transitório e movimento do tecido ao redor da sonda, o que significa que é improvável que tanto a profundidade de inserção quanto as formas de onda de pico se estabilizem diretamente. Como tal, as gravações imediatas podem servir principalmente para verificar a qualidade geral do sinal e a integridade do implante. Recomenda-se que o trenó móvel de microdrive seja utilizado nos dias subsequentes após a cirurgia, uma vez que o cérebro tenha se estabilizado para ajustar a posição. Isso também ajuda a evitar mover a sonda em mais de 1000 μm por dia, minimizando os danos ao local de gravação e, assim, melhorando a longevidade do local de gravação.
Finalmente, os usuários podem querer adaptar o sistema para gravar de mais de um local de destino. Como este sistema é modular, o usuário tem muita margem de manobra sobre como montar e colocar os componentes em relação uns aos outros (veja acima e a Figura Suplementar 3 e a Figura Suplementar 4). Isso inclui modificações que permitiriam que um vaivém estendido horizontalmente fosse montado no microdrive, permitindo que várias sondas ou grandes sondas de múltiplas hastes fossem implantadas, bem como a implantação de vários microdrives individuais (consulte a Figura Suplementar 3 e a Figura Suplementar 4). Tais modificações requerem apenas o uso de um anel de coroa adaptado, com um número maior de zonas de montagem para conectores/placas de interface/headstages. No entanto, as limitações de espaço desse design são ditadas pelo modelo animal, neste caso, o mouse, o que torna o empilhamento de várias sondas em um microdrive mais atraente em termos de pegada do que a implantação de vários microdrives independentemente uns dos outros. Os microdrives usados aqui podem suportar sondas empilhadas e, portanto, a única limitação real é o número de headstages ou conectores que podem se ajustar às restrições de espaço e peso definidas pelo modelo animal. Os espaçadores também podem ser usados para aumentar ainda mais os caminhos de montagem e inserção não verticais.
Em conclusão, este protocolo permite a implantação barata, leve e ajustável de uma sonda, com o benefício adicional de um design de microdrive que prioriza a recuperação da sonda. Isso aborda os problemas do custo proibitivo das sondas de uso único, a alta barreira das habilidades cirúrgicas e de implantação, bem como o fato de que as soluções comerciais para implantação crônica são muitas vezes difíceis de adaptar a casos de uso exclusivos. Essas questões representam um ponto problemático para os laboratórios que já usam eletrofisiologia aguda e um impedimento para aqueles que ainda não realizam experimentos de eletrofisiologia. Este sistema visa facilitar a aceitação mais ampla da pesquisa em eletrofisiologia crônica além dessas limitações.
Divulgações
TS, AN e MNH são co-fundadores da 3Dneuro BV, que fabrica os microdrives de código aberto e as coroas de Faraday usadas neste protocolo. FB e PT fazem parte do conselho consultivo científico da 33Dneuro B.V.. O FB e a PT não recebem qualquer compensação financeira por esta posição.
Agradecimentos
Este trabalho foi apoiado pelo Conselho Holandês de Pesquisa (NWO; Crossover Program 17619 "INTENSE", TS) e recebeu financiamento do Sétimo Programa-Quadro da União Europeia (FP7/2007-2013) ao abrigo do acordo de subvenção n.º 600925 (Neuroseeker, TS, FB, PT), bem como da Sociedade Max Planck.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
Referências
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados