Method Article
DREAM Implant: 머리가 고정되고 자유롭게 행동하는 마우스의 만성 전기생리학을 위한 가볍고 비용 효율적인 모듈식 임플란트 시스템
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 설치류의 만성 전기 생리학을 위한 가볍고 비용 효율적인 프로브 임플란트 시스템을 소개하며, 사용 편의성, 프로브 회수율, 실험적 다양성 및 행동과의 호환성에 최적화되어 있습니다.
초록
설치류의 만성 전기 생리학적 기록은 신경 역학과 그 행동 관련성에 대한 우리의 이해를 크게 향상시켰습니다. 그러나 프로브를 만성적으로 이식하는 현재의 방법은 비용, 사용 편의성, 크기, 적응성 및 장기적 안정성 간에 급격한 절충안을 제시합니다.
이 프로토콜은 현재 사용 가능한 옵션과 관련된 트레이드오프를 극복하도록 설계된 DREAM(Dynamic, Recoverable, Economical, Adaptable, and Modular)이라는 마우스용 새로운 만성 프로브 임플란트 시스템을 도입합니다. 이 시스템은 표준화된 하드웨어 요소를 갖춘 가볍고 모듈식이며 비용 효율적인 솔루션을 제공하며, 간단한 단계로 결합 및 주입할 수 있으며 회수 및 프로브의 여러 재사용을 위해 안전하게 이식할 수 있어 실험 비용을 크게 절감할 수 있습니다.
DREAM 임플란트 시스템은 세 가지 하드웨어 모듈을 통합합니다: (1) 모든 표준 실리콘 프로브를 운반할 수 있는 마이크로드라이브, 실험자가 최대 7mm의 이동 거리에서 기록 깊이를 조정할 수 있음; (2) 전기 차폐, 충격 보호 및 커넥터 배치를 위해 구리 메쉬로 덮인 웨어러블 패러데이 케이지를 위한 3차원(3D) 인쇄 가능한 오픈 소스 설계, (3) 동물 복지 및 사용 편의성 향상을 위한 소형 머리 고정 시스템. 해당 수술 프로토콜은 속도(총 소요 시간: 2시간), 프로브 안전성 및 동물 복지를 위해 최적화되었습니다.
임플란트는 동물의 행동 레퍼토리에 미치는 영향을 최소화하고, 자유롭게 움직이고 머리가 고정된 상황에 쉽게 적용할 수 있으며, 임플란트 후 몇 주간의 데이터 수집 동안 명확하게 식별 가능한 스파이크 파형과 건강한 신경 반응을 제공했습니다. 감염 및 기타 수술 합병증은 극히 드물었습니다.
따라서 DREAM 임플란트 시스템은 생쥐의 만성 전기 생리학을 위한 다재다능하고 비용 효율적인 솔루션으로, 동물의 웰빙을 향상시키고 보다 윤리학적으로 건전한 실험을 가능하게 합니다. 이 설계는 다양한 연구 요구에 따라 실험 절차를 단순화하여 광범위한 연구 실험실에 대한 설치류의 만성 전기 생리학에 대한 접근성을 높입니다.
서문
만성적으로 이식된 실리콘 프로브를 사용한 전기생리학은 유전적 및 실험적 다루기 쉬움으로 인해 행동하는 동물, 특히 마우스의 신경 활동과 연결성을 조사하는 강력한 기술로 부상했습니다1. 특히 층류 실리콘 프로브는 대뇌 피질 열2 내의 기능적 관계를 식별하고 이전에는 불가능했던 방식으로 대규모 신경 세포 집단의 역학을 행동과 관련시키는 데 매우 유용한 도구임이 입증되었습니다3.
생체 내 신경 활동을 기록하기 위한 현재의 황금 표준은 두 가지 보완적인 접근법이다: 이광자 현미경(two-photon microscopy)4,5 과 세포외 전기생리학(extracellular electrophysiology)6. 기록 방법의 선택은 얻을 수 있는 판독값의 특성을 제한합니다: 이광자 현미경은 시간이 지남에 따라 대규모 집단에서 개별적으로 식별 가능한 뉴런에 대한 종단 연구에 특히 적합하지만 높은 장비 비용으로 어려움을 겪고 있으며 온전한 뇌의 피질의 표층으로 제한됩니다. 또한 ~30Hz의 일반적인 시간 해상도는 진행 중인 뉴런 역학을 캡처하는 능력을 제한합니다 7,8.
이와는 대조적으로, 전기생리학적 기록은 높은 시간 해상도(최대 40kHz)를 제공하여 신경 세포 활동을 순간순간 추적할 수 있고, 대뇌 피질 깊이뿐만 아니라 종 전반에 걸쳐 광범위하게 적용할 수 있으며, 이광자 현미경에 비해 상대적으로 저렴한 설정을 제공합니다. 그러나 개별 뉴런의 식별과 뉴런 집단의 종단 추적은 달성하기 어렵습니다. 이는 특히 사극과 같은 와이어 전극 및 급성 전극 삽입에 적용됩니다. 기록세션 전반에 걸쳐 뉴런을 추적하는 능력이 부족할 뿐만 아니라9, 반복적인 급성 삽입은 면역 반응11을 일으키는 국소 외상(local trauma)10을 유발하여 감염 및 신경교증(gliosis)의 가능성을 증가시킨다. 이는 궁극적으로 기록된 신경 활동의 안정성과 실험 동물의 기대 수명을 감소시키고, 급성 전기생리학적 기록을 특징으로 하는 종단 연구의 범위를 단 몇 일로 제한한다12.
만성 고밀도 실리콘 프로브 기록은 급성 전기생리학과 이광자 이미징의 가장 우수한 특성 중 일부를 결합하는 것을 목표로 합니다. 그들은 세션 전반에 걸쳐 신경 집단 역학을 추적할 수 있으며, 이광자 이미징에 비해 개별 뉴런을 식별하는 능력은 다소 낮습니다13. 이러한 기록은 기록된 신호의 공간적 배치와 정밀한 시간적 해상도에 높은 유연성을 제공할 뿐만 아니라, 급성 기록에 비해 실험 동물의 수명과 복지를 향상시킨다14. 더욱이, 급성 기록과 대조적으로, 만성 전기생리학은 단 한 번의 주입 이벤트만 필요하므로 감염 및 조직 손상의 위험을 효과적으로 줄이고 동물에 대한 스트레스를 최소화합니다15. 이러한 장점들을 종합해 볼 때, 만성 전기생리학은 신경계의 조직과 기능을 조사하기 위한 강력한 도구가 됩니다.
그러나 마우스에 일반적으로 사용되는 만성 이식 기술은 연구자들이 행동 기록과의 호환성, 임플란트 무게, 임플란트의 복제 가능성, 재정적 비용 및 전반적인 사용 편의성 사이에서 상당한 절충안을 만들도록 제약합니다. 많은 임플란트 프로토콜은 프로브(16)의 재사용을 용이하게 하도록 설계되지 않아, 개별 실험의 유효 비용을 급격히 증가시키고, 따라서 일부 실험실에서 만성 전기생리학을 사용하는 것을 재정적으로 어렵게 만든다. 또한 광범위한 사내 프로토타이핑 및 설계 작업이 필요한 경우가 많으며, 이에 대한 전문 지식과 리소스가 없을 수 있습니다.
반면에, 통합 임플란트 시스템(17 )은 설치류의 만성 전기생리학을 위한 보다 광범위하게 접근 가능한 솔루션을 제공한다. 이 시스템은 프로브를 고정하는 마이크로드라이브를 임플란트의 나머지 부분과 통합하여 임플란트 취급 및 수술 절차를 단순화하도록 설계되었습니다. 그러나 일단 이식되면 이러한 시스템은 상단이 무거워질 수 있으며 실험자가 다른 목표 좌표에 맞게 실험을 유연하게 조정할 수 있는 능력을 제한할 수 있습니다. 종종, 그들의 무게는 더 작은 동물에 임플란트를 할 수 없게 하고, 잠재적으로 동물의 움직임을 손상시키며, 스트레스를 유발한다18. 이는 청소년 및 여성 코호트에 대한 연구에 불균형적으로 영향을 미칠 수 있으며, 체중 제한이 이러한 그룹에 더 영향을 미칠 가능성이 높기 때문입니다.
또한 모든 통합 시스템이 이식 후 전극 위치를 조정할 수 있는 것은 아닙니다. 이는 프로브 삽입(19)으로 인한 신경교증 또는 흉터, 특히 이식(20) 후 초기 48시간 동안에 기록된 뉴런 활성의 품질을 감소시킬 수 있기 때문에 관련이 있다. 프로브 삽입 깊이를 미세하게 조정하면 신호 무결성에 대한 이러한 부정적인 영향을 제한할 수 있습니다. 따라서 일반적으로 마이크로드라이브라고 하는 미세포지셔닝 메커니즘은 길이에 걸쳐 많은 수의 전극이 분포된 프로브에서도 유용할 수 있습니다.
이러한 트레이드오프를 극복하기 위해 당사는 가볍고 비용 효율적인 모듈식 솔루션을 제공하여 이전 설계의 한계를 해결하는 새로운 마우스용 만성 전기생리학 임플란트 시스템을 도입합니다. DREAM 임플란트 시스템은 무게가 쥐의 일반적인 체중의 10%(~2.1g) 미만으로 설계되어 동물 복지를 보장하고 행동에 미치는 영향을 최소화합니다. DREAM 임플란트 설계의 검증은 두개골에 하중이 가해질 때 설치류에서 상당한 영향을 받을 수 있는 운동과 같은 행동 주요 지표에 미치는 영향을 최소화하는 것으로 나타났습니다. 이는 동물의 복지를 증진하고 보다 윤리학적으로 건전한 실험을 허용함으로써 자유롭게 움직이는 동물과 머리가 고정된 동물을 활용하는 실험 패러다임에 도움이 될 수 있습니다.
이 시스템에는 최대 7mm의 기록 깊이를 유연하게 조정할 수 있는 마이크로드라이브가 포함되어 있으며 다양한 유형의 프로브 및 기록 장치에 적용할 수 있어 연구원에게 다양한 실험 응용 분야를 위한 비용 효율적이고 다재다능한 도구를 제공합니다. 이 시스템은 다른 시스템에 비해 일관된 프로브 회수율을 제공하고(예상 평균 회수율: 프로브당 약 3회의 신뢰할 수 있는 재사용) 개별 실험 비용을 크게 절감하는 금속 마이크로드라이브21과 일상적으로 결합됩니다.
이 설계는 3D 프린팅된 보호 패러데이 케이지를 특징으로 하여 전기 생리학적 노이즈, 기계적 충격 및 감염성 물질로부터 저렴하면서도 강력한 보호를 가능하게 하여 최소한의 감염률로 어려움을 겪으면서 안정적이고 노이즈 없는 녹음을 가능하게 합니다. 이 이식형 케이지는 충격 보호를 위해 설계되고 패러데이 케이지의 전도성 금속 메쉬 코팅을 위한 구조를 제공하도록 설계된 소위 '크라운'과 이식형 증폭기 및/또는 프로브 커넥터의 마운트 역할을 하는 크라운 링으로 구성됩니다( 그림 1 참조).
마지막으로, 모듈식 임플란트 시스템에 포함된 헤드플레이트는 임플란트에 추가적인 부피를 추가하지 않고도 새롭고 효율적인 헤드 고정 시스템과 호환되도록 설계되었습니다. 기존의 다른 시스템과 달리 임플란트 가까이에 작은 나사를 조일 필요가 없어 실험 설정에서 마우스의 고정 속도를 높이고 실험자-동물 관계 및 행동 순응도를 개선합니다. 동시에 헤드플레이트는 DREAM 만성 전기생리학 시스템의 다른 모듈을 구축하기 위한 베이스로 사용됩니다.
DREAM 임플란트의 디자인 파일은 https://github.com/zero-noise-lab/dream-implant/ 에서 오픈 소스 하드웨어로 게시됩니다. 다음 섹션에서는 DREAM 임플란트 시스템의 설계 및 제작에 대해 설명하고, 마우스 모델에서의 성공적인 구현을 시연하며, 기존 시스템과 비교하여 잠재적인 응용 분야와 이점에 대해 논의합니다.
프로토콜
모든 실험 절차는 막스 플랑크 협회의 기관 지침에 따라 수행되었으며 지방 정부 윤리 위원회(Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, 프로젝트 승인 코드: F149-2000)의 승인을 받았습니다.
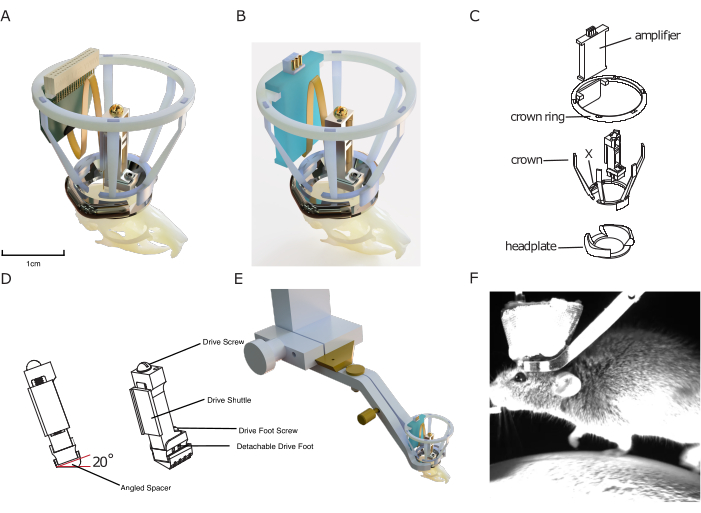
그림 1: 임플란트 디자인. (A) 프로브 커넥터에 연결된 실리콘 프로브를 사용하여 쥐의 두개골에 겹쳐진 임플란트의 3D 렌더링. 헤드플레이트의 중앙 조리개는 스케일의 경우 약 10mm입니다. 드라이브의 높이는 약 17mm입니다. 패러데이 크라운의 외부를 형성하는 구리 메쉬와 접지/참조 와이어는 표시되지 않습니다. (B) 프로브 커넥터 대신 증폭기 보드에 연결하는 (A)와 동일합니다. (C) 임플란트의 구성 요소를 보여주는 폭발한 기술 도면. (D) 마이크로드라이브 아래에 이식할 수 있는 각진 스페이서의 렌더링으로, 미리 정의된 각도(여기: 20°)로 마이크로드라이브를 일관되게 삽입할 수 있습니다. (E) 통합 머리 고정 메커니즘의 렌더링, 패러데이 크라운이 있는 이식된 헤드플레이트와 주변 머리 고정 클램프 및 설정에 대한 도브 테일 연결을 보여줍니다. (F) 임플란트의 통합 머리 고정 메커니즘을 사용하여 트레드밀에 고정된 쥐의 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: 섹션 1과 2에서는 수술 전 준비에 대해 설명합니다.
1. 실리콘 프로브의 준비
- 프로브를 재사용하는 경우 프로브 공급업체의 권장 사항에 따라 실리콘 프로브를 청소하십시오. 프로브를 효소 세척제( 재료 표 참조)에 5-10분 동안 담근 다음 탈염수로 헹굽니다. 이식 후 가능한 한 빨리 이 작업을 수행하십시오. (재)이식 하루 전에 소독을 위해 프로브를 70% 에탄올에 최소 30분 동안 담그십시오.
- 채널 임피던스를 측정하여 기록된 신호의 사양 내에 있는지 확인합니다. Neuropixels 사용자 매뉴얼22의 노이즈 레벨 테스트 프로토콜을 따르고, 원하는 레코딩 소프트웨어(예: https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing)를 통해 임피던스를 측정하고, 실리콘 프로브 제조업체 또는 데이터시트의 목표 채널 임피던스를 따릅니다. 임피던스가 너무 높으면 전극 부위23을 다시 코팅하는 것이 좋습니다.
- 0.05" 솔더 테일 소켓( 재료 표 참조)을 프로브의 접지(GND) 와이어에 납땜합니다. 수술 중 소켓을 GND 핀에 연결합니다(다음 단계).
알림: 이 프로토콜에서는 GND 및 REF가 헤드s에서 단락되므로 별도의 참조(REF) 핀이 사용되지 않습니다.tage, 사용된 . 따라서 프로토콜의 나머지 부분에서는 GND 핀만 언급됩니다. 별도의 REF를 사용하는 경우 REF 핀에 대해 다음 단계를 반복합니다. - GND 핀을 준비하려면 삽입이 거의 불가능할 때까지 0.05" 솔더 테일 소켓( 재료 표 참조)의 핀 쪽을 GND 0.05" 솔더 테일 소켓에 반복적으로 삽입합니다. 금도금 핀을 사용하면 이 스무딩 단계의 필요성을 줄일 수 있습니다. 이렇게 하면 수술 중에 과도한 압력을 가할 필요 없이 GND 핀과 소켓을 쉽게 연결할 수 있어 동물의 부상 및 프로브 손상 위험을 줄일 수 있습니다.
- 실리콘 프로브용 이식 가능한 전치 증폭기를 사용하는 경우 공급업체의 절차에 따라 만성 주입을 준비합니다. 그런 다음 부착 amp실리콘 석고를 사용하여 증폭기를 고정하도록 설계된 패러데이 링 영역에 붙입니다. 증폭기/커넥터를 패러데이 케이지의 링에 붙입니다( 그림 1 참조).
알림: 공급업체의 절차에 따라 만성 이식을 위한 실리콘 프로브용 이식 가능한 프리앰프를 준비하는 것에는 습기로 인한 전자 장치 손상을 방지하기 위해 실리콘 또는 에폭시로 코팅하는 것과 반복적으로 결합하는 것이 포함될 수 있습니다. 또한 반복적으로 결합하는 것 ampliifier 커넥터를 연결할 때 결합력을 줄이기 위해 amp녹음 중 ampliifier를 녹음 시스템에 연결합니다. 이는 Omnetics 사용자에게 특히 유용합니다.
2. 마이크로 드라이브 및 헤드 기어 준비
- 마이크로드라이브 본체의 나사를 돌려 마이크로드라이브 셔틀이 거의 완전히 위쪽으로 들어가도록 합니다.
- 선택적으로, 시아노아크릴레이트 접착제 또는 치과용 시멘트를 사용하여 마이크로드라이브 바닥에 각진 스페이서( 그림 1D 참조)를 부착하고, 예를 들어 중앙 고랑 내 영역의 피질층을 통해 기록하거나 비수직 접근이 필요할 수 있는 깊은 구조 내에서 특정 정도의 기울기를 허용하는 데 사용할 수 있습니다(각진 스페이서의 경우, 재료 표 참조).
- 마이크로드라이브를 마이크로드라이브 홀더에 수평으로 놓습니다(보충 그림 1).
- 작은 접착 퍼티 조각( 재료 표 참조)을 마이크로드라이브 홀더에 헤드-스테이지 커넥터가 배치될 마이크로드라이브 위의 거리에 놓습니다. 이 거리는 실리콘 프로브를 헤드스테이지 커넥터에 연결하는 플렉스 케이블의 길이에 따라 다릅니다.
- 실리콘 석고의 작은 방울 ( 재료 표 참조)을 셔틀에 놓습니다.
- 끝이 뭉툭하고 부드러운 집게를 사용하여 실리콘 프로브를 포장에서 꺼냅니다. 표준 바늘 코 집게에 3mm 직경의 열수축 튜브를 코팅하여 만듭니다( 재료 표 참조). 플렉스 케이블이 있는 프로브를 먼저 마이크로드라이브 셔틀에 놓아 플렉스 케이블의 하단 가장자리가 마이크로드라이브 셔틀의 하단 가장자리보다 약간 위에 매달리도록 합니다.
- 플렉스 케이블의 하단 가장자리가 마이크로드라이브 셔틀의 하단 가장자리와 만날 때까지 플렉스 케이블을 마이크로드라이브 위쪽으로 부드럽게 당깁니다. 이 단계에서 플렉스 케이블을 마이크로드라이브 셔틀의 왼쪽 가장자리에 대고 밀어 끝에 있는 마이크로드라이브에 정확히 수직으로 놓도록 하십시오. 이 시점에서 실리콘 프로브의 섕크가 마이크로드라이브의 아래쪽 가장자리를 지나 돌출되지 않도록(또는 최소한으로만) 확인하십시오(프로브 섕크의 정확한 길이와 대상 뇌 영역의 깊이에 따라 다름).
- 헤드 위치에 놓습니다.tage 프로브의 커넥터를 홀더 상단의 접착 퍼티에 놓아 프로브가 떨어지지 않도록 보호합니다.
- 27G 주사기 바늘을 사용하여 플렉스 케이블과 셔틀 사이에 시아노아크릴레이트 접착제( 재료 표 참조)를 소량 떨어뜨려 프로브를 제자리에 고정합니다. 접착제가 마이크로 드라이브나 셔틀 너머의 플렉스 케이블을 따라 흐르지 않도록 하십시오(이것은 매우 중요합니다).
- 플렉스 케이블이 제자리에 붙으면 amp실리콘 석고를 사용하여 liifier를 크라운 링( 재료 표 참조)에 연결합니다. 그런 다음 플렉스 케이블을 증폭기에 연결하고 연결부와 케이블을 실리콘 석고의 얇은 층으로 덮습니다.
- 5분 후 석고가 굳으면 나중에 사용할 때까지 마이크로드라이브와 프로브를 안전하게 보관하십시오.
- 구리 메쉬 조각( 재료 표 참조)을 열린 도넛 모양( 보충 그림 2의 절단 패턴 참조)으로 절단하여 패러데이 케이지를 덮습니다.
- 구리 메쉬 컷아웃을 작은 에폭시 수지 방울로 패러데이 케이지에 고정합니다( 재료 표 참조). 이 단계를 위해 에폭시를 치과용 시멘트로 대체할 수도 있습니다.
알림: 패러데이 케이지에는 프로브 커넥터 또는 증폭기를 수용할 수 있는 공간이 있습니다. 이 공간은 설계 파일에서 X로 표시되며, 증폭기/커넥터를 위한 지지 베이스와 케이지의 인접한 두 스포크 사이의 더 큰 거리를 포함합니다. 주변에 충분한 공간을 만들려면 ampliifier/connector, 인접한 두 스포크 사이에 소량의 추가 메쉬를 고정하여 돌출부를 만듭니다. 이렇게 하면 증폭기/커넥터는 나중에 패러데이 케이지를 건드리지 않고 이 '포켓'에 배치할 수 있습니다. 뒤틀림을 최소화하면서 안정적인 접착력을 보장하려면 크라운에 직접 배치된 크라운 링을 사용하여 모양을 유지하고 크라운의 얇은 스포크를 지지하십시오. 또한 건조하는 동안 납땜 도움의 손을 사용하여 크라운과 메쉬를 고정하십시오. 시술을 받을 때 크라운의 모양을 유지하는 데 어려움을 겪는 경우 뒤틀림을 방지하기 위해 한 번에 두 개의 크라운 암만 에폭시를 시도하십시오. - 패러데이 케이지의 별도 접지가 필요한 경우 작은 헤더 핀을 30mm 접지선에 납땜한 다음( 재료 표 참조) 전도성 에폭시를 사용하여 와이어를 구리 메쉬 컷아웃에 부착합니다.
참고: 이 단계는 실습에서 준수되지 않습니다. - 이때 준비한 부품을 안전하게 보관하고 나중에 수술을 진행하십시오.
참고: 섹션 3-6에서는 마이크로드라이브와 헤드기어의 이식에 대해 설명합니다.
3. 수술 : 프로브 및 작업 공간 준비
- 승인된 절차에 따라 수술 작업 공간에 수술 기구를 소독하고 배치합니다.
참고: 여기에는 승인된 실험 프로토콜에 따라 비드 멸균기, 고압멸균 기기 사용 또는 30% 과산화물 또는 90% 에탄올로 헹굼이 포함될 수 있습니다. - 치과용 시멘트를 준비하는 데 사용되는 세라믹 접시를 치과용 시멘트 키트의 지침에 따라 아이스 박스, 냉장고 또는 냉동고에 넣습니다( 재료 표 참조). 시멘트가 가단성이 있는 시간을 늘리기 위해 시멘트 혼합 중에 냉각된 세라믹 접시를 사용하십시오. 더 긴 접합 단계가 필요할 때마다 냉각된 접시를 사용하십시오.
- 실험이 끝날 때 프로브 배치에 대한 조직학적 검증이 필요한 경우 수술 직전에 마이크로드라이브의 나사를 시계 반대 방향으로 돌려 실리콘 프로브를 확장하고 친유성 염료( 재료 표 참조)를 염료의 작은 방울에 담가 프로브에 적용합니다. 상업적으로 구입한 디메틸 설폭사이드(DMSO) 또는 에탄올(EtOH) 희석 원액( 재료 표 참조)에서 친유성 염료를 PBS와 같은 적절한 완충액에 1-5μM 농도로 희석하여 준비합니다.
4. 수술 : 동물의 준비
- 무균 상태에서 2-4시간 설치류 수술을 위해 승인된 마취 프로토콜을 따르십시오. 여기에는 전신 및 국소 마취, 진통, 눈 연고 도포 및 식염수 주사가 포함될 수 있습니다. 여기에서 주사용 마취제(케타민 100[mg/kg]/메데토미딘 0.5[mg/kg])와 국소 진통 크림 및 안연고( 자료표 참조)를 함께 사용하고 동물을 가열 패드에 올려 체온을 조절합니다.
- 동물이 완전히 마취되면 별도의 비멸균 면도 구역으로 옮깁니다.
- 동물이 충분히 따뜻해졌는지 확인하십시오. 예를 들어, 가열 패드에 놓습니다. 두개골 위쪽의 털을 제거합니다. 전기 면도기나 제모 크림( 재료 표 참조)을 사용하거나 70% 에탄올로 덮인 메스로 정수리를 반복적으로 면도하십시오.
- 나중에 노출된 조직에 닿지 않도록 느슨한 머리카락을 조심스럽게 제거합니다. 털을 제거하려면 예를 들어 70% 에탄올로 적신 조직 및/또는 스퀴즈 볼 펌프를 사용하십시오. 제모 크림을 사용하는 경우 면봉과 식염수를 사용하여 철저히 제거해야 합니다.
- 면봉을 사용하여 요오드 계 소독제 ( 재료 표 참조)와 알코올로 면도 부위를 여러 번 소독하고 머리 중앙에서 옆으로 이동하여 절개 부위에 남아있는 느슨한 머리카락을 털어냅니다.
- 베타딘을 사용하여 머리 위와 머리 주변의 털을 소독합니다. 이를 통해 멸균 작업 공간을 보장하고 수술 기구와 재료가 멸균되지 않은 털과 접촉하는 것을 방지할 수 있습니다.
- 귀 막대와 코 홀더를 사용하여 동물을 정위 프레임에 놓습니다( 재료 표 참조).
- 작은 수술용 가위( 재료 표 참조)를 사용하여 두개골 상단의 피부에 아몬드 모양의 구멍을 잘라 람다 봉합사의 뒤쪽에서 눈 사이까지 도달합니다.
- 아직 젖은 상태에서 잘라내어 피하막과 골막을 제거한 다음 메스 칼날로 두개골을 긁어 치과용 시멘트의 접착을 방해할 수 있는 두개골 표면의 부드러운 막 조직을 제거합니다.
- 선택 사항: 두개골에서 막 조직이 제거되면 0.5% 과산화수소의 얇은 층을 잠시 바르고 수성 요오드 소독제(예: 베타딘)로 씻어낸 후 두개골 표면을 거칠게 하여 뇌관과 두개골의 접착력을 향상시킵니다.
- 메스 끝을 거꾸로 뒤집어 십자형 패턴을 긁어 두개골 표면을 조심스럽게 거칠게 만듭니다. 이것은 치과 시멘트가 나중에 두개골에 부착되는 데 도움이 됩니다.
알림: 봉합사 위를 너무 세게 긁으면 봉합사가 파열되어 두개내액이 누출되어 치과용 시멘트의 접착력을 손상시킬 수 있으므로 긁지 마십시오. - 메스 칼날과 멸균 면봉을 번갈아 가며 근육이 소뇌 상단의 두개골 '가장자리'로 밀려날 때까지 람다 봉합사의 측면에 부착된 목 근육을 부드럽게 긁거나 밀어냅니다. 이는 신경 세포 기록에서 근육 소음을 최소화하는 데 도움이 됩니다.
- 1mL 주사기에 27G 바늘( 재료 표 참조)에 소량의 수술용 시아노아크릴레이트 접착제( 재료 표 참조)를 채웁니다. 그런 다음 주사기를 사용하여 피부를 두개골 가장자리에 붙여서 그 위에 작은 초강력 접착제 방울을 바릅니다. 임플란트를 위한 공간을 확보하기 위해 조직을 두개골에 가능한 한 평평하게 붙입니다. 이 절차는 피부와 근육이 임플란트의 일부와 직접 접촉하지 않도록 하여 녹음에서 근육 소음을 방지하고 치과용 시멘트의 접착력을 향상시킵니다.
- 추가 접착을 위해 두개골 전체에 치과용 시멘트 프라이머를 바르고 UV 광선으로 경화시킵니다( 재료 표 참조). 이것은 치과 시멘트 접착력을 향상시키고 두개골 봉합사가 누출되어 시간이 지남에 따라 두개골-시멘트 결합이 약화되는 것을 방지합니다.
- 브레그마 또는 람다를 기준으로 프로브 이식의 대상 위치를 찾고 수술 마커로 주변의 개두술을 윤곽을 그립니다. 개두술이 그 안에 놓이도록 헤드플레이트를 두개골에 놓고 개두술의 한쪽에 마이크로드라이브를 위한 공간과 1-2개의 접지 핀을 위한 공간이 있습니다.
- 치과용 시멘트를 사용하여 헤드플레이트를 이식합니다. 지정된 냉각된 세라믹 접시에 치과용 시멘트를 혼합합니다(3.2단계 참조). 헤드플레이트가 모든 면에서 두개골에 부착되어 방수 '우물'을 형성하는지 확인합니다.
- 치과 드릴(US 1/2 HP 크기)을 사용하여 GND/REF로 사용할 뇌 영역 위에 1.4단계에서 준비한 헤더 핀 너비의 작은 버 구멍을 뚫습니다. 패러데이 케이지를 접지하려면 패러데이-GND 헤더 핀을 위해 패러데이 케이지 가장자리 가까이에 다른 작은 버 구멍을 뚫습니다.
알림: GND/REF 헤더 핀의 경우 헤더 핀 자체가 나중에 패러데이 케이지를 건드리지 않고 그 안에 배치될 수 있도록 케이지 가장자리에서 충분한 거리에 개두술을 놓습니다. - 주사기로 멸균 식염수를 부드럽게 떨어뜨리고 흘리지 않는 물티슈로 제거하여 개두술을 청소합니다( 재료 표 참조). 모든 혈액과 느슨한 조직이 제거될 때까지 반복합니다.
- 식염수에 0.7% 한천( 재료 표 참조) 용액을 준비하고 약간 식힌 다음 1mL 주사기에 27G 바늘을 사용하여 개두술에 도입합니다.
- 이전 단계에서 뚫은 각 개두술에 GND 핀(1.3단계 참조)을 부드럽게 삽입합니다. 핀은 모든면이 한천으로 둘러싸여 있습니다 (4.17 단계 참조). 헤더 핀 주위에 시멘트를 도포하여 고정하고 전기 절연을 제공합니다.
- 세라믹 접시를 청소하고 냉장고/냉동고에 다시 넣으십시오.
- 치과 드릴을 사용하여 가장자리를 일정한 움직임으로 움직여 더 큰 개두술(원형 또는 사각형)의 윤곽을 뚫습니다. 개두술이 1mm x 1mm에서 2mm x 2mm인지 확인하여 피질을 너무 많이 노출시키지 않고 혈관을 피하기 위해 프로브 위치를 약간 조정할 수 있습니다. 가능하면 봉합사 위에 개두술을 놓지 마십시오. 20-30초 단위로 드릴링하고 드릴링 라운드 사이에 식염수로 두개골을 식힙니다.
주: 드릴링을 시작할 때 마이크로드라이브의 앞 가장자리를 마커로 표시하여 드릴링 할 때 직선 가장자리가 마이크로드라이브 앞 가장자리와 평행하게 형성될 수 있도록 하는 것이 유용합니다. 이렇게 하면 마이크로드라이브를 제자리에 고정할 때 개두술에서 시멘트가 생기는 것을 방지할 수 있을 뿐만 아니라 접착력이 향상되고, 마이크로드라이브가 개두술 위로 돌출되는 것을 방지하고, 최종 레코딩 사이트 위치와 관련하여 마이크로드라이브를 배치할 때 측면 기동성을 높일 수 있습니다. - 처음 몇 차례의 드릴링 후 미세한 집게(크기 5 이상, 재료 표 참조)로 부드럽게 밀어 뼈의 뚫린 부분의 저항을 테스트합니다.
- 밀었을 때 뼈가 겸자 아래에서 '튀어오르기' 시작할 때까지 드릴링 라운드 사이에 테스트를 계속하십시오. 이 경우 개두술 위에 식염수 한 방울을 추가하여 뼈를 부드럽게 한 다음 집게를 사용하여 뚫린 뼈 조각을 부드럽게 제거합니다.
- 뼈를 부드럽게 제거할 수 없는 경우 뼈가 여전히 더 강하게 붙어 있는 지점에 중점을 두고 다시 한 번 드릴링을 합니다. 일반적으로 조직 손상을 최소화하기 때문에 완전히 뚫리기 전에 집게에서 부드러운 압력으로 두개골을 제거하는 것을 목표로 합니다.
알림: 온도를 낮추기 위해 드릴링하는 동안과 뼈 피판을 제거한 후 경막의 표면이 정기적으로 적셔지도록 하십시오. 이렇게 하면 경막이 건조되어 침투하기가 더 어려워지는 것을 방지하여 프로브를 쉽게 삽입할 수 있는 가능성이 높아집니다. 경막이 너무 단단하여 침투할 수 없거나 뭉툭하거나 다중 생크 프로브를 사용하는 경우, 27G 바늘로 경막을 들어 올리고 식염수를 담근 상태에서 작은 절개를 수행하여 경막이 뇌 표면에 달라붙는 것을 방지합니다.
- 경막과 뇌를 보호하기 위해 시원하고 멸균된 식염수에 적신 지혈 스폰지( 재료 표 참조)로 개두술을 덮습니다.
5. 수술 : 프로브 이식
- 사용자 정의 마이크로드라이브 홀더( 재료 표 참조)를 정위 장치의 암에 부착하십시오. 프로브 준비 후 마이크로드라이브를 마이크로드라이브 홀더에서 분리한 경우, 실리콘 프로브가 부착된 마이크로드라이브를 마이크로드라이브 홀더에 끼웁니다. 원하는 목표 뇌 영역에 도달하기 위해 필요에 따라 스테레오택스 암의 각도를 조정합니다. 부착된 크라운 링을 놓습니다 ampliifier를 마이크로드라이브 홀더 후면에 있는 3개의 수직 핀에 놓습니다( 추가 그림 1 참조).
- 마이크로드라이브를 개두술에서 ~0.5mm 이내로 내린 다음 겸자를 사용하여 프로브에 부착된 GND/REF 헤더 핀을 두개골에 이식된 해당 GND/REF 핀에 연결합니다(4.14-4.15단계 참조). 추가 그림 3 및 추가 그림 4 를 참조하십시오.amp드라이브, 개두술 및 GND/REF 핀 배치의 예.
- 제자리에 놓이면 보다 견고한 연결을 위해 전도성은 에폭시 한 방울( 재료 표 참조)로 핀을 선택적으로 고정합니다. 은 에폭시가 경화되면 연결된 핀을 소량의 치과용 시멘트( 재료 표 참조)로 덮어 연결이 장기간 안정적으로 유지되고 주변 조직 및/또는 임플란트 요소와 전기적 연결이 없는지 확인합니다.
- 개두술에서 지혈 스폰지를 제거합니다(4.22단계 참조).
- 마이크로드라이브가 있는 정위 팔을 개두술 위에 놓습니다.
알림: 프로브가 접혀 있는 경우 프로브가 큰 혈관이 없는 개두술의 일부에 닿을 수 있는 위치에 마이크로드라이브를 배치해야 합니다. - 필요한 경우 프로브 생크가 대상 영역의 경막 또는 뇌 표면(4.21단계 참조)에 닿을 때까지 위치와 각도를 조정하여 마이크로드라이브를 내립니다.
- 지정된 세라믹 접시에 치과용 시멘트를 혼합하고(3.2단계 참조) 전극을 향하지 않는 마이크로드라이브 베이스의 세 면에 중점을 두고 마이크로드라이브 베이스를 제자리에 시멘트합니다. 시멘트가 탈착식 '베이스' 위의 마이크로드라이브에 닿지 않도록 합니다( 그림 1D 참조).
- 기저부와 두개골 사이의 공간이 치과용 시멘트로 완전히 덮여 있는지 확인하십시오. 세라믹 접시를 청소하고 냉장고/냉동고에 다시 넣으십시오. 시멘트가 경화될 때까지 약 10-15분 동안 기다립니다.
알림: 마이크로드라이브 베이스와 두개골 사이에 작은 틈이 있으며 시멘트는 이를 채우기 위해 가장 유동적인 형태로 사용됩니다. 시멘트가 약간 두꺼워지면 마이크로드라이브 베이스의 벽과 두개골 사이의 시멘트가 쌓입니다. 물질의 흐름을 예측할 수 없고 더 많은 부피가 원치 않는 영역으로 흐를 수 있기 때문에 항상 매우 적은 양의 시멘트가 사용됩니다. 식염수에 담근 소량의 지혈 스폰지를 사용하여 개두술의 일부를 덮을 수 있습니다. 시멘트가 실수로 개두술에 흘러 들어간 경우 필름과 같은 농도가 되면 집게로 시멘트를 제거합니다.
- 기저부와 두개골 사이의 공간이 치과용 시멘트로 완전히 덮여 있는지 확인하십시오. 세라믹 접시를 청소하고 냉장고/냉동고에 다시 넣으십시오. 시멘트가 경화될 때까지 약 10-15분 동안 기다립니다.
- 실리콘 프로브를 뇌에 내리고 현미경을 통해 프로브 위치를 주의 깊게 모니터링합니다. 프로브 생크가 뇌에 닿으면 프로브를 ~250μm(나사의 한 바퀴는 282μm) 빠르게 낮추어 프로브가 경막/피질 표면의 저항을 뚫도록 합니다.
- 이를 시각적으로 확인합니다. 프로브가 피질에 침입하지 않은 경우 5분 동안 기다린 다음 듀라/피질이 프로브 팁에서 장력을 받는 동안 프로브를 수십 마이크로미터 정도 반복적으로 올리고 내려 섕크 팁으로 듀라를 통해 에칭을 시도합니다.
- 프로브가 피질 표면을 뚫고 나오면 목표 좌표에 도달하거나 프로브가 1000μm 이상 이동할 때까지 더 느린 속도(100-200μm/min)로 점차적으로 낮춥니다. 대상에서 프로브가 1000μm 이상 이동해야 하는 경우 대상 좌표에 도달할 때까지 다음 기록 세션에서 최대 1000μm/세션 단계로 프로브를 진행합니다.
참고: 실리콘 프로브를 내리는 동안 신경 신호를 모니터링하는 것이 선호되는 경우 이 단계를 건너뜁니다. 이를 위한 단계는 섹션 7에 설명되어 있습니다. - 지침에 따라 실리콘 엘라스토머를 준비하고 ( 재료 표 참조) 1mL 주사기를 사용하여 개두술에 작은 방울을 분배합니다 ( 재료 표 참조).
- 건조가 완료되면 실리콘 엘라스토머를 본왁스와 미네랄 오일의 50/50 혼합물로 덮습니다. 이 단계는 프로브를 더욱 보호하고 개두술 위에 파편과 건조 플라즈마가 축적되는 것을 방지하여 추출을 더 간단하고 안전하게 만듭니다. 프로브를 내린 상태에서 주변에서 작업하면 파손될 수 있으므로 주의하십시오.
6. 수술 : 패러데이 케이지 이식
- 치과용 시멘트가 완전히 응고되면 육각 렌치로 드라이브를 고정하는 측면 나사를 풀어 마이크로드라이브 홀더를 풉니다( 보충 그림 1 참조). 마이크로드라이브가 독립형이 되도록 홀더를 ~1cm 부드럽게 집어넣지만 프로브 증폭기/커넥터는 플렉스 케이블을 늘리지 않고 임플란트 홀더에 고정된 상태를 유지합니다.
- 개구부에서 케이지를 늘려 미리 만들어진 크라운과 패러데이 메쉬를 헤드플레이트 주위에 놓고 마이크로드라이브와 플렉스 케이블 위에 수평으로 끼운 다음 치과용 시멘트로 헤드플레이트에 고정합니다.
알림: 임플란트가 오염되지 않도록 보호하기 위해 패러데이 케이지와 두개골 사이의 모든 공간을 치과용 시멘트로 막아야 합니다. - 프로브 커넥터/헤드가 있는 패러데이 크라운 링( 재료 표 참조)을 놓습니다.tage 크라운 위에, 프로브용 통합 홀더 ampliifier/커넥터를 패러데이 크라운의 움푹 들어간 'X'로 표시된 영역에 맞춥니다(2.13단계 참조).
- 각 스포크 링 접합부에서 시아노아크릴레이트 접착제 또는 치과용 시멘트를 소량 떨어뜨리고 링을 패러데이 케이지에 고정합니다.
- 통합 프로브가 있는 패러데이 링이 있는 ampliifier/connector가 제자리에 고정되면 마이크로드라이브 홀더가 있는 정위 암을 완전히 집어넣습니다. 보충 그림 3 을 참조하여 이러한 구성 요소의 조립에 대한 단계별 가이드를 확인하십시오.
7. 수술 후 검사 기록
- 프로브 연결 ampliifier/connector를 녹음 하드웨어에 연결하고 녹음을 시작합니다.
- 초기 삽입 시 프로브가 아직 목표 위치에 도달하지 않은 경우(5.9단계 참조) 뉴런 신호를 모니터링하면서 마이크로드라이브 나사를 시계 반대 방향으로 천천히 돌려 프로브를 내립니다.
알림: 신호는 a) 전극이 개두술 위의 실리콘 엘라스토머 층에 닿을 때와 b) 전극이 뇌로 이동하기 시작할 때 변경되어야 합니다(7.2단계 참조). 고주파 신경 세포 활동은 뇌에 완전히 삽입된 전극에 의해 등록되는 반면, 뇌 표면의 CSF와 접촉하는 전극은 일반적으로 스파이크 활동 없이(EEG 추적과 유사) 저역 통과 필터링된 신경 세포 집단 신호를 보여주며, 공기 중의 기록 부위는 증가된 전기 노이즈를 등록합니다. 테스트 기록 후 개별 채널의 임피던스를 측정하여 프로브 삽입 깊이를 추가로 확인할 수 있습니다. 공기와 접촉하는 채널은 높은 임피던스(개방 회로를 나타냄)와 뇌척수액에 닿거나 이미 뇌에 있는 채널에 대해 수술 전에 측정된 것과 같은 임피던스를 보여야 합니다. 최대 속도는 약 75μm/min으로 세션당 최대 총 거리가 약 1000μm인 실리콘 프로브를 전진시킵니다(5.5단계 참조). - 프로브 전체에서 신경 국소자기장 전위가 보이거나 프로브가 최대 1000μm 전진하면 테스트 기록을 종료하고 헤드 스테이지 커넥터를 분리합니다.
8. 회복
- 패러데이 케이지를 자체 접착 수의학 랩으로 덮습니다( 재료 표 참조).
- 마취를 끝내고 승인된 실험 지침에 따라 동물이 몇 일 동안 회복하도록 합니다.
- 실리콘 프로브의 전극이 아직 원하는 대상 위치에 있지 않으면 세션당 최대 4번의 전체 회전(또는 ~1000μm)으로 마이크로 드라이브의 나사를 작은 단계로 돌립니다. 필요한 경우 목표에 도달할 때까지 며칠 동안 이 절차를 반복합니다. 프로브 이동을 동시 기록과 결합하여 통과 영역의 전기생리학적 활성을 평가하는 것이 권장됩니다.
9. 행동 실험 및 만성 기록
- 작업 수행 중 만성적인 머리 고정 녹음의 경우 패러데이 케이지 바닥에 있는 헤드플레이트를 헤드 고정 cl에 부착합니다.amp 수동으로 cl을 열고 clamp이식된 헤드플레이트( 그림 1C, E, F 참조).
알림: 머리 고정이 필요하지 않은 경우 이 임플란트 시스템을 사용하여 자유롭게 움직이는 녹음에도 사용할 수 있습니다. 녹음을 자유롭게 이동하려면 9.1 및 9.7 단계를 건너뜁니다. - 임플란트에서 자체 접착 수의학 랩을 제거합니다.
참고: 동물의 불편함을 최소화하기 위해, 실험자가 임플란트를 다루는 동안 주의를 산만하게 하기 위해 이 단계 전에 간단하고 보람 있는 행동 작업을 시작하는 것이 좋습니다. - 부착 amp녹음 장비에 liifier/커넥터.
- 동물이 작업을 수행하는 동안 신경 세포 기록을 수행합니다.
참고: 기록된 세포외 단위의 수를 최대화하는 것이 목표인 경우, 한 위치의 신경 수율이 감소할 때마다 셔틀을 수십 마이크로미터 이동시키십시오. 프로브를 이동한 후 신호가 안정화되는 데 몇 분에서 몇 시간이 걸릴 수 있습니다. 따라서 다음 세션이 시작될 때까지 신호가 복구될 수 있도록 세션이 끝날 때 프로브를 이동하는 것이 도움이 될 수 있습니다. - 기록 장비를 분리하고 행동 기록이 끝나면 새 수의학 랩으로 임플란트를 덮습니다.
- 머리 고정 cl을 엽니다.amp 머리 고정에서 동물을 분리합니다.
10. 프로브 복구
- 최종 기록이 끝나면 나사를 시계 방향으로 돌려 실리콘 프로브를 마이크로 드라이브에 최대한 집어넣습니다. 동물이 머리를 고정하고 행동하는 동안 또는 수술 환경에서 동물이 마취된 상태에서 이 작업을 수행합니다. 뉴런 신호를 동시에 모니터링하고 뇌에 잠겨 있거나 뇌 표면에 닿거나 공기와 접촉하는 전극의 서명을 확인하여 프로브가 뇌에서 빠져나가는 경로를 차트로 표시합니다(7.3단계 참조).
알림: 조직학 프로토콜 및 프로브에 따라 프로브에서 일부 전극의 정확한 위치를 결정하기 위해 프로브를 집어넣기 전에 전해 병변이 수행됩니다. 신경 세포 기록을 통해 프로브 출구를 모니터링할 필요가 없는 경우, 동물이 제거된 후 프로브를 후퇴시키는 것도 가능합니다. - 승인된 지침에 따라 동물을 처분합니다(후속 조직학을 위해 뇌를 고정할 계획인 경우 동물을 관류하는 것이 포함됨).
- 동물이 죽은 후 ~ 10 분 동안 기다리십시오. 그런 다음 동물의 머리를 스테레오택스에 고정하고 프로브 파손을 방지하기 위해 이식하는 동안 동물의 머리가 움직이지 않도록 합니다.
- 개두술 위에 식염수 한 방울을 떨어뜨리고 몇 분 동안 담가두어 프로브 섕크의 건조된 생물학적 조직을 부드럽게 하고 섕크 파손 가능성을 낮춥니다.
- 스테레오택틱 홀더를 마이크로드라이브에서 약 0.5cm 위에 놓습니다. 그런 다음 작은 수술용 가위로 패러데이 케이지의 스포크 상단을 잘라( 재료 표 참조) ampliifier/커넥터를 고정하는 패러데이 링을 확보하고 링을 정위 홀더 상단의 수직 핀으로 다시 옮깁니다(5.1단계 및 추가 그림 1 참조).
- 패러데이 크라운의 스포크 사이에 있는 U자형 메쉬 영역을 잘라내어 동일한 수술용 가위로 구리 메쉬를 조심스럽게 잘라냅니다. 그런 다음 바닥에서 크라운의 플라스틱 스포크를 잘라냅니다.
알림: 인쇄된 플라스틱 스포크를 절단할 때 부러져 플라스틱 파편이 프로브 쪽으로 날아갈 수 있으므로 구부리지 마십시오. - 홀더의 측면 나사를 사용하여 마이크로드라이브가 홀더에 고정될 수 있을 때까지 정위 홀더를 내리고 마이크로드라이브를 고정한 다음 마이크로드라이브 본체를 마이크로드라이브 베이스에 연결하는 T1 나사를 풉니다.
- 임플란트 홀더가 있는 정위 암을 천천히 집어넣어 마이크로드라이브를 베이스에서 들어 올립니다. 마이크로드라이브가 수직 각도(즉, 베이스에서 '수직')로 베이스에서 분리되는지 확인합니다.
주: 마이크로드라이브 본체와 베이스가 쉽게 분리되지 않는 경우, 정위 암의 움직임이 마이크로드라이브 방향에 비해 비스듬하지 않은지 확인하십시오. 필요한 경우 홀더와 마이크로 드라이브는 동물 머리의 고정을 약간 느슨하게 하고 그에 따라 재배치하여 서로 재정렬됩니다. 올바른 정렬은 마이크로 드라이브를 쉽게 복구하기 위한 중요한 측면 중 하나입니다. 또한 마이크로드라이브와 마이크로드라이브 베이스를 연결하는 치과용 시멘트가 남아 있는지 확인하십시오(5.5단계 참조). 그렇다면 사용된 시멘트의 양에 따라 메스 및/또는 치과 드릴로 시멘트를 조심스럽게 긁어냅니다. - 부착된 프로브로 정위 암을 들어 올려 그 아래에 충분한 공간을 만듭니다.
- 스테레오택스에서 동물을 제거하고, 원하는 경우 승인된 조직학 프로토콜에 따라 뇌를 준비한다. 이식된 마이크로드라이브 베이스를 복구하고 나중에 재사용할 수 있도록 몇 시간 동안 아세톤에 담가 청소합니다.
- 깨끗한 마이크로드라이브 베이스를 접착 퍼티에 놓고( 재료 표 참조) 마이크로드라이브를 베이스 위로 내리고 나사를 조입니다. 파손을 방지하려면 공정 전반에 걸쳐 현미경으로 프로브 위치를 모니터링하십시오. 먼저 이식된 마이크로드라이브 베이스를 청소하여 재사용해야 하는 경우 이 단계를 나중에 완료할 수 있습니다.
알림: 이 프로토콜은 접착 퍼티를 베이스의 플랫폼으로 사용해야 하며, 이는 베이스를 고정하는 동시에 어느 정도의 기브를 유지하여 베이스가 미끄러져 프로브와 충돌하지 않도록 하기 때문에 매우 중요합니다. 퍼티는 프로브가 내려갈 마이크로드라이브 베이스 측면에 수직의 '절벽면' 모양이어야 합니다. 이렇게 하면 프로브가 베이스를 지나 내려갈 때 아래에 있는 퍼티와 접촉하지 않습니다. 퍼티 '타워'는 또한 마이크로드라이브 베이스를 지나 내려갈 경우 프로브가 퍼티가 놓인 테이블 표면과 접촉하지 않을 만큼 충분히 높아야 합니다. 마지막으로 퍼티를 표면에 잘 고정하여 미끄러지거나 떨어지지 않도록 합니다. 마이크로드라이브를 퍼티가 잡고 있는 마이크로드라이브 베이스에 내려줄 때 측면 프로를 확인하십시오.file view 프로브가 내려갈 때 베이스나 퍼티와 충돌하지 않도록 현미경에서 진행 상황을 모니터링합니다. - 제조업체의 지침에 따라 프로브를 청소하고 멸균하십시오. 가장 일반적으로 사용 가능한 프로브의 경우 효소 세척제( 재료 표 참조)에 12시간 동안 담근 다음 탈염수로 헹구고 알코올로 소독합니다. 정위 암의 마이크로드라이브 홀더에 부착된 상태에서 효소 세척제가 들어 있는 큰 비커에 프로브를 내리면 됩니다.
알림: 원하는 경우 세척 후 프로브에서 전극의 임피던스를 측정하여 개별 전극의 잠재적인 성능 저하를 모니터링합니다. - 청소한 프로브가 있는 마이크로드라이브를 다음 실험까지 안전하게 보관하십시오.
결과
이 프로토콜은 연구자가 행동하는 마우스에서 가볍고 비용 효율적이며 안전한 만성 전기 생리학 기록을 구현할 수 있도록 하는 만성 이식 시스템을 제공합니다(그림 1). 이 접근법의 성공적인 적용을 결정하는 주요 요인에는 두개골의 완전한 시멘트 적용 범위, 최소 침습적이고 적절하게 보호되는 개두술, 두개골에 대한 마이크로드라이브 및 배선의 안전한 부착 및 보호용 패러데이 재료의 완전한 연속성이 포함됩니다. 이러한 점을 고려하면 일관되게 고품질 녹음에 도달할 수 있습니다. 다음은 수술 성공의 다음과 같은 주요 측면과 관련된 대표적인 결과를 보여줍니다.
1) 임플란트가 동물의 행동이나 복지를 방해합니까?
2) 신호 품질이 높으며 신호를 장기간 유지할 수 있습니까?
3) 녹음을 작업 수행과 쉽게 결합할 수 있습니까?
임플란트가 동물 행동에 미치는 영향을 평가하기 위해 임플란트를 이식한 5마리의 추적된 운동 패턴을 분석했습니다. 그림 2A 는 임플란트 전과 이식 후 1주일 동안 10분 동안 놀이 케이지 안에서 자유롭게 움직이는 동물의 예를 보여줍니다. 움직임 패턴이 변하지 않았음을 알 수 있습니다. 이 관찰은 동물 간의 이동 속도와 머리 방향의 분포를 보여주는 그림 2B, C 에 의해 확인됩니다. 달리기 속도와 머리 방향은 이식 전과 후 모두 큰 변화가 없었으며, 오히려 수술 후 달리기 속도가 약간 증가한 것 같았습니다. 보충 비디오 1 은 이식 수술 후 6일 후의 동물의 짧은 비디오 녹화를 보여줍니다. 가정 환경에서의 이동, 그루밍, 양육 및 먹이 찾기와 같은 일반적인 홈 케이지 행동은 모두 볼 수 있으며 수술 후 성공적인 회복과 전반적인 건강 상태를 나타냅니다. 임플란트의 행동에 미치는 영향이 낮은 것은 가벼운 무게와 관리 가능한 높이 때문일 가능성이 큽니다.
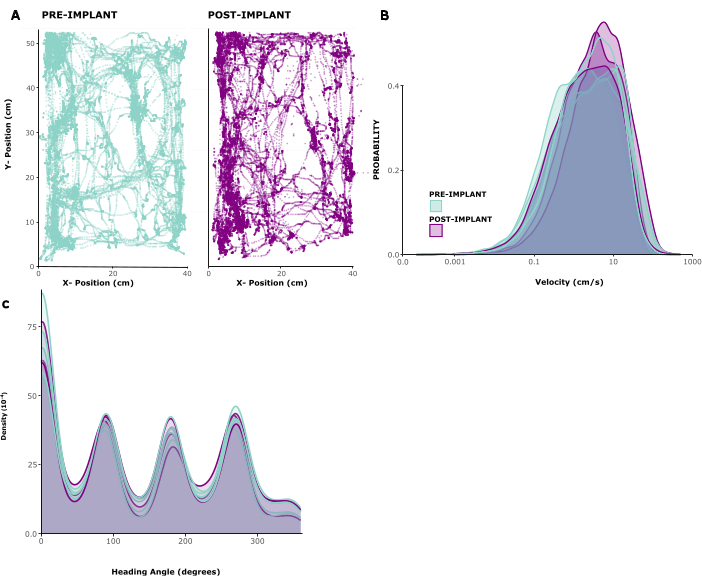
그림 2: 수술 전과 후의 운동. (A) 이식 전(왼쪽 패널)과 후(오른쪽 패널) 동물의 운동 예시. x/y 좌표는 센티미터 단위이며, 포인트는 10분 동안 각 시점에서 동물의 위치를 나타냅니다. (B) 5마리의 동물에 이식하기 전 5개 세션과 이식 후 3개 세션에 대한 이동 속도 분포(cm/s). (C) (B)에서 분석된 동일한 세션에 대해 다른 방향으로 이동할 확률에 대한 커널 밀도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음으로, LFP(Local Field Potential)의 신호 품질과 레코딩 사이트 전반의 스파이킹 활동을 평가합니다. 여기에서는 1차 시각 피질(V1)의 대뇌 피질 기록의 대표 데이터를 보여줍니다. 검증을 위해 Kilosort 3을 사용하여 깨어 있는 쥐의 V1에 기록된 광대역 신경 신호에서 추정 단일 단위 활동을 추출했습니다( 그림 3 참조). 그림 3A 는 프로브 섕크에서 추출된 단일 단위의 위치를 보여주고, 그림 3B 는 해당 스파이크 파형을 보여주며, 그림 3C 는 전류 소스 밀도(CSD) 프로토콜에 대한 동일한 뉴런의 스파이크 반응을 보여줍니다. 이 패러다임에서는 200번의 시도에 걸쳐 1Hz의 주파수(즉, 300ms 켜짐, 700ms 꺼짐)에서 광시야 플래시가 300ms의 지속 시간으로 제공되었습니다. 마지막으로, 그림 3D 는 회색 배경에 무작위로 선택된 흑백 사각형의 2000개 프레임으로 구성된 시각적 수용 필드 매핑 프로토콜에 대한 동일한 단위의 응답을 보여주며, 각 프레임은 16.6ms 동안 표시됩니다. 사각형은 각각 12도의 시각적 각도를 포함하며 15 x 5 가능한 위치의 필드에서 선택되어 매핑 패러다임이 총 -90도에서 +90도의 방위각과 -30도에서 +40도의 고도의 시각적 공간을 포함하도록 했습니다. 각 자극 프레임에 대한 발사 속도 응답은 16.6ms 창에서 최대 발사 속도를 분석하여 추출되었으며, 각 창의 최대 활동을 기반으로 채널당 최적으로 식별된 40-140ms 사이의 지연이 적용됩니다. 이러한 유형의 기록은 각 전극의 삽입 깊이를 조정하고 임플란트 수술 후 신호 품질을 평가하는 데 사용할 수 있습니다.
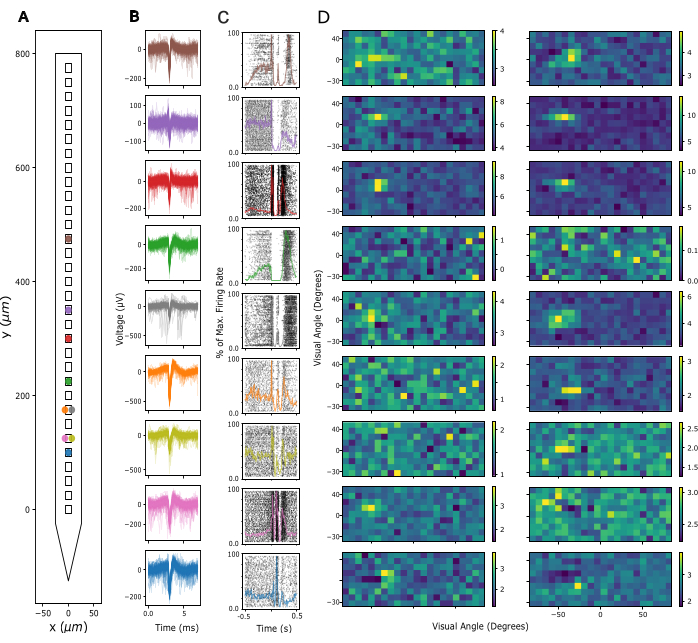
그림 3: 기록된 뉴런 신호. (A) 프로브의 전극 접점을 따라 Kilosort 3 스파이크 분류 패키지로 정렬된 단일 장치의 추론된 위치. (B) 5ms의 시간에 걸쳐 A에 표시된 동일한 단위에 대한 스파이크 파형. 가는 선: 개별 스파이크 파형. 굵은 선: 평균 스파이크 파형. (C) 300ms 광시야 플래시와 700ms 블랙 스크린을 나타내는 CSD(Current Source Density) 패러다임에 대한 응답으로 스파이크의 래스터 플롯. A와 B와 동일한 단위에 대한 응답이 표시됩니다. 겹쳐진 컬러 라인은 동일한 반응의 PSTH(Peri-Stimulus Time Histogram)를 나타냅니다. PSTH의 발사 속도는 10ms bins로 계산된 다음 전체 PSTH에서 최대 발사 속도로 정규화되었습니다. 시간 0은 광시야 플래시 자극을 중심으로 합니다. (D) A-C와 동일한 단위의 추정된 수용 필드로, Sparse Noise Receptive Field Mapping 패러다임으로 측정되었습니다. 각 플롯은 흰색 및 검은색 사각형 자극의 시작(왼쪽 패널) 또는 오프셋(오른쪽 패널)에 대한 응답으로 16.6ms 분석 창 동안의 평균 발사 속도 활동을 보여줍니다. 자극은 16.6ms 동안 가로로 180도의 시야각, 세로로 70도의 시야각에 걸쳐 5 x 15 정사각형 그리드에 무작위로 배치되어 제시되었습니다. 발사 속도 활동은 전체 수용 필드 그리드에서 z-점수가 매겨졌습니다(색상 막대 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
녹음 품질은 몇 주에서 몇 달 동안 반복된 녹음에서도 높게 유지되었습니다. 그림 4A는 15주 동안 한 동물의 종단적 LFP 기록을 보여줍니다. LFP는 위에서 설명한 CSD 패러다임에 대한 응답으로 기록되었습니다(그림 3A-C 참조). 그림 4A는 플래시 시작 후 500ms 후의 평균 LFP 응답을 보여줍니다. 이 예에서는 전극 간 거리가 25μm인 32개의 채널이 있는 선형 프로브를 사용했습니다. 18일째에는 프로브 깊이를 조정하여 프로브를 600μm 아래쪽으로 이동했습니다. 이 조정 전후에 LFP 신호는 녹화일 내내 안정적으로 유지되었습니다.
이와 일치하게, 추정되는 단일 단위의 스파이크 파형은 많은 녹음에서 식별할 수 있었습니다. 그림 4B 는 한 달간의 녹음에 걸쳐 3개의 녹음 세션에서 얻은 대표적인 스파이크 파형을 보여주며, 시간이 지남에 따라 단일 장치 활동을 성공적으로 식별할 수 있음을 보여줍니다. 그림 4C 는 최대 100일에 걸쳐 6마리의 동물에서 만성 기록에서 추출한 추정 단일 단위의 전체 수를 보여줍니다. 단일 단위는 kilosort 3.0의 기본 기준에 따라 정의되었습니다( 보충 표 1 참조). 보시다시피, 명확하게 정의 된 단일 단위의 수는 일반적으로 이식 후 첫 주에 ~ 40에 달했으며 점차적으로 감소하여 ~ 20 단위의 명백하게 안정적인 점근선으로 이동했습니다. 이러한 기록이 선형 32채널 프로브를 사용하여 수행되었다는 점을 감안할 때, 이는 이식 직후 전극당 약 1.25개의 단일 단위의 예상 수율과 동일하며, 장기 기록에서는 전극당 약 0.65개의 단일 장치로 감소합니다. 세션에 걸쳐 임플란트의 증폭기/커넥터에 반복적으로 연결하는 것은 증폭기/커넥터를 고정하는 패러데이 크라운이 표준 커넥터에 필요한 최대 결합력보다 큰 10뉴턴 이상의 반복적인 힘을 견딜 수 있기 때문에 녹음 품질이나 임플란트 안정성에 영향을 미치지 않는 것으로 나타났습니다( 보충 비디오 2 참조).
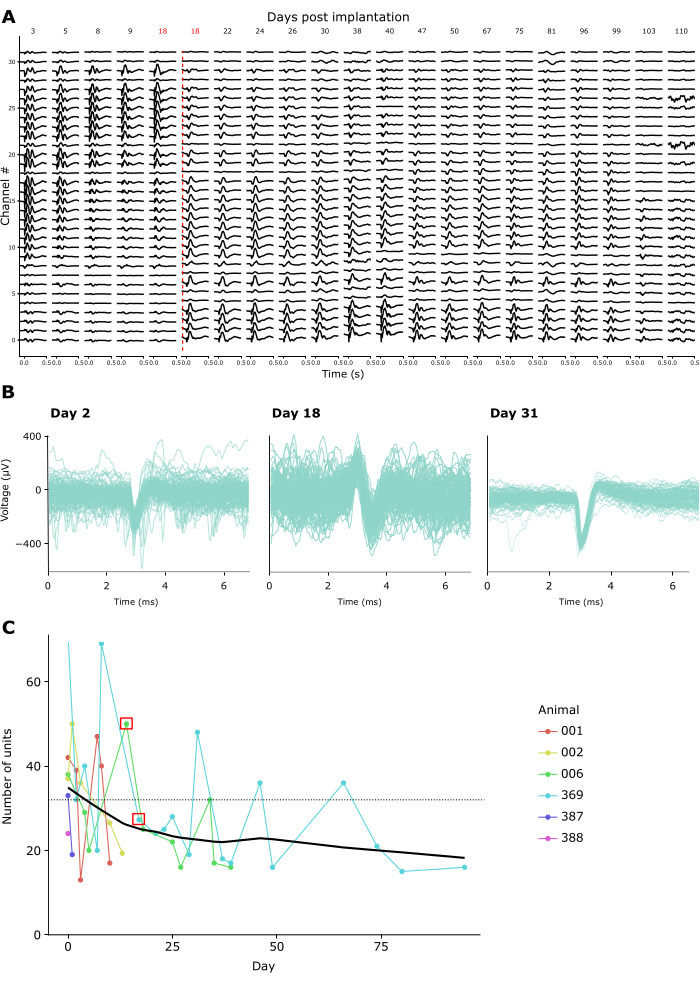
그림 4: 시간 경과에 따른 신경 세포의 안정성. (A) 이식 후 3-110일 동안 만성적으로 이식된 프로브의 32개 채널 모두에서 표시된 광시야 플래시 CSD 자극에 대한 평균 LFP 활성. 빨간색 수직선은 수술 후 18일째까지 뇌 외부에서 채널 0-8 녹음으로 인해 프로브가 새로운 위치로 내려가고 있음을 나타냅니다. (B) 동일한 만성 임플란트에서 4주에 걸쳐 반복적으로 기록된 3개의 예시 단위의 스파이크 파형. 가는 선: 개별 스파이크 파형. 두꺼운 중첩 선: 평균 스파이크 파형입니다. (C) 6마리의 동물에 대해 기록일 동안 Kilosort 3에 의해 감지된 추정 단일 단위의 수(삽입 범례 참조). 빨간색 사각형은 프로브가 이동된 날짜를 나타냅니다. 점선은 이러한 기록에 사용된 임플란트당 전극의 수를 나타냅니다(32). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마지막으로, 이 프로토콜은 마이크로드라이브, 웨어러블 패러데이 케이지, 임플란트 베이스 및 머리 고정 장치로도 사용할 수 있는 헤드플레이트를 포함한 모듈식 시스템을 제공함으로써 만성 전기 생리학과 머리 고정 동작의 통합을 가능하게 합니다. 여기에서는 구형 트레드밀에서 가상 환경을 횡단하는 쥐의 예제 데이터를 보여줍니다. 그림 5A 는 예시 시험에서 20단위의 달리기 관련 스파이킹 활동을 보여줍니다. 그림 5B 는 개별 스파이크 분류 단위의 달리기 속도와 스파이크 활동 사이의 다양하지만 강력한 관계를 보여주며, 그림 5C에서 동일한 효과에 대한 개체군 평균을 보여주며, 설치류 V124의 신경 활동에 대한 운동 활동의 잘 확립된 효과를 확인합니다.
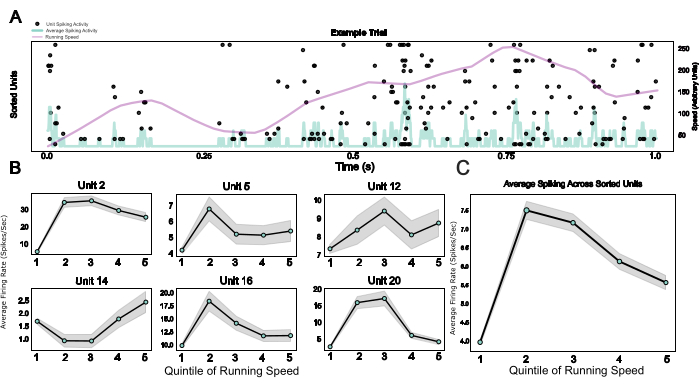
그림 5: 머리가 고정된 행동 동안의 신경 세포 반응. (A) 예시 시험에서 모든 단일 단위의 달리기 속도(보라색 선)와 평균 발사 속도(연한 파란색 선)가 겹쳐진 단일 단위 반응의 래스터 플롯. (B) 다양한 달리기 속도 범주 동안의 단일 단위 활동, 6개의 예제 단위에 대해 표시됨. (씨) 하나의 예제 세션에서 모든 단일 단위에 걸친 평균 스파이크 활동으로, 주행 속도 분포의 5개 퀴니타일에 걸쳐 표시됩니다. 이 세션의 달리기 속도는 0에서 0.88미터/초 사이였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 그림 3, 그림 4 및 그림 5에 표시된 녹음에서 단일 단위를 식별할 때 Kilosort 3에서 사용하는 기본 매개변수를 보여주는 표입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 1: 임플란트 후 동물의 운동 활동을 보여주는 비디오. 5일간의 회복 단계 후 촬영한 비디오는 정상적인 운동 행동과 임플란트의 크기 및 무게에 대한 적응을 보여줍니다. 이 동물은 일반적으로 환경 풍부화가 들어있는 놀이 케이지를 탐색하는 것을 볼 수 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 2: 조립된 패러데이 크라운에 힘이 가해지는 것을 보여주는 비디오. 패러데이 크라운이 견디는 힘은 4핀 극성 나노 커넥터와 같은 표준 커넥터에 필요한 연결 힘보다 약 한 자릿수 더 큽니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: 드라이브 홀더의 이미지를 보여주는 그림. 인쇄 가능한 디자인 파일은 해당 Github 저장소(https://github.com/zero-noise-lab/dream-implant/)에서 찾을 수 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 구리 메시를 위한 템플렛. 원래 배율로 템플릿을 인쇄하고 스텐실을 사용하여 구리 메쉬를 잘라냅니다(2.12단계). 축척 막대를 사용하여 확인하고 필요한 경우 인쇄물의 축척을 조정합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 수술 중 임플란트의 조립 단계를 보여주는 사진 시리즈. 이 경우 두 개의 마이크로 드라이브와 두 개의 증폭기가 설치됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: 드라이브, 개두술(녹색) 및 GND/REF 핀(빨간색)의 배치 예를 보여주는 쥐 두개골 그림. 핀 위치는 소뇌에 위치하기 때문에 제안되며, 이는 대뇌 피질 기록을 방해하지 않을 것입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 원고는 프로브의 빠르고 안전하며 표준화된 주입을 위한 프로토콜을 제시하며, 이를 통해 실험 종료 시 프로브 회수 및 재사용도 가능합니다. 이 접근 방식은 임플란트 구성 요소의 모듈식 시스템, 특히 모든 일반 실리콘 프로브 및 기록 시스템과 호환되는 마이크로드라이브, 머리 고정 동작 실험에 사용할 수 있는 헤드플레이트, 임플란트를 보호하기 위한 웨어러블 패러데이 케이지를 사용합니다. 이 별자리를 통해 사용자는 프로세스에서 임플란트의 표준화를 희생하지 않고도 머리를 고정하는 동작과 자유롭게 움직이는 동작 또는 임플란트 소형화(패러데이 케이지 제외) 대 장기 신호 견고성 향상(패러데이 케이지 사용)과 같은 다양한 실험 패러다임에 임플란트를 유연하게 적용할 수 있습니다.
이 접근 방식은 만성 전기생리학적 기록을 보다 표준화하고(수작업으로 조립할 필요가 없는 조립식 요소를 통해), 비용이 적게 들고(프로브 회수를 통해), 시간이 덜 걸리고(수술 단계 간소화를 통해), 동물 복지 및 행동과 더 쉽게 호환되도록(임플란트 크기 감소 및 스트레스 없는 머리 고정을 통해) 만듭니다. 따라서 이 프로토콜은 이 분야의 최첨단에 있는 선구적인 실험실을 넘어 더 광범위한 연구자들이 행동하는 설치류에 전기생리학적 임플란트를 사용할 수 있도록 하는 것을 목표로 합니다.
이 목표를 달성하기 위해 여기에 제시된 프로토콜은 마이크로드라이브 임플란트의 여러 가지 중요한 측면, 즉 유연성, 모듈성, 이식 용이성, 안정성, 전체 비용, 거동과의 호환성 및 프로브 재사용성 간의 절충을 최소화합니다. 현재 사용 가능한 접근 방식은 이러한 측면 중 일부에서 탁월한 경우가 많지만 다른 기능에 비해 비용이 많이 듭니다. 예를 들어, 장기간에 걸쳐 절대적인 임플란트 안정성을 요구하는 사용 사례의 경우, 최상의 임플란트 접근법은 프로브를 두개골(25)에 직접 접합하는 것일 수 있다. 그러나 이는 또한 프로브 재사용을 방지하고 기록 품질이 좋지 않은 경우 기록 부위의 재배치를 방지하며 표준화된 임플란트 배치와 호환되지 않습니다. 유사하게, AMIE 드라이브는 회수 가능한 프로브 주입을 위한 경량의 저비용 솔루션을 제공하지만, 이는 단일 프로브로 제한되고 대상 좌표(17)의 배치에 제한이 있다. 스펙트럼의 반대쪽 끝에서, 일부 상업적으로 입수가능한 나노-드라이브(표 1 참조: 16,17,21,26,27,28,29,30 참조)는 극히 작고, 두개골 상에 자유롭게 배치될 수 있으며, 단일 동물에 이식될 수 있는 프로브의 수를 최대화한다16. 그러나 다른 솔루션에 비해 비용이 많이 들고, 성공적인 임플란트 수술을 위해 실험자가 고도로 숙련되어야 하며, 프로브 재사용을 금지합니다. Vöröslakos et al.21이 개발한 경량 버전인 마이크로드라이브는 사용 편의성 향상, 가격 절감 및 프로브 재사용성을 위해 작은 임플란트 크기를 희생했습니다
표 1: 설치류의 만성 프로브 임플란트에 대한 인기 있는 전략 비교. 가용성: 마이크로드라이브가 오픈 소스(연구원이 직접 구축할 수 있음), 상업적으로 사용 가능한지 또는 둘 다인지 여부. 모듈성: 통합 시스템은 서로 고정된 관계에 있는 하나 또는 몇 개의 구성 요소로 구성되며, 모듈식 시스템을 사용하면 임플란트 생산 후(예: 수술 시) 보호 장치(헤드 기어/패러데이 케이지)를 기준으로 프로브/마이크로드라이브를 자유롭게 배치할 수 있습니다. 모듈성은 나열된 임플란트의 게시된 정보 또는 이식 프로토콜로부터 결정되었습니다. 헤드픽스: 예: 임플란트는 헤드 고정 메커니즘이 디자인에 통합되어 있고, X: 임플란트는 큰 문제 없이 고정을 위해 추가 헤드플레이트를 추가할 공간을 남겨둡니다, 아니오: 임플란트의 디자인은 공간 문제를 일으키거나 헤드 고정과 함께 사용하기 위해 상당한 디자인 수정이 필요할 수 있습니다. 프로브 배치: 제한됨: 임플란트 설계 단계에서 프로브 위치가 제한됩니다. 유연성: 수술 중에도 프로브 위치를 조정할 수 있습니다. 프로브 수: 이식할 수 있는 프로브의 수입니다. 마우스에 >2 프로브를 이식하는 것은 선택한 임플란트 시스템과 무관하게 상당한 문제가 됩니다. 프로브 재사용성: 예, 이론적으로 프로브를 재사용할 수 있는 경우입니다. 무게/크기: 임플란트의 무게와 부피. 이 표를 다운로드하려면 여기를 클릭하십시오.
이러한 다양한 요구 사항을 보다 원활하게 조화시키는 시스템을 만들기 위해 DREAM 임플란트는 Vöröslakos 임플란트21을 기반으로 설계되었지만 몇 가지 근본적인 수정 사항이 있었습니다. 첫째, 전체 임플란트 무게를 줄이기 위해 여기에 사용된 마이크로드라이브는 3D 프린팅 스테인리스강이 아닌 가공 알루미늄으로 제작되었으며, 패러데이 크라운은 소형화되어 헤드플레이트 재질 선택에 따라 전체 무게를 1.2-1.4g 줄였습니다(표 2 참조). 둘째, 마이크로드라이브를 둘러싼 헤드플레이트는 빠르고 스트레스 없는 헤드 고정을 가능하게 하는 통합 헤드 고정 메커니즘을 허용하도록 설계되었으며, 패러데이 케이지의 베이스로도 사용되어 신경 세포 기록을 위한 대부분의 잠재적 대상 영역에 접근할 수 있도록 하고 임플란트에 최소한의 무게만 추가할 수 있습니다. 고정 메커니즘의 평평한 모양과 돌출부의 부족은 또한 동물의 시야 또는 운동의 손상을 최소화하며(그림 2A-C 참조), 이는 이전 시스템에 비해 분명한 개선입니다(31,32). 헤드플레이트에 고정된 패러데이 크라운과 링도 이전 디자인에 비해 크게 변경되었습니다. 이제 수술 전반에 걸쳐 임시방편적인 조정(예: 커넥터 배치) 또는 납땜이 필요하지 않아 임플란트 손상 및 임플란트 품질의 예측할 수 없는 변동의 잠재적 원인을 제거할 수 있습니다. 대신, DREAM 임플란트는 각 커넥터를 사전 정의된 4개의 위치 중 하나에 배치할 수 있는 여러 가지 표준화된 크라운 링 변형을 제공하여 수술 중 변동성과 노력을 최소화합니다. 마지막으로, 프로브 회수를 위해 임플란트 시스템을 최적화함으로써 DREAM 임플란트는 마이크로드라이브와 프로브를 일반적으로 함께 회수, 세척 및 재사용할 수 있기 때문에 실험자가 임플란트당 준비 시간과 비용을 크게 줄일 수 있습니다.
다양한 임플란트 시스템으로 인해 발생하는 트레이드오프에 대한 자세한 개요는 표 1을 참조하십시오. 여기에 제시된 접근 방식은 일반적으로 크기, 안정성 또는 비용 측면에서와 같은 다른 모든 전략에 비해 최대 성능을 제공하지는 않지만 이러한 모든 매개변수에서 상위 범위에서 작동하므로 광범위한 실험에 더 쉽게 적용할 수 있습니다.
프로토콜의 세 가지 측면은 각 특정 사용 사례에 적응하는 데 특히 중요합니다: 접지 및 기준의 별자리, 마이크로드라이브를 접합하는 기술, 신경 세포 기록을 통한 임플란트 검증. 첫째, 접지 및 참조 핀을 이식할 때 목표는 기계적/전기적 안정성과 침습성 사이의 스위트 스폿을 식별하는 것이었습니다. 예를 들어, 한천에 매립된 부유 은선은 뼈 나사(33)보다 덜 침습적이지만, 시간이 지남에 따라 제거되는 경향이 더 높다. 한천과 결합된 핀을 사용하면 안정적인 전기 연결이 보장되는 동시에 삽입 중에 제어가 더 쉬워 조직 외상을 피할 수 있는 이점이 있습니다. 두개골에 접착된 접지 핀은 빠질 가능성이 거의 없으며, 와이어가 핀에서 분리되는 경우 이식된 핀의 더 큰 표면적과 안정성으로 인해 일반적으로 재부착이 간단합니다.
표 2: Vöröslakos et al.21에서 설명한 DREAM 임플란트와 임플란트 간의 구성 요소 중량 비교. 이 표를 다운로드하려면 여기를 클릭하십시오.
둘째, 마이크로드라이브의 접합은 일반적으로 뇌에 프로브를 삽입하기 전에 이루어져야 합니다. 이것은 삽입하는 동안 마이크로 드라이브가 정위 홀더에 완벽하게 고정되지 않은 경우 뇌 내부의 프로브의 측면 이동을 방지합니다. 마이크로드라이브를 제자리에 접합하기 전에 프로브의 위치를 확인하기 위해 현미경의 시차 이동을 감안할 때 터치다운 위치를 추정하는 것이 어려울 수 있으므로 프로브 생크의 끝을 잠시 내려 뇌와 접촉할 위치를 확인할 수 있습니다. 마이크로드라이브 위치가 설정되면 마이크로드라이브를 접합하기 전에 실리콘 엘라스토머로 개두술을 선택적으로 보호하여 시멘트가 실수로 개두술과 접촉하지 않도록 할 수 있습니다. 그러나 실리콘 엘라스토머 잔여물이 뇌로 빨려 들어가 염증과 신경교증을 유발할 수 있으므로 실리콘 엘라스토머를 통해 프로브를 낮추는 것은 권장되지 않습니다.
셋째, 사용된 실험 프로토콜에 따라 수술 직후 테스트 기록이 유용할 수도 있고 그렇지 않을 수도 있습니다. 대체로 프로브 삽입 직후 기록된 신경 활동은 일시적인 뇌 부종 및 프로브 주위의 조직 이동과 같은 요인으로 인해 만성적으로 기록된 활동을 직접 대표하지 않으며, 이는 삽입 깊이와 스파이크 파형이 모두 직접 안정화될 가능성이 낮다는 것을 의미합니다. 따라서 즉각적인 기록은 주로 일반적인 신호 품질과 임플란트 무결성을 확인하는 데 도움이 될 수 있습니다. 이동식 마이크로드라이브 썰매는 수술 후 뇌가 안정되어 위치를 미세 조정한 후 며칠 동안 사용하는 것이 좋습니다. 이는 또한 프로브가 하루에 1000μm 이상 이동하는 것을 방지하여 기록 부위의 손상을 최소화하여 기록 부위의 수명을 향상시키는 데 도움이 됩니다.
마지막으로, 사용자는 둘 이상의 대상 위치에서 기록하도록 시스템을 조정하기를 원할 수 있습니다. 이 시스템은 모듈식이기 때문에 사용자는 구성 요소를 서로 관련하여 조립하고 배치하는 방법에 대해 많은 재량권을 가질 수 있습니다(위 및 보충 그림 3 및 추가 그림 4 참조). 여기에는 수평으로 확장된 셔틀을 마이크로드라이브에 장착할 수 있는 수정 사항이 포함되어 여러 프로브 또는 대형 다중 생크 프로브를 이식할 수 있을 뿐만 아니라 여러 개의 개별 마이크로드라이브를 이식할 수 있습니다( 보충 그림 3 및 추가 그림 4 참조). 이러한 수정은 커넥터/인터페이스 보드/헤드스테이지를 위한 장착 영역의 수가 증가된 개조된 크라운 링만 사용하면 됩니다. 그러나 이 설계의 공간 제한은 동물 모델(이 경우 마우스)에 의해 결정되며, 이로 인해 여러 개의 프로브를 하나의 마이크로드라이브에 적층하는 것이 여러 마이크로드라이브를 서로 독립적으로 이식하는 것보다 설치 공간 측면에서 더 매력적입니다. 여기에 사용된 마이크로드라이브는 적층형 프로브를 지원할 수 있으며, 따라서 유일한 실제 제한 사항은 동물 모델에 의해 정의된 공간 및 무게 제약에 맞을 수 있는 헤드스테이지 또는 커넥터의 수입니다. 스페이서를 사용하여 수직이 아닌 장착 및 삽입 경로를 더욱 늘릴 수도 있습니다.
결론적으로, 이 프로토콜은 저렴하고 가벼우며 중요하게 조정 가능한 프로브 주입을 허용하며, 프로브 복구를 우선시하는 마이크로드라이브 설계의 추가 이점을 제공합니다. 이는 일회용 프로브의 엄청난 비용, 수술 및 이식 기술의 높은 장벽, 만성 이식을 위한 상용 솔루션이 고유한 사용 사례에 적응하기 어려운 경우가 많다는 사실을 해결합니다. 이러한 문제는 이미 급성 전기생리학을 사용하고 있는 실험실에 골칫거리이며, 아직 전기생리학 실험을 수행하지 않는 실험실에는 방해가 됩니다. 이 시스템은 이러한 한계를 넘어 만성 전기생리학 연구의 광범위한 활용을 촉진하는 것을 목표로 합니다.
공개
TS, AN 및 MNH는 이 프로토콜에 사용된 오픈 소스 마이크로드라이브와 패러데이 크라운을 제조하는 3Dneuro B.V.의 공동 설립자입니다. FB와 PT는 33Dneuro B.V.의 과학 자문 위원회의 일원입니다. FB와 PT는 이 직책에 대해 어떠한 금전적 보상도 받지 않습니다.
감사의 말
이 연구는 네덜란드 연구위원회(Dutch Research Council, NWO; Crossover Program 17619 "INTENSE", TS)에 등록되어 있으며, 보조금 계약 번호 600925(Neuroseeker, TS, FB, PT)에 따라 유럽 연합의 7차 프레임워크 프로그램(FP7/2007-2013)과 막스 플랑크 협회(Max Planck Society)로부터 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
참고문헌
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유