Method Article
Имплантат DREAM: легкая, модульная и экономичная система имплантатов для хронической электрофизиологии у мышей с фиксированной головой и свободно ведущих себя мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы представляем легкую, экономичную систему имплантатов зондов для хронической электрофизиологии у грызунов, оптимизированную по простоте использования, восстановлению зонда, экспериментальной универсальности и совместимости с поведением.
Аннотация
Хронические электрофизиологические записи у грызунов значительно улучшили наше понимание нейронной динамики и их поведенческой значимости. Тем не менее, современные методы хронической имплантации зондов представляют собой резкий компромисс между стоимостью, простотой использования, размером, адаптируемостью и долгосрочной стабильностью.
Этот протокол представляет собой новую систему имплантатов хронических зондов для мышей под названием DREAM (Dynamic, Recoverable, Economical, Adaptable and Modular), разработанную для преодоления компромиссов, связанных с доступными в настоящее время вариантами. Система представляет собой легкое, модульное и экономичное решение со стандартизированными аппаратными элементами, которые можно комбинировать и имплантировать в простых шагах и безопасно эксплантировать для восстановления и многократного повторного использования зондов, что значительно снижает затраты на эксперименты.
Система имплантатов DREAM включает в себя три аппаратных модуля: (1) микропривод, который может нести все стандартные силиконовые зонды, что позволяет экспериментаторам регулировать глубину записи на расстоянии до 7 мм; (2) трехмерная (3D) печатная конструкция с открытым исходным кодом для носимой клетки Фарадея, покрытой медной сеткой для электрического экранирования, защиты от ударов и размещения разъемов, и (3) миниатюрная система фиксации головы для улучшения благополучия животных и простоты использования. Соответствующий протокол операции был оптимизирован с учетом скорости (общая продолжительность: 2 часа), безопасности датчика и благополучия животных.
Имплантаты оказывали минимальное влияние на поведенческий репертуар животных, были легко применимы в свободно движущихся и неподвижных контекстах, а также обеспечивали четко идентифицируемые формы волн спайков и здоровые нейронные реакции в течение нескольких недель сбора данных после имплантации. Инфекции и другие хирургические осложнения встречались крайне редко.
Таким образом, система имплантатов DREAM является универсальным, экономически эффективным решением для хронической электрофизиологии у мышей, улучшая благополучие животных и позволяя проводить более этологически обоснованные эксперименты. Его конструкция упрощает экспериментальные процедуры для различных исследовательских потребностей, повышая доступность хронической электрофизиологии у грызунов для широкого круга исследовательских лабораторий.
Введение
Электрофизиология с помощью хронически имплантируемых силиконовых зондов стала мощным методом исследования нейронной активности и связей у животных, особенно у мышей, благодаря их генетической и экспериментальной податливости. Зонды из ламинарного кремния, в частности, оказались бесценным инструментом для идентификации функциональных отношенийв колонках коры головного мозга 2 и для связи динамики больших нейронных популяций с поведением таким образом, который ранее был невозможен.
В настоящее время золотыми стандартами регистрации нейронной активности in vivo являются два взаимодополняющих подхода: двухфотонная микроскопия 4,5 и внеклеточная электрофизиология6. Выбор методологии записи ограничивает характер полученных считываний: двухфотонная микроскопия особенно хорошо подходит для продольных исследований индивидуально идентифицируемых нейронов в больших популяциях во времени, но страдает от высокой стоимости оборудования и ограничена поверхностными слоями коры головного мозга в неповрежденном мозге. Кроме того, типичное временное разрешение ~30 Гц ограничивает его способность улавливать текущую нейронную динамику 7,8.
В отличие от этого, электрофизиологические записи предлагают высокое временное разрешение (до 40 кГц) для отслеживания активности нейронов в каждый момент, могут широко применяться как в разных видах, так и в корковых глубинах, и имеют относительно недорогие настройки по сравнению с двухфотонной микроскопией. Тем не менее, идентификация отдельных нейронов, а также продольное отслеживание популяций нейронов являются труднодостижимыми. Особенно это относится к проволочным электродам, например, тетродам, и к введению острых электродов. Помимо отсутствия возможности отслеживать нейроны во время сеансов записи9, повторные острые вставки вызывают локальную травму10 , которая вызывает иммунный ответ11, увеличивая вероятность инфекции и глиоза. Это в конечном итоге снижает стабильность регистрируемой нейронной активности и продолжительность жизни подопытных животных, ограничивая объем лонгитюдных исследований с острыми электрофизиологическими записями всего несколькими днями12.
Хронические записи кремниевых зондов высокой плотности призваны объединить некоторые из лучших характеристик острой электрофизиологии и двухфотонной визуализации. Они могут отслеживать динамику нейронной популяции между сеансами с несколько меньшей способностью идентифицировать отдельные нейроны по сравнению с двухфотонной визуализацией13. Эти записи обеспечивают высокую гибкость в пространственном размещении и точное временное разрешение регистрируемых сигналов, а также улучшенную продолжительность жизни и благополучие экспериментальных животных по сравнению с острыми записями14. Кроме того, в отличие от острых регистраций, хроническая электрофизиология требует только одного случая имплантации, что эффективно снижает риск инфекции и повреждения тканей и сводит к минимуму стрессдля животных. В совокупности эти преимущества делают хроническую электрофизиологию мощным инструментом для исследования организации и функционирования нервной системы.
Тем не менее, широко используемые методы хронической имплантации мышей вынуждают исследователей идти на значительные компромиссы между совместимостью с поведенческими записями, весом имплантата, воспроизводимостью имплантатов, финансовыми затратами и общей простотой использования. Многие протоколы имплантации не предназначены для облегчения повторного использования зондов, что резко повышает эффективную стоимость отдельных экспериментов и, таким образом, затрудняет использование хронической электрофизиологии в некоторых лабораториях. Кроме того, они часто требуют обширных внутренних работ по созданию прототипов и проектированию, для которых может не хватать опыта и ресурсов.
С другой стороны, интегрированные системы имплантатов17 предлагают более широко доступное решение для хронической электрофизиологии у грызунов. Эти системы предназначены для интеграции микропривода, удерживающего зонд, с остальной частью имплантата, что упрощает работу с имплантатами и хирургические процедуры. Однако после имплантации такие системы могут быть тяжелыми и ограничивать способность экспериментатора гибко адаптировать эксперимент к различным целевым координатам. Часто их вес не позволяет установить имплантаты у мелких животных, потенциально затрудняет движение животного и вызывает стресс18. Это может непропорционально повлиять на исследования в юношеских и женских когортах, поскольку ограничения по весу с большей вероятностью затронут эти группы.
Кроме того, не все интегрированные системы позволяют регулировать положение электродов после имплантации. Это актуально, так как глиоз или рубцевание из-за введения зонда19, особенно в первые 48 ч после имплантации20, может снизить качество регистрируемой нейронной активности. Микрорегулировка глубины ввода пробника может ограничить эти негативные последствия для целостности сигнала. Таким образом, механизмы микропозиционирования, обычно называемые микроприводами, могут быть полезны даже в зондах с большим количеством электродов, распределенных по их длине.
Чтобы преодолеть такие компромиссы, мы представляем новую систему имплантатов для хронической электрофизиологии для мышей, которая устраняет ограничения предыдущих конструкций, предлагая легкое, экономичное и модульное решение. Система имплантатов DREAM рассчитана на вес менее 10% (~2,1 г) от типичной массы тела мыши, что обеспечивает благополучие животных и минимальное влияние на поведение. Валидация конструкции имплантата DREAM показала минимальное влияние на ключевые поведенческие показатели, такие как локомоция, которая может быть значительно затронута у грызунов при нагрузке на череп. Это может принести пользу экспериментальным парадигмам, в которых используются свободно движущиеся животные, а также животные с фиксированной головой, повышая благополучие животных и позволяя проводить более этологически обоснованные эксперименты.
Система включает в себя микропривод для гибкой регулировки глубины записи до 7 мм и может быть адаптирована к различным типам зондов и записывающих устройств, предоставляя исследователям экономичный и универсальный инструмент для различных экспериментальных применений. Система обычно комбинируется с металлическим микроприводом21, который обеспечивает стабильное восстановление зонда по сравнению с другими системами (ожидаемая средняя скорость восстановления: около трех надежных повторных использований на зонд) и значительно снижает стоимость отдельных экспериментов.
Конструкция включает в себя напечатанную на 3D-принтере защитную клетку Фарадея, обеспечивающую дешевую, но надежную защиту от электрофизиологического шума, механических воздействий и инфекционных материалов, что позволяет вести стабильные и бесшумные записи с минимальным уровнем заражения. Этот имплантируемый кейдж состоит из так называемой «коронки», предназначенной для защиты от ударов и обеспечения структуры проводящего металлического сетчатого покрытия кейджа Фарадея, и коронного кольца, которое служит креплением для имплантируемого усилителя и/или разъема зонда (см. Рисунок 1).
Наконец, оголовки, входящие в модульную систему имплантатов, спроектированы таким образом, чтобы быть совместимыми с новой, эффективной системой фиксации головы без увеличения объема имплантата. В отличие от других существующих систем, она не требует закручивания небольших винтов вплотную к имплантату, ускорения фиксации мышей в экспериментальной установке, улучшения взаимоотношений экспериментатора и животного, а также приверженности к поведению. В то же время оголовье используется в качестве основы для сборки других модулей системы хронической электрофизиологии DREAM.
Файлы дизайна имплантата DREAM опубликованы в https://github.com/zero-noise-lab/dream-implant/ как оборудование с открытым исходным кодом. В следующих разделах будет описана конструкция и изготовление системы имплантатов DREAM, продемонстрирована ее успешная реализация в мышиной модели, а также будут обсуждены ее потенциальные применения и преимущества по сравнению с существующими системами.
протокол
Все экспериментальные процедуры проводились в соответствии с институциональными директивами Общества Макса Планка и были одобрены этическим комитетом местного самоуправления (Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, код утверждения проекта: F149-2000).
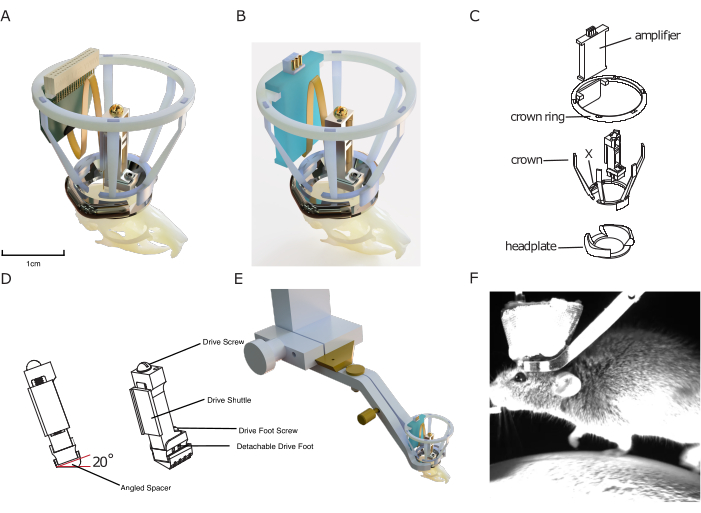
Рисунок 1: Дизайн имплантата. (A) 3D-визуализация имплантата, наложенного на череп мыши с помощью силиконового зонда, подключенного к разъему зонда. Центральное отверстие оголовья составляет примерно 10 мм для шкалы. Высота привода составляет примерно 17 мм. Медная сетка, которая образует внешнюю сторону короны Фарадея, а также заземляющие/опорные провода не показаны. (B) То же, что и (A) с подключением к плате усилителя вместо разъема пробника. (В) Разобранный технический чертеж имплантата с указанием его компонентов. (D) Рендеринг угловой распорки, которая может быть имплантирована под микропривод, что позволяет последовательно имплантировать микропривод под заданным углом (здесь: 20°). (E) Визуализация встроенного механизма фиксации головы, показывающая имплантированную головную пластину с коронкой Фарадея с окружающим зажимом для фиксации головы и соединением типа «ласточкин хвост» для установки. (F) Изображение головы мыши, закрепленной на беговой дорожке с помощью встроенного в имплантат механизма фиксации головки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
ПРИМЕЧАНИЕ: В разделах 1 и 2 обсуждается предоперационная подготовка
1. Подготовка силиконового зонда
- В случае повторного использования щупа очистите силиконовый щуп в соответствии с рекомендациями поставщика щупа. Замочите зонд в ферментном очистителе (см. Таблицу материалов) на 5-10 минут, затем промойте его в деминерализованной воде. Сделайте это как можно быстрее после эксплантации. За сутки до (повторной) имплантации замочите зонд в 70% этаноле не менее чем на 30 минут для дезинфекции.
- Измерьте импедансы канала, чтобы убедиться, что они находятся в пределах спецификаций для записанного сигнала. Следуйте протоколу проверки уровня шума из руководства пользователяNeuropixels 22, измерьте импеданс с помощью требуемого программного обеспечения для записи (например, https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing) и следуйте импедансу целевого канала, указанному производителем кремниевого зонда или в техническом описании. Если импедансы слишком высоки, рассмотрите возможность повторного нанесения покрытия на участки электродов23.
- Припаяйте гнездо для хвостового пайка 0,05 дюйма (см. Таблицу материалов) к проводу заземления (GND) пробника. Подсоедините гнездо к штифту GND (следующий шаг) во время операции.
ПРИМЕЧАНИЕ: В данном протоколе отдельный референсный контакт (REF) не используется, так как GND и REF закорочены на используемой головной сцене. Таким образом, в остальной части протокола будет упомянут только контакт GND. Если используется отдельный REF, повторите следующий шаг для контакта REF. - Чтобы подготовить контакт GND, многократно вставьте сторону контакта 0,05-дюймового паяльного гнезда (см. Таблицу материалов) в 0,05-дюймовое паяльное гнездо GND до тех пор, пока установка не станет в значительной степени легкой. Использование позолоченных штифтов может уменьшить потребность в этом этапе сглаживания. Это гарантирует, что штифт и гнездо GND можно легко соединить во время операции без необходимости приложения чрезмерного давления, что снижает риск травм животного и повреждения зонда.
- Если используется имплантируемый предусилитель для кремниевого зонда, подготовьте его к хронической имплантации после процедур поставщика. Затем прикрепите усилитель/разъем к кольцу клетки Фарадея, используя силиконовый пластырь, чтобы приклеить его к области кольца Фарадея, предназначенной для удержания усилителя (см. Рисунок 1).
ПРИМЕЧАНИЕ: Подготовка имплантируемого предварительного усилителя для силиконового зонда для хронической имплантации в соответствии с процедурами поставщика может включать в себя покрытие их силиконом или эпоксидной смолой во избежание повреждения электроники влагой, а также многократное сопряжение разъема усилителя для уменьшения силы сопряжения при подключении усилителя к записывающей системе во время записи. Это особенно полезно для пользователей Omnetics.
2. Подготовка микропривода и головного убора
- Поверните винт на корпусе микродисковода так, чтобы челнок микродисковода был почти полностью втянут вверх.
- При необходимости прикрепите наклонную спейсер (см. рис. 1D) к нижней части микродисковода с помощью цианоакрилатного клея или стоматологического цемента, который можно использовать для обеспечения определенной степени наклона, например, при записи через кортикальные слои в области центральной борозды или в глубоких структурах, которые могут потребовать неперпендикулярного подхода (для наклонной спейсера, см. Таблицу материалов).
- Установите микродисковод горизонтально на держатель микродисковода (дополнительный рисунок 1).
- Поместите небольшой кусочек клеевой шпатлевки (см. Таблицу материалов) на держатель микродисковода на расстоянии от микродисковода, на котором будет размещен разъем головного столика. Это расстояние зависит от длины гибкого кабеля, который соединяет силиконовый щуп с разъемом головного этапа.
- Нанесите крошечную каплю силиконовой штукатурки (см. Таблицу материалов) на шаттл.
- Извлеките силиконовый зонд из упаковки с помощью тупых щипцов с мягким наконечником. Сделайте это, покрыв стандартные игольчатые щипцы термоусадочной трубкой диаметром 3 мм (см. Таблицу материалов). Поместите щуп с гибким кабелем сначала на челнок микродисковода так, чтобы нижний край гибкого кабеля слегка свисал над нижним краем челнока микродисковода.
- Осторожно потяните гибкий кабель к верхней части микродисковода до тех пор, пока нижний край гибкого кабеля не встретится с нижним краем челнока микродисковода. Во время этого шага обязательно прижмите гибкий кабель к левому краю челнока микродисковода так, чтобы в конце он был размещен точно вертикально на микродисководе. На этом этапе убедитесь, что хвостовики силиконового зонда не выступают (или выступают минимально) за нижний край микродисковода (в зависимости от точной длины хвостовика щупа и глубины целевой области мозга).
- Поместите соединитель головки щупа на клейкую шпаклевку в верхней части держателя, чтобы защитить щуп от падения.
- С помощью иглы шприца массой 27 г нанесите небольшую каплю цианоакрилатного клея (см. Таблицу материалов) между гибким кабелем и челноком, чтобы закрепить зонд на месте. Убедитесь, что клей не стекает на микропривод или вдоль гибкого кабеля за пределы челнока (это очень важно)
- После того, как гибкий кабель будет приклеен на место, прикрепите усилитель к коронному кольцу (см. Таблицу материалов) с помощью силиконовой штукатурки. Затем прикрепите гибкий кабель к усилителю и покройте соединение и кабель тонким слоем силиконовой штукатурки.
- Через 5 минут, когда пластырь схватится, храните микропривод и щуп в безопасном месте до дальнейшего использования.
- Вырежьте кусочки медной сетки (см. Таблицу материалов) в форме открытого пончика (см. схему резки на дополнительном рисунке 2), чтобы накрыть клетку Фарадея.
- Закрепите вырез из медной сетки на клетке Фарадея с помощью небольших капель эпоксидной смолы (см. Таблицу материалов). Для этого шага также можно заменить эпоксидную смолу стоматологическим цементом.
ПРИМЕЧАНИЕ: Каркас Фарадея содержит место для размещения разъема пробника или усилителя. Это пространство отмечено буквой X в файле проекта и содержит опорное основание для усилителя/разъема, а также большее расстояние между двумя соседними спицами каркаса. Чтобы создать достаточное пространство вокруг усилителя/разъема, закрепите небольшое количество дополнительной сетки между двумя соседними спицами, создав выступ. Это гарантирует, что усилитель/разъем впоследствии может быть размещен в этом «кармане», не касаясь клетки Фарадея. Чтобы обеспечить надежное сцепление с минимальной деформацией, используйте кольцо коронки, размещенное непосредственно на заводной головке, для сохранения формы и поддержки тонких спиц коронки. Кроме того, используйте пайку, помогающую руками, чтобы закрепить корону и сетку во время сушки. Если вы изо всех сил пытаетесь сохранить форму коронки во время процедуры, попытайтесь нанести эпоксидную смолу только на две коронные ветви за раз, чтобы предотвратить деформацию. - Если требуется отдельное заземление клетки Фарадея, припаяйте небольшой контакт коллектора к заземляющему проводу диаметром 30 мм (см. Таблицу материалов), затем используйте проводящую эпоксидную смолу для присоединения провода к вырезу медной сетки.
ПРИМЕЧАНИЕ: Этот шаг не соблюдается в лаборатории. - На этом этапе безопасно храните подготовленные детали и проведите операцию на более позднем этапе.
ПРИМЕЧАНИЕ: В разделах 3-6 обсуждается имплантация микропривода и головного убора.
3. Хирургия: подготовка зонда и рабочего места
- Стерилизуйте и разместите хирургические инструменты в хирургическом рабочем пространстве в соответствии с утвержденной процедурой.
ПРИМЕЧАНИЕ: Это может включать использование стерилизатора гранул, инструментов для автоклавирования или промывание 30% перекисью или 90% этанолом, в зависимости от утвержденного протокола эксперимента. - Поместите керамическую чашку, используемую для приготовления стоматологического цемента, в холодильник или морозильную камеру, следуя инструкциям в наборе стоматологического цемента (см. Таблицу материалов). Используйте охлажденную керамическую чашку во время замешивания цемента, чтобы увеличить время, в течение которого цемент становится ковким. Используйте охлажденную посуду всякий раз, когда требуются более длительные этапы цементирования.
- Если требуется гистологическая верификация размещения зонда в конце эксперимента, выдвиньте силиконовый зонд непосредственно перед операцией, повернув винт на микроприводе против часовой стрелки, и нанесите липофильный краситель (см. Таблицу материалов) на зонд, окунув его в небольшую каплю красителя. Приготовьте липофильный краситель из коммерчески купленного раствора диметилсульфоксида (ДМСО) или этанола (EtOH) (см. Таблицу материалов), разбавив его в подходящем буфере, таком как PBS, в концентрации 1-5 мкМ.
4. Хирургическое вмешательство: подготовка животного
- Следуйте утвержденному протоколу анестезии для 2-4-часовой операции на грызунах в асептических условиях. Это может включать общую и местную анестезию, обезболивание, применение глазных мазей, инъекции физраствора. Здесь используйте инъекционную анестезию (кетамин 100 [мг/кг]/медетомидин 0,5 [мг/кг]) вместе с кремом для местного обезболивания и глазной мазью (см. Таблицу материалов) и положите животное на грелку для регулирования температуры тела.
- Когда животное будет полностью обезболито, переместите его в отдельную нестерильную зону для бритья.
- Следите за тем, чтобы животное достаточно согревалось; Например, разместить его на грелке. Удалите волосы на макушке черепа. Делайте это с помощью электробритвы или крема для депиляции (см. Таблицу материалов) или многократно сбривая макушку скальпелем, покрытым 70% этанолом.
- Осторожно удаляйте отмершие волоски, чтобы в дальнейшем они не соприкасались с открытыми тканями. Для удаления волосков используйте, например, салфетки, смоченные 70% этанолом, и/или отжимной шариковый насос. Если вы используете крем для депиляции, убедитесь, что он тщательно удален с помощью ватных палочек и физиологического раствора.
- Продезинфицируйте выбритый участок несколько раз с помощью дезинфицирующего средства на основе йода (см. Таблицу материалов) и спирта с помощью ватных тампонов, двигаясь от центра головы к бокам, чтобы убрать оставшиеся выпавшие волоски с места разреза.
- Продезинфицируйте шерсть на голове и вокруг нее с помощью бетадина. Это обеспечивает стерильную рабочую зону и защищает хирургические инструменты и материалы от контакта с нестерильным мехом.
- Поместите животное в стереотаксическую рамку с помощью ушных планок и держателя для носа (см. Таблицу материалов).
- С помощью небольших хирургических ножниц (см. Таблицу материалов) вырежьте миндалевидное отверстие в коже в верхней части черепа, идущее от задней части лямбда-шва до промежутка между глазами.
- Удалите подкожную оболочку и надкостницу, отрезав еще влажную, затем поцарапайте череп лезвием скальпеля, чтобы удалить мягкую мембранную ткань на поверхности черепа, которая может препятствовать адгезии стоматологического цемента.
- Дополнительно: После того, как череп будет очищен от мембранной ткани, кратковременно нанесите тонкий слой 0,5% перекиси и промойте его дезинфицирующим средством йодом на водной основе (например, бетадином) перед тем, как придать шероховатость поверхности черепа для улучшения адгезии грунтовки к черепу.
- Тщательно придайте шероховатости поверхности черепа, процарапав крест-накрест кончиком скальпеля, перевернутым вверх ногами. Это помогает зубному цементу прилипать к черепу в дальнейшем.
ПРИМЕЧАНИЕ: Не чешите слишком сильно верхнюю часть швов, так как это может привести к разрыву швов и утечке внутричерепной жидкости, что ухудшит адгезию стоматологического цемента. - Чередуйте лезвие скальпеля и стерильные ватные палочки, чтобы аккуратно поцарапать/оттолкнуть мышцы шеи, прикрепленные к бокам лямбда-шва, пока мышцы не будут отодвинуты назад к «краю» черепа на вершине мозжечка. Это помогает свести к минимуму мышечный шум в нейронных записях.
- Наполните шприц объемом 1 мл иглой 27 G (см. Таблицу материалов) небольшим количеством хирургического цианоакрилатного клея (см. Таблицу материалов). Затем приклейте кожу к краям черепа с помощью шприца, чтобы размазать по ней крошечные капли суперклея. Приклейте ткань как можно более плоской к черепу, чтобы оставить место для имплантатов. Эта процедура гарантирует, что кожа и мышцы не вступают в прямой контакт с частями имплантата, что позволяет избежать мышечного шума при записи и улучшает адгезию стоматологического цемента.
- Нанесите стоматологический цементный грунт на череп для дополнительной адгезии и затвердейте под воздействием ультрафиолетового излучения (см. Таблицу материалов). Это улучшает адгезию стоматологического цемента и предотвращает протекание черепных швов и ослабление черепно-цементной связи с течением времени.
- Найдите целевое место для имплантации зонда относительно брегмы или лямбды и очертите трепанацию черепа вокруг него хирургическим маркером. Поместите оголовье на череп так, чтобы краниотомия располагалась внутри него, оставив место для микропривода с одной стороны краниотомии, а также для 1-2 заземляющих штифтов.
- Имплантируйте оголовок с помощью стоматологического цемента. Смешайте стоматологический цемент в специальной охлажденной керамической чашке (см. шаг 3.2). Убедитесь, что оголовье прилегает к черепу со всех сторон, образуя водонепроницаемый «колодец».
- С помощью стоматологической бормашины (размер US 1/2 HP) просверлите небольшое отверстие для заусенцев шириной с штифты коллектора, подготовленные на шаге 1.4, над областью (областями) мозга, которая будет использоваться в качестве GND/REF. Если требуется заземление клетки Фарадея, просверлите еще одно небольшое отверстие для заусенцев рядом с краем клетки Фарадея для штифта разъема Фарадея-GND.
ПРИМЕЧАНИЕ: Для контактов разъема GND/REF поместите краниотомию на достаточном расстоянии от края каркаса, чтобы сам контакт коллектора можно было поместить внутрь него позже, не касаясь каркаса Фарадея. - Очистите трепанацию черепа, аккуратно капнув на нее стерильный физиологический раствор с помощью шприца и удалив ее непроливающимися салфетками (см. Таблицу материалов). Повторяйте до тех пор, пока не будет удалена вся кровь и рыхлые ткани.
- Приготовьте 0,7% раствор агара (см. Таблицу материалов) в физрастворе, немного охладите его и введите в трепанацию черепа с помощью иглы 27 G на шприце объемом 1 мл.
- Аккуратно вставьте штифт GND (см. шаг 1.3) в каждую трепанацию черепа, просверленную на предыдущем этапе. Контакт (контакты) будет окружен агаром со всех сторон (см. шаг 4.17). Нанесите цемент вокруг штифтов коллектора, чтобы закрепить их и обеспечить электрическую изоляцию.
- Очистите керамическую посуду и поставьте ее обратно в холодильник/морозильную камеру.
- С помощью бормашины просверлите контур более крупного трепанации черепа (кругового или квадратного), двигаясь по краю устойчивыми движениями. Убедитесь, что трепанация черепа имеет размеры от 1 мм x 1 мм до 2 мм x 2 мм, чтобы можно было внести небольшие коры в положение зонда, чтобы избежать кровеносных сосудов, не обнажая слишком большую часть коры головного мозга. По возможности избегайте наложения трепанации черепа поверх швов. Сверлите в раунды по 20-30 с, а между сверлильными раундами охлаждайте череп физиологическим раствором.
ПРИМЕЧАНИЕ: Перед началом сверления полезно разметить маркером переднюю кромку микропривода, тем самым гарантируя, что при сверлении прямая кромка может быть сформирована параллельно передней кромке микропривода. Это повышает шансы избежать образования цемента в краниотомии при фиксации микропривода на месте, а также улучшает адгезию, предотвращая нависание микропривода над краниотомией и обеспечивая большую боковую маневренность при размещении микропривода по отношению к конечному положению места записи. - После нескольких начальных раундов сверления проверьте сопротивление высверленной части кости, осторожно надавливая на нее тонкими щипцами (размер 5 или мельче; см. Таблицу материалов).
- Продолжайте тестировать между раундами сверления, пока кость не начнет «подпрыгивать» под щипцами при надавливании. В этом случае добавьте каплю физиологического раствора поверх трепанации черепа, чтобы размягчить кость, затем с помощью щипцов аккуратно удалите высверленный кусок кости.
- Если кость не может быть удалена мягко, проведите еще один раунд сверления, сосредоточившись на точках, где кость все еще прикреплена сильнее. Как правило, стремитесь удалить череп с легким давлением щипцов до того, как он будет полностью просверлен, поскольку это обычно сводит к минимуму повреждение тканей.
ПРИМЕЧАНИЕ: Убедитесь, что поверхность твердой мозговой оболочки регулярно увлажняется, как во время сверления для снижения температуры, так и после удаления костного лоскута. Это повышает шансы на легкое введение зонда, предотвращая высыхание твердой мозговой оболочки и ее более трудное проникновение. Если твердая мозговая оболочка оказывается слишком трудной для проникновения или используются тупые или многохвостые зонды, дуротомия выполняется путем подъема твердой мозговой оболочки иглой 27 G и выполнения небольшого разреза под погружением в физиологический раствор, чтобы предотвратить прилипание твердой мозговой оболочки к поверхности мозга.
- Накройте трепанацию черепа гемостатической губкой (см. Таблицу материалов), смоченной в прохладном, стерильном физрастворе для защиты твердой мозговой оболочки и мозга.
5. Хирургия: имплантация зонда
- Прикрепите специальный держатель микродисковода (см. Таблицу материалов) к кронштейну стереотаксического аппарата. Если микродисковод был извлечен из держателя микродисковода после подготовки щупа, поместите микродисковод с подключенным силиконовым щупом в держатель микродисковода. Наклоните руку стереотакса по мере необходимости, чтобы достичь желаемой целевой области мозга. Поместите кольцо коронки с подключенным усилителем на три вертикальных штифта в задней части держателя микродисковода (см. дополнительный рисунок 1).
- Опустите микропривод на расстояние ~0,5 мм от краниотомии, затем с помощью щипцов соедините контакт (контакты) разъема GND/REF, прикрепленный к зонду, к соответствующему контакту (контактам) GND/REF, имплантированному на череп (см. шаги 4.14-4.15). На Дополнительном рисунке 3 и Дополнительном рисунке 4 приведены примеры установки привода, трепанации черепа и контактов GND/REF.
- После установки закрепите контакт (контакты) каплей с помощью проводящей серебряной эпоксидной смолы (см. Таблицу материалов) для более прочного соединения. После отверждения эпоксидной смолы серебра покройте соединенные штифты небольшим количеством стоматологического цемента (см. Таблицу материалов), чтобы обеспечить стабильность соединения в течение длительного времени и отсутствие электрического соединения с окружающими тканями и/или элементами имплантата.
- Извлеките гемостатическую губку из краниотомии (см. шаг 4.22).
- Расположите стереотаксический рычаг с микроприводом над трепанацией черепа.
ПРИМЕЧАНИЕ: Если зонд втянут, убедитесь, что микропривод расположен таким образом, чтобы зонд касался части краниотомии, которая не содержит крупных кровеносных сосудов. - При необходимости опустите микропривод, регулируя положение и угол до тех пор, пока хвостовик щупа не коснется твердой мозговой оболочки или поверхности мозга (см. шаг 4.21) в целевой области.
- Смешайте стоматологический цемент в специальной керамической чашке (см. шаг 3.2) и зацементируйте основание микропривода на месте, уделяя особое внимание трем сторонам основания микропривода, которые не обращены к электроду. Убедитесь, что цемент не соприкасается с микроприводом над съемным «основанием» (см. Рисунок 1D).
- Убедитесь, что любое пространство между основанием и черепом полностью покрыто стоматологическим цементом. Очистите керамическую посуду и поставьте ее обратно в холодильник/морозильную камеру. Подождите, пока цемент застынет, примерно 10-15 минут.
ПРИМЕЧАНИЕ: Между основанием микропривода и черепом остается небольшой зазор, и для его заполнения используется цемент в наиболее жидкой форме. Как только цемент немного загустеет, цемент между стенками основания микропривода и черепом накапливается. Всегда используется очень небольшое количество цемента, так как поток вещества может быть непредсказуемым, и большие объемы могут поступать в нежелательные области. Небольшое количество гемостатической губки, смоченной в физрастворе, можно использовать для покрытия участков трепанации черепа. Если цемент случайно попал на краниотомию, удалите цемент щипцами, как только он войдет в пленкообразную консистенцию.
- Убедитесь, что любое пространство между основанием и черепом полностью покрыто стоматологическим цементом. Очистите керамическую посуду и поставьте ее обратно в холодильник/морозильную камеру. Подождите, пока цемент застынет, примерно 10-15 минут.
- Опустите силиконовый зонд на мозг, внимательно отслеживая положение зонда через микроскоп. Когда хвостовик зонда коснется мозга, быстро опустите зонд на ~250 мкм (один полный оборот винта равен 282 мкм), чтобы гарантировать, что зонд преодолеет сопротивление твердой мозговой оболочки/кортикальной поверхности.
- Убедитесь в этом визуально. Если зонд не проник в кору головного мозга, подождите 5 минут, затем попытайтесь протравить твердую мозговую оболочку кончиком хвостовика, многократно поднимая и опуская зонд на несколько десятков микрометров, пока твердая мозговая оболочка/кора находится под напряжением от кончика зонда.
- После того, как зонд прорвался через поверхность коры головного мозга, постепенно опускайте его более медленными темпами (100-200 мкм/мин) до тех пор, пока не будут достигнуты целевые координаты или зонд не переместится более чем на 1000 мкм. Если цель требует, чтобы зонд переместился более чем на 1000 мкм, продвигайте зонд с шагом не более 1000 мкм/сеанс в течение следующих сеансов записи до тех пор, пока не будут достигнуты целевые координаты.
ПРИМЕЧАНИЕ: Пропустите этот шаг, если вы предпочитаете отслеживать нейронные сигналы при опускании кремниевого зонда. Шаги для этого описаны в разделе 7. - Приготовьте силиконовый эластомер в соответствии с инструкцией (см. Таблицу материалов) и внесите небольшую каплю в краниотомию с помощью шприца объемом 1 мл (см. Таблицу материалов).
- После высыхания покройте силиконовый эластомер смесью костного воска и минерального масла в соотношении 50/50. Этот шаг дополнительно защищает зонд и предотвращает накопление мусора и сухой плазмы над краниотомией, что делает экстракцию более простой и безопасной. Соблюдайте осторожность, так как работа вокруг датчика в опущенном состоянии может привести к поломке.
6. Хирургия: имплантация клетки Фарадея
- Когда стоматологический цемент полностью застынет, ослабьте держатель микродисковода путем ослабления бокового винта, фиксирующего привод с помощью шестигранного ключа (см. дополнительный рисунок 1). Аккуратно втяните держатель на ~1 см, чтобы микропривод оставался свободным, но усилитель/разъем зонда оставался закрепленным на держателе имплантата, не растягивая гибкий кабель.
- Поместите готовую коронку и сетку Фарадея вокруг оголовья, растянув клетку в отверстии и наложив ее на микропривод и гибкий кабель горизонтально, затем закрепите ее на оголовье с помощью стоматологического цемента.
ПРИМЕЧАНИЕ: Обязательно закройте все пространства между клеткой Фарадея и черепом стоматологическим цементом, чтобы защитить имплантат от загрязнения. - Наденьте на заводную головку кольцо Фарадея (см. Таблицу материалов) с разъемом щупа/подголовником, совместив встроенный держатель усилителя/разъема щупа с областью, отмеченной отступом «X» на заводной головке Фарадея (см. шаг 2.13).
- Закрепите кольцо на клетке Фарадея с помощью небольшой капли цианоакрилатного клея или стоматологического цемента на каждом стыке спиц и кольца.
- После того, как кольцо Фарадея со встроенным усилителем/разъемом щупа будет закреплено на месте, полностью втяните стереотаксический кронштейн с держателем микропривода. На дополнительном рисунке 3 приведено пошаговое руководство по сборке этих компонентов.
7. Запись послеоперационных анализов
- Подключите усилитель/разъем пробника к записывающему оборудованию и начните запись.
- Если зонд еще не достиг своего целевого положения во время первоначального введения (см. шаг 5.9), медленно поверните винт микропривода против часовой стрелки, чтобы опустить зонд и одновременно отслеживая нейронные сигналы.
Примечание: Сигналы должны изменяться а) когда электроды касаются слоя силиконового эластомера над краниотомией, и б) когда электроды начинают перемещаться в мозг (см. шаг 7.2). Высокочастотная нейронная активность будет регистрироваться электродами, которые полностью вставлены в мозг, в то время как электроды, которые находятся в контакте с спинномозговой жидкостью на поверхности мозга, обычно показывают низкочастотный сигнал нейронной популяции без всплеска активности (сродни трассировке ЭЭГ), а регистрирующие участки в воздухе будут регистрировать повышенный электрический шум. Имеется возможность дополнительной проверки глубины ввода преобразователя путем измерения импеданса отдельных каналов после контрольной записи. Каналы, контактирующие с воздухом, должны иметь высокий импеданс (указывающий на обрыв цепи) и импедансы, подобные тем, которые измерялись до операции для каналов, соприкасающихся с спинномозговой жидкостью или уже находящихся в мозге. Переместите кремниевый зонд на максимальное общее расстояние примерно 1000 мкм за сеанс с максимальной скоростью около 75 мкм/мин (см. шаг 5.5). - Если на щупе видны нейронные потенциалы локального поля и/или датчик продвинут максимум на 1000 мкм, завершите запись теста и отсоедините разъем головного столика.
8. Восстановление
- Накройте клетку Фарадея самоклеящейся ветеринарной пленкой (см. Таблицу материалов).
- Прекратите анестезию и дайте животному восстановиться в течение нескольких дней в соответствии с утвержденными экспериментальными рекомендациями.
- Если электроды на кремниевом зонде еще не находятся в нужном целевом месте, поворачивайте винт микропривода небольшими шагами, максимум четыре полных оборота (или ~1000 мкм) за сеанс. При необходимости повторяйте эту процедуру в течение нескольких дней до тех пор, пока цель не будет достигнута. Рекомендуется сочетать движение зонда с одновременными записями для оценки электрофизиологической активности в пересекаемых областях.
9. Поведенческие эксперименты и хронические записи
- Для хронической фиксации головы во время выполнения задачи прикрепите оголовную пластину у основания клетки Фарадея к зажиму для фиксации головы, вручную открыв зажим и зажав имплантированную оголовную пластину (см. рис. 1C, E, F).
ПРИМЕЧАНИЕ: Если фиксация головы не требуется, эту систему имплантатов также можно использовать для свободно движущихся записей. Для свободного перемещения записей пропустите шаги 9.1 и 9.7. - Снимите самоприлипающую ветеринарную пленку с имплантата.
Примечание: Чтобы свести к минимуму дискомфорт для животного, рекомендуется начать выполнение простого, полезного поведенческого задания перед этим этапом, чтобы отвлечься, пока экспериментатор работает с имплантатом. - Подключите усилитель/разъем к записывающему оборудованию.
- Проводите нейронные записи по мере того, как животное выполняет задачу.
Примечание: Если цель состоит в том, чтобы максимизировать количество регистрируемых внеклеточных единиц, перемещайте шаттл на несколько десятков микрометров всякий раз, когда нейронная производительность в определенном месте уменьшается. Обратите внимание, что после перемещения щупа для стабилизации сигнала может потребоваться от нескольких минут до нескольких часов. Таким образом, может быть полезно перемещать зонд в конце сеанса, чтобы сигнал мог восстановиться до начала следующего сеанса. - Отключите записывающее оборудование и накройте имплантат новой ветеринарной пленкой в конце поведенческой записи.
- Откройте зажим для фиксации головы, чтобы отсоединить животное от фиксатора головы.
10. Восстановление зонда
- В конце окончательной записи втяните силиконовый щуп как можно дальше на микродисковод, повернув винт по часовой стрелке. Делайте это, когда животное зафиксировано на голове и ведет себя хорошо или когда животное находится под наркозом в хирургической установке. Составьте график выхода зонда из мозга, одновременно отслеживая нейронные сигналы и проверяя сигнатуру электродов, погруженных в мозг, соприкасающихся с поверхностью мозга или контактирующих с воздухом (см. шаг 7.3).
ПРИМЕЧАНИЕ: В зависимости от гистологического протокола и зонда, электролитические поражения выполняются перед втягиванием зонда, чтобы определить точное расположение некоторых электродов на зонде. Если нет необходимости контролировать выход зонда с помощью нейронной записи, также можно втянуть зонд после того, как животное было уничтожено. - Устраните животное в соответствии с утвержденными рекомендациями (это включает в себя перфузию животного, если планируется фиксация мозга для последующей гистологии).
- Подождите ~ 10 минут после смерти животного. Затем зафиксируйте голову животного в стереотаксисе, убедившись, что голова животного не может двигаться во время экспланта, чтобы предотвратить поломку зонда.
- Нанесите каплю физиологического раствора на верхнюю часть краниотомии и дайте ей впитаться в течение нескольких минут, чтобы размягчить высохшую биологическую ткань на хвостовике зонда и снизить вероятность поломки хвостовика.
- Поместите стереотаксический держатель примерно на 0,5 см выше микродисковода. Затем обрежьте верхний конец спиц клетки Фарадея маленькими хирургическими ножницами (см. Таблицу материалов), чтобы освободить кольцо Фарадея, удерживающее усилитель/разъем, и перенесите кольцо обратно на вертикальные контакты в верхней части стереотаксического держателя (см. шаг 5.1 и дополнительный рисунок 1).
- Аккуратно отрежьте медную сетку теми же хирургическими ножницами, вырезав U-образные участки сетки между спицами коронки Фарадея. Затем обрежьте пластиковые спицы заводной головки у основания.
ПРИМЕЧАНИЕ: Не сгибайте напечатанные пластиковые спицы во время резки, так как они могут сломаться и отправить пластиковые обломки в сторону щупа. - Опустите стереотаксический держатель до тех пор, пока микродисковод не будет зафиксирован в держателе с помощью бокового винта держателя, зафиксируйте микродисковод, затем ослабьте винт T1, которым корпус микродисковода соединяется с основанием микродисковода.
- Медленно втяните стереотаксический кронштейн с держателем имплантата, чтобы оторвать микропривод от основания. Убедитесь, что микродисковод отделяется от основания под перпендикулярным углом (т. е. «вертикально» от основания).
ПРИМЕЧАНИЕ: Если корпус и основание микродисковода не разделяются легко, убедитесь, что движение стереотаксического рычага не происходит под углом по сравнению с ориентацией микродисковода. При необходимости держатель и микропривод повторно выравниваются друг относительно друга, слегка ослабляя фиксацию головы животного и соответствующим образом перемещая ее. Правильная юстировка является одним из важнейших аспектов для легкого восстановления микродиска. Кроме того, проверьте, нет ли остатков стоматологического цемента, соединяющего микропривод и основание микропривода (см. шаг 5.5). Если это так, цемент осторожно соскабливается скальпелем и/или бормашиной в зависимости от количества используемого цемента. - Поднимите стереотаксический кронштейн с прикрепленным щупом, чтобы создать достаточное пространство под ним.
- Извлеките животное из стереотаксиса и подготовьте мозг, следуя утвержденному протоколу гистологии, если это необходимо. Восстановите имплантированную базу микродиска и очистите ее, замочив в ацетоне на несколько часов для последующего повторного использования.
- Поместите чистое основание микропривода на клеевую шпатлевку (см. Таблицу материалов), затем опустите микропривод на основание и затяните винт. Чтобы предотвратить поломку, следите за положением зонда под микроскопом на протяжении всего процесса. Этот шаг можно выполнить позже, если сначала необходимо очистить имплантированную базу микродиска для повторного использования.
ПРИМЕЧАНИЕ: Этот протокол предусматривает использование адгезивной шпатлевки в качестве платформы для основания, что жизненно важно, поскольку она не только надежно фиксирует основание, но и имеет определенную степень податливости, гарантируя, что основание не скользит и не столкнется с зондом. Шпаклевке следует придать вертикальную форму «обрыва» на той стороне основания микродиска, куда будет опускаться зонд. Это гарантирует, что если зонд опущен за основание, он не соприкоснется со шпаклевкой под ним. «Башня» для шпатлевки также должна быть достаточно высокой, чтобы при опускании за основание микродиска щуп не соприкасался с поверхностью стола, на котором размещена шпатлевка. Наконец, хорошо закрепите шпаклевку на поверхности, чтобы предотвратить ее соскальзывание или падение. При опускании микропривода на основание микродиска, удерживаемое шпатлевкой, убедитесь, что микроскоп имеет вид в профиль сбоку, чтобы следить за ходом движения, чтобы при опускании щупа он не сталкивался ни с основанием, ни с шпатлевкой. - Очистите и простерилизуйте зонд в соответствии с инструкциями производителя. Для наиболее распространенных доступных зондов замочите их в ферментном очистителе (см. Таблицу материалов) на 12 часов, затем промойте в деминерализованной воде и продезинфицируйте в спирте. Для этого опустите зонд в большой стакан, содержащий ферментативный очиститель, все еще прикрепленный к держателю микродисковода на стереотаксическом кронштейне.
ПРИМЕЧАНИЕ: При желании измерьте импедансы электродов на щупе после очистки, чтобы контролировать потенциальную деградацию отдельных электродов. - Храните микропривод вместе с очищенным зондом в безопасном месте до следующего эксперимента.
Результаты
Этот протокол представляет собой систему хронической имплантации, которая позволяет исследователям осуществлять легкие, экономичные и безопасные записи хронической электрофизиологии на мышах, ведущих себя (рис. 1). К основным факторам, определяющим успешное применение данного подхода, относятся: полное цементное покрытие черепа, минимально инвазивная и должным образом защищенная трепанация черепа, надежное крепление микропривода и проводки к черепу и полная непрерывность защитного материала Фарадея. Когда эти моменты учтены, можно добиться стабильного высокого качества записи. Здесь представлены репрезентативные результаты, относящиеся к следующим основным аспектам успеха операции:
1) Мешает ли имплантат поведению или благополучию животных?
2) Высокое ли качество сигнала и можно ли поддерживать его в течение длительных периодов времени?
3) Можно ли легко совмещать записи с выполнением задач?
Чтобы оценить влияние имплантата на поведение животных, мы проанализировали отслеживаемые паттерны передвижения у пяти имплантированных животных. На рисунке 2А показан пример животного, свободно передвигающегося внутри игровой клетки в течение 10 минут до и 1 недели после имплантации. Видно, что характер движения не изменился. Это наблюдение подтверждается рисунком 2B, C , показывающим распределение скоростей движения и направления головы у животных. Скорость бега и направление движения головы практически не изменились до и после имплантации, и, во всяком случае, скорость бега, по-видимому, немного увеличилась после операции. В дополнительном видео 1 показана короткая видеозапись животного через 6 дней после операции по имплантации. Типичное поведение в домашней клетке, такое как передвижение, груминг, выращивание и поиск пищи в домашних условиях, заметно и указывает на успешное восстановление после операции, а также на общее состояние здоровья. Низкое поведенческое воздействие имплантата, скорее всего, связано с его небольшим весом и управляемой высотой.
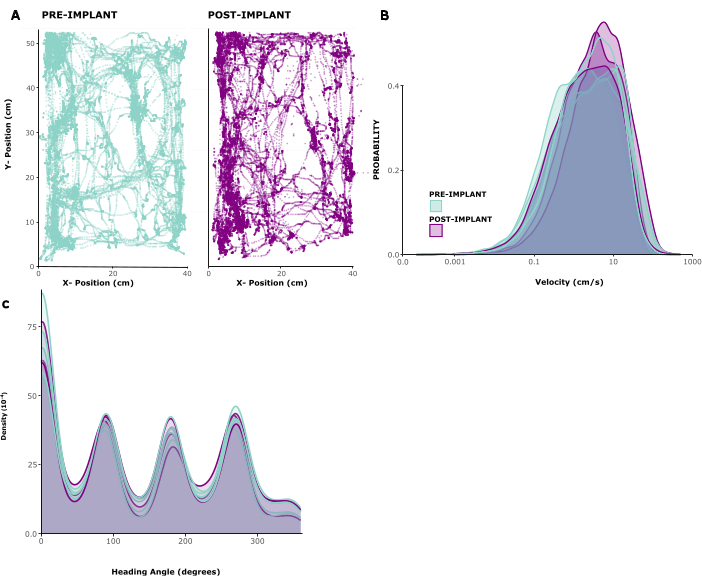
Рисунок 2: Локомоция до и после операции. (А) Пример передвижения животного до (левая панель) и после (правая панель) имплантации. Координаты x/y указаны в сантиметрах, точки показывают положение животного в каждой временной точке за период 10 мин. (B) Распределение скоростей движения в см/с за 5 сеансов до и 3 сеанса после имплантации у 5 животных. (C) Плотность ядер для вероятности движения в разных направлениях для одних и тех же сеансов, проанализированных в (B). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Затем оценивается качество сигнала в локальном потенциале поля (LFP) и пиковая активность на всех участках записи. Здесь мы показываем репрезентативные данные из корковых записей в первичной зрительной коре (V1). Для валидации предполагаемая одиночная активность была извлечена из широкополосных нейронных сигналов, записанных в V1 бодрствующей мыши с использованием килосортии 3 (см. рис. 3). На рисунке 3A показано расположение выделенных одиночных единиц на хвостовике зонда, на рисунке 3B показаны соответствующие формы волн спайков, а на рисунке 3C показаны спайковые отклики тех же нейронов на протокол плотности источника тока (CSD). В этой парадигме широкопольные вспышки были представлены с длительностью 300 мс с частотой 1 Гц (т.е. 300 мс вкл., 700 мс выкл.) в течение 200 попыток. Наконец, на рисунке 3D показана реакция тех же единиц на протокол визуального рецептивного отображения полей, состоящий из 2000 кадров случайно выбранных черных и белых квадратов на сером фоне, каждый из которых представлен в течение 16,6 мс. Квадраты покрывали по 12 градусов угла зрения каждый и были выбраны из поля 15 x 5 возможных местоположений таким образом, чтобы парадигма картографирования охватывала визуальное пространство от -90 до +90 градусов по азимуту и от -30 до +40 градусов по углу места. Реакция на частоту срабатывания на каждый кадр стимула была извлечена путем анализа максимальной скорости срабатывания в окне 16,6 мс с задержкой в 40-140 мс, определенной как оптимальная для каждого канала на основе максимальной активности в каждом окне. Этот тип записи может быть использован для регулировки глубины введения каждого электрода и для оценки качества сигнала после операции по имплантации.
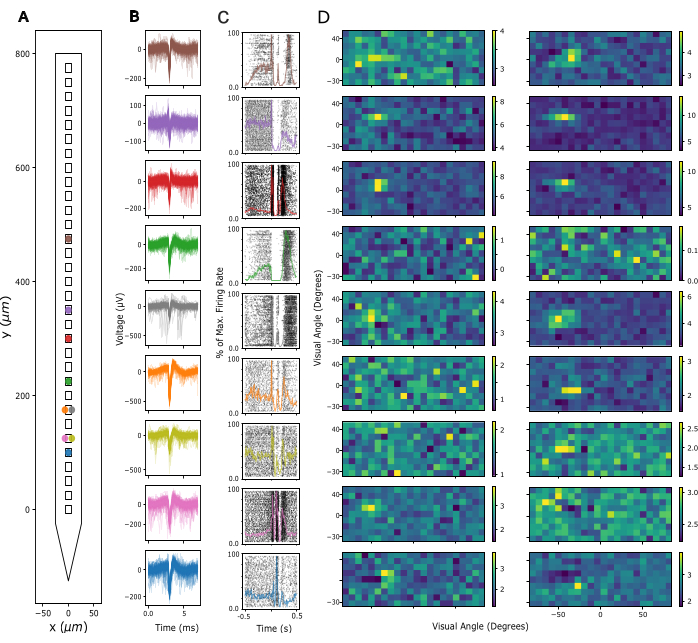
Рисунок 3: Записанные нейронные сигналы. (A) Предполагаемое расположение отдельных единиц, отсортированных по пакету сортировки шипов Kilosort 3 вдоль электродных контактов зонда. (B) Формы спайковых сигналов для тех же единиц, показанных в A, в течение 5 мс. Тонкие линии: отдельные формы волны спайка. Толстые линии: Средняя форма волны спайка. (C) Растровый график пиков в ответ на парадигму плотности источника тока (CSD), представляющий широкопольные вспышки со скоростью 300 мс, за которыми следует черный экран с длительностью 700 мс. Ответы отображаются для тех же единиц, что и в А и В. Наложенные цветные линии представляют временные гистограммы перистимулов (PSTH) тех же реакций. Скорость срабатывания для PSTH рассчитывалась в ячейках по 10 мс, а затем нормализовалась на максимальную скорость срабатывания по всему PSTH. Время 0 сосредоточено вокруг широкопольного импульса вспышки. (D) Оцененные рецептивные поля тех же единиц, что и в A-C, измеренные с помощью парадигмы Sparse Noise Receptive Field Mapping. Каждый график показывает среднюю скорость срабатывания в течение 16,6 мс аналитического окна в ответ на начало (левая панель) или смещение (правая панель) белых и черных квадратных стимулов. Стимулы предъявлялись в течение 16,6 мс, расположенные случайным образом на квадратной сетке 5 x 15 с углом зрения 180 градусов по горизонтали и 70 градусов по вертикали. Активность скорости срабатывания была z-оценена по всей сетке рецептивного поля (см. цветную полосу). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Качество записи оставалось высоким при повторных записях от нескольких недель до нескольких месяцев. На рисунке 4А показаны продольные записи LFP от одного животного в течение 15 недель. LFP были зарегистрированы в ответ на описанную выше парадигму CSD (см. рисунок 3A-C). На рисунке 4A показаны усредненные отклики LFP через 500 мс после начала вспышки. В данном примере мы использовали линейный зонд с 32 каналами, с межэлектродним расстоянием 25 мкм. Обратите внимание, что на 18-й день глубина зонда была скорректирована, сместив зонд вниз на 600 мкм. Как до, так и после этой корректировки сигналы LFP оставались стабильными в течение всех дней записи.
В соответствии с этим, спайковые формы волн предполагаемых одиночных единиц были различимы на многих записях. На рисунке 4B показаны репрезентативные примеры пиковых сигналов из трех сеансов записи в течение месяца записи, демонстрирующие, что активность одного устройства может быть успешно идентифицирована с течением времени. На рисунке 4C показано общее количество предполагаемых одиночных единиц, извлеченных из хронических записей у шести животных, охватывающих период до 100 дней. Отдельные единицы были определены в соответствии с стандартными критериями килосортировки 3.0 (см. дополнительную таблицу 1). Как можно видеть, количество четко определенных единичных единиц обычно составляло ~40 в течение первой недели после имплантации, а затем постепенно снижалось, приближаясь к очевидно стабильной асимптоте в ~20 единиц. Учитывая, что эти записи проводились с использованием линейных 32-канальных зондов, это соответствует ожидаемому выходу около 1,25 одиночных единиц на электрод сразу после имплантации, снижаясь до примерно 0,65 одиночных единиц на электрод при длительных записях. Повторное подключение к усилителю/разъему имплантата в течение сеансов, по-видимому, не повлияло ни на качество записи, ни на стабильность имплантата, поскольку коронка Фарадея, которая удерживает усилитель/разъем, может выдерживать повторяющиеся силы более 10 Ньютон, что на порядок больше, чем даже максимальные усилия сопряжения, необходимые для стандартных соединителей (см. Дополнительное видео 2).
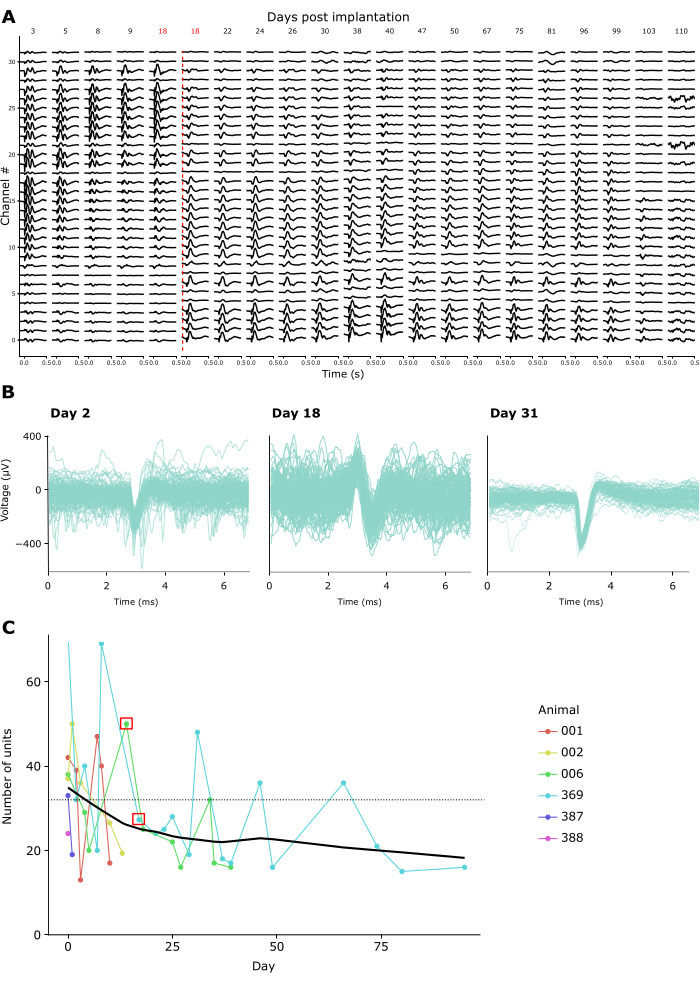
Рисунок 4: Стабильность нейронных записей с течением времени. (A) Средняя активность LFP в ответ на широкопольный импульсный стимул CSD, показанная по всем 32 каналам хронически имплантированного зонда в период от 3 до 110 дней после имплантации. Красная вертикальная линия обозначает, что зонд опускается в новое место из-за записи каналов 0-8 извне мозга на 18-й день после операции. (B) Формы спайковых волн трех образцов единиц от одного и того же хронического имплантата, зарегистрированные повторно в течение четырех недель. Тонкие линии: отдельные формы волны спайка. Толстая наложенная линия: Средняя форма волны спайка. (C) Количество предполагаемых единичных единиц, обнаруженных Kilosort 3 в течение дней регистрации для 6 животных (см. легенду на врезке). Красным квадратом обозначены дни, когда зонд был перемещен. Пунктирной линией обозначено количество электродов на имплантат, использованных в этих записях (32). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Наконец, предоставляя модульную систему, включающую микропривод, а также носимую клетку Фарадея и оголовье, которое также служит основанием для имплантата и устройством для фиксации головы, этот протокол позволяет интегрировать хроническую электрофизиологию с поведением, зафиксированным головой. Здесь показаны примеры данных мышей, проходящих по виртуальной среде на сферической беговой дорожке. На рисунке 5A показана связанная с бегом пиковая активность 20 единиц в примере испытания. На рисунке 5B показаны разнообразные, но устойчивые взаимосвязи между скоростью бега и спайковой активностью отдельных единиц, отсортированных по шипам, а также среднее значение популяции для того же эффекта на рисунке 5C, подтверждая хорошо установленное влияние локомоторной активности на активность нейронов у грызунов V124.
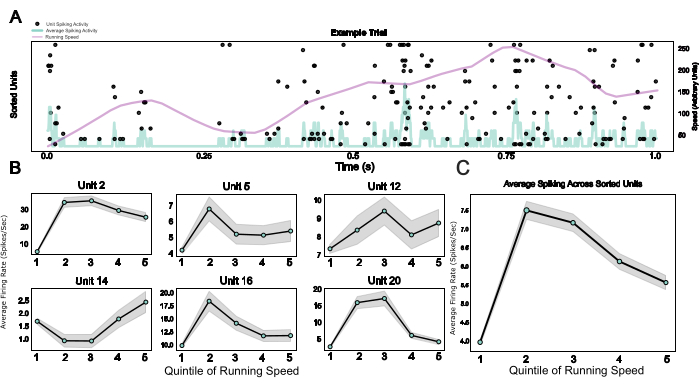
Рисунок 5: Нейронные реакции во время фиксированного на голове поведения. (A) Растровый график реакций отдельных единиц в примере испытания, со скоростью бега (фиолетовая линия) и средней скоростью срабатывания по всем одиночным единицам (светло-голубая линия). (B) Активность одной единицы при различных категориях скорости бега, показанная для шести примеров единиц. (с) Средняя активность спайков по всем отдельным единицам в одном примере сеанса, построенная по пяти факторам распределения скорости бега. Скорость бега в этой сессии варьировалась от 0 до 0,88 метра в секунду. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительная таблица 1: Таблица, показывающая стандартные параметры, используемые Kilosort 3 при идентификации отдельных единиц в записях, показанных на рисунках 3, 4 и 5. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное видео 1: Видео, показывающее локомоторную активность животных после имплантации. Видео, снятое после 5-дневной фазы восстановления, завершено, демонстрируя нормальное поведение опорно-двигательного аппарата, а также адаптацию к размеру и весу имплантата. Можно увидеть, как животное обычно исследует игровую клетку, содержащую обогащение окружающей среды. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительное видео 2: Видео, показывающее усилие, приложенное к собранной заводной головке Фарадея. Усилия, которые выдерживает заводная головка Фарадея, примерно на порядок больше, чем усилие подключения, необходимое для стандартных разъемов, таких как 4-контактные поляризованные наноразъемы. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 1: Рисунок, показывающий изображения держателя диска. Файлы дизайна для печати можно найти в соответствующем репозитории Github (https://github.com/zero-noise-lab/dream-implant/). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Шаблон для медной сетки. Распечатайте шаблон с оригинальным масштабированием и используйте трафарет для вырезания медной сетки (шаг 2.12). Используйте масштабную линейку для проверки и, при необходимости, корректировки масштабирования отпечатка. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Серия фотографий, показывающая этапы сборки имплантата во время операции. В этом случае устанавливаются два микропривода, а также два усилителя. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Рисунок черепа мыши с примерами размещения дисков, краниотомий (зеленым) и штифта GND/REF (красным ). Расположение булавок предполагается из-за размещения в мозжечке, что вряд ли помешает записи в коре головного мозга. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В данной рукописи представлен протокол быстрой, безопасной и стандартизированной имплантации зондов, который также позволяет извлекать зонды и повторно использовать их в конце эксперимента. Подход использует модульную систему компонентов имплантата, в частности, микропривод, который совместим со всеми распространенными силиконовыми зондами и записывающими системами, оголовок, который можно использовать для поведенческих экспериментов с фиксированной головой, и носимую клетку Фарадея для защиты имплантата. Эта констелляция позволяет пользователям гибко адаптировать свой имплантат к различным экспериментальным парадигмам, таким как фиксация головы против свободно движущегося поведения или миниатюризация имплантата (без кейджа Фарадея) против повышенной долгосрочной надежности сигнала (с кейджем Фарадея) - без необходимости жертвовать стандартизацией имплантата в процессе.
Такой подход делает хронические электрофизиологические записи более стандартизированными (за счет сборных элементов, не требующих ручной сборки), менее дорогостоящими (за счет восстановления зонда), менее трудоемкими (за счет упрощения этапов операции) и более совместимыми с благополучием и поведением животных (за счет уменьшения размера имплантата и беззаботной фиксации головы). Таким образом, этот протокол направлен на то, чтобы сделать электрофизиологические имплантаты у грызунов доступными для более широкого круга исследователей, выходящих за рамки новаторских лабораторий на переднем крае этой области.
Для достижения этой цели представленный здесь протокол сводит к минимуму компромисс между несколькими часто одинаково важными аспектами микродрайвовых имплантатов, а именно: гибкостью, модульностью, простотой имплантации, стабильностью, общей стоимостью, совместимостью с поведением и возможностью повторного использования зонда. В настоящее время доступные подходы часто превосходят некоторые из этих аспектов, но имеют высокую цену для других функций. Например, для случаев использования, требующих абсолютной стабильности имплантата в течение длительных периодов времени, наилучшим подходом к имплантации может быть непосредственное закрепление зонда на черепе25. Однако это также предотвращает повторное использование зонда, а также изменение положения мест записи в случае плохого качества записи, и это несовместимо со стандартизированной установкой имплантатов. Аналогичным образом, в то время как привод AMIE представляет собой легкое и недорогое решение для извлекаемой имплантации зондов, он ограничен одиночными зондами и ограничен в размещении целевых координат17. На противоположном конце спектра находятся некоторые коммерчески доступные наноприводы (см. Таблицу 16,17,21,26,27,28,29,30) чрезвычайно малы, могут свободно размещаться на черепе и максимально увеличивают количество зондов, которые могут быть имплантированы одному животному.. Однако они стоят дорого по сравнению с другими решениями, требуют от экспериментаторов высокой квалификации для успешных операций по имплантации и запрещают повторное использование зондов. Микропривод, разработанный Vöröslakos et al.21, облегченная версия которого также является частью этого протокола, жертвует небольшим размером имплантата ради большей простоты использования, более низкой цены и возможности повторного использования зонда
Таблица 1: Сравнение популярных стратегий для имплантации хронических зондов у грызунов. Доступность: является ли микродиск открытым исходным кодом (для самостоятельного сборки исследователями), коммерчески доступным или и тем, и другим. Модульность: Интегрированные системы состоят из одного или нескольких компонентов, которые находятся в фиксированном отношении друг к другу, в то время как модульные системы позволяют свободно размещать зонд/микропривод относительно защиты (головного убора/клетки Фарадея) после изготовления имплантата (например, во время операции). Модульность определялась на основе опубликованной информации или протоколов имплантации перечисленных имплантатов. Крепление головы: Да: Имплантат имеет встроенные в его конструкцию механизмы фиксации головки, X: Имплантат оставляет пространство для добавления дополнительной оголовки для фиксации без больших проблем, Нет: Конструкция имплантата, вероятно, создает проблемы с пространством или требует существенных изменений конструкции для использования с фиксацией головки. Размещение зонда: Ограничено: Расположение зонда ограничено на этапе проектирования имплантата. Гибкость: расположение зонда можно регулировать даже во время операции. Количество зондов: количество зондов, которые могут быть имплантированы. Обратите внимание, что имплантация датчиков >2 на мышь представляет собой значительную проблему, не зависящую от выбранной системы имплантации. Возможность повторного использования зондов: да, если датчики теоретически могут быть использованы повторно. Вес/размер: вес и громоздкость имплантата. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Чтобы создать систему, которая более органично согласует эти различные требования, имплантат DREAM был разработан на основе имплантата Vöröslakos21, но с несколькими фундаментальными модификациями. Во-первых, чтобы снизить общий вес имплантата, используемый здесь микропривод изготовлен из обработанного алюминия, а не из нержавеющей стали, напечатанной на 3D-принтере, а коронка Фарадея миниатюризирована, что позволяет снизить общий вес на 1,2-1,4 г в зависимости от выбора материала оголовья (см. Таблицу 2). Во-вторых, оголовье вокруг микродиска было спроектировано таким образом, чтобы обеспечить встроенный механизм фиксации головы, который обеспечивает быструю и безнапряжную фиксацию головы, в то же время выступая в качестве основы для клетки Фарадея, обеспечивая доступ к большинству потенциальных целевых областей для нейронных записей и добавляя лишь минимальный вес имплантату. Плоская форма фиксирующего механизма и отсутствие выступов также обеспечивают минимальное ухудшение поля зрения или локомоции животных (см. рисунок 2A-C), что является явным улучшением по сравнению с предыдущими системами31,32. Корона Фарадея и кольцо, которые закреплены на оголовье, также были существенно изменены по сравнению с предыдущими конструкциями. Теперь они не требуют специальной адаптации (например, с точки зрения размещения разъема) или пайки на протяжении всей операции, устраняя потенциальные причины повреждения имплантатов и непредсказуемые изменения в качестве имплантатов. Вместо этого имплантат DREAM обеспечивает несколько стандартизированных вариантов коронкового кольца, которые позволяют размещать каждый соединитель в одном из четырех заранее определенных положений, сводя к минимуму вариативность и усилия во время операции. Наконец, оптимизируя систему имплантатов для извлечения зонда, имплантат DREAM позволяет экспериментаторам значительно сократить стоимость, а также время подготовки одного имплантата, поскольку микропривод и зонд обычно можно восстанавливать, очищать и повторно использовать вместе.
Для более полного обзора компромиссов, связанных с различными системами имплантатов, см. Таблицу 1. Несмотря на то, что представленный здесь подход в целом не обеспечивает максимальной производительности по сравнению со всеми другими стратегиями, например, с точки зрения размера, стабильности или стоимости, он работает в верхнем диапазоне по всем этим параметрам, что делает его более применимым к широкому спектру экспериментов.
Три аспекта протокола особенно важны для адаптации к каждому конкретному сценарию использования: созвездие заземления и эталона, техника цементирования микропривода и валидация имплантата с помощью нейронной записи. Во-первых, при имплантации заземления и контрольных контактов цель состояла в том, чтобы определить золотую середину между механической/электрической стабильностью и инвазивностью. Хотя, например, плавающие серебряные провода, встроенные в агар, менее инвазивны, чем костяные винты33, они, вероятно, более склонны к смещению с течением времени. Использование штифтов в сочетании с агаром обеспечивает стабильное электрическое соединение, а также имеет преимущество в том, что их легче контролировать во время введения, что позволяет избежать травмирования тканей. Заземляющие штифты, прикрепленные к черепу, вряд ли будут смещены, а в случае отделения провода от штифта, повторное крепление обычно является простым из-за большей площади поверхности и стабильности имплантированного штифта.
Таблица 2: Сравнение веса компонентов между имплантатом DREAM и имплантатом, описанным Vöröslakos et al.21. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Во-вторых, цементирование микропривода, как правило, должно происходить до введения зонда в мозг. Это предотвращает боковое перемещение зонда внутри мозга, если микропривод не идеально зафиксирован в стереотаксическом держателе во время введения. Чтобы проверить положение зонда перед тем, как закрепить микропривод на месте, можно ненадолго опустить кончик хвостовика зонда, чтобы определить, где он будет контактировать с мозгом, поскольку экстраполяция положения приземления может быть затруднена из-за смещения параллакса микроскопа. После того, как положение микропривода установлено, можно дополнительно защитить трепанацию черепа силиконовым эластомером перед цементированием микропривода, чтобы гарантировать, что цемент случайно не соприкоснется с краниотомией; Однако опускать зонд через силиконовый эластомер не рекомендуется, так как остатки силиконового эластомера могут попасть в мозг и вызвать воспаление и глиоз.
В-третьих, в зависимости от используемого экспериментального протокола, тестовая запись сразу после операции может быть полезной, а может и не быть полезной. В целом, активность нейронов, зарегистрированная сразу после введения зонда, не будет напрямую отражать активность, зарегистрированную хронически, из-за таких факторов, как преходящий отек мозга и движение тканей вокруг зонда, а это означает, что как глубина введения, так и формы волн спайков вряд ли стабилизируются напрямую. Таким образом, немедленная запись может в основном служить для установления общего качества сигнала и целостности имплантата. Рекомендуется использовать передвижные салазки с микроприводом в последующие дни после операции, когда мозг стабилизируется для точной настройки положения. Это также помогает избежать перемещения зонда более чем на 1000 мкм в сутки, сводя к минимуму повреждение места записи и, таким образом, увеличивая срок службы места записи.
Наконец, пользователи могут захотеть адаптировать систему для записи из более чем одного целевого места. Поскольку эта система является модульной, пользователь имеет большую свободу действий в отношении того, как собирать и размещать компоненты по отношению друг к другу (см. выше, а также дополнительный рисунок 3 и дополнительный рисунок 4). Это включает в себя модификации, которые позволили бы установить горизонтально вытянутый челнок на микроприводе, что позволило бы имплантировать несколько щупов или большие многостоечные зонды, а также имплантацию нескольких отдельных микродисков (см. дополнительный рисунок 3 и дополнительный рисунок 4). Такие модификации требуют только использования адаптированного кронен-кольца с увеличенным количеством зон крепления для разъемов/интерфейсных плат/насадок. Тем не менее, ограничения по пространству этой конструкции продиктованы животной моделью, в данном случае мышью, что делает размещение нескольких датчиков на одном микродиске более привлекательным с точки зрения занимаемой площади, чем имплантация нескольких микродисков независимо друг от друга. Используемые здесь микроприводы могут поддерживать многоуровневые зонды, и, таким образом, единственным реальным ограничением является количество головных каскадов или разъемов, которые могут соответствовать ограничениям по пространству и весу, определенным моделью животного. Распорки также могут использоваться для дальнейшего увеличения невертикальных путей монтажа и вставки.
В заключение, этот протокол позволяет недорого, легко и, что важно, регулировать имплантацию зонда, с дополнительным преимуществом конструкции микропривода, которая отдает приоритет восстановлению зонда. Это решает проблемы непомерно высокой стоимости одноразовых зондов, высокого барьера хирургических и имплантационных навыков, а также того факта, что коммерческие решения для хронической имплантации часто трудно адаптировать к уникальным случаям использования. Эти проблемы представляют собой болевую точку для лабораторий, уже использующих острую электрофизиологию, и сдерживающий фактор для тех, кто еще не проводит эксперименты по электрофизиологии. Эта система направлена на содействие более широкому внедрению исследований в области хронической электрофизиологии за пределами этих ограничений.
Раскрытие информации
TS, AN и MNH являются соучредителями компании 3Dneuro B.V., которая производит микродиски с открытым исходным кодом и коронки Фарадея, используемые в этом протоколе. FB и PT входят в состав научно-консультативного совета 33Dneuro B.V. FB и PT не получают никакой финансовой компенсации за эту должность.
Благодарности
Эта работа была поддержана Голландским исследовательским советом (NWO; Crossover Program 17619 "INTENSE", TS) и получил финансирование от Седьмой рамочной программы Европейского Союза (FP7/2007-2013) в рамках грантового соглашения No 600925 (Neuroseeker, TS, FB, PT), а также от Общества Макса Планка.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
Ссылки
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены