Células solares sensibilizadas por corante
Visão Geral
Fonte: Tamara M. Powers, Departamento de Química da Texas A&M University
O mundo moderno de hoje requer o uso de uma grande quantidade de energia. Enquanto aproveitamos a energia de combustíveis fósseis, como carvão e petróleo, essas fontes não são renováveis e, portanto, o fornecimento é limitado. Para manter nosso estilo de vida global, devemos extrair energia de fontes renováveis. A fonte renovável mais promissora, em termos de abundância, é o Sol, que nos fornece energia solar mais do que suficiente para abastecer totalmente nosso planeta muitas vezes.
Então, como extraimos energia do sol? A natureza foi a primeira a descobrir: a fotossíntese é o processo pelo qual as plantas convertem água e dióxido de carbono em carboidratos e oxigênio. Esse processo ocorre nas folhas das plantas, e conta com os pigmentos de clorofila que colorem as folhas verdes. São essas moléculas coloridas que absorvem a energia da luz solar, e essa energia absorvida que impulsiona as reações químicas.
Em 1839, Edmond Becquerel, então um físico francês de 19 anos experimentando no laboratório de seu pai, criou a primeira célula fotovoltaica. Ele iluminou uma solução ácida de cloreto de prata que estava ligada a eletrodos de platina que geravam uma tensão e corrente. 1 Muitas descobertas e avanços foram feitos no final do séculoXIX e primeiro semestre do séculoXX, e foi apenas em 1954 que a primeira célula solar prática foi construída pela Bell Laboratories. A partir da década de 1950, as células solares eram usadas para alimentar satélites no espaço. 2
Células solares são dispositivos elétricos que utilizam a luz para criar uma corrente. Este vídeo demonstra a preparação e o teste de um desses tipos de célula, a célula solar sensibilizada por corante (DSSC). Inventado pela primeira vez na UC Berkeley por Brian O'Regan e Michael Grätzel, Grätzel prosseguiu este trabalho na École Polytechnique Fédérale de Lausanne, na Suíça, culminando no primeiro DSSC altamente eficiente em 1991. 3 Essas células solares, como as plantas, usam um corante para ajudar a aproveitar a energia do sol.
Princípios
Teoria da banda:
Quando dois átomos se unem para formar orbitais moleculares, dois orbitais são formados, um com uma ligação e outro com uma simetria antibonding. 4 Estes são separados por uma certa quantidade de energia. Quando n átomos se unem para formar orbitais moleculares, como em um sólido, n orbitais moleculares se formam. Quando n é grande, o número de orbitais que estão intimamente espaçados em energia é igualmente grande. O resultado é uma faixa de orbitais de energia semelhante(Figura 1). Elétrons dos átomos residem nessas bandas. A banda valance é a banda de maior energia que é povoada com elétrons. É semelhante ao orbital molecular mais ocupado (HOMO) de moléculas. A faixa de condução é a banda mais baixa que não é povoada por elétrons, e é semelhante ao menor orbital molecular desocupado (LUMO) de moléculas. A diferença de banda é a diferença de energia entre essas duas bandas.
Quando a abertura da banda é grande, o material sólido é um isolador: os elétrons não podem fluir livremente dentro do material(Figura 1). Em contraste, os condutores são aqueles em que a faixa valance-condução é borrada. Em um maestro, como um metal, aplicar uma tensão eleva alguns dos elétrons na faixa de valência à banda de condução. Estes elétrons animados são livres para se mover. Os elétrons deixam para trás buracos positivos, que também são livres para se mover. Na realidade, os buracos não se movem, mas sim elétrons se movem para preencher os buracos positivos. Nos condutores, à medida que a temperatura aumenta, as vibrações moleculares aumentam, obstruindo assim o fluxo de elétrons e diminuindo a condutividade.
Os semicondutores são materiais que atuam como isoladores a 0 Kelvin, mas tornam-se condutores à medida que a temperatura aumenta(Figura 1). Isso ocorre porque a lacuna de banda - a energia entre a valência e a banda de condução - é pequena, de modo que a energia térmica é suficiente para excitar elétrons na banda de condução. Os semicondutores intrínsecos típicos incluem silício e germânio.
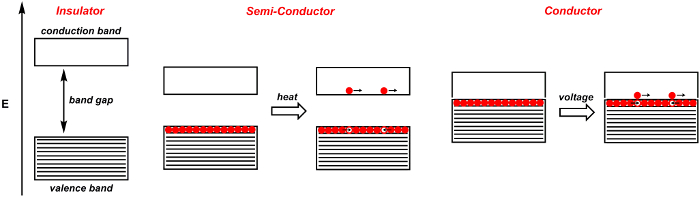
Figura 1. Diagrama de banda para um isolador, semicondutor e condutor. Bandas sombreadas são preenchidas com elétrons, enquanto as faixas brancas estão vazias. Elétrons discretos são indicados por uma esfera vermelha, enquanto buracos discretos são indicados por uma esfera branca.
Efeito fotovoltaico:
Quando a luz atinge um semicondutor, pode excitar um elétron da banda de valência até a banda de condução. Este elétron pode então recombinar com o buraco que deixou para trás, resultando em nenhum fluxo líquido de elétrons. Ou, ele pode se mover através do semicondutor, em torno de um circuito, e recombinar com um buraco na outra extremidade do circuito. Este fluxo de elétrons criados a partir da exposição à luz solar é chamado de efeito fotovoltaico. Este último cenário é desejado para gerar eletricidade e, portanto, os sistemas devem ser projetados para favorecer essa recombinação.
Uma maneira de favorecer isso é projetar células com uma junção p-n, ou seja,uma junção entre um semicondutor n-e p-doped. Estes são semicondutores pelos quais alguns dos átomos foram substituídos por átomos vizinhos na tabela periódica. Em semicondutores n-dopados, estes são substituídos por átomos que têm mais elétrons, e em semicondutores p-dopados, estes são substituídos por átomos que têm menos elétrons. Células solares "tradicionais" baseadas em silício fazem uso dessa abordagem.
No entanto, um tipo emergente de células solares são DSSC, muitas vezes referido como a célula Grätzel. 5 Estes são promissores na forma de serem semi-translúcidos, e seu custo é significativamente menor. Essas células solares ainda fazem uso de semicondutores, mas é um corante que é usado para absorver a luz do sol.
Componentes de um DSSC:
Existem muitos componentes para um DSSC, que é mostrado na Figura 2.
Tingir
Para promover o efeito fotovoltaico, um DSSC faz uso de corantes. A molécula de corante absorve a luz, promovendo um elétron de um orbital de ligação a um orbital anti-ligação. Este elétron animado pode então cair de volta para o orbital de ligação, resultando em nenhum fluxo de elétrons. Ou pode ser injetado em um semicondutor, o caminho produtivo de um DSSC. Isso deixa para trás um buraco, que deve ser preenchido para completar o circuito. Para o caminho produtivo, a energia do elétron de estado excitado no corante deve ser maior do que a faixa de condução do semicondutor. O corante também deve absorver grande parte do espectro solar, para melhorar a eficiência da célula. Corantes típicos são à base de rutênio (Ru) e, portanto, limita um DSSC, já que este metal não é muito econômico.
Neste experimento, estaremos utilizando um corante natural (antocianinas) encontrado em algumas frutinhas, como amoras e framboesas. A estrutura do corante de antocianina deve apresentar vários grupos =O ou -OH, que permitem que o corante se ligue à superfície TiIVO2 (Figura 3). 6
Semicondutor
O elétron excitado então flui para a faixa de condução do semicondutor. O semicondutor que usaremos neste experimento é o TiO2.
Ânodo
O elétron flui do semicondutor para o ânodo, que neste caso, é vidro revestido de SnO2. O SnO2 permite uma superfície condutora no vidro, que de outra forma seria um isolador.
Catodo
Depois de passar por uma carga, o elétron chega ao cátodo, que também é coberto em SnO2. O cátodo é adicionalmente coberto com um catalisador, neste caso, grafite, que ajuda a promover a reação redox do mediador.
Mediador
O elétron passa do cátodo para i3-, reduzindo-o a I-. Esta molécula reduzida pode então doar um elétron para o buraco deixado para trás na molécula de corante, completando o circuito. Este processo regenera I3-. A diferença entre o potencialcelular I3-/I e o nível de Fermi corresponde ao potencial do circuito aberto da célula solar, ou à tensão máxima que pode ser produzida com a célula.
Neste vídeo, um DSSC é preparado e seu desempenho é avaliado.

Figura 2. Esquema de um DSSC. A luz solar é absorvida pelo corante, levantando um elétron para um orbital anti-ligação no corante. Este elétron então se move para a banda de condução TiO2, deixando para trás um buraco. O elétron gira em torno do circuito e passa por uma carga, e é usado para reduzir I3- para I-, que é então oxidado de volta para I3- como o elétron preenche o buraco deixado no corante.
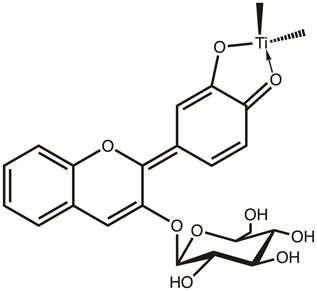
Figura 3. Pigmento de antocianina encontrado em algumas frutinhas vai sequim para a superfícietio 2.
Procedimento
1. Preparação da pasta TiO2
- Masse 6 g de pó de TiO2 coloidal, e coloque-o em uma argamassa.
- Adicione cuidadosamente 2-3 mL de vinagre ao TiO2, e comece a moer a suspensão com o pilão até que uma pasta uniforme seja obtida. A moagem serve para quebrar aglomerados agregados no pó.
- Continue adicionando vinagre, em ~ incrementos de 1 mL durante a moagem, até ~ 9 mL de volume total. Antes de cada adição, a consistência da pasta deve ser uniforme e livre de caroços. A pasta final deve ser grossa, mas não tão grossa que não possa ser espremida de uma garrafa de caixas.
- Adicione 1 gota de sabão de prato a 1 mL de água destilada, misture delicadamente.
- Adicione a solução de sabão de prato à suspensão TiO2 e misture delicadamente, tomando cuidado para não produzir bolhas.
- Deixe a suspensão equilibrar por 15 minutos. O sabão de prato serve como um surfactante, para ajudar a tornar a suspensão mais facilmente espalhada em um filme uniforme no vidro.
2. Deposição de TiO2 no Vidro
- Limpe dois slides de vidro condutores. Mergulhe um kimwipe com etanol e use-o para limpar duas lâminas de vidro condutoras. Coloque os slides limpos em um kimwipe fresco.
- Determine qual lado do vidro é condutivo. Usando um conjunto de multímetros para ohms, toque ambos leva a um lado do vidro. Se uma leitura entre 10 e 30 Ω é observada, é o lado condutor. Uma leitura de 0 Ω indica o lado não condutor.
- Mascarar o slide. Coloque um deslizamento de vidro com seu lado condutor para cima e o outro com seu lado condutor para baixo. Mantendo cuidadosamente os slides tocando, fita os slides de vidro para o topo do banco. Coloque fita em três dos quatro lados dos slides, certificando-se de que ~ 5-8 mm do slide esteja coberto por fita em cada um dos três lados(Figura 4). Pressione a fita com firmeza, para garantir que não haja bolhas de ar.
- Aplique a pasta TiO2. Usando uma haste de vidro, aplique uma fina linha de pasta através da borda superior mascarada do slide. Use a haste de vidro para enrolar cuidadosamente a pasta pelo comprimento do slide e voltar para cima. Repita este movimento 2-3x sem levantar a haste, ou até que um filme uniforme seja obtido.
- Se o filme não for uniforme, basta limpá-lo com um kimwipe, limpar o vidro com etanol, e uma vez seco, tente novamente.
- Deixe o filme secar um pouco e, em seguida, remova cuidadosamente a fita do vidro. O slide com o filme TiO2 deve estar no lado condutor. O outro slide pode ser limpo e usado posteriormente.
- Anneal, o filme TiO2. Coloque cuidadosamente o slide (TiO2 lado para cima) em uma placa quente que está definida para 450 °C. Observe como o TiO2 escurece para uma cor roxa/marrom, e recupera sua cor branca. Neste ponto, desligue a placa de aquecimento e deixe o filme esfriar lentamente. Se o slide for resfriado muito rapidamente, ele pode quebrar ou quebrar.
- Com uma régua, meça a superfície coberta com o filme, e observe esse valor.
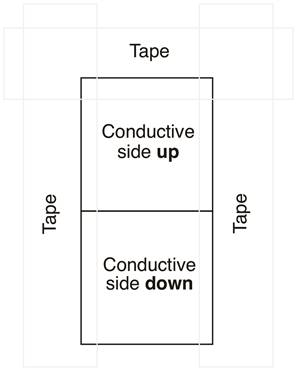
Figura 4. Depoimento de TiO2 em vidro.
3. Manche o filme TiO2 com corante
- Coloque algumas amoras, framboesas ou cerejas em uma argamassa e esmague-as com um pilão.
- Filtre a solução através de um filtro de café e em uma placa de Petri. Pode ser necessário adicionar alguns mL de água ao suco.
- Coloque o filme TiO2 resfriado, de lado para baixo na placa de Petri. Tenha cuidado para não riscar nenhum TiO2. Permita que o corante seja adsorvido no filme. Isso pode levar vários minutos.
- Uma vez que o filme esteja totalmente revestido (deve ser vermelho escuro ou roxo e não há manchas brancas), levante o slide com pinças (tenha cuidado apenas para endurecer o vidro e não o filme), e enxágue o escorregador com água, depois etanol. Borricar o filme seco com um kimwipe, e usar imediatamente.
- Se não for usado imediatamente, então armazene o filme em uma placa de Petri que contenha ácido acético no pH 3-5, e cubra a placa com a tampa e enrole em papel alumínio.
4. Prepare o eletrodo de contador
- Usando outra lâmina de vidro condutora, siga os passos 2.1-2.2.
- Aplique o catalisador de carbono no lado condutor. Usando pinças, segure o slide, lado condutor para baixo, sobre a ponta de um queimador Bunsen. Mova o slide para que a fuligem se colete em toda a superfície, mas por não mais do que 30 s. Deixe o slide esfriar e limpe a fuligem ao longo de um lado do escorregador com um cotonete.
- Alternativamente, usando um lápis HB, cubra toda a superfície condutora com grafite. Isso dá um eletrodo mais robusto, mas que tem um desempenho menos bom.
5. Montar a Célula Solar
- Seque o filme manchado. Enxágüe com etanol e coloque-o em um kimwipe. Limpe suavemente o filme com um segundo kimwipe. O filme deve estar seco para não impactar a solução de eletrólitos.
- Com o lado do filme de eletrodo para cima, coloque suavemente o eletrodo revestido de carbono em cima (cara de carbono para baixo). Certifique-se de compensar os slides para que as laterais expostas de ambos os eletrodos possam ser cortadas em fios. Coloque dois clipes de aglutinante nas laterais adjacentes ao vidro offset.
- Coloque algumas gotas da solução de eletrólitos ao longo de uma borda dos slides e abra/feche cuidadosamente cada lado da célula, abrindo/fechando alternadamente os clipes da pasta. Certifique-se de que toda a área manchada esteja em contato com a solução de eletrólitos e repita o passo 5.2, se necessário.
- Limpe o excesso de eletrólitos das áreas expostas usando kimwipes e etanol.
- Aperte clipes de jacaré para os dois lados expostos da célula solar.
6. Medição do desempenho celular
Nota: Idealmente, essas medidas devem ser feitas lá fora. No entanto, se o tempo não está permitindo, eles podem ser feitos dentro usando uma lâmpada halógena. Todas as medições devem ser feitas sem movimento da célula para que sejam realizadas em condições idênticas.
- Certifique-se de orientar a célula para que o filme TiO2 esteja voltado para o sol, e coloque uma tampa de policarbonato sobre a célula. Isso protege a célula contra danos uv.
- Conecte o eletrodo negativo (vidro revestido TiO2)ao fio negativo do multimetro, e o eletrodo positivo (C) ao fio positivo do ultrômetro(Figura 5).
- Coloque o multimetro em volts e meça a tensão. Este é o potencial do circuito aberto (tensão máxima em corrente zero). Cubra a célula (com uma mão ou um objeto sólido) para garantir que a tensão diminua.
- Defina o mímetro em miliamperes (mA) e meça a corrente máxima. Esta é a corrente de curto-circuito (corrente máxima a zero tensão). Cubra a célula com (com uma mão) para garantir que a corrente diminua.
- Registo uma curva de tensão de corrente completa usando um potencialiômetro de 500 Ω como carga variável.
- Determine qual o chumbo no potencialiômetro é a torneira central. Este chumbo permite que a resistência seja variada. Para isso, conecte o multímetro (definido para ohms) a dois dos leads no potencialiômetro, e varie a resistência no potencialiômetro. Observe se a resistência mudar. Repita isso com as outras duas combinações de leads. Alterações na resistência devem ser observadas em duas das três combinações. O chumbo que foi usado em ambas as combinações que deram mudanças é o toque central, e os outros dois são funcionalmente idênticos.
- Monte o circuito como mostrado na Figura 5 (à direita).
- Defina o potencialiômetro para a resistência completa (ou zero) e observe a corrente e a tensão.
- Altere a resistência no potencialiômetro em pequenos incrementos e observe a corrente e a tensão para que haja vários pontos que abrangem toda a gama do potencialiômetro. Certifique-se de não mover a célula durante essas medições. Uma vez que a corrente comece a mudar, certifique-se de coletar muitos pontos de dados; menos pontos de dados podem ser obtidos quando é constante.
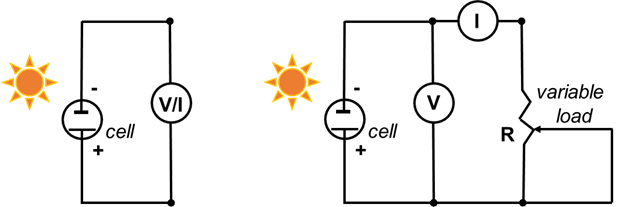
Figura 5. Diagrama de circuito para medir o potencial de circuito aberto e a corrente de curto-circuito (esquerda, passos 6.3 e 6.4), e para gravar a curva I-V (direita).
Resultados
Para cada ponto de dados coletado nas etapas 6.5.3-6.5.4, calcule a densidade atual (mA/cm2) e a densidade de energia (mW/cm2). Para calcular a densidade atual, divida a corrente pela área superficial do filme que foi determinada na etapa 2.7. Para calcular a densidade de energia, multiplique a tensão por densidade de corrente. Plote a corrente (mA) versus tensão (mV) para os dados coletados nas etapas 6.3, 6.4 e 6.5.3-6.5.4. Plote a densidade atual versus volts para todos os dados. Isso deve estar perto do "joelho" da curva. Determine a luz solar para a eficiência de conversão de energia elétrica dividindo a potência máxima (mW/cm2) pela energia solar de entrada (considerada de 800-1.000 W/m2), e multiplicando-se por 100%.
A análise dos dados e a preparação das curvas I-V é padrão na literatura de células solares como forma de comparar o desempenho das células. A tensão do circuito aberto medida deve ser entre 0,3 e 0,5 V, e deve-se obter um curto-circuito de 1-2 mA/cm2.
Aplicação e Resumo
Este vídeo mostrou a preparação e análise de um simples DSSC.
As células solares estão se tornando mais comuns, e há muita pesquisa sendo feita para avançar suas performances. Células solares tradicionais baseadas em semicondutores de silício são usadas para fazer painéis solares que são usados no espaço e na Terra. O Aeroporto Internacional de Denver faz uso do clima ensolarado do Colorado e tem quatro matrizes solares que fornecem 6% das necessidades energéticas do aeroporto.
Os DSSCs operam com eficiências de até 15%,7 em comparação com 14-17% de eficiência para os tradicionais painéis comerciais de silício de baixo custo. Embora a eficiência operacional dos DSSCs seja competitiva, o alto custo dos materiais (como o Ru-dye) é problemático para aplicações em larga escala. Possivelmente a maior desvantagem dos DSSCs é o uso de um eletrólito líquido sensível às mudanças de temperatura. O eletrólito líquido pode congelar a baixas temperaturas, interrompendo assim a produção de energia e/ou resultando em danos estruturais ao painel solar. Em altas temperaturas, o eletrólito líquido se expande, o que torna a vedação dos painéis desafiadora.
Referências
- Williams, R. Becquerel Photovoltaic Effect in Binary Compounds. J Chem Phys, 32 (5), 1505-1514 (1960).
- Perlin (2005), Late 1950s - Saved by the Space Race", Solar Evolution - The history of Solar Energy. The Rahus Institute. Retrieved 28 June 2016.
- Regan, B., Gratzel, M. Nature, 353, 737-740 (1991).
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry, Pearson, 2014.
- Wikipedia page: Dye-sensitized solar cell,
- Smestad, G. P., Grätzel, M. Demonstrating Electron Transfer and Nanotechnology: A Natural Dye-Sensitized Nanocrystalline Energy Converter. J Chem Ed. 75 (6), 752 (1998).
- Burschka, J., Pellet, N., Moon, S.-J., Humphry-Baker, R., Nazeeruddin, M. K., Grätzel, M. Sequential deposition as a route to high-performance perovskite-sensitized solar cells. Nature, 499 (7458), 316-9 (2013).
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Células solares sensibilizadas por corante
Inorganic Chemistry
15.7K Visualizações

Síntese de um metaloceno de Ti(III) usando a técnica da linha de Schlenk
Inorganic Chemistry
31.5K Visualizações

GloveBox e Sensores de Impurezas
Inorganic Chemistry
18.6K Visualizações

Purificação do ferroceno por sublimação
Inorganic Chemistry
54.4K Visualizações

O Método Evans
Inorganic Chemistry
68.3K Visualizações

Difração de Raios-X de Monocristais e de Pó
Inorganic Chemistry
104.2K Visualizações

Espectroscopia de ressonância paramagnética eletrônica (EPR)
Inorganic Chemistry
25.4K Visualizações

Espectroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizações

Interação Ácido-Base de Lewis em Ph3P-BH3
Inorganic Chemistry
38.8K Visualizações

Estrutura do ferroceno
Inorganic Chemistry
79.3K Visualizações

Aplicação da Teoria dos Grupos à Espectroscopia de IV
Inorganic Chemistry
45.1K Visualizações

Teoria do Orbital Molecular (TOM)
Inorganic Chemistry
35.2K Visualizações

Pás de Roda Quádrupla com Ligação Metal-Metal
Inorganic Chemistry
15.3K Visualizações

Síntese de um Complexo de Cobalto(II) Transportador de Oxigênio
Inorganic Chemistry
51.6K Visualizações

Iniciação fotoquímica de reações de polimerização radical
Inorganic Chemistry
16.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados