Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство С. Элеганс Трансгенов через Recombineering с GalK Выбор маркера
В этой статье
Резюме
Способность производить трансгенов для Caenorhabditis Элеганс Использование геномной ДНК несет fosmids особенно привлекателен, как и все родные регуляторные элементы сохраняются. Описывается простой и надежной процедуры для производства трансгенов через recombineering с GalK Селективного маркера.
Аннотация
Создание трансгенных животных широко применяется в C. Элеганс исследований, включая использование белков GFP слияния для изучения регуляции и экспрессии генов интересов или поколение очистки тандеме сродством (TAP) меткой версии специфических генов для облегчения их очистки. Как правило трансгенов создаются путем размещения промоутер перед геном GFP репортера или кДНК, представляющих интерес, и это часто приводит к представителю выражению. Тем не менее, критические элементы регуляции генов, таких как элементы управления в нетранслируемой области 3 'или альтернативных промоторов, может не хватать такого подхода. Далее только один вариант сплайсинга могут быть изучены обычно это означает. В противоположность этому, использование червя геномной ДНК несет клонов ДНК fosmid вероятно, включает в себя большинство, если не все элементы, участвующие в регуляции генов в естественных условиях, которая позволяет более широкие возможности для захвата подлинной выражению и сроки. Для облегчения поколения трансгенов использованием fosmid ДНК, мы описываем Е. кишечной основан recombineering процедуры для вставки GFP, TAP-тег, или другие последовательности интереса в любом месте в геном. Процедура использует galK гена как выбор маркера для позитивной и негативной селекции шаги в recombineering что приводит к получению желаемого модификация с высокой эффективностью. Кроме того, плазмиды, содержащие ген galK окружении гомологии оружия обычно используются GFP и TAP слияние генов доступны, которые снижают стоимость олигонуклеотидов на 50% при генерации или белка GFP TAP синтеза. Эти плазмиды использовать происхождения R6K репликации что исключает необходимость широкого очистки продуктов ПЦР. Наконец, мы также продемонстрировать технику для интеграции UNC-119 маркеров на fosmid основу, которая позволяет fosmid напрямую вводили или бомбардировке в червей для получения трансгенных животных. Это видео демонстрирует процедур, необходимых для создания трансгенных через recombineering используя этот метод.
протокол
Обзор
Многие трансгенов, используемые в поколение трансгенных C. Элеганс состоят из последовательности промоутер и, возможно, ген кДНК клонировали в один из векторов порожденных лаборатории доктора Энди Пожар 1. Хотя эти трансгенов часто успешно по отношению к производству ген GFP репортера или выражения кДНК в желаемую картину, эти трансгены могут отсутствия альтернативных промоторов, усилитель элементами, и 3 'нетранслируемой области (УТР) элементов, которые играют важную роль в контроле экспрессии генов в естественных условиях 2. Например, и DAF-12 и фа-1 генов важных элементов усилителя, которые лежат за пределами проксимальных промоутер, которые были упущены в промоутер только строит 3,4,5. Далее многие конструкции трансгенов использовать UNC-54, который предотвращает 3'UTR регулирования соответствующих генов микроРНК 6,7,8. Следовательно, создание трансгенов с большими сегментами червя геномной ДНК была бы идеальной для захвата всех промоутеров, сращивание вариантов, и 3 'UTR элементы управления. Недавно С. Элеганс fosmid библиотека, которая состоит из ~ 40 регионах кб геномной ДНК и охватывает почти весь геном был построен. Использование червя геномной ДНК несут эти fosmid ДНК клона приводит к более широкие возможности для захвата подлинной выражению и сроки конкретных генов 2,8,9,10,11.
Однако, работая с крупными регионами геномной ДНК представляет практические проблемы, такие как большие трудности с использованием стандартных методов молекулярной биологии 12. Чтобы преодолеть эти ограничения, методы для изменения fosmids или бактериальные искусственные хромосомы с помощью гомологичной рекомбинации у Е. палочки были разработаны и называются recombineering 12,13. Recombineering позволяет бесшовной вставки GFP, очистки тандеме сродством (TAP)-тег, или другие последовательности интереса в любом месте в геном несет C. Элеганс fosmid клон 2,10,14. Гомологичные рекомбинация происходит между ПЦР-продукт окружении 50 регионах б.п. гомологии на сайт целевой и целевой ДНК в специально модифицированные Е. штаммов.
Мы недавно описал двухэтапная процедура для модификации C. Элеганс fosmids по recombineering которая включает вставки galK гена в нужное место, а затем заменить этот ген с желаемой последовательности 2. Ген galK служит эффективным маркером выбора для обоих шагов в процессе, поскольку она может быть выбрана за и против с помощью использования селективной среде, рост 15. На первом этапе модификации fosmid, ген galK вставляется через гомологичной рекомбинации в нужном месте и правильно изменение fosmids определенные положительные отбор на способность использовать галактозы в качестве источника углерода 2,15. На втором этапе, ген galK заменяется желаемой последовательности, а правильно изменение fosmids определяются по принципу отрицательного отбора против galK гена за счет использования токсичных производных галактозы deoxygalactose который убивает бактерии galK + 2,15. Преимущество galK это способность одного гена, который будет использоваться для положительных и отрицательных шагов выбора, а не другие маркеры, которые имеют отдельные гены для каждого шага, и приводит к получению желаемого модификация с высокой эффективностью 2,15.
Чтобы облегчить применение этого метода к C. Элеганс исследования, мы сделали несколько изменений в имеющихся ресурсов. Во-первых, GFP и TAP-теги, как правило, используются для создания червя трансгенов, так что мы построили в 50 регионах б.п. гомологии для каждого из этих тегов в pMOD4 galK-G и pMOD4 galK-GT плазмидами, которые служат источником гена galK 2. Эти области позволяют единый набор олигонуклеотидов, которые будут использоваться для обоих этапов fosmid модификация, которая экономит нужно заказать второй комплект несколько дороже олигонуклеотидов. Во-вторых, использование этих плазмид происхождения R6K репликации что исключает необходимость для переваривания плазмиды родителей или обширные ПЦР продукт очистки, как родитель плазмиды не способен размножаться в бактерий, используемых для recombineering, и может только повторить в специальные штаммы, такие как EC100 2 , 16 (Таблица 1 и Таблица 2). Наконец, распространенный способ получения трансгенных C. Элеганс через использование biolistic бомбардировки с последующим отбором для трансгенных червей по спасению UNC-119 мутаций 17. Для того, чтобы fosmids совместимы с бомбардировкой, мы разработали pLoxP UNC-119 плазмиды, который может быть использован для интеграции UNC-119 маркеров на fosmid позвоночник 2.
I. Дизайн Oligo
С recombineering желаемой последовательности могут быть вставлены в любом месте в пределах гена. Общие сайты на 5 'конце или 3' конца в зависимости от функциональных областей, сращивания вариантов, или пост-трансляционной модификации, такие как расщеплению протеазами. PMOD4 GFP плазмида созданные нашей лаборатории могут быть использованы для вставки FLAG-меткой GFP в любом месте, как плазмида включает в себя инициатором кодон и недостатки стоп-кодон 3 '(рис. 1). В противоположность этому, TAP тега конкретные версии для 5 'и 3' из-за слияния TEV расщепления используется во время очистки 18,19.
- План сайта тег вставки в геном. Рассмотрение альтернативных промоторов, функциональных областей, альтернативные нарезки, и пост-поступательные изменения при рассмотрении вставки сайта. Различные сайты вставки могут быть использованы для пометки всех, один или несколько изоформ конкретного гена. Определить 50 б.п. регионах вверх и вниз по течению от точки вставки.
- Дизайн олигонуклеотидов (табл. 1). Либо 100 нм масштабе - гель очищенные олигонуклеотиды или Ultramer олигонуклеотидов из-интегрированные технологии ДНК можно использовать для процедуры.
Для выполнения galK recombineering, нужно разработать galK праймеров с 50 б.п. до гомологии области фланговые желаемый сайт, чтобы быть модифицированы и 3 'конца эти праймеры связываться с кассетой galK, который присутствует в обоих pMOD4 galK-G и pMOD4 galK-GT (рис. 1). Вперед олиго будет 5'------- 50 б.п. гомологии ------- CCTGTTGACAATTAATCATCGGCA-3 'и обратный один как 5'------- 50 б.п. гомологии на комплементарной цепи - ------ TCAGCACTGTCCTGCTCCT-3 '.
Для выполнения galK recombineering с GFP, нужно разработать pMOD4 galK-G или pMOD4 galK-GT праймеров с 50 б.п. до гомологии области фланговые желаемый сайт, чтобы быть модифицирована (рис. 1). Не забудьте сохранить слитого белка в кадре. ATG можно отказаться, если это необходимо. Конец 3 'из этих праймеров связывается с регионами GFP гомологии фланговые galK кассету. Примечание: первый и последний кодонов GFP подчеркнуты, чтобы продемонстрировать рамки считывания. Вперед олиго будет 5'------- 50 б.п. гомологии ------- ATG GATTACAAGGACGATGACGATAAGATGAG -3 '3' и 5'обратная ------- 50 б.п. гомологии на дополнительных прядь ------- CAA AGCTTGTGGGCTTTTGTATAG-3 '
Для выполнения galK C-термина TAP recombineering, нужно разработать pMOD4 galK-GT праймеров с 50 б.п. до гомологии области фланговые желаемый сайт, чтобы быть модифицирована (рис. 1). Не забудьте сохранить слитого белка в кадре. Конец 3 'из этих праймеров связывается с регионами TAP гомологии фланговые galK кассету. Примечание: первый и последний кодонов TAP подчеркнуты, чтобы продемонстрировать рамки считывания. Вперед олиго будет 5'------- 50 б.п. гомологии ------ ATG GAAAAGAGAAGATGGAAAAAG - -3 'и обратная 5'------- 50 б.п. гомологии на комплементарной цепи - ------ ГГТ TGACTTCCCCGC -3 '
Для выполнения galK N перспективе TAP recombineering, нужно разработать pMOD4 galK-GT праймеров с 50 б.п. до гомологии области фланговые желаемый сайт, чтобы быть модифицирована (рис. 1). Не забудьте сохранить слитого белка в кадре. Конец 3 'из этих праймеров связывается с регионами TAP гомологии фланговые galK кассету. Примечание: первый и последний кодонов TAP подчеркнуты, чтобы продемонстрировать рамки считывания. Вперед олиго будет 5'------- 50 б.п. гомологии ------ ATG GCAGGCCTTGCGC - -3 'и обратная 5'------- 50 б.п. гомологии на комплементарной цепи - ------ AAG TGCCCCGGAGGATGAGATTTTCT -3 ' - Создание набора фланговые олигонуклеотидов для ПЦР на последующих этапах, а также для секвенирования fosmid. Это стандартные олигонуклеотидов ПЦР, которая должна связать ~ 100 б.п. до и после вставки узла.
II. Передача Fosmid для SW016 бактерии
Fosmids из C. Элеганс fosmid библиотека предоставляет в EPI300 штамм бактерий (F-ЗОМК Δ (МРТ-hsdRMS-mcrBC) φ80dlacZΔM15 ΔlacX74 recA1 endA1 araD139 Δ (ара, НОУ) 7697 Galu galK λ-RPSL nupG trfA Тона) (Эпицентр Биотехнологии, Мэдисон, Висконсин ), которая позволяет fosmid выражение быть увеличена выше единственном экземпляре на ячейку для улучшения ДНК дает в процессе очистки (табл. 2). Для recombineering, fosmid должны быть переданы SW106 бактериального штамма (ЗОМК Δ (МРТ-hsdRMS-mcrBC) ΔlacX74 deoR endA1 araD139 Δ (ара, НОУ) 7697 RPSL recA1 nupG φ80dlacZΔM15 [λc1857 (Cro-bioA) <> Тет ] (Cro-bioA) <> AraC-PBAD Cre ΔgalK) (NCI-Фридрих) штамма, который несет λred гомологичной рекомбинации генов под контролем чувствительных к температуре λ-репрессора и индуцибельной арабинозы CRE рекомбиназы (табл. 2) 15.
- Закажите fosmid клон гена интереса (ГОИ) от GeneService (Кембридж, Великобритания) с использованием Wormbазы в качестве ориентира. При выборе клоны, мы выбираем те, которые имеют ГОИ в центре последовательности. Те, которые исключают соседних генов может быть предпочтительнее, но может быть трудно найти.
- Культура fosmid клон ГОИ в LB содержащей 12,5 мкг / мл хлорамфеникола при температуре 37 ° C.
- Расти 1,5 мл ночной культуры в fosmid и мини-приготовительные fosmid ДНК с использованием Эпицентр fosmid приготовительные комплект (Эпицентр Биотехнологии, Мэдисон, Висконсин). Мы следуем альтернативный протокол, описанный в инструкции, которые включает в себя добавление Riboshredder смеси на предыдущем шаге.
- Определите fosmid концентрации ДНК с помощью спектрофотометра.
- Подготовка electrocompetent SW106 клеток растущего 5 мл ночной культуры в SW106 в 14 мл оснастки колпачок трубки с LB бульоне с 12,5 мкг / мл хлорамфеникола при 32 ° C.
- Привить 1 мл на 100 мл LB с хлорамфеникола в 2-литровую колбу. Расти SW106 бактерий OD 600 0,6-0,8. НЕ теплового шока.
- Гранул путем центрифугирования при 5000xg в течение 5 минут, ресуспендируют осадок, осторожно вортексе и добавьте 50 мл ледяной 10% глицерина. Повторите это мыть один раз.
- Гранул SW106 путем центрифугирования и аспирации всех, кроме ~ 500 мкл каждого супернатанта
- Ресуспендируют окатышей нежный вортексе. Замораживание 100 мкл аликвоты в жидком азоте или в сухом льду, и хранить при температуре -80 ° C для дальнейшего использования.
- Преобразование fosmid ДНК в electrocompetent SW106 клеток electroporating бактерий с ~ 50 нг fosmid ДНК с использованием Eppendorf 2510 electroporator при 1350 вольт в 0,1 см кювет пробел.
- Восстановление бактерий в 1 мл LB течение 1 часа при 32 ° C.
- Пластина аликвот на LB пластины с хлорамфеникол (12,5 мкг / мл) и инкубируют при 32 ° С в течение ночи.
- Проверьте наличие ГОИ по колонии PCR. Расти 5 мл ночной культуры в LB с 12,5 мкг / мл хлорамфеникола при 32 ° C. Добавить 0,5 мкл культуры к стандартной реакции ПЦР с флангового олигонуклеотидов и увеличить первоначальный 95 ° C инкубации до 5 минут, чтобы лизировать бактерии до ПЦР.
- Подготовка глицерина запас для длительного хранения.
III. Введение гена galK по Recombineering
На первом этапе модификации fosmid, ген galK вставляется в fosmid гомологичной рекомбинации и правильно изменение fosmids выбраны для ростом на минимальную среду, содержащую галактозы в качестве единственного источника углерода (рис. 2А). SW106 бактерии растут медленно на минимальные средства массовой информации и через 3-5 дней требуется, чтобы увидеть колонии.
- Подготовка MOPS минимальным пластин среду, содержащую 0,2% галактозы. MOPS минимальные средства массовой информации можно получить Teknova Inc (Hollister, Калифорния) (каталог # M2106), но не используют включены глюкозы.
MOPS минимальных средах с 0,2% галактозы (1 л)
Автоклав 15 грамм агара в 870 мл воды
Остудить до 55 ° С и добавить:100 мл 10X MOPS минимальных средах 5 мл 0,2 мг / мл D-биотин (стерильной фильтрации) 4,5 мл 10 мг / мл L-лейцин (1%, с подогревом, затем охлаждается и стерильной фильтрации) 10 мл 20% галактозы (автоклавного) 1 мл 12,5 мг / мл хлорамфеникола в этаноле 2,55 мл 20% NH 4 Cl 10 мл 0,132 М двухосновный фосфат калия - ПЦР усиливают pMOD4 galK-G или pMOD4 galK-GT кассеты использованием праймеры выше. Мы использовали Phusion (Новая Англия Биолабс, Ипсвич, Массачусетс) или GoTaq (Promega, Madison, WI).
- Гель очищает результате группа. Количественная урожайности на гель или Nanodrop спектрофотометр. Этот продукт ПЦР готов к шагу 3,14.
- Привить культуру ночь SW106 клетки, содержащие ДНК fosmid в 5 мл LB с хлорамфениколом (12,5 мкг / мкл). Вырасти на 32 ° C.
- Установить пожимая водяной бане до 42 ° С до разминки с 250 мл стерильной колбе в держателе. Использование пожимая водяной бане имеет решающее значение для получения высокой эффективности.
- Добавить 1 мл ночной культуры к 100 мл LB и хлорамфеникола в 2-литровую колбу. Вырасти на ОД 0.6-0.8. Это обычно занимает 3-4 часа.
- Передача 50 мл SW106 клетки 250 мл колбу и теплового шока при 42 ° С в течение ровно 20 мин. В пожимая водяной бане при 100 оборотов в минуту Оставьте оставшихся бактерий при 32 ° С, как uninduced контроля.
- Прохладный индуцированных и uninduced бактерий на льду в течение 10 минут.
- Передача образцов на две стерильные пробирки центрифуги и гранул при ~ 5000xg течение 5 минут.
- Вылейте все супернатант и ресуспендируют осадок в 1 мл ледяной 10% глицерина, осторожно вортексе (т.е. настройка 3-4).
- Когда ресуспендировали, добавьте еще 49 мл ледяного 10% глицерина и гранул образцов при ~ 5000хе в течение 5 минут.
- Повторите шаг 3,9, 3,10 и 3,11 раз.
- Удалите все супернатант инвертирующего трубы, и ресуспендируют осадок в оставшуюся жидкость (примерно 500 мкл каждой). Алиготе в 100 мкл образцов, замораживание сухим льдом, и хранить при температуре -80 ° C. Это хорошие недель до нескольких месяцев. (Обычно мы останавливаться и выполнять электропорации следующий день).
- Electroporate индуцированных и uninduced SW106 клеток с 150 нг продукта ПЦР с использованием 0,1 см кювет разрыв в Эппендорф 2510 electroporator установлен в 1350 вольт.
- Восстановление бактерий в 1 мл LB в трубке 14 мл Falcon. Инкубировать при 32 ° C в течение 4,5 часов.
- Гранул бактерий в микроцентрифужную на 13200 оборотов в минуту в течение 15 секунд. Бактерии ресуспендировали в M9, а затем дважды промывают удалить любой богатой среде (см. ниже рецепт).
- M9 среда (1 л)
- 6 г Na 2 HPO 4
- 3g KH 2 PO 4
- 1 г NH 4 Cl
- 0,5 г NaCl
- АВТОКЛАВ
- После второго мытья, супернатант удаляют, а осадок ресуспендируют в 1 мл до M9 покрытие серийных разведений в M9 (100 мкл, 100 мкл разведения 1:10 и 1:100 100 мкл) на MOPS минимальными средствами массовой информации.
- Выдержите 3-5 дней при 32 ° C в инкубаторе. Примечание: Будьте терпеливы, как истинно положительных растут медленно.
- Подряд несколько колоний на пластинах МакКонки агар индикатор (BD # 281810) с добавлением 1% галактозы и хлорамфеникол 12,5 мкг / мл. Все колонии, появляющееся после последнего шага должны быть galK +, но для того, чтобы избавиться от любых galK - загрязнители, важно получить одно, ярко-розовых колоний прежде чем приступить ко второму шагу. GalK - колонии будет белый / бесцветный и бактерий galK + будет ярко-красным / розовым из-за изменения рН в результате брожения галактозы после инкубации в течение ночи при температуре 32 ° C.
- Выберите одну колонию и привить 5 мл LB + хлорамфеникол ночной культуры для роста при 32 ° C.
- Подтвердите вставку гена galK в нужном месте с помощью ПЦР с использованием фланговых олигонуклеотидов. Добавить 0,5 мкл культуры стандартной реакции ПЦР и увеличить первоначальный 95 ° C инкубации до 5 минут, чтобы лизировать бактерии. ПЦР-продукт должен быть upshifted в размере из-за наличия гена galK.
- Подготовка глицерина акции для хранения.
IV. Замена galK с тегом Последовательности по Recombineering
На этой стадии ген galK заменяется необходимый тег последовательности и правильно изменение fosmids выбраны для отбора против генной galK от токсичных галактозы аналогового deoxygalactose (DOG) (рис. 2В).
- Подготовка MOPS минимальным пластин среду, содержащую 0,2% deoxygalactose (DOG) и 0,2% глицерина. MOPS минимальные средства массовой информации можно получить Teknova Inc (Hollister, Калифорния) (каталог # M2106), но не используют включены глюкозы.
MOPS минимальных средах с 0,2% СОБАКА и глицерин (1 л)
Автоклав 15 грамм агара в 860 мл воды
Остудить до 55 ° С и добавить:100 мл 10X MOPS минимальных средах 5 мл 0,2 мг / мл D-биотин (стерильной фильтрации) 4,5 мл 10 мг / мл L-лейцин (1%, с подогревом, затем охлаждается и стерильной фильтрации) 10 мл 20% deoxygalactose (стерильной фильтрации) 10 мл 20% глицерина (автоклавного) 1 мл 12,5 мг / мл хлорамфеникола в этаноле 2,55 мл 20% NH 4 Cl 10 мл 0,132 М двухосновный фосфат калия - ПЦР усиливают теги фрагменты из pMOD4 GFP, pBS1761 (N перспективе TAP), или pBS1479 (C-термина TAP) с использованием тех же олигонуклеотидов, используемых в первом туре или с помощью коротких GFP или TAP конкретных олигонуклеотидов (внутренний последовательности в шаге 1,2 ). Если вы делаете несколько конструкций, что особенно полезно использовать короткие олигонуклеотиды как же продукта ПЦР может быть использована для всех конструкций.
- Гель очищают продукт ПЦР и измерить концентрацию с помощью геля или спектрофотометрии.
- Генерация индуцированного и uninduced компетентных SW106 проведения fosmid с геном galK вставлены следующие шаги 3.4-3.13 выше.
- Electroporate индуцированных и uninduced SW106 клеток с ~ 100 нг продукта ПЦР с использованием 0,1 см кювет разрыв в Эппендорф 2510 electroporator установлен в 1350 вольт.
- Восстановить в 1 мл LB в 14 мл оснастки колпачок трубки и инкубировать в 32 ° C шейкере в течение 4,5 часов.
- Вымойте и разбавленных бактерии, с шагом 3.16 и 3.17. Пластина бактерий на MOPS минимальным пластин среду, содержащую 0,2% 2-дезокси-галактозы (DOG) и 0,2% глицерина.
- Инкубировать при 32 ° С в течение трех дней.
- Четыре колонии используются, чтобы сделать 5 млночь культур в Л.Б. с 12,5 мкг / мл хлорамфеникола. Они используются для колонии PCR, что и выше, чтобы подтвердить, что кассета была вставлена. Мы используем оба короче GFP / TAP конкретных олигонуклеотидов и фланговые олигонуклеотидов, чтобы продемонстрировать право вставлять и правильный сайт. GFP составляет ~ 800 б.п. и TAP составляет ~ 550 б.п., тогда как galK составляет 1,4 кб.
- Подготовка глицерина акций.
В. Добавление UNC-119 гена CRE-loxP Рекомбинация
Распространенных способов получения трансгенных животных с модифицированными fosmids через использование biolistic бомбардировки. Эта техника использует ДНК-частицы, покрытые золотом ввести fosmid ДНК в C. Элеганс. Трансгенные животные как правило, выявляются через спасение UNC-119 мутант с UNC-119 трансгена. На этом этапе, UNC-119 гена добавляется fosmid позвоночник в СНГ по CRE-loxP рекомбинации с pLoxP UNC-119 плазмиды (рис. 2С).
- Подготовка компетентных SW106 бактерионосительства изменение fosmid с шагом 4,9 используя шаги 2.5-2.9. НЕ вызывать на 42 ° C.
- Electroporate с 50 нг. pLoxP UNC-119 с мини-приготовительные помощью 0,1 см кювет разрыв в Эппендорф 2510 electroporator установлен в 1350 вольт.
- Восстановление бактерий в LB, содержащей 0,1% арабинозы течение 1 часа при 32 ° C.
- Пластина аликвот на LB пластинах содержащих 50μg/mL ампициллин и 12,5 мкг / мл хлорамфеникола. Инкубировать при 32 ° С в течение ночи. , который выбирает для интеграции pLoxP UNC-119 в fosmid.
- Расти ночной культуры в LB содержащие 50μg/mL ампициллин и 12,5 мкг / мл хлорамфеникола. Используйте 0,5 мкл для ПЦР проверить наличие UNC-119 гена с UNC-119 F (5'-CAAATCCGTGACCTCGACAC-3 ') и UNC-119 R (5'-CACAGTTGTTTCTCGAATTTGG-3') олигонуклеотидов (табл. 1).
- Сделайте запас глицерина окончательного fosmid.
VI. Большой Подготовка Fosmid шкале
Для облегчения получения больших количеств ДНК fosmid необходимые для бомбардировки, в этом шаге fosmid передается EPI300 бактерий. Этот штамм имеет способность увеличивать fosmid числа копий для повышения урожайности в течение препарата ДНК.
- Расти 5 мл ночной культуры бактерий с шага 5.5 в LB, содержащей ампициллин и хлорамфеникол на 32 ° C. Используйте Эпицентр fosmid приготовительные комплект для изоляции fosmid от 1,5 мл культуры.
- Electroporate ~ 50 нг в EPI300 бактерий с помощью 0,1 см кювет разрыв в Эппендорф 2510 electroporator установлен в 1350 вольт. EPI300 бактерии могут быть приобретены у Биотехнологии Эпицентр (Мэдисон, Висконсин).
- Восстановление бактерий в LB в течение 1 часа при температуре 37 ° C. Пластина аликвот на LB агар, содержащий 50 мкг / мл и 12,5 мкг / мл хлорамфеникола.
- Расти и вызывают бактерии EPI300 содержащие модифицированный fosmid помощью входящего в комплект инструкций. 50 мл индуцированной культуры даст> 10 мкг очищенного fosmid ДНК. Purify fosmid с Эпицентр fosmid приготовительные комплект.
VII. Бомбардировка
- Использование 10 мкг. из fosmid ДНК, чтобы бомбардировать DP38 червь напряжение, как описано (Д. Hochbaum, А. Фергюсон, А. Фишер, Юпитера, в печати).
VIII. Представитель Результаты
Модификация fosmids через recombineering надежный и процент успеха> 90% в отрицательном шаге Выбор обычно наблюдается 2. Этот протокол также занимает ~ 2 недель, что делает подготовку трансгенов довольно быстро. Протокол также был судим других лабораторий с успехом 20.
| Oligo | Последовательность |
| С перспективе TAP F | ATGGAAAAGAGAAGATGGAAAAAG |
| С перспективе TAP R | GGTTGACTTCCCCGC |
| ФЛАГ-GFP F | ATGGATTACAAGGACGATGACGATAAGATGAG |
| ФЛАГ-GFP R | CAAAGCTTGTGGGCTTTTGTATAG |
| N перспективе TAP F | ATGGCAGGCCTTGCGC |
| N перспективе TAP R | AAGTGCCCCGGAGGATGAGATTTTCT |
| galK F | CCTGTTGACAATTAATCATCGGCA |
| galK R | TCAGCACTGTCCTGCTCCT |
| UNC-119 F | CAAATCCGTGACCTCGACAC |
| UNC-119 R | CACAGTTGTTTCTCGAATTTGG |
Таблица 1. Олигонуклеотиды используются для ПЦР.
| Плазмиды | Источник | Свободное место на |
| Fosmid клон | Geneservice ООО | Geneservice |
| pGalK | 15 | NCI-Фредерик |
| pMOD4-RT-G | 2 | Addgene |
| pMOD4-galK-G | ||
| pMOD4-galK-GT | ||
| pLoxP-UNC-119 | ||
| pMOD4-GFP | ||
| Бактерии | ||
| SW106 | 15 | NCI-Фредерик |
| EPI300 | Эпицентр Биотехнологии | Эпицентр |
| EC100D пир-116 | ||
Таблица 2. Процедить и вектор доступности.
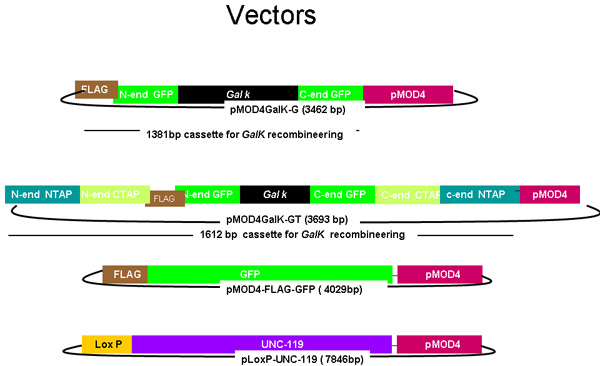
Рисунок 1.
Схема pMOD4-galK-G, и pMOD4-galK-GT, pMOD4 GFP, pLoxP-UNC-119
PMOD4-galk-G плазмид состоит из кассеты galK (черный) окружении 50 нуклеотидных регионах идентична 5 'и 3' концах ФЛАГ (Brown)-GFP (зеленый), а PMOD 4-galK-GT состоит из galK Кассета окружении как ФЛАГ-GFP гомологии регионах и 50 нуклеотидных регионах идентична 5 'и 3' концах N-терминал и С-концевой TAP (синий и оранжевый, соответственно). pMOD4-FLAG-GFP состоит из полного кассету GFP с 5 'теги флаг и pLoxP UNC-119 состоит из UNC-119 геномной последовательности (фиолетовый) в плазмиды, содержащей loxP сайта. Все плазмиды использовать R6K основе pMOD4 (красный) основу, которая не может размножаться в SW106.
Рисунок 2.
Обзор процесса recombineering galK
Рисунок 2А-2С Отдельные цифры, показывающие шаги и времени, необходимого для использования recombineering galK кассету. Это те же самые цифры, которые были объединены на рисунке 2-й, но при условии, отдельно для ясности и легкости чтения. Fosmid интерес сначала изменить в два этапа с участием вставки galK кассету окружении 50 б.п. регионов гомологии с FLAG-GFP или TAP (рис. 2А), а затем замена этой кассеты ФЛАГ-GFP или TAP ( Рисунок 2B). Позже UNC-119 маркер для использования при создании трансгенных животных, вставляется в LoxP сайта на fosmid позвоночник (рис. 2С).
Рис 2D показывает, объединены фигурой процедуры recombineering galK.
План galK recombineering процедуру, как описано в выше, включая время, необходимое для каждого шага от слияния Рисунок 2А-2С.
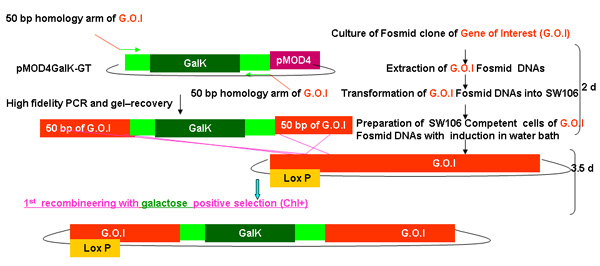
На рисунке 2а. Вставки galk в recombineering galk.
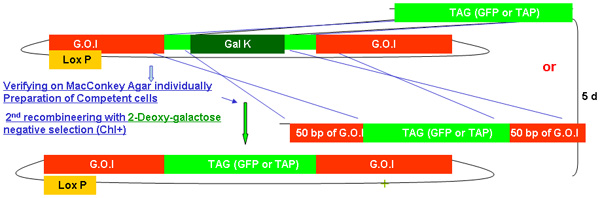
На рисунке 2б. TAG (GFP / TAP) включение в recombineering galk.
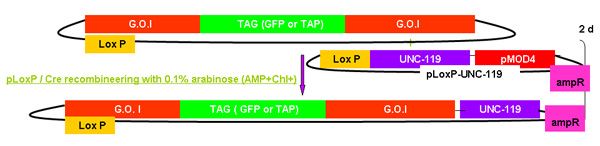
Рис 2в. Добавлением UNC-119.
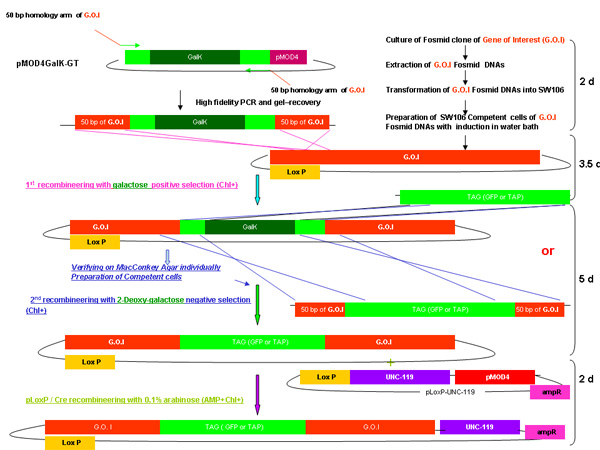
Рисунок 2г. Объединены обзор recombineering galk.
Обсуждение
Поколения трансгенов из fosmids предлагает благо сохраняя все родную стихию промоутер, сращивание вариантов, и 3 'UTR регуляторных элементов. Это может привести к строительству трансгенов которая в большей степени соответствовали родной выражению, или строительство функциональных тран?...
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить Линдси Нэш за помощь в развитии техники. Эта работа финансировалась NIH грант AG028977 для ALF, грант пилотного проекта из Университета Питтсбурга OAIC (AG024827), а также семян средств из Университета Питтсбурга.
Материалы
| Name | Company | Catalog Number | Comments |
| FosmidMAX kit | Epicentre Biotechnologies | FMAX046 | |
| GoTaq | Promega Corp. | M7122 | |
| MOPS Media | TEKnova, Inc. | M2120 | |
| 0.132 M Potassium phosphate solution | TEKnova, Inc. | M2102 | |
| D-galactose | Sigma-Aldrich | G0750 | |
| 2-deoxygalactose | Sigma-Aldrich | D4407 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Leucine | Sigma-Aldrich | L8000 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Phusion DNA polymerase | New England Biolabs | F-530S | |
| MacConkey agar base | BD Biosciences | 281810 | |
| Arabinose | Sigma-Aldrich | A3131 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S5136 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Sodium chloride | Sigma-Aldrich | S5886 | |
| Glycerol | Sigma-Aldrich | G2025 | |
| Bacto Agar | BD Biosciences | 214010 |
Ссылки
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Zhang, Y., Nash, L., Fisher, A. L. A simplified, robust, and streamlined procedure for the production of C. elegans transgenes via recombineering. BMC Dev Biol. 8, 119-119 (2008).
- Antebi, A., Yeh, W. H., Tait, D., Hedgecock, E. M., Riddle, D. L. daf-12 encodes a nuclear receptor that regulates the dauer diapause and developmental age in C. elegans. Genes and Development. 14, 1512-1527 (2000).
- Snow, M. I., Larsen, P. L. Structure and expression of daf-12: a nuclear hormone receptor with three isoforms that are involved in development and aging in Caenorhabditis elegans. Biochim. Biophys. Acta. 1494, 104-116 (2000).
- Fisher, A. L., Page, K. E., Lithgow, G. J., Nash, L. The Caenorhabditis elegans K10C2.4 Gene Encodes a Member of the Fumarylacetoacetate Hydrolase Family. A CAENORHABDITIS ELEGANS MODEL OF TYPE I TYROSINEMIA. J Biol.Chem. 283, 9127-9135 (2008).
- Wightman, B., Ha, I., Ruvkun, G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 75, 855-862 (1993).
- Lehrbach, N. J. LIN-28 and the poly(U) polymerase PUP-2 regulate let-7 microRNA processing in Caenorhabditis elegans. Nat Struct Mol Biol. 16, 1016-1020 (2009).
- Tursun, B., Cochella, L., Carrera, I., Hobert, O. A toolkit and robust pipeline for the generation of fosmid-based reporter genes in C. elegans. PLoS One. 4, e4625-e4625 (2009).
- Bamps, S., Hope, I. A. Large-scale gene expression pattern analysis, in situ, in Caenorhabditis elegans. Brief. Funct. Genomic. Proteomic. , (2008).
- Dolphin, C. T., Hope, I. A. Caenorhabditis elegans reporter fusion genes generated by seamless modification of large genomic DNA clones. Nucleic Acids Res. 34, e72-e72 (2006).
- Sarov, M. A recombineering pipeline for functional genomics applied to Caenorhabditis elegans. Nat. Methods. 3, 839-844 (2006).
- Yang, X. W., Model, P., Heintz, N. Homologous recombination based modification in Escherichia coli and germline transmission in transgenic mice of a bacterial artificial chromosome. Nat Biotechnol. 15, 859-865 (1997).
- Court, D. L., Sawitzke, J. A., Thomason, L. C. Genetic engineering using homologous recombination. Annu.Rev.Genet. 36, 361-388 (2002).
- Westenberg, M., Bamps, S., Soedling, H., Hope, I. A., Dolphin, C. T. Escherichia coli MW005: lambda Red-mediated recombineering and copy-number induction of oriV-equipped constructs in a single host. BMC Biotechnol. 10, 27-27 (2010).
- Warming, S., Costantino, N., Court, D. L., Jenkins, N. A., Copeland, N. G. Simple and highly efficient BAC recombineering using galK selection. Nucleic Acids Res. 33, e36-e36 (2005).
- Penfold, R. J., Pemberton, J. M. An improved suicide vector for construction of chromosomal insertion mutations in bacteria. Gene. 118, 145-146 (1992).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157, 1217-1226 (2001).
- Puig, O. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat.Biotechnol. 17, 1030-1032 (1999).
- Achilleos, A., Wehman, A. M., Nance, J. PAR-3 mediates the initial clustering and apical localization of junction and polarity proteins during C. elegans intestinal epithelial cell polarization. Development. 137, 1833-1842 (2010).
- Maduro, M., Pilgrim, D. Identification and cloning of unc-119, a gene expressed in the Caenorhabditis elegans nervous system. Genetics. 141, 977-988 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены