Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Секвенирование бактериальной микрофлоры в периферической крови: Наш опыт работы с ВИЧ-инфицированных пациентов
В этой статье
Резюме
Наш эксперимент покажет, как выполнить последовательность анализа видов бактерий translocating в периферической крови ВИЧ-инфицированных пациентов.
Аннотация
Здоровый желудочно-кишечного тракта является физиологически колонизирована большое разнообразие комменсальной микробов, которые влияют на развитие гуморального и клеточного иммунного 1,2 слизистой системы.
Микробиоты защищена от иммунной системы с помощью сильного слизистый барьер. Инфекции и антибиотики, как известно, изменить как в нормальном, желудочно-кишечного тракта и барьер состав резидентов бактерий, которые могут привести к возможной иммунных нарушений 3.
ВИЧ вызывает нарушения в желудочно-кишечный барьер с прогрессивной провал иммунитет слизистой оболочки и утечки в системный кровоток бактериальных биопродуктов, таких как липополисахарида и бактериальных фрагментов ДНК, которые способствуют системной активации иммунной 4-7. Микробная транслокация замешана в борьбе с ВИЧ / СПИДом иммунопатогенеза и реакции на лечение 4,8.
Мы стремились, чтобы характеризовать состав бактерий translocating в периферической крови ВИЧ-инфицированных пациентов. Для осуществления нашей цели мы создали для реакции ПЦР для panbacteric 16S ribosomial генов последующим секвенирования.
Короче говоря, цельная кровь с обеих ВИЧ-инфицированных и здоровых людей используется. Учитывая, что здоровых людей настоящее нормальной кишечной гомеостаза не транслокация микрофлоры, как ожидается, у этих пациентов. После целого сбора крови из вены и плазмы разделение, ДНК, извлеченных из плазмы и используется для выполнения широкого спектра ПЦР-реакции panbacteric 16S ribosomial ген 9. После очистки продукт ПЦР, клонирования и секвенирования анализы выполняются.
протокол
Обработка ВИЧ-инфицированных образцов крови требует некоторых важных рекомендаций.
Все образцы крови должны перевозиться в надежных герметичных контейнерах. Необходимо соблюдать осторожность при сборе образцов, чтобы избежать загрязнения внешней контейнера и любых сопровождающих документов образца.
Все лица, обработки зараженной кровью, должны носить перчатки. Перчатки должны быть изменены и руки мыть после завершения обработки образцов.
Обработка ВИЧ-инфицированных образцов крови должно быть сделано в классе II капот кабинет биологической опасности.
Механические пипетки средства должны быть использованы.
Использование игл и других острых инструментов (в том числе, например, стеклянные пипетки или капиллярной трубки) должно быть ограничено ситуациями, в которых нет альтернативы.
Лаборатория поверхности должны быть обеззаражены дезинфицирующим раствором химического после разлива крови и при работе мероприятия будут завершены.
Загрязненная используемые материалы должны быть обеззаражены перед повторным использованием или должны быть уничтожены с помощью правильного клинического маршрут отходов.
Каждый случай профессионального контакта с потенциально инфицированными кровью или жидкостями (т.е. тех, которые требуют универсальных мер предосторожности) следует рассматривать в качестве неотложной медицинской помощи, как мероприятия должны быть начаты незамедлительно быть эффективным.
Протокол требует 5 дней для его завершения. Таймфрейма, изображенной на рисунке 1.
Бактериальные виды идентифицируются с помощью методов, описанных на рисунке 2.
1. Забора проб
- 9 мл цельной крови втягивается в ЭДТА содержащие труб.
- Трубы центрифугировали при 2000 оборотов в минуту в течение 10 минут при комнатной температуре для получения плазмы.
- Плазма собирается в стерильный 2 мл Eppendorf-трубку.
2. Экстракции ДНК из плазмы крови
- Адекватно дезинфекции капот, пипетки и материалы, необходимые для эксперимента, чтобы гарантировать стерильность.
- Установите все материалы под ультрафиолетовых ламп в течение 30 минут.
- Протрите перчатки с дезинфицирующим средством.
- Замочите несколько бумажных полотенец в этаноле и поставить их под капотом. Каждый раз, когда кончик отбрасывается протрите пипетки на мокрой бумажные полотенца.
ДНК извлекали с помощью коммерческого набора следующими инструкциями изготовителя (Easy-DNA Kit, Invitrogen, Карлсбад Калифорния, США).
- 350 мкл плазмы помещают в стерильную пробирку 2 мл Эппендорф.
- 350 мкл с фильтром сверхчистой воды используются в качестве отрицательного контроля.
- Добавьте 10 мкл лизоцима (1mg/ml) для образцов.
- Инкубировать 30 минут при 37 ° C.
- Добавить 500 мкл Лизис решения и осторожно смешать с образцами.
- Инкубируйте в течение 7 минут при температуре 65 ° C.
- Добавить 900 мкл хлороформа в образцах.
- Vortex энергично, пока образцы равномерно вязкой.
- Добавьте 200 мкл раствора осадков и вихревые энергично.
- Центрифуга образцов при 10500 оборотов в минуту в течение 10 минут при комнатной температуре для разделения фаз и образуют интерфейс.
- Передача верхней водной фазы в новую пробирку микроцентрифужных, содержащей 1 мл этанола 100%.
- Центрифуга образцов при 10500 оборотов в минуту в течение 10 минут при 4 ° C.
- Удалить этанола.
- Добавить 1 мл этилового спирта 70%.
- Центрифуга образцов при максимальной скорости в течение 10 минут при 4 ° C.
- Удалить этанола. Остаточного этанола должна быть удалена с pipettator.
- Ресуспендируют гранул в 50 мкл воды высокой степени очистки.
- Прочитано концентрации ДНК с помощью спектрофотометра.
3. 16S рРНК генов ПЦР
ПЦР-амплификации проводят, как описано выше 9.
- Amplify ДНК в 100 мкл реакционной смеси, состоящей из 10 мкл 10х буфера ПЦР, 5 мкл 25 мМ MgCl2, 5 мкл 2 мМ общего дНТФ, 1 мкл 50 мкМ грунтовки RW01 (AACTGGAGGAAGGTGGGGAT), 1 мкл 50 мкМ грунтовки DG74 (AGGAGGTGATCCAACCGCA), 34 мкл H20 и 0,5 мкл Taq-полимеразы (AmpliTaq Золото, прикладной Biosystem, Фостер Сити, Калифорния, США).
- Передача ПЦР смеси в фильтры, чтобы избежать возможного заражения бактериальными полимеразы Taq.
- Центрифуга фильтры (микроконтроллер, Millipore, Billerica, Массачусетс, США) в течение 30 минут при 500 RCF при 4 ° C.
- Аликвотировать смесь ПЦР в зависимости от количества проб, которые должны быть усилены (положительный и отрицательный ПЦР-контроль, образцы и экстрагируют водой).
- Используйте следующие тепловые условия циклер: 94 ° С в течение 10 минут, 40 раз в течение 1 минуты каждый раз при 94 ° С, 55 ° C и 72 ° С и 10 мин при 72 ° C.
- Визуализация продукта ПЦР на 2% агарозном геле. Используйте 100 б.п. ДНК лестнице. ПЦР-продукта размером около 360 б.п. (рис. 3).
4. ПЦР продукт очистки
Только ПЦР-положительных образцов должны быть очищены. Очистка производится с помощьюкоммерческим производителем следующий набор инструкций (PureLink ПЦР microkit, Invitrogen, Карлсбад Калифорния, США).
- Добавить 4 тома Привязка буфер, содержащий изопропиловый спирт на 1 объем продукта ПЦР.
- Передача продукта ПЦР Связующее Буфер колонки.
- Центрифуга в течение 1 минуты при 10000 RCF при комнатной температуре.
- Промыть колонку с промывочного буфера, содержащих этанол.
- Центрифуга в течение 1 минуты при 10000 RCF при комнатной температуре.
- Центрифуга с максимальной скоростью в течение 1 минуты при комнатной температуре в сухом кремнезема мембраны и удалить остатки промывочного буфера с этанолом.
- Добавьте 10 мкл воды высокой степени очистки.
- Инкубируйте в течение 1 минуты при комнатной температуре.
- Центрифуга на максимальной скорости в течение 2 минут при комнатной температуре для сбора очищенной ДНК.
5. Клонирование
Лизогении Отвар (LB) пластина подготовка
- Растворить 25 г смеси в LB примерно 800 мл воды.
- Довести до конечного объема 1 л
- Добавьте 15 г Bactoagar.
- Автоклав на 20 минут.
- После автоклавирования, энергично водоворот раствор в колбе смешать расплавленный агар.
- Охладите раствор до 50 ° C.
- Добавить ампициллин (50 мкг / мл) и водоворот, пока он не растворится.
- Налейте пластины на глубину около 3 мм.
- Оставьте пластин при комнатной температуре.
- Распространение X-Gal (40mg/ml) и IPTG (100 мм) на каждой пластине LB и инкубировать при 37 ° С до готовности к использованию.
Компетентные Преобразование Клетки
Преобразование производится с помощью инструкции коммерческим производителем следующий комплект (Topo Т. А. Клонирование комплект, Invitrogen, Карлсбад Калифорния, США).
- Подготовьте смесь клонирования реакции (1-4 мкл свежий продукт ПЦР, 1 мкл раствора соли, 1 мкл вектора и воды, если это необходимо).
- Смешайте реакции мягко и инкубировать в течение 5-10 минут при комнатной температуре.
- Место реакции на льду.
- Добавьте 2 мкл клонирования реакции в пузырек компетентных клеток и аккуратно перемешать.
- Инкубировать на льду в течение 30 минут.
- Тепло-шок клетки в течение 30 секунд при температуре 42 ° C.
- Сразу передачи трубки в лед.
- Добавьте 250 мкл среды.
- Крышка трубки tighly и встряхните пробирку горизонтально при температуре 37 ° С в течение 1 часа.
- Спред 50 мкл из каждого преобразования на нагретого селективного пластины.
- Выдержите в течение ночи при температуре 37 ° C.
После инкубации, белый и синий колонии развиваться по тарелкам. Белый колонии являются позитивными для вставки продуктов ПЦР и синие колонии отрицательным для вставки продуктов ПЦР.
6. Последовательность анализа
Последовательность реакций
- Смеси производится с использованием этих реагентов: 2,5 мкл ДНК, 1 мкл праймера (5pmol / мкл) 1,1 мкл BigDye (Applied Biosystem, Фостер Сити, Калифорния, США).
- Температурные условия циклер: 96 ° С в течение 1 минуты, 25 раз за 96 ° С в течение 10 сек, 55 ° С в течение 15 сек и 60 ° С в течение 4 мин.
Колонка очистки
- Для каждой реакции, подготовить один MicroSpin Колонка (Qiagen,, Милан, Италия).
- Обратить колонки и вихревые смешать смолу.
- Привязка от нижней части колонны, ослабьте крышку ¼ оборота, и место в колонке микроцентрифужных трубки.
- Центрифуга 3200 оборотов в минуту в течение 1 минуты.
- Передача колонку в чистую пробирку микроцентрифужных.
- Тщательно пипетки всей последовательности ПЦР-реакции в центре колонны.
- Центрифуга 3200 оборотов в минуту в течение 1 минуты.
- Очищенная ДНК eluite в трубку (20 мкл воды высокой степени очистки).
Последовательность анализа
- Нагрузка очищенного образца (20 мкл) в 96-многоямного пластины.
- Нагрузка пластинки в секвенсор. Автоматизированная Секвенсоры ДНК генерировать с четырьмя цветами хроматограмме, показывающей результаты секвенирования перспективе.
- Входной нуклеотидную последовательность, запрос к общедоступные базы данных последовательности. Поиск осуществляется по NCBI баз данных и серверов, с базовой инструмент местной Поиск Выравнивание (BLAST).
- Рассмотрим только бактерии с 98-100% гомологии.
7. Представитель Результаты
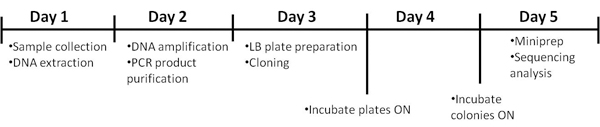
Рисунок 1. Хронология процедуры.
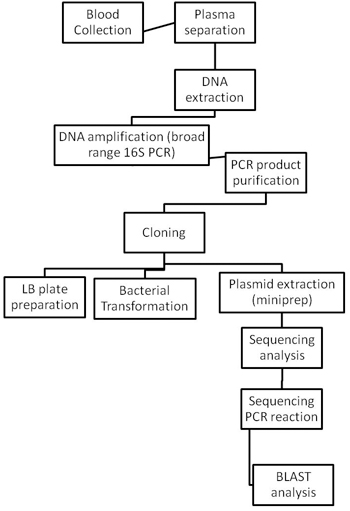
Рисунок 2. Технологические схемы всей бактериальной процедуру идентификации.
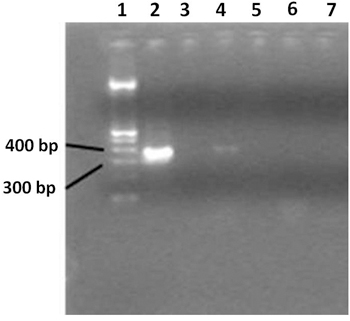
Рисунок 3. 2% агарозном геле показывает широкий спектр гена 16S рРНК продуктов ПЦР. Лейн 1 содержит 100bp лестницу ДНК, переулок 2 содержит ПЦР положительный контроль, переулок 3 показывает отрицательный контроль ПЦР. Лейн 4 показаны образцы из ВИЧ-позитивных пациентов, и переулок 5 содержит воду. Лейн 6 шРМО образцы из здорового человека и негативной реакции ПЦР, переулок 7 содержит воду. Только ВИЧ-положительных пациентов показывает положительный ПЦР. Сверхчистой воды, используемой в качестве отрицательного контроля в процессе добычи шаг, указывает, что загрязнение произошло.
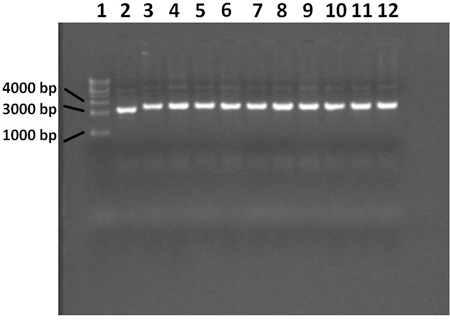
Рисунок 4. 0,7% агарозном геле показывает плазмиды экстрагируют процедуры miniprep. Лейн 1 содержит 1 Kilobase ДНК лестнице, переулок 2 содержит синий колонии контроль, переулков с 3 по 12 содержат белые колонии. Плазмиды из синего колонии не содержит ПЦР вставить продукта. Все 10 белых колоний содержат плазмиду с правильной вставки.

Рисунок 5. Показывает пример бактериального анализа последовательности в плазме крови от одного ВИЧ-позитивным человеком. Наши результаты показывают, что микробная транслокация в ВИЧ-инфекции включает в себя polimicrobic флоры, которая не видела у ВИЧ-отрицательных субъектов, предлагая существенные неудачи кишечника иммунитет в борьбе с бактериями транслокации.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Настоящим шоу ПЦР / последовательности протокола, чтобы охарактеризовать транслокации бактерий в периферической крови ВИЧ-инфицированных лиц.
Самые надежные результаты получаются при использовании плазмы, взятой в ЭДТА-содержащие труб. После забора крови, плазмы ...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Мы благодарны Джанни Scimone за отличную помощь с видео-решений.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
|---|---|---|---|
| Исти-DNA Kit | Invitrogen | К 180001 | |
| Хлороформ | Sigma-Aldrich | C2432 | |
| Этанол | Sigma-Aldrich | E7203 | |
| Сверхчистых Waer | Invitrogen | 10977049 | |
| Лизоцим | Fluka | 62970 | 10 мкг / мл в дистиллированной воде |
| AmpliTaq золото | Прикладные Biosystem | 26478701 | |
| Микроконтроллер 100 | Millipore | 42413 | |
| ПЦР праймеры | Invitrogen | ||
| Агароза | Эппендорф | C1343 | |
| ДНК лестницы | Invitrogen | 15628019 | |
| Purelink ПЦР микро комплект | Invitrogen | K310050 | |
| LB агар, порошок | Invitrogen | 22700025 | |
| Bactoagar | Invitrogen | ||
| Ампициллин | Invitrogen | 11593027 | 10 мг / мл в дистиллированной воде |
| X-гал | Invitrogen | 15520034 | 40mg/mL в ДМФА |
| IPTG | Invitrogen | 15529019 | 100mM в дистиллированной воде |
| Topo Т. А. Клонирование комплект | Invitrogen | K450002 | |
| Purelink Быстрый набор плазмид Miniprep | Invitrogen | K210010 | |
| Большой красителя | Прикладные Biosystem | 4337455 | |
| DyeEx 2,0 спина комплект | Qiagen | 63204 |
Ссылки
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat Rev Immunol. 10, 159-169 (2010).
- Macpherson, A. J., Harris, N. L. Interactions between commensal intestinal bacteria and the immune system. Nat Rev Immunol. 4, 478-485 (2004).
- Kanauchi, O., Mitsuyama, K., Araki, Y., Andoh, A. Modification of intestinal flora in the treatment of inflammatory bowel disease. Curr Pharm Des. 9, 333-346 (2003).
- Brenchley, J. M. Microbial translocation is a cause of systemic immune activation in chronic HIV infection. Nat Med. 12, 1365-1371 (2006).
- Brenchley, J. M., Price, D. A., Douek, D. C. HIV disease: fallout from a mucosal catastrophe. Nat Immunol. 7, 235-239 (2006).
- Jiang, W. Plasma levels of bacterial DNA correlate with immune activation and the magnitude of immune restoration in persons with antiretroviral-treated HIV infection. J Infect Dis. 199, 1177-1185 (2009).
- Marchetti, G. Microbial translocation is associated with sustained failure in CD4+ T-cell reconstitution in HIV-infected patients on long-term highly active antiretroviral therapy. AIDS. 22, 2035-2038 (2008).
- Marchetti, G. Role of Microbial Translocation and Immune Hyperactivation in Disease Progression of HIV+ Patients with Preserved CD4 Count in the Absence of ART. The 17th Conference on Reteroviruses and Opportunistic Infections (CROI), San Francisco, CA, USA, , (2010).
- Greisen, K., Loeffelholz, M., Purohit, A., Leong, D. PCR primers and probes for the 16S rRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid. J Clin Microbiol. 32, 335-351 (1994).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены