Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бромдезоксиуридин (BrdU) Маркировка и последующих флуоресценции Активированный сотовый Сортировка по культуре независимой Определение растворенного органического углерода, разрушающих бактериопланктона
В этой статье
Резюме
Экологические бактериопланктона инкубируют с моделью растворенного органического углерода (DOC) соединения и реагента ДНК маркировки, бромдезоксиуридин (BrdU). Потом, DOC-унижающие клетки отделяются от основной массы сообщества, основанного на поднятом включения BrdU с помощью флуоресцентной активированный сортировки клеток (FACS). Эти клетки затем определили последующими молекулярного анализа.
Аннотация
Микробы являются основными агентами посредническую деградации многочисленных растворенного органического углерода (DOC) субстратов в водной среде. Тем не менее, выявление бактериальных таксонов, которые преобразуют конкретных пулов DOC в природе представляет собой сложную техническую задачу.
Здесь мы опишем подход, что пары бромдезоксиуридин (BrdU) регистрации, флуоресценции активирован сортировки клеток (FACS) и 16S рРНК генов основе молекулярного анализа, который позволяет культуры независимой идентификационной бактериопланктона, способных разлагать конкретного соединения DOC в водной среде. Микрокосмы Triplicate бактериопланктона настроены получить как BrdU и соединения модели DOC (DOC изменениями и дополнениями), или только BrdU (без того контроля). BrdU заменителей позиции тимидина во вновь синтезированной ДНК бактерий и BrdU-меченых ДНК могут быть легко immunodetected 1,2. Через 24-часовая инкубация, бактериопланктона, которые способны использовать добавил соединения DOC как ожидается, будут выборочно активирован, и, следовательно, имеют более высокие уровни включения BrdU (HI клеток), чем не отвечающих клеток в поправках DOC и клеток в не- Помимо контроля (низкое включение BrdU клетки, Л. И. клетки). После флуоресценции иммунодетекции, HI клетки отличаются и физически отделены от клетки Л. И. флуоресцентной активированный сортировки ячейки (FACS) 3. Сортировать DOC проблематику клеток (HI клеток) извлекаются для ДНК и таксономически, выявленных в ходе последующего гена 16S рРНК основе анализа, включая ПЦР, клонирование строительство библиотеки и последовательности.
протокол
1. Обработка пробы воды
- Фильтры 10L экологические воды через 1 мкм порами размером мембранных фильтров для удаления крупных частиц и bacteriovores. Сбор воды фильтрата в бутыль.
- Передача 36 мл фильтрата каждый на 3 стерильные пробирки Эппендорф (50 мл), содержащего 4 мл свежеприготовленного параформальдегида решение (PFA; 10%). Инкубируйте в течение 2 часов при комнатной температуре сохранить клетки. Сбор клеток на 0,22 мкм пор по размерам белого мембранных фильтров вакуумной фильтрации. Мыть фильтры, передав 10 мл фосфатно-солевом буфере (PBS) через фильтр вакуумной фильтрации. Этикетка фильтров, как отрицательный контроль и хранить их при температуре -20 ° C.
Шаги 1.3-1.4 не являются обязательными для установления DOC-ограниченных условиях.
- Добавить смесь из неорганического азота и фосфора (5 мкМ NH 4 Cl, 5 мкМ NaNO 3 и 1 мкм NaH 2 PO 4 конечная концентрация) в бутыль.
- Инкубировать в темноте при температуре на месте в течение 48 часов с редкими волнения.
2. Создание микрокосма и инкубации
- Заполните каждой из шести 1-L стеклянные 800 мл пробы воды из бутыли с шагом от 1,4 до создания микрокосм. Добавить BrdU (10 мкМ, конечная концентрация) для каждого микрокосма. Хорошо перемешайте.
- Добавить 1 мл модели DOC сложный раствор в три микрокосм, то они будут служить в качестве поправок DOC. Добавьте 1 мл стерильной PBS в трех оставшихся микрокосм, то они будут служить не-того контроля.
- Инкубируйте все микрокосм в инкубаторе шейкере и инкубировать в темноте при температуре на месте при встряхивании при 100 оборотах в минуту.
- Сбор 36 мл пробы воды из каждого микрокосма и передачи в 50 мл стерильные пробирки Эппендорф в моменты времени 0, 8, 16 и 24 часов. Сразу же добавить 4 мл свежей PFA (10%) до коллекции трубок и инкубировать в течение 2 часов при комнатной температуре, чтобы сохранить клетки.
- Фильтры сохранились клетки через 0,22 мкм пор по размерам фильтры поликарбонатные мембраны. Мыть фильтры с 10 мл PBS. Немедленно приступить к следующему шагу или магазин фильтров при температуре -20 ° C.
3. Натурные иммунодетекции для включения BrdU
- Оттепель фильтры (DOC поправками образцы, нет, кроме контроля и отрицательный контроль) при комнатной температуре.
- Нанести 1 мл раствора лизоцима [10 мг / мл лизоцима яичного белка в 100 мМ трис, 50 мМ ЭДТА (рН = 8)] 4 для покрытия бактериальных клеток на фильтре. Инкубируйте при комнатной температуре в течение 30 минут. Мыть фильтры, передав 10 мл PBS через него под вакуумом.
- Добавьте 1 мл раствора протеиназы K [2 мг / мл протеиназы К в 100 мМ трис, 50 мМ ЭДТА (рН = 8)] 4 для покрытия бактериальных клеток на фильтре. Инкубируйте при комнатной температуре в течение 30 минут. Мыть фильтры, передав 10 мл PBS через него под вакуумом.
- Добавить 1 мл экзонуклеазная решение [экзонуклеазная III (50 ед / мл) в 5 мМ MgCl 2 и 50 мМ Трис-HCl] 5, для покрытия бактериальных клеток на фильтре. Инкубировать при 37 ° С в течение 30 минут. Мыть фильтры, передав 10 мл PBS через него под вакуумом.
- Соберите кадров печать инкубации камер (Bio-Rad) в соответствии с инструкциями производителя.
- Нарежьте фильтр на восьмые использованием стерильных лезвие на алкоголь очищенную сухую поверхность.
- Использование щипцов, место восьмой части фильтра в один собранный каркас уплотнение камеры инкубации (восемь кадров уплотнение камеры необходимы для каждого фильтра выборки). Стороне фильтра раздел, который содержит клетки должны быть обращены вверх. Влаги в задней части фильтра позволит фильтр придерживаться слайда. Если фильтр становится сухой, применяют капельку (2 мкл) DIH 2 O в центре камеры перед установкой фильтра раздел на слайде.
Шаги 3.8-3.20 использовать реагенты из РОШ В Ситу Kit пролиферации клеток, FLUOS следующие процедуры изменения с инструкциями производителя. Кроме PBS, все реагенты предоставляются в течение комплект.
- Нанесите достаточное количество буфера инкубации (0,5% бычьего сывороточного белка, 0,1% Tween20 в PBS) равномерно покрывают всю секции фильтра в камере инкубации, не вызывая переполнение раз печать применяется.
- Место покрытие полиэстер кадр за кадром камеры инкубации. Надавите, чтобы плотно уплотнение инкубации камеры. Избегайте пузырьков воздуха выше фильтра. Инкубируйте запечатанных камерах в течение 10 мин при комнатной температуре в темноте.
- Удалить полиэстера печать и открытой инкубации камер. (Примечание: открытие камерах иногда будет тянуть до кадра печать со слайда В этом случае, подготовить новую камеру для следующих шагов..)
- Внесите из инкубационного буфера из угла в угол камеры. Избегать контакта с фильтром.
- Промойте фильтр, осторожно пипеткой по 100 мкл PBS в ииз камеры в 3 раза.
- Подготовка анти-BrdU-FLUOS рабочего раствора следующие шаги, рекомендованные производителем непосредственно перед употреблением.
- Внесите 120 мкл анти-BrdU-FLUOS рабочего раствора на фильтр, заботясь, чтобы равномерно покрывают всю поверхность.
- Reseal камеры с новой обложкой полиэстера. Избегайте пузырьков воздуха в верхней части фильтра. Инкубируйте камеры в темное время суток при температуре 37 ° С в течение 3 часов. Этот шаг будет этикетке BrdU включены ДНК на месте с флуоресцеина изотиоцианат (FITC).
- Удалить полиэфирного покрытия и открытой инкубации камеры. Внесите из анти-BrdU-FLUOS рабочего раствора. Промойте фильтр 3 раза PBS.
- Передача фильтр из камеры инкубации стерильной поверхности. Нарежьте фильтр раздел на мелкие части, используя стерильные лезвия.
- Передача фильтр части в 2 мл пробирок микроцентрифужных, каждый из которых содержит 1 мл PBS. Плотно колпачок трубки и печать с парафильмом. Инкубировать при 37 ° С и 200 оборотов в минуту в течение 10 мин.
- Безопасные труб на vortexer и вихря на максимальной скорости в течение 5 минут. Внесите супернатант в стерильных 15 мл трубки Эппендорф. Повторите инкубации и вихревые шаги для еще 5 раз. Комбинат супернатант в том же 15 мл Eppendorf трубки для каждого образца. Как правило, 80% клетки могут быть восстановлены в суспензии.
- Магазин супернатанта с ресуспендировали клетки при 4 ° C. Сортировать течение 2 дней.
4. FACS анализ
Процедура потока BD FACSAria цитометр и соответствующего программного обеспечения описан здесь.
- Оптимизация установки проточного цитометра следующие шаги, рекомендованные производителем. Это влечет за собой: регулировка усиления управления для установки необходимых параметров обрыва и сладкое пятно; оптимизации задержки лазерных и факторы области масштабирования для давления оболочки эксперимента и оптимизации настроек для FSC и SSC напряжения, FSC порог, FSC флуоресценции масштабирование, флуоресценция напряжения ФЭУ и т.д.
- Выполнить отрицательные контрольные образцы на поток цитометр (ТСМ), основанные на интенсивности флуоресценции FITC и боковые рассеяния (SSC). Увеличение FITC порог пока нет клеток в отрицательной управления могут быть визуализированы FITC-SSC приобретение просмотров.
- Выполнить не-присоединения контрольных проб и исследовать характер распределения 10000 клеток на основе FITC и SSC приобретения. Определить ворота приложить все клетки и обозначить их как "с низким клетки интенсивности" (LIS).
- Выполнить DOC-изменены образцы и изучить характер распределения 10000 клеток на основе FITC и SSC. Некоторые клетки появится в заданной ворота LI. Определите другие ворота вложить клетки, которые имеют более высокую интенсивность флуоресценции (HIS), чем Лис. Приобретать статистику, чтобы посмотреть относительное обилие закрытых ячеек.
- Сортировать HI клеток в коллекции пробирки, содержащие 500 мкл PBS в "очистить 1 капля" режиме. Завершить сортировки, если число его достигает 500 тысяч на счету.
5. Фильтры ПЦР-амплификации генов 16S рРНК
Фильтры ПЦР процедуры являются модификациями Kirchman и др. 6.
- Фильтры отсортированных клеток на белых, 0,22 мкм пор по размерам, 25 мм в диаметре, поликарбонат мембранный фильтр. Аккуратный от края фильтра, который не содержит бактериальные клетки, используя стерильные лезвия. Нарежьте фильтр на 8 равных части по размеру.
- Место одного фильтра кусок в трубке реакции ПЦР, с которыми сталкивается клетки внутрь трубки. Добавьте 45 мкл ПЦР-класса воды в трубке реакции ПЦР. Погрузите фильтр полностью в воде.
- Добавьте 2 РОШ иллюстрации PuReTaq чтения To-Go ПЦР бисер в трубку реакции ПЦР, кратко вихря. Добавьте 2 мкл прямом и обратном гена 16S рРНК праймеры (0,4 мкМ конечной концентрации для каждого праймера), например, 27F и 1492R 7, в каждую из труб ПЦР реакции.
- (Дополнительно) Добавить 1 мкл бычьего сывороточного альбумина решение (BSA, конечная концентрация является 30μg/100 мкл) в реакционной смеси ПЦР, чтобы помочь адсорбировать ингибиторы усиления. Если выбрать, чтобы не добавить BSA, добавить 1 мкл воды вместо.
- Выполните ПЦР-амплификации на термоциклер. Приземлиться программы ПЦР рекомендуется, которая температуры отжига последовательно снижается с 62 до 52 ° С на 1 ° C за один цикл в течение 11 циклов, а затем 15 циклов с отжигом температуре 52 ° C. Все циклы включают денатурации (при 95 ° С), отжиг (на 62 до 52 ° С) и расширение (при 72 ° С) этапов продолжительностью 50 лет. Первые 3 мин денатурации и окончательный 10-минутной расширение шаг также включены в программу ПЦР.
- Подтвердите ПЦР-амплификации методом электрофореза на бромистый этидий окрашенных 1% агарозном геле. Акцизный ПЦР ампликонов из геля и чистый с QIAGEN QIAquick комплект добычи геля.
- Выполните два дополнительных ПЦР амплификации для каждого образца, каждый раз использовать новый фильтр раздела. После ПЦР гель purificatiо, бассейн ампликонов того же образца вместе. Очищенная 16S рДНК ампликонов теперь готовы для ряда молекулярных анализов, которые позволяют таксономической идентификации, такие как клон строительство библиотеки и последовательности.
6. Представитель результаты:
Представитель результаты описываются с помощью изучения путресцин, разрушающих бактерий в качестве примера. Пробы воды были собраны из прибрежных сайта Грузии и обрабатываются в соответствии с процедурами, описанных выше. FACS анализ показал, что путресцин того индуцированного развития группы бактерий с высокой интенсивности флуоресценции FITC, что указывает на высокую скорость включения BrdU (рис. 1). Эти клетки были обозначены как высокого BrdU-включение клеток (HIS) и, как ожидается, в основном содержат путресцин, разрушающих бактерий. Его не хватало в не-того контроля, который содержится только клетки с более низкими уровнями включения BrdU (LIS). Лис, как ожидается, в основном содержат бактериопланктона, которые были не в состоянии использовать добавил путресцин. Его были разделены на отдельные трубы, а затем собрали на мембранные фильтры. 16S рРНК ампликонов гена были получены высокие клетки HI с помощью фильтра ПЦР.
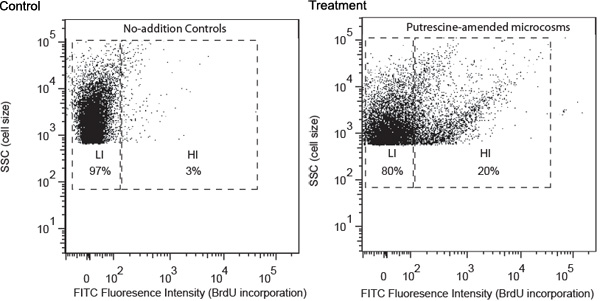
Рисунок 1. Проточной цитометрии не-того контроля и модели составного поправками (путресцин, как например здесь) образцы, собранные после 24 ч инкубации. Анализ распределения клеток было основано на (1) интенсивности флуоресценции FITC маркировки (оси Х), которая имеет положительную связь с уровнем включения BrdU, и (2) стороны рассеяния (SSC, ось у), которая имеет положительную связь с ячейки размер. Ворота обозначений основано на уровень BrdU регистрации, (HI, высокого BrdU-регистрации; Л.И., низким BrdU-регистрации). Относительное содержание HI и Л. И. клетки приведены в соответствующих ворот.
Обсуждение
Наш подход пары BrdU регистрации, FACS и 16S рДНК анализ, чтобы на уровне видов идентификации бактериопланктона, которые усваивают отдельные компоненты DOC в водной среде. Анализ BrdU включения этикетки бактериальных клеток на основе метаболической активности, которая позволяет анализировать...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Финансирование данного проекта была осуществлена Национальным научным фондом OCE1029607 гранты (до XM) и MCB0702125 (для МАМ) и Гордона и Бетти Мур Фонд (по МАМ).
Материалы
| Name | Company | Catalog Number | Comments | |
| Имя | Тип | Компания | Номер в каталоге | Комментарии |
| BrdU | Реагент | Сигма | B5002-5G | |
| Лизоцим | Реагент | Сигма | L6876-5G | |
| Протеиназы K | Реагент | Сигма | P2308-25 мг | |
| В Ситу пролиферации клеток Kit, FLUOS | Комплект | Roche | 11810740001 | Потребляйте больше Anti-BrdU-FLUOS и Инкубационный буфер на реакцию, чем предложенные производителем. |
| Frame-Seal палат Инкубационный | Материал | Bio-Rad | SLF-1201 | |
| Поликарбонат Мембранные фильтры (142-мм в диаметре, 1,0 мкм пор по размерам) | Материал | Millipore | FALP14250 | |
| Поликарбонат Мембранные фильтры (25-мм в диаметре, 0,2 мкм пор по размерам) | Материал | Millipore | FGLP02500 | |
| иллюстрации PuReTaq Ready-To-Go ПЦР бисер | Комплект | GE Healthcare | 27-9559-01 | |
| QIAquick гель добычи комплект | Комплект | QIAGEN | 28704 | |
| FailSafe PCR System | Комплект | ЭПИЦЕНТР | FS99060 |
Ссылки
- Pernthaler, A., Pernthaler, J., Schattenhofer, M., Amann, R. Identification of DNA-synthesizing bacterial cells in coastal North Sea plankton. Appl. Environ. Microbiol. 68, 5728-5728 (2002).
- Urbach, E., Vergin, K. L., Giovannoni, S. J. Immunochemical detection and isolation of DNA from metabolically active bacteria. Appl. Environ. Microbiol. 65, 1207-12 (1999).
- Mou, X. Z., Hodson, R. E., Moran, M. A. Bacterioplankton assemblages transforming dissolved organic compounds in coastal seawater. Environ. Microbiol. 9, 2025-2025 (2007).
- Hodson, R. E., Dustman, W. A., Garg, R. P., Moran, M. A. In situ PCR for visualization of microscale distribution of specific genes and gene products in prokaryotic communities. Appl. Environ. Microbiol. 61, 4074-4074 (1995).
- Dinjens, W. N. Bromodeoxyuridine (BrdU) immunocytochemistry by exonuclease III (Exo III) digestion. Histochemistry. 98, 199-199 (1992).
- Kirchman, D. L., Yu, L. Y., Fuchs, B. M., Amann, R. Structure of bacterial communities in aquatic systems as revealed by filter PCR. Aquat. Microb. Ecol. 26, 13-13 (2001).
- Delong, E. F., Wickham, G. S., Pace, N. R. Phylogenetic stains: ribosomal RNA-based probes for the identification of single cells. Science. 243, 1360-1360 (1989).
- Artursson, V., Jansson, J. K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae. Appl. Environ. Microbiol. 69, 6208-6208 (2003).
- Mou, X. Z. Bacterial carbon processing by generalist species in the coastal ocean. Nature. 451, 708-708 (2008).
- Mou, X. Flow-cytometric cell sorting and subsequent molecular analyses for culture-independent identification of bacterioplankton involved in dimethylsulfoniopropionate transformations. Appl. Environ. Microbiol. 71, 1405-1405 (2005).
- Dean, F. B. Comprehensive human genome amplification using multiple displacement amplification. Proc. Natl. Acad. Sci. U.S.A. 99, 5261-5261 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены