Method Article
Эффективное нуклеиновые кислоты Добыча и 16S рРНК генов Секвенирование для Бактериальные сообщества Характеристика
В этой статье
Резюме
Описывается эффективный, надежный и экономически эффективный способ извлечения нуклеиновой кислоты из мазков для определения характеристик бактериальных сообществ с использованием 16S рРНК гена ампликона секвенирования. Метод позволяет общий подход обработки для нескольких типов проб и вмещает несколько ниже по течению аналитических процессов.
Аннотация
Существует растущая оценка роли микробных сообществ как критические модуляторов для здоровья человека и болезней. технологии секвенирования высокой пропускной способности позволили для быстрого и эффективного определения характеристик бактериальных сообществ с использованием 16S рРНК секвенирование гена из различных источников. Несмотря на то, легко доступные инструменты для анализа последовательностей 16S рРНК имеют стандартных вычислительных рабочих процессов, обработки образцов для экстракции ДНК остается постоянной источник изменчивости в различных исследованиях. Здесь мы опишем эффективный, надежный и экономически эффективный способ извлечения нуклеиновой кислоты из мазков. Мы также разграничить вниз по течению методы 16S рРНК секвенирования генов, в том числе генерации библиотек секвенирования, контроль качества данных и анализа последовательности. Рабочий процесс может работать с несколькими типами образцов, в том числе стула и смывов, собранных из различных анатомических мест и видов хозяев. Кроме того, выделяют ДНК и РНК могут быть разделены и использованыдля других приложений, в том числе весь секвенирование генома или Секвенирование РНК. Описанный метод позволяет общий подход обработки для нескольких типов образцов и вмещает вниз по течению анализ геномной, метагеномной и транскрипционный информации.
Введение
Человек ниже репродуктивного тракта, желудочно - кишечного тракта, дыхательных путей, кожи и заселены сложных бактериальных сообществ , которые имеют решающее значение для поддержания гомеостаза тканей и поддержания здоровья хозяина 1. Например, некоторые лактобактерии создают неблагоприятную среду для патогенных микроорганизмов путем подкисления свода влагалища, производя антимикробных эффекторы и модуляции локального иммунитета хозяина 2-4. Растущее признание важности для бактериальной микробиомом имеет также повышенный интерес к характеризующая бактериальных сообществ во многих клинических ситуациях. Здесь мы опишем метод определения состава бактериальной микробиомом из генитальных мазках. Протокол может быть легко модифицирован для образцов стула и смывов, собранных из других анатомических местах и других видов хозяев.
Из-за ограничений, присущих в количестве образцов, которые могут быть собраны и хранятся от данного шпилькеучастник Y, этот протокол был разработан для извлечения ДНК, РНК , а возможно даже белок из одного тампона с использованием адаптированной фенол-хлороформ на основе бусинка биений метода 5,6. Сочетание физического разрушения бактериальных клеточных стенок с бисерной избиению и химического разрушения с моющими средствами позволяет быстро лизиса грамположительных, грамотрицательных и кислотоустойчивые бактерии без дополнительных ферментативных стадий пищеварения. Для получения высокого качества РНК, рекомендуется использовать сухие тампоны, которые хранились при температуре не ниже 4 ° С сразу после сбора и во время транспортировки в лабораторию (если это применимо), и хранится долгосрочной перспективе, при -80 ° С.
Для определения бактериальной микробиомом в данном образце, эта процедура использует 16S рРНК гена ампликона секвенирования, который в настоящее время является наиболее экономически эффективным средством для комплексного назначить бактериальной таксономии и выполняют относительную количественную оценку. Альтернативные методы включают целевые кПЦР 7, пользовательские microarrAYS 8, и все-секвенирование генома 9. Ген 16S рРНК содержит девять гипервариабельные области, и нет единого мнения относительно оптимального область V, чтобы последовательность для вагинальных исследований микробиомом. При этом мы используем набор праймеров 515F / 806R и построить на трубопроводе , разработанный Caporaso и др. 10-12. Caporaso и др. 'S набор праймеров 515F / 806R позволяет мультиплексирование сотен образцов на один прогон секвенирования из - за наличия тысяч проверенных праймеров и со штрих совместимости с Illumina секвенирования платформ. В отличие от 27F / 338R праймера человеческого микробиомом проекта установлено 13, 515F / 806R также эффективно усиливает Bifidobacteriaceae и , таким образом , точно фиксирует Gardnerella влагалищной, является важным членом вагинального микробного сообщества у некоторых женщин. В качестве альтернативы, пара 338F / 806R праймер был успешно использован для Пиросеквенирование вагинальных образцов 14 и пара 515F / 926R праймер имеет Recently становятся доступными для следующего поколения секвенирования 12.
И, наконец, этот протокол содержит основные инструкции по выполнению анализа 16S ампликона с использованием количественного Исследования в микробной экологии (QIIME) пакета программного обеспечения 15. Успешная реализация команд QIIME, описанных здесь, дает таблицу, содержащую бактериальные таксономические содержаний для каждого образца. Множество дополнительных мер контроля качества, таксономические методы классификации и этапы анализа могут быть включены в анализ, как это подробно описано на веб-сайте QIIME (http://qiime.org/index.html). Если анализ будет выполняться на компьютере Apple, пакет MacQIIME 16 обеспечивает легкую установку QIIME и его зависимостей. Альтернативные пакеты программного обеспечения для анализа последовательностей генов 16S рРНК включают Mothur 17 и UPARSE 18.
протокол
Протокол исследования был одобрен и следовали рекомендациям Исследовательского Комитета по этике биомедицинских Университета Квазулу-Натал (Дурбан, Южная Африка) и Совета по Massachusetts General Hospital Институциональный Review (2012P001812 / MGH; Бостон, штат Массачусетс).
1. Добыча Total нуклеиновой кислоты из цервиковагинальными мазков
Примечание: Выполните экстракцию нуклеиновых кислот в наборах из 16 образцов или меньше. Протокол, как написано ниже предполагается, образцы обрабатываются в наборах 12. При выполнении нескольких раундов извлечений, последовательно пронумеровать партии извлечения и записи экстракции номер партии каждого образца, а также другую информацию об образце (включая метаданные, такие как участника идентификационный номер, возраст , дата / время сбора мазков, гормональных контрацептивов типа, передаваемых половым путем, результаты тестирования инфекции и т.д.) в таблице 1.
- Приготовление реагентов и вытяжкой
- Подготовить буфер, состоящий из 200 мМ хлорида натрия (NaCl), 200 мМ Трис, и 20 мМ этилендиаминтетрауксусная кислота (ЭДТА) в 100 мл нуклеазы без воды. Фильтр-стерилизовать раствор путем пропускания его через фильтр с размером пор 0,22 мкм. Охладить аликвоты 10 мл буферного раствора на влажный лед.
- Доводят рН фенола: хлороформ: изоамиловый спирт (ИУК) (25: 24: 1) до рН 7,9 добавлением 65 мкл Трис-щелочного буфера на 1 мл фенола, встряхивания смеси в течение 2 мин, и оставление две фазы отдельный естественным путем или путем центрифугирования при 10000 х г в течение 5 мин при комнатной температуре.
Внимание: Фенол является токсичным при проглатывании, при вдыхании или при контакте с кожей и глазами. Не вдыхать пары. Надевайте непроницаемые перчатки, защитные очки с боковыми щитками и пальто лаборатории. - Фильтр-стерилизовать 25 мл 20% -ного додецилсульфата натрия (SDS) через фильтр с размером пор 0,22 мкм. Приготовьте 5 мл аликвот стерилизованных SDS.
- Охладить 10 мл аликвоты изопропанола при -20 ° С.
- Приготовьте шарик бьющееся трубки для каждого SWAB подлежащих обработке путем взвешивания 0,3 г стеклянных шариков в стерильный 2 мл трубки, которая подходит для бисерной колотушки.
- Получение тампоны путем отбора проб Ectocervix со стерильным впитывающего тампона. Сразу же после сбора, поместите тампон в пустой и стерильной криопробирку, хранят при температуре 4 ° С в течение от 1 до 4 ч во время транспортировки в лабораторию, и хранить в течение нескольких месяцев при температуре -80 ° C. Передача тампоны (содержащиеся в отдельных трубок), подлежащих обработке на мокром льду.
- Подготовка биологической безопасности (BSC). Использование BSC с "наперсток", соединенный с выхлопной трубы здания, чтобы обеспечить надлежащее удаление летучих химических веществ.
- Удалите все материалы с капюшоном.
- Очистите все поверхности капота с отбеливателем, а затем с помощью дезинфицирующего, удаляющий РНКазы, ДНКазы и ДНК из поверхностей. Очистите все последующие элементы привели в капюшон, используя отбеливатель с последующим обеззараживающего нуклеиновой кислоты, в том числе перчатки. Используйте свежие РНКазы / ДНКазы, свободной от реагентов, таких как рipette советы, когда это возможно.
- Лента стерилизованного химической биологической опасности мешок к задней части капота. Все сухие отходы, содержащие фенол или хлороформ, должны быть помещены в этот мешок для правильной утилизации.
- Поместите стерильную бутылку в капюшон для сбора жидких отходов, содержащих фенол или хлороформ.
- экстракцию фенолом-хлороформом.
- В капот, чтобы каждый шарик бьющегося трубки, добавьте 500 мкл буфера (от этапа 1.1.1), 210 мкл 20% додецилсульфата натрия и 500 мкл фенол: хлороформ: ИУК (25: 24: 1, рН 7,9 ).
- Перенесите тампон из транспортного флакона в шарик бьющегося трубки с использованием новой пары стерильных пинцетов. Тщательно потереть головку тампон к внутренним стенкам трубы шарика размола целлюлозы в течение по меньшей мере 30 с. Повторно колпачком образец, когда сделано. При выполнении экстракцию из нескольких мазков, меняйте перчатки между каждого образца.
- Охладите образец на льду в течение не менее 10 мин. Удалить тампон изшарик избивая трубку, держа тампон ручку стерильными пинцетами, нажимая на головку тампон к внутренней стенке трубы с помощью чистой кончик P200. Откажитесь от швабры в сухой мешок для химических отходов. Примечание: "швабра" действие (нажатие головки тампона) освободит жидкость из впитывающего тампона и увеличить извлечение нуклеиновой кислоты.
- Поместите шарик размола трубки в шарик било и гомогенизируют в течение 2 мин при 4 ° С.
- Центрифуга шарик Избиение трубки в течение 3 мин при 6000 х г и 4 ° C , чтобы осадить твердые частицы и отделением водного и фенола фаз.
- Перенести водную фазу (~ 500 - 600 мкл) в стерильном 1,5 мл трубки. Добавить равный объем фенола: хлороформа: IAA. Смешать инверсии и краткой встряхиванием.
- Отцентрифугировать пробирку в течение 5 мин при 16000 х г и 4 ° С.
- Перенести водную фазу к новой стерильной 1,5 мл трубки. Будьте консервативны и не переносят материал из межфазного слоя или лежащего в основе фенолафаза. Обратите внимание, объем переданной водной фазы. Сохраните фазу фенола для будущего выделения белка.
- Добавьте 0,8 объема изопропанола и 0,1 объема 3 М ацетата натрия (рН 5,5). Тщательно перемешать переворачиванием и кратко встряхиванием.
- Осадить нуклеиновой кислоты путем охлаждения трубки при -20 ° С в течение по меньшей мере 2 ч (до O / N).
- осаждение изопропанолом и мыть этанол
- Отцентрифугировать пробирку в течение 30 мин при температуре приблизительно 16,000 XG и 4 ° С. Осторожно использовать пипетку, чтобы удалить супернатант, оставляя осадок нетронутыми.
- Добавьте 500 мкл 100% -ного этанола. Выбить осадок с нежным встряхиванием или пипеткой, не касаясь гранул. Центрифуга в течение 5 мин при 16000 х г и 4 ° С.
- Осторожно удалите супернатант этанол. Используйте P10 пипетку, чтобы удалить как можно больше этанола, насколько это возможно, не нарушая гранул.
- Воздух сухой осадок при комнатной температуре в течение 15 мин.
- Ресуспендируют осадок в 20 мкл ULTRA-чистый 0,1 x Трис-ЭДТА буфера. Дайте образец охладить на льду в течение 10 мин и пипеткой несколько раз для обеспечения полного взмучивания. Если осадок не растворяется, перенесите трубку к блоку С теплом 40 ° в течение до 10 мин, чтобы способствовать растворению.
- Измеряют концентрацию нуклеиновой кислоты с использованием спектрофотометра 19.
- При желании отдельные ДНК из РНК с использованием набора для очистки на колонках, в соответствии с протоколом производителя 20.
- Хранить нуклеиновую кислоту, при температуре -80 ° С или продолжить.
2. ПЦР - амплификации 16S рРНК генов V4 гипервариабельной области
Примечание: Выполнить ПЦР-амплификации в наборах из 12 образцов или меньшем количестве, чтобы свести к минимуму риск загрязнения и человеческой ошибки. При выполнении нескольких раундов амплификации, последовательно пронумеровать амплификации партий и записи амплификации номер партии каждого образца в Таблице 1.
- Подготовка Oе реагентов и ПЦР-колпаком
- Добавить ПЦР - амплификации набора информации в таблице 1, который будет служить в качестве основы файла отображения на этапе анализа последовательности.
- Удалите все материалы с капюшоном ПЦР и тщательно очистить внутренние поверхности с отбеливателем последующим обеззараживающего, который удаляет РНКазы, ДНКазы и ДНК. Обязательно обеззараживают каждый реагент и часть оборудования (например, пипеток) перед помещением их в капот. Носите свежие перчатки протирать дезинфицирующим нуклеиновой кислоты до работы в капюшоне.
- При необходимости разбавить шаблон нуклеиновой кислоты до 50 - 100 нг / мкл с использованием ДНК-бесплатно и нуклеазы без воды.
- Оттепель аликвоты 5x высокоточный (HF) буфера, дНТФ и праймеров в ПЦР чистой капюшоном. Аккуратно вихревой и центрифуга все решения после размораживания. Чтобы свести к минимуму циклов замораживания-оттаивания и риск загрязнения акций, готовят аликвоты 5x ВЧ буфера, дНТФ и праймеров.
- Поместитечистый настольный кулер стойка для микропробирок и пластинчатый охладитель ПЦР в капот.
- Для ПЦР-реакции, подготовить мастер смеси путем объединения 15,5 мкл сверхчистой воды, 5 мкл 5x HF буфера, 0,5 мкл дНТФ, 0,5 мкл 515F прямого праймера, 0,75 мкл 3% ДМСО и 0,25 мкл полимеразной для каждая реакция. Собрать все компоненты реакции в холодильнике и добавьте полимеразы в последнюю очередь. Тщательно перемешать с помощью пипетки. Добавьте две дополнительные пробы для подсчета реакции при подготовке основной смеси, чтобы учесть ошибки пипетирования.
- ПЦР установка реакция:
Примечание: Выполнение уточнениями в трех экземплярах, а это означает каждый образец усиливается в трех отдельных 25 мкл реакции. Выполнить контроль воды нет-шаблона с каждой парой праймеров. Работают быстро, но осторожно, избегая введения каких-либо загрязнений.- Добавьте в полосу 8-а с отдельными крышками и поместить в охладитель PCR.
- Пипеток 90 мкл основной смеси в первыйЧто ж.
- Добавляют 2 мкл обратного праймера (Supplemental File 1). Обязательно внимательно обратите внимание на штрих - код , обратный праймер , используемый с каждым образцом в таблице 1.
- Тщательно перемешать и передать 23 мкл основной смеси для четвертой скважины (контроль не-шаблон).
- Добавляют 2 мкл воды к четвертой скважины.
- Добавить 6 мкл соответствующего образца в первую лунку. Тщательно перемешать и передать 25 мкл на второй скважины. Изменить советы и передать еще 25 мкл из первой скважины на третью скважину. Плотно колпачок каждую лунку, убедившись в том, чтобы не касаться внутренней части колодцев или колпачка в процессе.
- Повторите эти действия для каждого образца.
- Выполните ПЦР-амплификации
- Перенесите стрип пробирки в амплификатор и запустить следующую программу: 30 сек при 98 ° С, затем 30 циклов: 10 сек при 98 ° С, 30 с при 57 ° C, и 12 с при 72 ° С, за которым следует 10 мин держать при температуре 72 ° С и окончательной провестит 4 ° C.
- Выполните следующие действия на чистую лабораторном столе. Быстро вращать трубки для сбора жидкости из стенок. Объединить по трехкратным ПЦР-реакции из каждой пробы, с общим объемом 75 мкл, в стерильную пробирку с надписью. Кроме того, передача 25 мкл каждого элемента управления не-шаблона в отдельную стерильную пробирку. Не совмещайте ампликонов из разных образцов пока нет.
- Проверка успешной ПЦР-амплификации образцов помощью гель-электрофореза.
- Подготовьте 1,5% агарозном геле (1,5 г агарозы порошка в 100 мл буфера 1x TAE) с достаточным количеством скважин , чтобы провести каждый ампликона, контроль воды, и лестницы 21.
- В то время как затвердеет гель (около 30 мин), подготовить образец для электрофореза: Добавить 1 мкл 6х красителем на новую, помеченную пробирку. К этой трубке, добавляют 5 мкл ампликона и перемешать с помощью пипетки.
- Когда гель установил, удалить гребни, поместите гель в электрофорез, резервуар и заполнить бак с буфером 1x TAE.
- К первой скважины, добавьте 5 мкл лестницы ДНК.
- Нагрузка 5 мкл образца ампликоне к другому хорошо. Нагрузка 5 мкл не-шаблон ампликоне в отдельную лунку. Продолжить по мере необходимости для каждого образца.
- Когда все образцы были загружены, сдвиньте крышку бачка на место и включите источник питания до 120 В. Разрешить гель работать в течение 30 - 60 мин.
- Просмотр гель под действием УФ-света.
- Проверка успешной амплификации каждого образца, отметив одну сильную полосу около 380 пар оснований. Если есть двойная полоса, повторно усиливают образец с другой обратной штрих-кода (шаг 2.3). Если нет полосы вообще, повторно усиливают образец с использованием либо один и тот же обратный штрих-код или новый обратный штрих-код (этап 2.3). Если повторное усиление неудачна, ингибиторы ПЦР могут присутствовать в образце, в этом случае, выполнить колонки на основе ДНК очистки для удаления ингибиторов ПЦР.
Примечание: Успешное усиление не может быть возможным, если бакконцентратах ДНК в иливыборка у исходных недостаточна (<5 нг / мкл). - Проверьте отсутствие загрязнения реагентов, отметив отсутствие полосы в контроле не-шаблона.
- Проверка успешной амплификации каждого образца, отметив одну сильную полосу около 380 пар оснований. Если есть двойная полоса, повторно усиливают образец с другой обратной штрих-кода (шаг 2.3). Если нет полосы вообще, повторно усиливают образец с использованием либо один и тот же обратный штрих-код или новый обратный штрих-код (этап 2.3). Если повторное усиление неудачна, ингибиторы ПЦР могут присутствовать в образце, в этом случае, выполнить колонки на основе ДНК очистки для удаления ингибиторов ПЦР.
- Храните оставшиеся 70 мкл ампликоне при -20 ° С. Выбросьте оставшиеся 20 мкл контроля нет-шаблона, предполагая, что он не уступал группу.
3. Библиотека Аккумулирование и высокая пропускная способность секвенирования
- Создание ампликону пул путем объединения равный объем (2 - 5 мкл) каждого ампликона в одну стерильную пробирку. Если группа из образца выглядел особенно слабым, добавьте два раза больше объема по отношению к остальной части образцов.
- Удалите ПЦР - праймеров из ампликона пула с использованием набора ПЦР очистки, в соответствии с инструкциями изготовителя 22. Выполните очистку с несколькими колонками, если объем ампликона пула составляет более 100 мкл. Примечание: Каждая колонка имеет емкость 100 мкл.
- Храните библиотеку при -20 & #176; C или перейти к следующему шагу.
- Если это применимо, объединить праймер свободные бассейны ампликоне для создания окончательной библиотеки. Определить концентрацию ДНК библиотеки с использованием спектрофотометра или флуорометрического системы 23. 260/280 соотношение между 1,8 - 2,0 является показателем чистой ДНК.
- Развести библиотеку до 20 нМ. Подтверждения качества библиотеки визуализацией одну полосу около 400 пар оснований, используя электрофорез инструмент. Confirm концентрацию библиотеки с помощью флуорометрического системы 23.
- Выполните окончательную разведение 1:10 в воде для разбавления библиотеку до 2 нм. Затем, хранить библиотеку при 20 ° C на неопределенный срок.
- Отправить аликвоты окончательной библиотеки с тремя необходимых праймеров для секвенирования (Read 1, Read 2, и индекс, см Таблицы материалов / оборудования) для секвенирования на секвенсор Illumina. Если меньше, чем 300 образцов были мультиплексированы для секвенирования, использовать одну торцевую 300 пар оснований перспективе и с индексом 12 б.п. чтения она MiSeq, с конечной концентрацией библиотеки 5 пМ и денатурированной PhiX шип-в 10%. Смотрите дополнительные материалы Caporaso и др. ИСМЕ J, 2012 10 для получения подробных инструкций секвенирования.
4. Анализ последовательности
Примечание: Изложенные здесь является основной трубопровод для анализа последовательностей с использованием программного пакета QIIME 1.8.0. Для простоты, обеспеченные команды предполагают, что файл отображение называется mapping.txt, индекс 12 п.н. чтения файл называется index.fastq и секвенирование 300 пар оснований прочитать файл называется sequences.fastq. Установить QIIME или MacQIIME 16 и ознакомиться с основами UNIX для выполнения следующих команд. Прочитайте полное руководство по QIIME по адресу:
- Заполните файл отображения для эксперимента (таблица 1). Включите как можно больше метаданных, как это возможно. Обратите внимание, какие образцы были извлечены или усиливаются в том же пакете, чтобы определить, есть ли какие-пакетные эффекты. Сохраните файл отображения в виде текстового файла, например, mapping.txt. Проверка форматирования файла отображения, выполнив следующую команду: validate_mapping_file.py -m -o mapping.txt mapping_output
- Проверьте качество секвенирования читает с использованием высокой пропускной последовательности качества данных программы проверки, такие как FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/). Рисунок 5 демонстрирует одну базовую последовательность качества что можно ожидать от успешного запуска.
Примечание: Секвенсор присваивает каждому нуклеотидную основание показатель качества Phred, что соответствует вероятности того, что база была ошибочно называется. Показатель качества Phred 10 указывает на то, что существует 10% вероятность того, что нуклеотид был неправильно назначитье изд, 20 указывает на 1% шанс, 30 показывает 0,1% шанс, и 40 (максимально возможный балл) указывает на 0,01% шанс 24. - Использование файла отображения в качестве ключа, демультиплексирования, качество фильтрации данных о последовательностях, и сохранить результаты в папку (в данном случае, называется "sl_out"), выполнив эту команду 25: split_libraries_fastq.py --rev_comp_mapping_barcodes -i sequences.fastq -о sl_out / -b index.fastq -m mapping.txt -q 29
Примечание: Флаг д обозначает максимальное количество баллов неприемлемого качества Phred, например, "-q 29" отфильтровывает любые последовательности с Phred баллов ниже 30, что обеспечивает 99,9% точности базовых вызовов. - Использование Greengenes 16S оперативной таксономическая единица (ОТУ) справочной базы данных 26 (http://qiime.org/home_static/dataFiles.html~~HEAD=dobj), выполняют с открытым ссылка ОТУ собирание, выполнив эту команду 27: pick_open_reference_otus.py -i sl_out / seqs. FNA -r -o 97_otus.fasta ucrss / -s 0,1
Примечание: Флаг -s указываетдоля последовательностей , которые не удалось выровнять к справочной базы данных , которая будет включена в De Novo кластеризацию. "-s 0.1" включает в себя 10% неудачных последовательностей в De Novo кластеризация. Используйте флаг -a для распараллеливания процесса загрузки OTU и сократить время обработки от нескольких дней до нескольких часов, если несколько ядер имеются. - Создание удобного таксономического таблицы изобилие путем слияния Otus на видовом уровне, выполнив эту команду 28: summarize_taxa.py -i ucress / otu_table_mc2.biom -o summarized_otuSpecies / -L 7
Примечание: Полученная таблица может быть легко просматривать в любой электронной таблицы программного обеспечения. Обратите внимание, что 16S рРНК последовательности не надежно обеспечивают разрешение на уровне видов. - Определить экологическое разнообразие внутри каждого образца путем вычисления нескольких метрик альфа-разнообразие с alpha_diversity.py QIIME сценария. Затем определяют разнообразие между парами образцов с помощью сценария beta_diversity.py QIIME.
- Висualize данные, например, с использованием основной Императору 29 координаты участка или Heatmap.
- Выполнение формальных статистических сопоставлений категорий файлов отображения, например, с compare_catagories.py сценария QIIME в 30.
Примечание: Эта команда использует встроенный "validate_mapping_file.py" QIIME скрипт, который делает новую папку, названную "mapping_output", содержащий файл с расширением .html с указанием ошибки отображения файлов, если таковые имеются.
Результаты
Общий обзор протокола, что позволяет определить относительные бактериальных содержаний из тампоном с использованием 16S рРНК гена секвенирование, показан на рисунке 1 протокол .The был оптимизирован для влагалищных тампонов человека, но может быть легко адаптирована для большинства участков отбора проб слизистых оболочек и другие хосты. Рисунок 2 демонстрирует ДНК высокого качества и РНК , которые могут быть выделены с использованием протокола бусинка-биений. Рисунок 3 иллюстрирует успешную ПЦР - амплификации из 12 образцов, где каждый амплификации с образцом дали единственную сильную полосу из правильного размер и каждый элемент управления вода не поддавалась группу. Рисунок 4 иллюстрирует количественную оценку конечного библиотечного пула до секвенирования. на рисунке 5 показан типичный профиль качества последовательности после одностороннего 300 п.н. MiSeq перспективе.
"SRC =" / файлы / ftp_upload / 53939 / 53939fig1.jpg "/>
Рисунок 1. Схема Обзор протокола. Во- первых, нуклеиновой кислоты извлекается из тампоном с помощью бисерной избиению в буферном растворе , содержащем фенол, хлороформ и изоамиловый спирт. Вариабельный участок 4 гена 16S рРНК затем усиливается из полученной нуклеиновой кислоты с помощью ПЦР. ПЦР-ампликонов до сотен образцов, затем комбинируются и секвенировали на один проход. Полученные последовательности сопоставляются с эталонной базой данных для определения относительных содержаний бактерий. Весь протокол может быть выполнена примерно через три дня. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
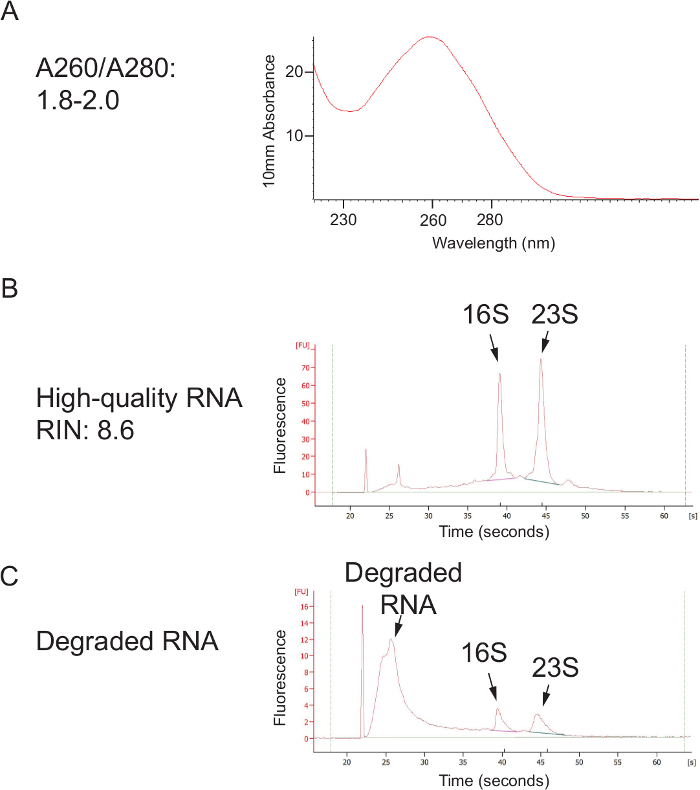
Рисунок 2. Высококачественная нуклеиновые кислоты извлекали с помощью Фенол: Хлороформ шарика Избиение Mеню. (А) качество ДНК, как оценено с помощью спектрофотометра. Отношение A260 / A280 от 1,8 до 2,0 показывает чистый нуклеиновой кислоты, не загрязненную с фенолом или белком. (B) После столбца очистки, этот протокол может дать высокого качества РНК, показали сильные пики 16S и 23S рРНК. (C) деградация РНК может происходить , если образец не держать в холоде после сбора (во время транспортировки и хранения) , или если РНКазы присутствуют во время обработки. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
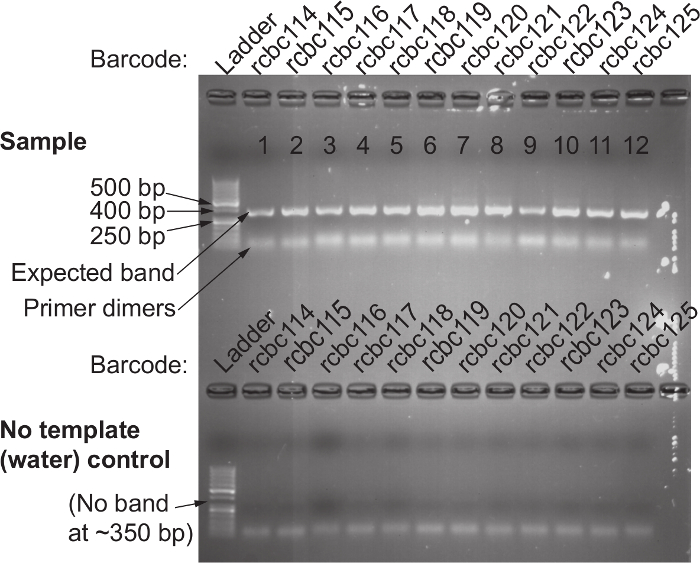
Рисунок 3. Подтверждение успешного 16S рРНК амплификации гена Используя 515F и Barcoded 806R Набор праймеров. Top) Гель - электрофорез используется для подтверждения присутствия одной полосы вокруг 380 пар оснований яп каждый образец, который был амплифицирован с шаблоном. Отсутствие полосы указывает неуспешные амплификации; это, как правило , из - за человеческой ошибки и реакции ПЦР из этого образца должна быть повторена. Дно) Нет шаблона (вода) управляет работать параллельно с той же парой праймеров не должен иметь полосу подарок. Присутствие полосы в контрольной воде указывает на загрязненную реагентов; отказаться от реагентов , которые могут быть загрязнены и повторно сделать ПЦР - амплификации обоих управления шаблонами и воды для этой пары праймеров. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
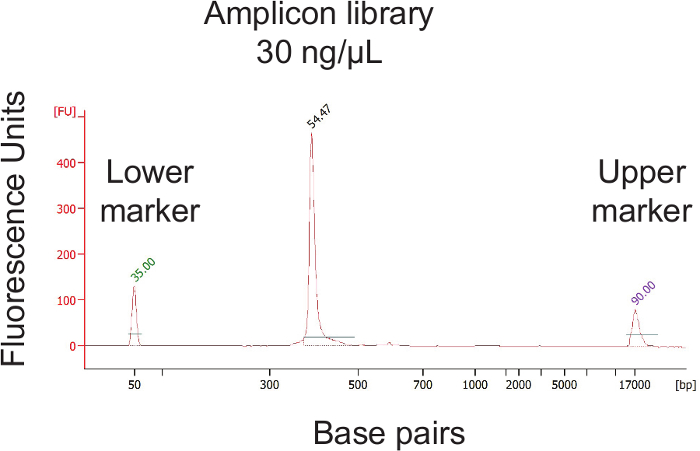
Рисунок 4. Количественная концентрации Заключительная библиотека Pool и проверка размера библиотеки. После объединения отдельных ампликонов образца, йе концентрация конечного пула библиотеки должны быть определены. Библиотека пул должен быть затем дополнительно разбавляют до достижения концентрации 2 нм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
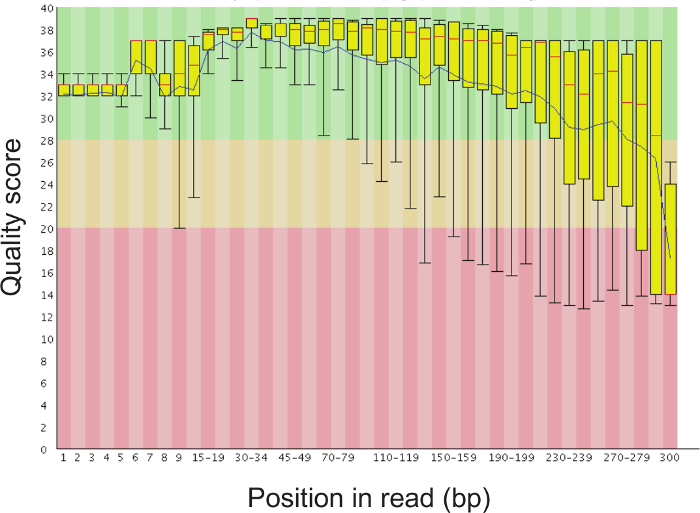
Рисунок 5. Представитель Bar Участок последовательности показателей качества на каждой позиции Read. Это нормально для качества последовательности падать после того, как 200 пар оснований, но средний показатель качества должен оставаться выше 30. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| #SampleID | Штрих - код Последовательность | LinkerPrimer Последовательность | rcbcPrimer | SampleType | экстракция партия | усиление Пластина | Описание | |||
| #An Пример файла отображения можно найти по адресу: http://qiime.org/_static/Examples/File_ Форматы / Пример_ Mapping_ File.txt | ||||||||||
| AG2350 | TCCCTTGTCTCC | CCGGACTACHVGGGTWTCTAAT | rcbc000 | шейный Тампон | 1 | |||||
Таблица 1. Сопоставление шаблона файла. Creaтин точный и тщательный файл отображения имеет решающее значение для успешного выполнения протокола. Файл отображения не требуется только для выполнения QIIME, но она также позволяет исследователю поддерживать связь между штрих - кодом выборки и метаданных, для анализа данных для каких - либо систематических ошибок (например, от партии к партии вариации), а также для определения интересные корреляции между метаданными и бактериальных популяций. Отображение файлов скелетное обеспечивается, но пользователям рекомендуется добавить столько столбцов, содержащих метаданные, как это возможно. Примеры дополнительных метаданных для вагинального тампона включает участника возраст, дата / время сбора мазков, гормонального типа контрацепции (если это применимо), передающихся половым путем инфекция приводит тестирование и т.д.
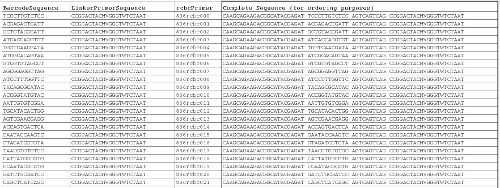
Справочная файла 1. Список Barcoded обратного праймера 10 . Первые три колонки могут быть использованы для завершения файла отображения, и последний столбец содержит всю последовательность праймера для заказа целей. Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
Обсуждение
Здесь мы опишем протокол для идентификации и характеристики относительных бактериальных содержаний в вагинальной тампоном человека. Этот протокол может быть легко адаптирована для других типов образцов, таких как кале и смывах других участков тела, а также для образцов, собранных из широкого спектра источников. Экстракция нуклеиновой кислоты по бусинок биения в буферном растворе фенола и хлороформа позволяет для выделения ДНК и РНК, что особенно важно при работе с драгоценными образцов, собранных с помощью клинических исследований. Выделенную ДНК микобактерий отлично подходит для бактериальной таксономической идентификации и геномной сборки, в то время как одновременный сбор РНК дает возможность определить функциональное бактериальная, хост и вирусные вклады через Секвенирование РНК. Описанный протокол использует проверенную набор праймеров , один шаг , который был успешно развернут на широком диапазоне типов образцов, включая человека, собак, а также отбор проб окружающей среды 10 . Наличие тысяч праймеров позволяет со штрих мультиплексирование образцов и значительной экономии на затратах секвенирования. Полная стоимость (включая все реагенты, один прогон последовательности, а также праймеры, но не оборудования) составляет около $ 20 за образец при 200 образцов мультиплексируются. Кроме того, существует очень высокая степень воспроизводимости при наличии нескольких мазки из того же сайта образец обрабатываются независимо друг от друга через весь трубопровод. В целом, протокол экономически эффективным, гибким, надежным и повторяемым.
Часть экстракции нуклеиновой кислоты данного протокола ограничивается мерами предосторожности, необходимые при работе с фенолом и хлороформом, а также проблем автоматизации трубопровода к высокой пропускной способностью, 96-луночного формата пластины. Кроме того, активная шарик Избиение используется для механического лизиса ножницы бактериальной ДНК приблизительно 6 фрагментов килобаза; если более длинные фрагменты ДНК необходимы для последующих применений, длительность шарика размола сhould быть сокращен. Ограничения бактериальной идентификации части этого протокола присущи любому методу, который опирается на 16S рРНК секвенирование гена. 16S рРНК секвенирование идеально подходит для идентификации бактерий к роду и даже видового уровня, но редко обеспечивает идентификацию уровня напряжения. В то время как вариабельной области В4 гена 16S рРНК обеспечивает надежную дискриминацию среди большинства видов бактерий 11, дополнительные вычислительные методы , такие как Oligotyping 31 , возможно , потребуется использовать для точного выявления определенных видов, таких как Lactobacillus crispatus. И, наконец, информация о точных бактериальных функциональных возможностей в конкретном образце не может быть определено с помощью 16S рРНК секвенирование гена в одиночку, хотя этот протокол позволяет извлекать всю геномную ДНК и РНК, которые могут быть использованы для достижения этой цели.
Самым важным шагом к обеспечению успеха с этим протоколом принимает большую осторожность, чтобы не допустить загрязнения дурьING сбор образцов, экстракции нуклеиновых кислот и ПЦР-амплификации. Обеспечение стерильности во время сбора образцов путем носить чистые перчатки и используя стерильные тампоны, трубки и ножницы. Для оценки на предмет загрязнения материалов сбора, сбора негативных тампоны контроля путем размещения дополнительных неиспользуемых тампоны непосредственно в транспортных труб во время отбора проб. В лаборатории, выполнять все этапы предварительной амплификации в стерилизованную колпаком, содержащие только обезвредить материалы и используя только молекулярный класс, ДНК свободных реагентов. Во время экстракции нуклеиновых кислот, предотвращения перекрестного загрязнения с использованием новых стерильного пинцета и свежие перчатки с каждого образца, и держать все пробирки не закрыты, если используется. Обработка неиспользуемых мазки параллельно обеспечивает стерильность как сбор образцов и выделения нуклеиновых кислот; неиспользованные тампоны не дают осадок после осаждения изопропанолом и промывания этанолом. Если осадок появляется, выполняют амплификации гена 16S рРНК, чтобы определить возможный источникзагрязнение (например, наличие стрептококков или стафилококков указывало бы загрязнение кожи). Кроме того, выполняют ПЦР амплификации без каких-либо реакций контрольных шаблонов параллельно, чтобы гарантировать, что реагенты и ПЦР-реакции не были загрязнены. Если полоса появляется в элементе управления нет шаблона, удалите реагенты и повторить амплификации со свежими реагентами. Принимая эти меры предосторожности обеспечит успешное секвенирование бактерий, представляющих интерес.
Стадии амплификации ПЦР, как правило, требуют наибольшего устранения неполадок. Усиливая в наборах из двенадцати образцов обеспечивает баланс между эффективностью и последовательностью. Полное отсутствие полос во всех образцах в заданном наборе амплификации указывает на систематический отказ, например, забывая добавить реагент или неправильно программирования Термоциклер. Отсутствие полосы из нескольких образцов, как правило, из-за человеческой ошибки, и усилений должен быть повторно гип с тем же спаривание образца и обратного праймера. В случае продолжающегося отсутствия полосы, образец может быть повторно амплифицировали с использованием обратного праймера с другим штрих-кодом. Повторные неудачи амплификации с множественными обратных праймеров может указывать ингибитор, присутствующий в образце. В этом случае очистка ДНК с колонной часто приводит к удалению ингибиторов без существенного изменения относительных бактериальных содержаний. Если несколько полос в результате после амплификации, повторной амплификации образца с другим обратным праймером штрих-кода.
В дополнение к предотвращению загрязнения окружающей среды и обеспечения амплификации одного конкретного продукта, успешное секвенирование опирается на уход при подготовке бассейн библиотеки. Цель состоит в том, чтобы объединить эквимолярные количества ампликонов каждого образца, чтобы обеспечить примерно такое же количество последовательности считывает одну пробу. Если концентрации нуклеиновых кислот до амплификации сопоставимы, просто добавляя равные объемы каждого саампликонов mple является достаточным при создании пула библиотеки. Тем не менее, если концентрации нуклеиновых кислот весьма различны, и добавлены в равном объеме, образец с низкой концентрацией нуклеиновых кислот будут плохо представлены с низким числом чтения. В этом случае, можно добавить больший объем ампликонов из-за низкой концентрации образца, основанной на относительной интенсивности полосы геля. В качестве альтернативы, можно более тщательно удалить праймеров из отдельных ампликонов, количественно концентрации ампликона отдельного сэмпла с помощью флуорометрического набора дц квантификации, и точно совместить эквимолярные количества каждого образца.
После того, как хорошо сбалансированный ампликона бассейн генерируется, становится критическим, чтобы тщательно измерить концентрацию пула. После разбавления осторожным и шип-ин с PhiX увеличить сложность чтения имеет решающее значение для достижения оптимальных результатов секвенирования. Высокая пропускная способность секвенсоры, которые используют sequenчных путем синтеза очень чувствительны к плотности кластеров на проточную кювету. Загрузка библиотеки пула , который слишком концентрированный приведет к overclustering, с более низкими показателями качества, низким выходом данных и неточной демультиплексирования 32. Загрузка библиотеки пул, который слишком разведенным также приведет к низким выходом данных. Тщательно количественной оценки пул библиотеки перед секвенированием обеспечит оптимальные результаты.
16S рРНК секвенирование гена обеспечивает комплексную оценку бактерий, присутствующих в данном образце и является абсолютно важным первым шагом в выработке гипотезы. Наличие богатого набора метаданных дальнейшего позволяет исследователю испытать ассоциации между отдельными видами бактерий и важных биологических факторов. Кроме того, тот же самый 16S информация может быть использована для вывода бактериальных функции , используя такие инструменты, как PICRUSt 33. Конечная цель состоит в том, чтобы использовать 16S характеристику для идентификации новых ассоциаций, которые могут бытьдополнительно испытана и утверждена в модельных системах, добавляя к нашему растущему пониманию воздействия бактериального микробиомом на здоровье человека и болезни.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы хотели бы поблагодарить Элизабет Бирн, Дэвид Gootenberg и Кристина Gosmann для критической обратной связи по протоколу; Меган Балдридж, Скотт Хэндли, Синди Монако, и Джейсон Норман для образца руководства подготовки и демонстраций; Венди Garrett, Кертис Huttenhower, Скип Virgin, и Брюс Уокер за советом протоколов и плодотворных дискуссий; и Джессика Hoisington-Лопес для поддержки секвенирования. Эта работа была поддержана Фондом Билла и Мелинды Гейтс и NIAID (1R01AI111918). DSK получил дополнительную поддержку со стороны Wellcome Фонда Burroughs. MNA была поддержана наградой номером T32GM007753 от NIGMS, и Павла и Daisy Soros Fellowship. Содержание исключительно ответственности авторов и не обязательно отражают официальную точку зрения NIGMS или НИЗ.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| Mini-Beadbeater-16 | BioSpec | 607 | |
| PCR workstation | Any PCR hood can be used, e.g., the AirClean 600. | ||
| Thermocycler | Any thermal cycler with a heated lid can be used, e.g., MJ Research PTC-200. | ||
| Electrophoresis system | Any electrophoresis system can be used, e.g. the Thermo Scientific Owl EasyCast B1 Mini Gel Electrophoresis system. | ||
| Nanodrop | Thermo Scientific | 2000C | Any other DNA quantification method will be sufficient |
| Bioanalyzer | Agilent | 2100 | An alternative is the Agilent 2200 TapeStation Instrument. Not absolutely necessary but very helpful. |
| MiSeq or HiSeq | Illumina | ||
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Catch-All Sample Collection swab | Epibio | QEC89100 | Other swabs can be used but the Catch-All swab is recommended by the Human Microbiome Project. |
| ELIMINase | Fisher | 04-355-31 | |
| SteriFlip 50 ml filtration device (0.22 µm) | EMD Millipore | SCGP00525 | |
| 0.1 mm glass beads | BioSpec | 11079101 | |
| 2 ml screw-cap tubes | Sarstedt | 72.694.006 | For bead beating |
| UltraPure 5M NaCl | Life Technologies | 24740-011 | Molecular Biology Grade |
| 1 M Tris-HCl | Ambion (Invitrogen) | AM9856 | Molecular Biology Grade |
| 0.5 M EDTA | Ambion (Invitrogen) | AM9260G | Molecular Biology Grade |
| Sodium Dodecyl Sulfate, 20% Solution | Fisher | BP1311-200 | Molecular Biology Grade |
| UltraPure DNase/RNase-free distilled water | Ambion | 10977-015 | Molecular Biology Grade, for buffer preparation |
| 2-Propanol BioReagent, for molecular biology, ≥99.5% | Sigma | I9516-500ML | Molecular Biology Grade |
| Phenol:Chloroform:IAA, 25:24:1 | Invitrogen | AM9730 | Warning: Toxic |
| 3 M Sodium Acetate, pH 5.5 | Life Technologies | AM9740 | Molecular Biology Grade |
| Disposable sterile polystyrene forceps, PS | Cole Parmer | EW-06443-20 | |
| 1.5 ml, clear, PCR clean tubes | Eppendorf | 22364120 | |
| PCR grade water | MoBio | 17000-11 | For PCR |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| dNTP mix | Sigma | D7295-0.5mL | |
| 0.2 ml PCR 8-tube with attached clear flat caps, natural | USA Scientific | 1492-3900 | Any 8-tube strips that are DNase, RNase, DNA, and PCR inhibitor free will work |
| Agarose | BioExpress | E-3121-25 | |
| 50x TAE buffer | Lonza | 51216 | |
| DNA gel stain | Invitrogen | S33102 | |
| 6x DNA Loading Dye | Thermo (Fisher) | R0611 | |
| 50 bp GeneRuler Ladder | Thermo (Fisher) | SM0373 | |
| AllPrep DNA/RNA kit | Qiagen | 80284 | |
| UltraClean PCR Clean-up Kit | MoBio | 12500-100 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P11496 | An alternative is Qubit Fluorometric Quantification (Life Technologies) |
| Name | Company | Catalog Number | Comments |
| Primers: | |||
| 515F (forward primer) 5'-AATGATACGGCGACCACCGAG ATCTACACTATGGTAATTGT GTGCCAGCMGCCGCGGTAA-3' | Order at 100 nmole; Purification: Standard Desalting. Resuspend at 100 µM. **Critical: primers must be resuspended with MoBio PCR Grade Water (see above) in a hood to avoid contamination.** | ||
| Reverse primers, see the Supplemental Code File and: ftp://ftp.metagenomics.anl.gov/data/misc/EMP/SupplementaryFile1_barcoded _primers_515F_806R.txt | IDT is recommended | If ordering large sets of primers, order as a 96-well plate at the 100 nmole scale. Resuspend at 100 μM. Full directions for primer ordering and resuspension at http://www.earthmicrobiome.org/files/2013/04/EMP_primer_ordering_and _resuspension.doc. **Critical: primers must be resuspended with MoBio PCR Grade Water (see above) in a hood to avoid contamination.** | |
| Read 1 Sequencing Primer 5'-TAT GGT AAT TGT GTG CCA GCM GCC GCG GTA A-3' | 25 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| Read 2 Sequencing Primer 5'-AGT CAG TCA GCC GGA CTA CHV GGG TWT CTA AT-3' | 26 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| Index Sequencing Primer 5'-ATT AGA WAC CCB DGT AGT CCG GCT GAC TGA CT-3' | 27 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| PhiX Control v3 | Illumina | FC-110-3001 | Required if performing the sequencing in-house. If the sequencing will be performed by a third-party sequencing center, they will already have PhiX. |
Ссылки
- Huttenhower, C. Structure, function and diversity of the healthy human microbiome. Nature. 486, 207-214 (2012).
- O'Hanlon, D. E., Moench, T. R., Cone, R. A. Vaginal pH and microbicidal lactic acid when lactobacilli dominate the microbiota. PloS one. 8, e80074(2013).
- Aldunate, M. Vaginal concentrations of lactic acid potently inactivate HIV. The Journal of antimicrobial chemotherapy. 68, 2015-2025 (2013).
- Anahtar, M. N., et al. Cervicovaginal bacteria are a major modulator of host inflammatory responses in the female genital tract. Immunity. 42, 965-976 (2015).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110, 20236-20241 (2013).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical biochemistry. 162, 156-159 (1987).
- Srinivasan, S., et al. Temporal variability of human vaginal bacteria and relationship with bacterial vaginosis. PloS one. 5, e10197(2010).
- Dols, J. A., et al. Microarray-based identification of clinically relevant vaginal bacteria in relation to bacterial vaginosis. American journal of obstetrics and gynecology. 204, 301-307 (2011).
- Segata, N., et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nature methods. 9, 811-814 (2012).
- Caporaso, J. G., et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. The ISME journal. 6, 1621-1624 (2012).
- Caporaso, J. G., et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences of the United States of America. 108, Suppl 1 4516-4522 (2011).
- 16S rRNA Amplification Protocol. Earthmicrobiome Project. , Available from: www.earthmicrobiome.org (2015).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, Suppl 1 4680-4687 (2011).
- Srinivasan, S., et al. Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PloS one. 7, e37818(2012).
- Caporaso, J. G., et al. QIIME allows analysis of high-throughput community sequencing data. Nature methods. 7, 335-336 (2010).
- Werner, J. MacQIIME. , Available from: http://www.wernerlab.org/software/macqiime (2015).
- Schloss, P. D., et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and environmental microbiology. 75, 7537-7541 (2009).
- Edgar, R. C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature. 10, 996-998 (2013).
- NanoDrop 2000/2000c Spectrophotometer, V1.0 User Manual. Thermo Fisher Scientific. , Available at: http://www.thermoscientific.com/content/dam/tfs/ATG/CAD/CAD Documents/Product Manuals & Specifications/Molecular Spectroscopy/UV Visible Spectrophotometers/Spectrophotometer Systems/NanoDrop/NanoDrop-2000-User-Manual-EN.pdf (2009).
- AllPrep DNA/RNA Mini Kit. Qiagen. , Available from: https://http://www.qiagen.com/us/shop/sample-technologies/rna-sample-technologies/dna-rna-protein/allprep-dnarna-mini-kit/ - orderinginformation (2015).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of visualized experiments. , (2012).
- UltraClean PCR Clean-Up Kit Instruction Manual. MoBio. , Available from: http://www.mobio.com/images/custom/file/12500(1).pdf (2013).
- Quant-iT PicoGreen dsDNA Reagent. Invitrogen. , Available at: https://tools.thermofisher.com/content/sfs/manuals/mp07581.pdf (2008).
- Quality Scores for Next-Generation Sequencing. Illumina. , Available from: http://www.illumina.com/documents/products/technotes/technote_Q-Scores.pdf (2011).
- split_libraries_fastq.py. QIIME. , Available from: http://qiime.org/scripts/split_libraries_fastq.html (2015).
- DeSantis, T. Z., et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB. Applied and environmental microbiology. 72, 5069-5072 (2006).
- pick_open_reference_otus.py. QIIME. , Available from: http://qiime.org/scripts/pick_open_reference_otus.html (2015).
- summarize_taxa_otus.py. QIIME. , Available from: http://qiime.org/scripts/summarize_taxa.html (2015).
- Vazquez-Baeza, Y., Pirrung, M., Gonzalez, A., Knight, R. EMPeror: a tool for visualizing high-throughput microbial community data. GigaScience. 2, 16(2013).
- Comparing categories. QIIME. , Available from: http://qiime.org/tutorials/category_comparison.html (2015).
- Eren, A. M., et al. Exploring the diversity of Gardnerella vaginalis in the genitourinary tract microbiota of monogamous couples through subtle nucleotide variation. PloS one. 6, e26732(2011).
- Diagnosing and preventing flow cell overclustering on the MiSeq system. Illumina. , Available from: http://support.illumina.com/content/dam/illumina-marketing/documents/products/other/miseq-overclustering-primer-770-2014-038.pdf (2015).
- Langille, M. G., et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature biotechnology. 31, 814-821 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены