Method Article
세균 커뮤니티 특성화에 대한 효율적인 핵산 추출 및 16S rRNA의 유전자 시퀀싱
요약
우리는 16S rRNA의 유전자의 증폭 시퀀싱을 사용하여 세균 지역 사회의 특성에 대한 면봉에서 핵산을 추출하기위한 효율적이고 강력하고 비용 효과적인 방법을 설명합니다. 이 방법은 여러 종류의 시료에 대한 일반적인 처리 방법을 허용하고 하류 공정 분석들을 수용한다.
초록
인간의 건강과 질병의 중요한 조절 등의 미생물 지역 사회의 역할에 대한 성장 감사가있다. 높은 처리량 시퀀싱 기술은 다양한 소스로부터의 16S rRNA 유전자 서열을 이용하여 세균 사회의 신속하고 효율적인 특성을 허용하고있다. 16S rRNA의 서열 분석에 용이하게 사용할 수있는 도구는 표준화 된 계산 흐름을 가지고 있지만, DNA 추출을위한 시료 처리 연구에 걸쳐 변화의 계속 소스 남아있다. 여기에서 우리는 면봉에서 핵산을 추출하기위한 효율적이고 강력하고 비용 효과적인 방법을 설명합니다. 또한 서열 라이브러리의 생성, 데이터 품질 제어 및 서열 분석을 포함한 16S rRNA 유전자 서열 하류 방법을 서술. 워크 플로 자 해부학 적 위치 및 호스트 다양한 종에서 수집 면봉 등 다양한 샘플 유형을 수용 할 수있다. 또한, DNA 및 RNA를 회수 분리하여 사용할 수있다전체 게놈 시퀀싱 또는 RNA-서열을 포함한 다른 응용 프로그램에 대한. 설명 된 방법은 여러 종류의 시료에 대한 일반적인 처리 방법을 허용하고, 군 유전체학 및 유전자 전사 정보 하류 분석을 수용한다.
서문
인간의 낮은 생식 기관, 소화 시스템, 호흡기 및 피부 조직의 항상성을 유지하고 호스트 1의 건강을 지원하기위한 중요한 복잡한 세균 지역 사회의 식민지된다. 예를 들어, 특정 유산균은 질 볼트를 산성화 항균 이펙터 생산 및 로컬 호스트 면역 2-4 변조하여 병원균에 대한 황폐 한 환경을 만들 수 있습니다. 박테리아 마이크로 바이 옴의 중요성에 대한 증가하는 감사는 또한 많은 임상 상황에서 세균 지역 사회의 특성에 대한 관심이 증가하고있다. 여기에서는 성기 면봉의 마이크로 바이 세균의 조성을 결정하는 방법을 설명한다. 프로토콜은 용이하게 다른 해부학 적 위치 및 다른 숙주 종에서 수집 대변 샘플 면봉을 위해 변형 될 수있다.
인해 주어진 스터드 수집 및 저장할 수있는 샘플의 수의 고유 제한Y 참가자는,이 프로토콜은 적응 페놀 - 클로로포름 기반 비드 치는 방법 5,6를 사용하여 단일 면봉의 잠재적 DNA, RNA, 심지어 단백질을 추출하도록 설계되었습니다. 세제와 비드 구타 및 화학 중단과 세균 세포벽의 물리적 파괴의 조합은 추가 효소 분해 단계없이, 그람 양성 그람 음성 및 항산 균의 신속한 용해 할 수 있습니다. 고품질의 RNA를 얻으려면, 그것은 또는 4 ° 이하로 유지하고 마른 면봉을 사용하는 것이 좋습니다 (C) 즉시 수집 후 및 -80 ° C에서 실험실 (해당되는 경우)에 전송 및 저장 장기간 동안.
주어진 샘플 내의 박테리아 마이크로 바이을 결정하기 위해이 과정은 현재 종합적 세균 분류 할당 상대적 정량을 수행 할 수있는 가장 경제적 인 방법이다 16S rRNA의 유전자의 증폭 순서화를 이용한다. 다른 방법이 qPCR에 7을 대상 포함, 사용자 정의 microarrAYS 8 및 전체 게놈 시퀀싱 구. 16S rRNA 유전자 아홉 가변 영역을 포함하고, 마이크로 바이 질 연구를위한 시퀀스 최적의 V 영역에 대한 합의가 없다. 여기에서 우리는 Caporaso 등. 10 ~ 12에 의해 설계 파이프 라인에 515F / 806R 프라이머 세트를 사용하여 구축 할 수 있습니다. Caporaso 외.의 515F / 806R 프라이머 세트 인해 Illumina의 시퀀싱 플랫폼과 검증 된 바코드 프라이머 및 호환성 수천의 가용성 단일 염기 서열의 실행에 샘플 수백 다중화 할 수 있습니다. 인간 마이크로 바이 옴 프로젝트의 27F / 338R 프라이머 (13) 설정과는 달리, 515F / 806R은 효과적으로 Bifidobacteriaceae를 증폭하여 정확하게 Gardnerella vaginalis에, 일부 여성의 질 미생물 지역 사회의 중요한 구성원 캡처합니다. 대안 적으로, 338F / 806R 프라이머 쌍을 성공적 질 샘플 14 및 515F / 926R 프라이머 쌍을 가지고 RECE의 pyrosequencing 사용되었습니다ntly 차세대 시퀀싱 12 가능해진다.
마지막으로,이 프로토콜은 미생물 생태학 (QIIME) 소프트웨어 패키지 (15)에 정량적 통계를 사용하여 16S에게 앰플 리콘의 분석을 수행하기위한 기본 지침을 제공합니다. 여기에 설명 된 QIIME 명령의 성공적인 구현은 각각의 샘플에 대한 세균 분류학 존재비를 포함하는 테이블을 산출한다. QIIME 사이트에 상세히 기술되는 바와 같이 많은 추가적인 품질 관리 단계, 분류 학적 분류 방법 및 분석 단계, 분석에 혼입 될 수있다 (http://qiime.org/index.html). 분석은 애플 컴퓨터에서 수행 될 경우, MacQIIME 패키지 (16)는 QIIME와 그 종속의 쉬운 설치를 제공합니다. 16S rRNA의 유전자 서열 분석을위한 대체 소프트웨어 패키지 Mothur 17 UPARSE (18)를 포함한다.
프로토콜
연구 프로토콜에 의해 승인 콰 줄루 - 나탈 대학의 생물 의학 연구 윤리위원회 (더반, 남아프리카 공화국)와 매사 추세 츠 종합 병원 임상 시험 심사위원회 (2012P001812 / MGH, 보스턴, MA)의 가이드 라인을 하였다.
자궁 경부 면봉에서 총 핵산 1. 추출
참고 : 16 샘플 이하의 세트 핵산 추출을 수행합니다. 아래 작성된 프로토콜 (예 참가자의 ID 번호, 연령 같은 메타 데이터를 포함 추출의 여러 차례 수행하는 직렬 추출 일괄 수와 각 시료의 취출 배치 번호뿐만 아니라 다른 샘플 정보를 기록하면 시료 (12)의 세트에서 처리하는 것으로 가정 표 1에 면봉 컬렉션 호르몬 피임 유형 성병 검사 결과 등)의 일자 / 시간.
- 시약 및 흄 후드의 제조
- 200 mM 염화나트륨 (염화나트륨), 200 mM 트리스, 및 클레아없는 물 100 mL에 20 mM의 에틸렌 다이아 민 테트라 아세트산 (EDTA)으로 이루어진 버퍼를 준비한다. 필터 멸균 0.22 ㎛의 필터를 통과하여 용액. 젖은 얼음에 버퍼 10 ㎖의 분취 량을 진정.
- (1 ~ 25 : 24)의 pH 7.9로 두 단계를 1 ml의 페놀 당 트리스 알칼리 버퍼의 65 μl를 추가 2 분 동안 혼합물을 흔들어 및 허용 기준 : 클로로포름 : 이소 아밀 알코올 (IAA) 페놀의 pH를 조정 자연적 또는 실온에서 5 분간 10,000 XG에 원심 분리하여 별도.
주의 : 흡입하면, 섭취, 피부 및 눈에 접촉하면 페놀은 독성이있다. 연기를 흡입하지 말 것. 불 침투성 장갑, 옆 가리개가있는 안전 안경 및 실험실 코트를 착용 할 것. - 필터 멸균 0.22 ㎛의 필터를 통해 20 % 소듐 도데 실 설페이트 (SDS) 25 mL로. 살균 SDS 5 ml의 분취 량을 확인합니다.
- -20 ℃에서 이소프로판올 10 ㎖ 분취 량을 냉각.
- 각 S에 대한 비드 구타 튜브를 준비WAB 비드 패는 적합한 멸균 2 ㎖의 튜브에 유리 비드 0.3 g을 칭량하여 처리한다.
- 멸균 흡수 면봉으로 ectocervix을 샘플링하여 면봉을 얻습니다. 즉시 수집 한 후 실험실로 운반하는 동안 1 시간 4 4 ° C에서 빈 멸균 cryovial, 가게에 면봉을 배치하고, -80 ° C에서 몇 달 동안 저장합니다. (개인 튜브 포함)을 면봉을 전송하는 젖은 얼음에 처리 할 수 있습니다.
- 생물 안전 캐비닛 (BSC)를 준비합니다. A는 "골무"휘발성 화학 물질의 적절한 제거를 보장하기 위해 건물 배기 접속으로 BSC를 사용합니다.
- 후드에서 모든 재료를 제거합니다.
- 표면에서 RNases, DNases하고, DNA를 제거하는 오염 제거제 다음 표백제와 후드, 모든 표면을 청소합니다. 면도 모든 후속 항목 장갑을 포함하는 핵산 오염 제거제, 다음 표백제를 사용하게 후드. 같은 페이지 신선한의 RNase / DNase의 무료 시약을 사용하여ipette 팁, 가능하면.
- 후드의 뒤쪽 살균 화학 생물 학적 가방 테이프. 페놀 또는 클로로포름을 포함하는 모든 건조 폐기물은 적절한 처분이 가방에 배치해야합니다.
- 페놀 또는 클로로포름을 포함하는 액체 폐기물을 수집하기 위해 후드로 멸균 병을 놓습니다.
- 페놀 - 클로로포름 추출.
- 후드에서 각 비드 비팅 튜브 버퍼 500 μL를 추가하고, 20 % 도데 실 황산나트륨 210 μL, 페놀 500 μL (1.1.1)에서 클로로포름 : IAA (25 : 24 : 1, pH가 7.9 ).
- 멸균 포셉의 새로운 쌍을 사용하여 비드 박동 튜브에 전송 유리 병에서 면봉을 전송합니다. 철저하게 적어도 30 초 동안 비드 박동 튜브의 내부 벽에 면봉 머리를 문질러. 다시 모자 샘플 다. 여러 면봉에서 추출을 수행하는 경우, 각 샘플 사이에 장갑을 변경합니다.
- 적어도 10 분 동안 얼음에 샘플을 진정. 로부터 면봉을 제거깨끗한 P200 팁을 사용하여 내부 튜브 벽에 면봉 헤드를 누른 상태에서 무균 핀셋 면봉 손잡이를 잡고 튜브 구타 비드. 건조 화학 폐기물 가방에 면봉을 버리십시오. 주 : "스퀴즈"작업 (면봉 헤드를 압박)이 흡수 면봉 액체를 해방하여 핵산 회수를 증가시킬 것이다.
- 비드 비터로 비드 박동 튜브를 넣고 4 ℃에서 2 분 동안 균질화.
- 원심 분리기 6000 XG에 3 분, 4 ° C에 대한 비드 박동 튜브 파편 펠렛 수성 페놀 단계를 분리합니다.
- 멸균 1.5 ML 튜브에 - (600 μL ~ 500) 성상을 전송합니다. 클로로포름 : 페놀의 동일한 볼륨을 추가 IAA합니다. 반전과 간단한 텍싱에 의해 섞는다.
- 16,000 XG에 5 분, 4 ℃로의 튜브를 원심 분리기.
- 새로운 멸균 1.5 ML 튜브에 수성 단계를 전송합니다. 보수적와 계면 층 또는 기본 페놀의 자료를 전송하지 않습니다단계. 전송 된 수성상의 부피를 참고. 미래의 단백질 분리를위한 페놀 위상을 저장합니다.
- 이소프로판올 0.8 볼륨 3M의 아세트산 나트륨 (산도 5.5)의 0.1 볼륨을 추가합니다. 역전과 짧게 텍싱에 의해 철저히 섞는다.
- (O / N까지), 적어도 2 시간 동안 -20 ℃에서 튜브를 차게하여 핵산을 침전.
- 아이소 프로필 알코올 침전 및 에탄올 세척
- 약 16,000 XG, 4 ° C를 30 분 동안 튜브를 원심 분리기. 조심스럽게 그대로 펠렛을 떠나, 상층 액을 제거하기 위해 피펫을 사용합니다.
- 100 % 에탄올 500 μl를 추가합니다. 펠렛을 건드리지 않고 부드러운 텍싱 또는 피펫으로 펠렛을 이동시키다. 16,000 XG에 5 분, 4 ° C에 대한 원심 분리기.
- 조심스럽게 에탄올 상층 액을 버린다. 펠렛을 교란시키지 않고 가능한 한 많은 에탄올을 제거 P10 피펫을 사용한다.
- 에어컨을 실온에서 15 분 동안 펠렛을 건조.
- U 20 μL에 펠렛을 재현 탁ltra 순수 0.1X 트리스 - EDTA 버퍼입니다. 전체 재 부유을 보장하기 위해 샘플을 반복적으로 10 분, 피펫 얼음에 진정 할 수 있습니다. 펠릿이 용해하지 않는 경우, 용해를 돕기 위해 10 분까지 해당하는 40 ° C 열 블록에 튜브를 옮긴다.
- 분광 광도계 (19)를 사용하여 핵산 농도를 측정한다.
- 원하는 경우, 제조자의 프로토콜 (20) 다음, 컬럼 정화 키트를 사용하여 RNA로부터 분리 된 DNA.
- -80 ° C에서 핵산을 저장하거나 계속합니다.
16S rRNA의 유전자 V4 가변 영역 2. PCR 증폭
주 : 오염 실수의 위험을 최소화하기 위해 샘플을 12 개 이하의 세트의 PCR 증폭을 수행한다. 증폭의 여러 라운드를 수행하는 경우, 직렬 증폭 배치 번호를 표 1에 각 샘플의 증폭 배치 번호를 기록한다.
- 준비 오시약 및 PCR 후드 F
- 서열 분석 단계에서 매핑 파일의 기초가 될 것 표 1로 PCR 증폭에 설정 정보를 추가한다.
- PCR을 후드에서 모든 재료를 제거하고 RNases, DNases, 그리고 DNA를 제거하는 오염 제거제 다음 표백제로 철저하게 내부 표면을 청소합니다. 후드에 배치하기 전에 모든 시약 및 장비 (예를 들면, 피펫)의 조각을 오염을 제거해야합니다. 이전 후드에서 작업을하는 핵산 오염 제거제로 청소 신선한 장갑을 착용 할 것.
- 필요한 경우, (50) 핵산 템플릿을 희석 - 100 NG / DNA없고 클레아없는 물을 사용 μL.
- 깨끗한 PCR 후드에서 5 배 높은 충실도 (HF) 버퍼, dNTPs를, 그리고 프라이머의 해동 분취. 부드럽게 소용돌이와 해동 후 모든 솔루션을 원심 분리기. 5 배 HF 버퍼의 dNTPs, 프라이머의 분취 량을 준비하고, 동결 - 해동 사이클 스톡 오염의 위험을 최소화한다.
- 장소마이크로 원심 튜브 및 후드으로 PCR 플레이트 쿨러 클린 벤치 탑 쿨러 랙.
- PCR 반응의 경우, 초순수 15.5 μL, 5 배 HF 완충액 5 μL, dNTPs를 0.5 μL, 515F 정방향 프라이머 0.5 μL 3 %의 DMSO 0.75 μL 및 중합 효소 0.25 μL를 조합하여 마스터 믹스를 조제 각 반응. 쿨러의 모든 반응 구성 요소를 조립하고 마지막으로 중합 효소를 추가합니다. 피펫으로 잘 섞는다. 피펫 오차를 고려하여, 마스터 믹스를 제조 할 때, 반응 카운트 개의 추가 샘플을 추가한다.
- PCR 반응 설정 :
참고 : 각 샘플은 세 개의 25 ㎕의 반응에서 증폭 의미 중으로 증폭을 수행합니다. 각각의 프라이머 쌍 노 템플릿 물 제어를 실행합니다. 어떤 오염의 도입을 방지, 신속하지만 신중하게 작업 할 수 있습니다.- PCR의 냉각기로 개별 캡 및 장소 8 잘 스트립 레이블.
- 첫 번째로 마스터 믹스의 피펫 90 μL잘.
- 역방향 프라이머 (보충 파일 1)의 2 μl를 추가합니다. 신중하게 표 1의 각 샘플에 사용되는 역방향 프라이머 바코드를주의해야합니다.
- 잘 믹스와 네 번째도 (노 서식 제어)에 마스터 혼합 23 μl를 전송합니다.
- 네 번째 우물에 물 2 μl를 추가합니다.
- 제 1 웰에 적절한 샘플의 6 μl를 추가합니다. 잘 혼합하고, 제 2 웰에 25 μl를 전송합니다. 변경 팁과 잘 세 번째로 첫 번째 우물에서 또 다른 25 μl를 전송합니다. 단단히 확인 과정에서 우물의 내부 또는 캡을 건드리지 않도록주의하면서, 모든 잘 모자.
- 각 샘플에 대해 반복합니다.
- PCR 증폭을 수행
- 열 순환기에 스트립 튜브에 옮기고 다음 프로그램 실행 : 57 ° C에서 98 ° C에서 30 초간 98 ℃에서 30 초, 10 초, 30주기 다음을하고, 그 다음 72 ℃에서 12 초, 10 분 72 ° C 및 최종 홀드 (A)에서 개최t 4 ° C를.
- 깨끗한 실험실 벤치에서 다음 단계를 수행합니다. 신속 벽에서 액체를 수집하기 위해 관 스핀. 멸균 분류 관에 75 ㎕의 총 부피로 각 샘플에서 삼중으로 PCR 반응을 결합한다. 또한 별도의 멸균 튜브에 각 노 템플릿 컨트롤의 25 μl를 전송합니다. 또 다른 샘플에서 증폭을 결합하지 마십시오.
- 겔 전기 영동에 의해 샘플의 성공적인 PCR 증폭을 검증.
- 각 앰플 리콘, 물 관리, 사다리 (21)를 유지하기에 충분한 우물과 (1X TAE 버퍼 100ml에 1.5 g 아가로 오스 분말) 1.5 % 아가 로스 젤을 준비합니다.
- 겔 굳어 (약 30 분) 동안 전기에 대한 샘플을 준비 : 새 레이블 튜브에 6 배 로딩 염료 1 μl를 추가합니다. 그 튜브 위해, 앰플 리콘의 5 μl를 추가하고 피펫으로 혼합한다.
- 젤이 설정되면, 콤를 제거 전기 영동 탱크에 젤을 배치하고 1X TAE 버퍼 탱크를 채우십시오.
- 제 1 웰에, DNA 사다리의 5 μl를 추가합니다.
- 로드 아니라 다른 샘플 앰플 리콘의 5 μl를. 로드 별도의 우물에 노 템플릿 앰플 리콘의 5 μL. 각 샘플에 대해 필요에 따라 계속합니다.
- 모든 샘플이 로딩되었을 때, 대신에 탱크 뚜껑을 슬라이드 (120)에 전원을 켜 V. 겔 (30)에 대해 실행하도록 허용 - 60 분.
- 자외선 아래에서 젤을 볼 수 있습니다.
- 380 bp의 주위에 하나의 강력한 밴드를 지적하여 각각의 샘플을 성공적으로 증폭을 확인합니다. 이중 대역이있는 경우, 다른 역 바코드 (단계 2.3)를 이용하여 시료를 재 - 증폭. 전혀 밴드가 없다면 동일한 역방향 바코드 또는 새로운 역방향 바코드 (단계 2.3)를 사용하여 시료를 재 - 증폭. 다시 증폭 실패하면 PCR 저해제, PCR 저해제를 제거하는 열 기반 DNA 정화를 수행하는 경우에는 시료에 존재할 수있다.
참고 : 성공적인 증폭이 가능하지 않을 경우에 박테리아 DNA의 농도 또는iginal 샘플이 부족 (<5 NG / μL)입니다. - 무 템플릿 제어 밴드의 부재에 주목하여 시약 오염의 부재를 확인한다.
- 380 bp의 주위에 하나의 강력한 밴드를 지적하여 각각의 샘플을 성공적으로 증폭을 확인합니다. 이중 대역이있는 경우, 다른 역 바코드 (단계 2.3)를 이용하여 시료를 재 - 증폭. 전혀 밴드가 없다면 동일한 역방향 바코드 또는 새로운 역방향 바코드 (단계 2.3)를 사용하여 시료를 재 - 증폭. 다시 증폭 실패하면 PCR 저해제, PCR 저해제를 제거하는 열 기반 DNA 정화를 수행하는 경우에는 시료에 존재할 수있다.
- -20 ° C에서 앰플 리콘의 나머지 70 μl를 저장합니다. 이 밴드를 산출하지 않았다 가정 노 템플릿 제어 나머지 20 μl를 버린다.
3. 라이브러리 풀링 및 높은 처리량 시퀀싱
- 하나의 멸균 튜브에 각 앰플 리콘의 - (5 μL 2) 동일한 볼륨을 결합하여 앰플 리콘 풀을 만듭니다. 샘플에서의 주파수 대역, 특히 약한 본다면, 샘플의 나머지 두 볼륨 대하여 추가한다.
- 제조업체의 지침 (22) 다음하는 PCR 정리 키트를 사용하여 앰플 리콘 풀에서 PCR 프라이머를 제거합니다. 앰플 리콘 풀 볼륨이 100 μL를 초과하면 여러 열로 청소를 수행합니다. 참고 : 각 열은 100 μl의 용량을 가지고있다.
- -20 & #에서 라이브러리를 저장(176), C 또는 다음 단계로 진행합니다.
- 해당되는 경우, 최종 라이브러리 생성하기 위해 프라이머없는 앰플 리콘 풀을 결합한다. 분광 형광 또는 시스템 (23)를 사용하여 라이브러리의 DNA 농도를 측정. 1.8 사이 260/280 비율 - 2.0 순수한 DNA를 나타낸다.
- 20 nm의 라이브러리를 희석. 전기 영동을 이용하여 기기 (400)의 주위 BP 단일 밴드를 시각화하여 라이브러리의 질을 확인한다. 형광 측정 시스템 (23)를 사용하여 라이브러리의 농도를 확인한다.
- 2 ㎚에 대한 라이브러리를 물에 희석하여 최종 1:10 희석을 수행한다. 그런 다음, 무기한 20 ° C의 라이브러리를 저장합니다.
- 세 가지 요구 시퀀싱 프라이머를 최종 라이브러리의 나누어지는 보내기 (1 읽기 (2)를 읽고, 색인, 자재 / 장비의 표 참조) Illumina의 시퀀서에 순서가 될 수 있습니다. 300 인 미만 샘플 시퀀싱 다중화 된 경우, O를 단일 엔드 300 bp의 실행을 사용하여 12 bp의 인덱스와 읽기오후 5시 최종 라이브러리 농도 10 % 변성 PhiX의 스파이크에와 NA MiSeq. 자세한 순서 지침 Caporaso 등. ISME J 2012 10의 보충 자료를 참조하십시오.
4. 서열 분석
주 : 여기에 설명은 QIIME 1.8.0 소프트웨어 패키지를 이용하여 서열 분석을위한 기본 파이프 라인이다. 편의를 위해 제공된 명령은 12 bp의 인덱스 파일 index.fastq이라고하고, 300 bp의 염기 서열은 파일 sequences.fastq이라고 판독 판독 매핑 파일 mapping.txt라는 것을 가정한다. QIIME 또는 MacQIIME (16)를 설치하고이 명령을 실행하는 UNIX의 기본 사항을 숙지. 에서 QIIME에 대한 전체 설명서를 읽기 :
- 실험 (표 1)에 대한 매핑 파일을 작성합니다. 가능한 한 많은 메타 데이터를 포함합니다. 배치 효과가 있는지 여부를 확인하기 위해 샘플을 추출하거나 동일한 일괄 적으로 증폭되고있는 주. 텍스트 파일, 예를 들어, mapping.txt으로 매핑 파일을 저장합니다. validate_mapping_file.py -m mapping.txt -o mapping_output : 다음 명령을 실행하여 매핑 파일의 서식의 유효성을 검사합니다
- 이러한 FastQC 같은 프로그램을 검사하는 높은 처리량 시퀀스 데이터 품질을 이용하여 판독한다 (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).도 5는 염기 서열마다 품질을 시험 시퀀스의 품질을 점검 그는 성공적으로 실행에서 예상 될 수있다.
참고 : 시퀀서는 기본이 잘못 호출 된 확률에 해당하는 각각의 뉴클레오티드 염기 Phred의 품질 평가 점수를 할당합니다. (10)의 Phred의 품질 평가 점수는 뉴클레오티드 할당이 잘못되었음을 10 %의 가능성이 있음을 나타냅니다에드는, 20 (30)은 0.1 %의 확률을 나타내며, 1 %의 확률을 나타내고, (40) (가능한 가장 높은 점수)는 0.01 %의 확률로 24를 나타냅니다. - split_libraries_fastq.py --rev_comp_mapping_barcodes -i sequences.fastq : 품질 시퀀싱 데이터를 필터링하고, (25)이 명령을 실행함으로써 ( "sl_out"이라는 경우에도, 폴더)에 그 결과를 저장하고, 역 다중화, 키로서 매핑 파일을 사용하여 -o sl_out / -b index.fastq -m mapping.txt -q (29)
주 : Q 플래그는 예를 들어, 최대 허용 할 수없는 Phred 품질 점수를 나타내며, "29 -q"기본 통화의 99.9 %의 정확도를 보장, 30 아래 Phred 점수 임의의 시퀀스를 필터링합니다. - Greengenes 16S 운영 분류 학적 단위 (OTU) 참조 데이터베이스 26 (http://qiime.org/home_static/dataFiles.html)를 사용하여이 명령 (27)을 실행하여 오픈 참조 OTU 따기 수행 pick_open_reference_otus.py -i sl_out / seqs. FNA -r 97_otus.fasta -o ucrss / -s 0.1
주 : -s 플래그를 나타냅니다디 노보 클러스터에 포함되는 참조 데이터베이스에 정렬 실패 서열의 일부분. 드 노보 클러스터링 실패한 서열의 10 %를 포함하는 "0.1 -s". OTU 따기 과정을 병렬화 및 다중 코어를 사용할 수있는 경우 시간 일에서 처리 시간을 줄이기 위해 -a 플래그를 사용하십시오. - summarize_taxa.py -i ucress / otu_table_mc2.biom -o summarized_otuSpecies / -L 7 : 28이 명령을 실행하여 종 수준에서 OTUs을 병합하여 사용자 친화적 분류 학적 풍부 테이블 만들기
주 : 결과 테이블 용이 스프레드 시트 소프트웨어에 의해 보여 질 수있다. 16S rRNA의 염기 서열이 확실하게 종 수준의 해상도를 제공하지 않습니다. - QIIME 스크립트 alpha_diversity.py와 여러 알파 다양성 지표를 계산하여 각 샘플 내에서 생태 학적 다양성을 결정합니다. 그 후, QIIME 스크립트 beta_diversity.py를 사용하여 샘플의 쌍 사이의 다양성을 결정합니다.
- 비스황제 (29) 교장을 사용하여, 예를 들어, 데이터를 ualize 것은 플롯 또는 히트 맵을 조정합니다.
- QIIME의 compare_catagories.py 스크립트 (30), 예를 들어, 매핑 파일 범주의 공식 통계 비교를 수행합니다.
주 :이 명령은 어떤 경우 매핑 파일의 오류를 나타내는 .html 파일이 포함 된 "mapping_output"라는 새 폴더를 만드는 내장 된 "validate_mapping_file.py"QIIME 스크립트를 사용합니다.
결과
16S rRNA 유전자 서열을 이용하여 면봉 상대 세균 존재비의 측정을 가능하게하는 프로토콜의 일반적인 개요 한 국지적 프로토콜 인간 질 면봉에 최적화 된 도면에 도시되어 있지만 쉽게 대부분 점막 샘플링 사이트에 적용될 수있다 다른 호스트.도 2는 비드 비팅 프로토콜을 사용하여 단리 할 수있는 고품질의 DNA와 RNA를 보여준다.도 3은 샘플마다 증폭 정확한 단일 강한 밴드가 수득 12 샘플의 성공적인 PCR 증폭을 도시한다 크기와 밴드를 양보하지 않은 각각의 물을 제어 할 수 있습니다. 그림 4는 이전 순서에 최종 라이브러리 풀의 정량화를 보여줍니다. (5)는 단일 엔드 300 염기쌍의 MiSeq 실행 후 전형적인 시퀀스 품질 프로파일을 보여줍니다.
"SRC ="/ 파일 / ftp_upload / 53939 / 53939fig1.jpg "/>
그림 1. 프로토콜의 도식 개요. 첫째, 핵산 이소 아밀 알코올 페놀, 클로로포름 등을 포함하는 완충 용액에서 비드 박동에 의해 면봉로부터 추출된다. 16S rRNA 유전자의 가변 영역 (4)은 다음 PCR을 이용하여 생성 된 핵산으로부터 증폭된다. 샘플 수백까지에서 PCR의 증폭은 결합과 단일 실행에 순서가있다. 얻어진 서열은 세균 상대 존재비를 결정하는 참조 데이터베이스에 매칭된다. 전체 프로토콜은 약 3 일을 수행 할 수 있습니다. 이 그림의 더 큰 버젼을 보려면 여기를 클릭하십시오.
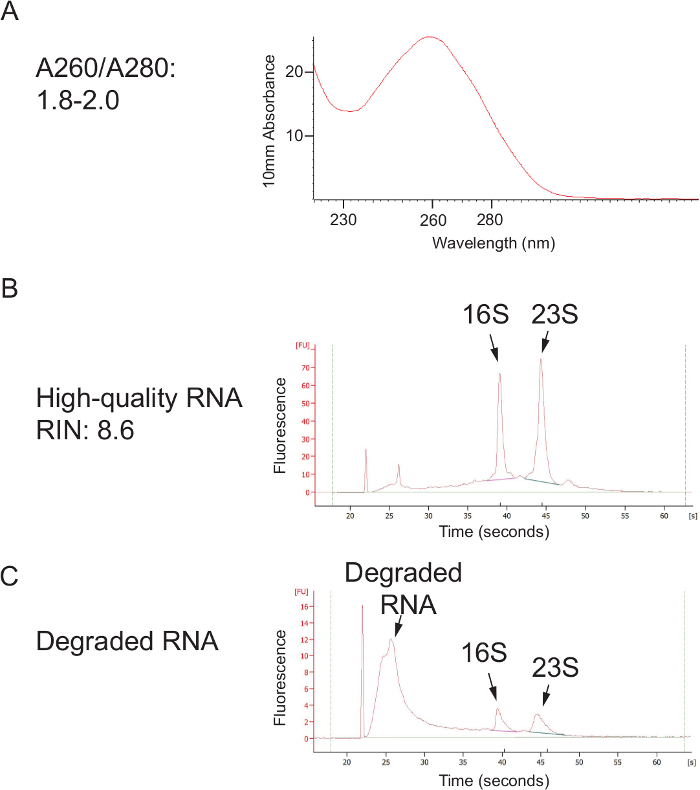
그림 2. 고품질 핵산 추출은 페놀을 사용하여 : 클로로포름 구슬은 M 잔ethod. (A) DNA 품질, 분광 광도계를 사용하여 평가 된 바와 같이. 1.8과 2.0 사이의 A260 / A280 비율은 페놀 또는 단백질에 오염되지 않은 순수한 핵산을 나타냅니다. (B) 열 정리 한 후,이 프로토콜은 고품질의 RNA를 얻을 수 있고, 강한 16S와 23S rRNA의 봉우리로 표시. 샘플을 수집 한 후 (수송 및 보관시) 차가운 유지되지 않으면 (C) RNA 저하가 발생할 수 있습니다 또는 RNases 처리 중에있는 경우. 이 그림의 더 큰 버전을 보려면 여기를 클릭하세요.
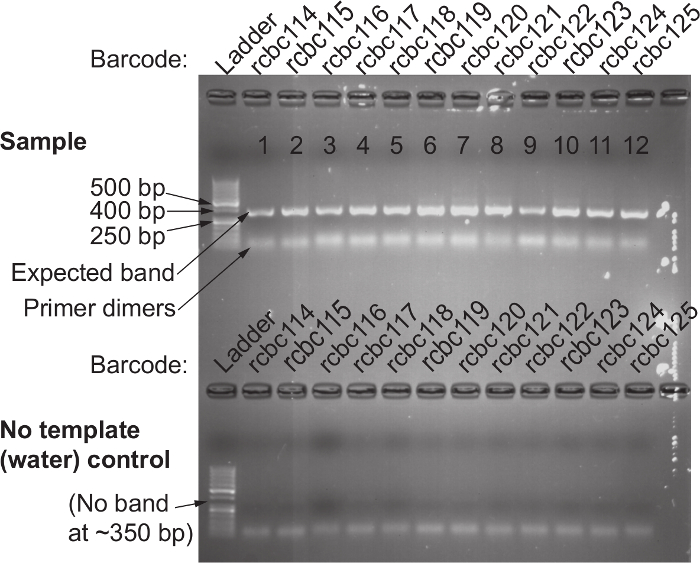
515F 및 바코드 806R 프라이머 세트를 사용하여 성공적인 16S rRNA의 유전자 증폭 그림 3. 확인. TOP) 젤 전기 영동은 380 염기쌍 약 단일 밴드의 존재를 확인하는 데 사용되는 난n은 템플릿으로 증폭 된 모든 샘플. 밴드의 부재는 실패 증폭을 나타냅니다; 이것은 인간의 오류로 인해 반복해야 그 샘플에서 PCR 반응에 일반적으로있다. 아래) 아니오 템플릿 (물) 컨트롤이 밴드의 선물을하지 말았어야 같은 프라이머 쌍을 병렬로 실행합니다. 수분 제어 밴드의 존재는 오염 된 시약을 나타내고; 오염 될 수있는 시약을 폐기 다시 수행하는 프라이머 쌍에 대한 템플릿과 물 제어 모두의 PCR의 증폭을. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
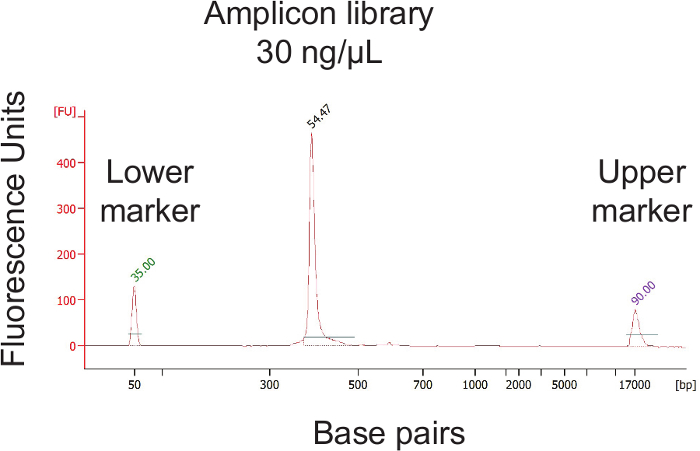
그림 4. 정량 최종 라이브러리 풀 농도 및 검증 라이브러리 크기. 각각의 샘플 증폭 풀링 후, 일최종 라이브러리 풀의 전자 농도를 결정한다. 라이브러리 풀 후 추가로 2 nM의 농도를 달성하기 위해 희석해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
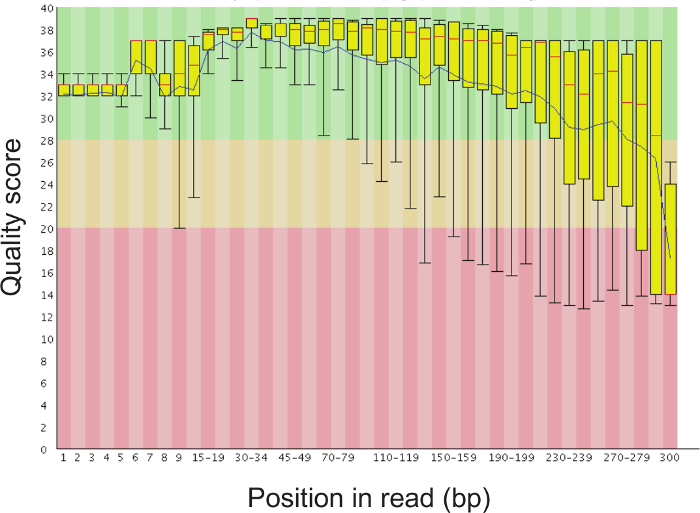
그림 5. 대표 바 읽기의 각각의 위치에서 순서 품질 평가 점수의 플롯. 시퀀스 품질 200 염기쌍 후 드롭하는 것은 정상이지만, 평균 품질 점수는 30 이상 남아 있어야 더 큰 버전을 보시려면 여기를 클릭하십시오 이 그림의.
| #SampleID | 바코드 순서 | LinkerPrimer 순서 | rcbcPrimer | SampleType | 추출 일괄 | 확대 플레이트 | 기술 | |||
| http://qiime.org/_static/Examples/File_ : #An 예를 매핑 파일에서 찾을 수 있습니다 형식 / 예_ Mapping_ file.txt를 | ||||||||||
| AG2350 | TCCCTTGTCTCC | CCGGACTACHVGGGTWTCTAAT | rcbc000 | 경부의 자루 걸레 | 1 | 에이 | ||||
표 1. 매핑 파일 템플릿입니다. 크레아팅은 정확하고 완전한 매핑 파일이 성공적 프로토콜을 실행하기위한 중요하다. 매핑 파일은 QIIME을 실행하기위한 필요뿐만 아니라 체계적인 편향에 대한 데이터 (예를 들어, 배치 별 편차)을 분석하기 위해 샘플 바코드 및 메타 데이터 간의 링크를 유지하고, 결정하기 위해 연구를 가능하게되지 메타 데이터 및 세균 집단 사이의 흥미로운 상관 관계. 베어 본 매핑 파일이 제공되지만, 사용자는 가능한 메타 데이터를 포함하는 많은 열을 추가하는 것이 좋습니다. 질 면봉에 대한 추가 메타 데이터의 예는 면봉으로 수집, 호르몬 피임 유형 (해당되는 경우), 성병 감염 테스트 결과 등 참가자의 연령, 날짜 / 시간을 포함
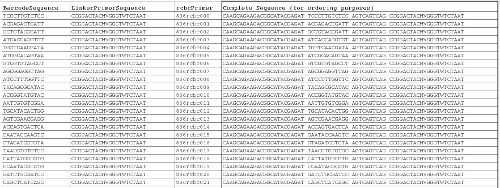
바코드 역방향 프라이머 시퀀스 (10)의 보조 파일 (1) 목록 . 처음 세 열은 매핑 파일을 완료하는 데 사용 할 수 있고, 마지막 열은 목적을 주문에 대한 전체 프라이머 시퀀스를 제공합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기서 우리는 인간의 질 면봉 내에서 식별 및 상대 세균의 존재비의 특성에 대한 프로토콜을 설명합니다. 이 프로토콜은 용이하게 다른 시료와 같은 의자와 같은 종류이나 다른 신체 부위의 면봉과 다양한 소스로부터 수집 된 샘플에 대해 적응 될 수있다. 페놀과 클로로포름의 완충 용액에서 비드 박동에 의한 핵산의 추출은 임상 연구를 통해 수집 된 귀중한 샘플로 작업 할 때 특히 중요하다 모두 DNA와 RNA의 분리 수 있습니다. RNA의 동시 컬렉션 RNA-서열을 통해 기능 세균, 호스트 및 바이러스 성 기부를 결정 할 수있는 기회를 제공한다 분리 된 세균의 DNA는 세균 분류학 식별 및 게놈 어셈블리에 대한 우수하다. 설명 된 프로토콜이 성공적으로 인간, 송곳니 포함한 샘플 유형의 넓은 범위에 배치 된 검증 원스텝 프라이머 세트, 환경 시료 (10)를 사용하여 . 바코드 프라이머 수천의 가용성은 시퀀싱 비용 샘플과 엄청난 비용 절감의 다중화 수 있습니다. 200 샘플을 다중화하는 경우 (모든 시약, 하나의 시퀀스를 실행하고, 프라이머하지만 장비 포함) 전체 비용은 샘플 당 약 $ 20입니다. 또한, 동일한 샘플 위치에서 여러 면봉는 전체 파이프 라인을 통해 독립적으로 처리되는 매우 높은 재현성이있다. 전반적으로, 프로토콜, 효율적인 유연하고 안정적이며 반복적 인 비용이다.
이 프로토콜의 핵산 추출 부는 페놀 및 클로로포름으로 작업 할 때 필요한 안전 조치 및 높은 처리량, 96- 웰 플레이트 형식으로 파이프 라인 자동화의 어려움에 의해 제한된다. 또한, 활발한 비드 매질은 약 6 킬로 조각에 기계 용해 가위에 대한 세균의 DNA를 사용; 긴 DNA 단편의 하류 어플리케이션 비드 비팅 (S)의 시간에 필요한 경우hould 단축 될 수있다. 이 프로토콜의 박테리아 식별 부분의 제한 16S rRNA 유전자 염기 서열에 의존하는 방법에 고유합니다. 16S rRNA의 염기 서열은 속 심지어 종 수준으로 세균 식별을위한 이상적이지만, 거의 변형 수준의 식별 정보를 제공하지 않습니다. 16S rRNA 유전자의 가변 영역 V4 대부분의 세균 종 (11) 사이에 견고한 판정을 제공하지만, 예컨대 31 Oligotyping 추가적인 계산 방법은 정확하게 이러한 락토 crispatus 같은 특정 종류를 식별하는데 사용될 필요가있다. 이 프로토콜은 이러한 목적으로 사용할 수있는 전체 게놈 DNA 및 RNA의 추출을 가능하게하지만 최종적으로, 특히 시료 내의 정확한 세균 작용 성능에 관한 정보는, 단독으로 16S rRNA 유전자 서열 분석에 의해 결정될 수 없다.
이 프로토콜 성공을 보장하는 가장 중요한 단계는 오염의 지속을 방지하기 위해 상당한주의를 취하고있다보내고 샘플 수집, 핵산 추출 및 PCR 증폭. 깨끗한 장갑을 착용하고 멸균 면봉, 튜브, 가위를 사용하여 시료 채취시 무균를 확인합니다. 수집 물질의 오염 평가하기 위해, 샘플링시에 반송 관에 직접 추가 미사용 면봉을 배치하여 음성 대조군 면봉을 모은다. 실험실에서, 단지 오염 제거 용품을 포함하는 단 분자 학년, DNA가없는 시약을 사용하여 멸균 후드에있는 모든 사전 증폭 단계를 수행합니다. 핵산 추출하는 동안, 사용하지 않는 폐쇄 모든 튜브를 각 샘플 새로운 멸균 집게와 신선한 장갑을 사용하고 유지하여 교차 오염을 방지합니다. 평행하지 않는 면봉을 처리하는 샘플 수집 및 핵산 추출 양의 무균을 보장한다; 사용되지 않는 면봉은 이소프로판올 침전과 에탄올 세척 후 펠렛을 양보해서는 안된다. 펠릿이 나타나지 않는 경우의 가능한 원인을 확인하기 위해 16S rRNA 유전자 증폭을 수행오염은 (예를 들어, 연쇄상 구균 또는 존재 피부 오염을 나타낼 것이다). 또한, PCR 반응 시약 및 오염되지 않은 것을 보장하기 위해 병렬 없음 템플릿 제어 반응으로 증폭 된 PCR를 수행한다. 밴드가 아니 템플릿 컨트롤에 표시되는 경우, 시약을 폐기하고 새로운 시약으로 증폭를 반복합니다. 이러한주의 사항을 복용 관심있는 박테리아의 성공적인 시퀀싱을 보장합니다.
상기 증폭 된 PCR 증폭 단계는 대부분의 문제를 요구하는 경향이있다. 열두 샘플 세트로 증폭하면 효율과 일관성 사이의 균형을 제공한다. 주어진 증폭 세트의 모든 샘플에서 밴드의 완전한 부재는 예를 들면, 시약을 추가 잊고 또는 잘못 열 순환기를 프로그래밍, 시스템 적 오류를 나타냅니다. 몇몇 샘플에서 밴드의 부재는 사람의 실수에 주로 기인하고 증폭 다시 R을해야샘플 및 역방향 프라이머의 동일한 쌍으로 해제. 밴드의 유무를 계속하는 경우, 시료가 다른 바코드와 역방향 프라이머를 사용하여 재 증폭 될 수있다. 여러 역방향 프라이머와 반복 증폭 실패는 시료에 존재하는 억제제를 나타낼 수 있습니다. 이 경우, 열으로 DNA를 청소 종종 상당히 상대 세균 존재비를 변경하지 않고 억제제를 제거합니다. 다중 대역이 증폭 후 발생할 경우, 다른 역방향 프라이머 바코드 샘플을 재-증폭.
라이브러리 풀을 제조 할 때 환경 오염을 방지하고, 하나의 특정 증폭 생성물을 보장 외에도 성공 시퀀싱 치료에 의존한다. 목표는 약 시퀀싱 동일한 수의 샘플 당 판독되도록 각 시료의 증폭 몰량을 결합하는 것이다. 종래 증폭 핵산 농도를 비교하는 경우, 단순히 각각 SA 같은 부피 첨가라이브러리 풀을 만들 때 mple의 증폭은 충분하다. 핵산 농도는 크게 상이하고, 동량으로 첨가하는 경우에는, 저 핵산 농도와 시료의 잘못 읽기 낮은 숫자로 표현한다. 이 경우에, 겔 밴드의 상대 강도에 기초하여 상기 저농도 샘플에서 증폭 높은 볼륨을 추가 할 수있다. 대안 적으로,보다 엄밀 샘플 몰량을, 각 앰플 리콘의 프라이머를 제거하려면 형광 dsDNA 정량 키트를 사용하여 각각의 시료의 앰플 리콘의 농도를 정량화하고 정확하게 조합 할 수있다.
균형 앰플 리콘 풀이 생성되면 신중 풀의 농도를 측정하는 것이 중요해진다. PhiX 후속주의 희석 스파이크의 판독의 복잡성이 최적의 시퀀싱 결과를 달성하는데 중요 증가. sequen를 사용하여 높은 처리량 시퀀서합성으로 향하도록는 플로우 셀의 클러스터의 농도에 매우 민감하다. 너무 낮은 품질 점수, 낮은 데이터 출력 및 부정확 한 역 다중화 (32), overclustering가 발생합니다 집중 라이브러리 풀로드. 너무 또한 낮은 데이터 출력됩니다 희석 된 라이브러리 풀로드. 조심스럽게 이전 순서로 라이브러리 풀을 정량화하는 것은 최적의 결과를 보장합니다.
16S rRNA 유전자 염기 서열은 주어진 샘플 내에 존재하는 박테리아의 포괄적 인 평가를 제공하고, 가설 생성에 절대적으로 중요한 첫 번째 단계입니다. 또한 메타 데이터의 풍부한의 존재는 특정 박테리아 종과 중요한 생물학적 요인 사이의 연결을 테스트 할 수있는 연구를 할 수 있습니다. 또한, 동일한 16S 정보는 PICRUSt 33 도구를 사용하여 세균 기능을 추론하는데 사용될 수있다. 궁극적 인 목표는 새로운 연결이 될 수 식별 할 수 16S 특성을 사용하는 것입니다추가 테스트 및 인간의 건강과 질병에 세균 마이크로 바이 옴의 영향을 우리의 성장 이해에 추가 모델 시스템에서 확인.
공개
The authors have nothing to disclose.
감사의 말
우리는 프로토콜에 중요한 피드백 엘리자베스 바 이른, 데이비드 Gootenberg, 그리고 크리스티나 Gosmann 감사드립니다; 샘플 준비 안내 및 시위에 대한 메간 볼드리지, 스콧 HANDLEY, 신디 모나코, 제이슨 노먼; 프로토콜 조언과 유익한 토론 웬디 가렛, 커티스 Huttenhower, 건너 뛰기 버진, 브루스 워커; 시퀀싱 지원 제시카 Hoisington - 로페즈. 이 작품은 빌과 멜린다 게이츠 재단과 NIAID (1R01AI111918)에 의해 지원되었다. DSK는 버로우즈 웰컴 펀드에서 추가 지원을 받았다. MNA 보너스 번호 NIGMS에서 T32GM007753, 그리고 바울과 데이지 소로스 원정대에 의해 지원되었다. 내용은 전적으로 저자의 책임이며 반드시 NIGMS 또는 NIH의 공식 견해를 대변하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| Mini-Beadbeater-16 | BioSpec | 607 | |
| PCR workstation | Any PCR hood can be used, e.g., the AirClean 600. | ||
| Thermocycler | Any thermal cycler with a heated lid can be used, e.g., MJ Research PTC-200. | ||
| Electrophoresis system | Any electrophoresis system can be used, e.g. the Thermo Scientific Owl EasyCast B1 Mini Gel Electrophoresis system. | ||
| Nanodrop | Thermo Scientific | 2000C | Any other DNA quantification method will be sufficient |
| Bioanalyzer | Agilent | 2100 | An alternative is the Agilent 2200 TapeStation Instrument. Not absolutely necessary but very helpful. |
| MiSeq or HiSeq | Illumina | ||
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Catch-All Sample Collection swab | Epibio | QEC89100 | Other swabs can be used but the Catch-All swab is recommended by the Human Microbiome Project. |
| ELIMINase | Fisher | 04-355-31 | |
| SteriFlip 50 ml filtration device (0.22 µm) | EMD Millipore | SCGP00525 | |
| 0.1 mm glass beads | BioSpec | 11079101 | |
| 2 ml screw-cap tubes | Sarstedt | 72.694.006 | For bead beating |
| UltraPure 5M NaCl | Life Technologies | 24740-011 | Molecular Biology Grade |
| 1 M Tris-HCl | Ambion (Invitrogen) | AM9856 | Molecular Biology Grade |
| 0.5 M EDTA | Ambion (Invitrogen) | AM9260G | Molecular Biology Grade |
| Sodium Dodecyl Sulfate, 20% Solution | Fisher | BP1311-200 | Molecular Biology Grade |
| UltraPure DNase/RNase-free distilled water | Ambion | 10977-015 | Molecular Biology Grade, for buffer preparation |
| 2-Propanol BioReagent, for molecular biology, ≥99.5% | Sigma | I9516-500ML | Molecular Biology Grade |
| Phenol:Chloroform:IAA, 25:24:1 | Invitrogen | AM9730 | Warning: Toxic |
| 3 M Sodium Acetate, pH 5.5 | Life Technologies | AM9740 | Molecular Biology Grade |
| Disposable sterile polystyrene forceps, PS | Cole Parmer | EW-06443-20 | |
| 1.5 ml, clear, PCR clean tubes | Eppendorf | 22364120 | |
| PCR grade water | MoBio | 17000-11 | For PCR |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| dNTP mix | Sigma | D7295-0.5mL | |
| 0.2 ml PCR 8-tube with attached clear flat caps, natural | USA Scientific | 1492-3900 | Any 8-tube strips that are DNase, RNase, DNA, and PCR inhibitor free will work |
| Agarose | BioExpress | E-3121-25 | |
| 50x TAE buffer | Lonza | 51216 | |
| DNA gel stain | Invitrogen | S33102 | |
| 6x DNA Loading Dye | Thermo (Fisher) | R0611 | |
| 50 bp GeneRuler Ladder | Thermo (Fisher) | SM0373 | |
| AllPrep DNA/RNA kit | Qiagen | 80284 | |
| UltraClean PCR Clean-up Kit | MoBio | 12500-100 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P11496 | An alternative is Qubit Fluorometric Quantification (Life Technologies) |
| Name | Company | Catalog Number | Comments |
| Primers: | |||
| 515F (forward primer) 5'-AATGATACGGCGACCACCGAG ATCTACACTATGGTAATTGT GTGCCAGCMGCCGCGGTAA-3' | Order at 100 nmole; Purification: Standard Desalting. Resuspend at 100 µM. **Critical: primers must be resuspended with MoBio PCR Grade Water (see above) in a hood to avoid contamination.** | ||
| Reverse primers, see the Supplemental Code File and: ftp://ftp.metagenomics.anl.gov/data/misc/EMP/SupplementaryFile1_barcoded _primers_515F_806R.txt | IDT is recommended | If ordering large sets of primers, order as a 96-well plate at the 100 nmole scale. Resuspend at 100 μM. Full directions for primer ordering and resuspension at http://www.earthmicrobiome.org/files/2013/04/EMP_primer_ordering_and _resuspension.doc. **Critical: primers must be resuspended with MoBio PCR Grade Water (see above) in a hood to avoid contamination.** | |
| Read 1 Sequencing Primer 5'-TAT GGT AAT TGT GTG CCA GCM GCC GCG GTA A-3' | 25 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| Read 2 Sequencing Primer 5'-AGT CAG TCA GCC GGA CTA CHV GGG TWT CTA AT-3' | 26 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| Index Sequencing Primer 5'-ATT AGA WAC CCB DGT AGT CCG GCT GAC TGA CT-3' | 27 nmole; Purification: Standard Desalting. Resuspend at 100 µM. | ||
| PhiX Control v3 | Illumina | FC-110-3001 | Required if performing the sequencing in-house. If the sequencing will be performed by a third-party sequencing center, they will already have PhiX. |
참고문헌
- Huttenhower, C. Structure, function and diversity of the healthy human microbiome. Nature. 486, 207-214 (2012).
- O'Hanlon, D. E., Moench, T. R., Cone, R. A. Vaginal pH and microbicidal lactic acid when lactobacilli dominate the microbiota. PloS one. 8, e80074(2013).
- Aldunate, M. Vaginal concentrations of lactic acid potently inactivate HIV. The Journal of antimicrobial chemotherapy. 68, 2015-2025 (2013).
- Anahtar, M. N., et al. Cervicovaginal bacteria are a major modulator of host inflammatory responses in the female genital tract. Immunity. 42, 965-976 (2015).
- Reyes, A., Wu, M., McNulty, N. P., Rohwer, F. L., Gordon, J. I. Gnotobiotic mouse model of phage-bacterial host dynamics in the human gut. Proceedings of the National Academy of Sciences of the United States of America. 110, 20236-20241 (2013).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical biochemistry. 162, 156-159 (1987).
- Srinivasan, S., et al. Temporal variability of human vaginal bacteria and relationship with bacterial vaginosis. PloS one. 5, e10197(2010).
- Dols, J. A., et al. Microarray-based identification of clinically relevant vaginal bacteria in relation to bacterial vaginosis. American journal of obstetrics and gynecology. 204, 301-307 (2011).
- Segata, N., et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nature methods. 9, 811-814 (2012).
- Caporaso, J. G., et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. The ISME journal. 6, 1621-1624 (2012).
- Caporaso, J. G., et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences of the United States of America. 108, Suppl 1 4516-4522 (2011).
- 16S rRNA Amplification Protocol. Earthmicrobiome Project. , Available from: www.earthmicrobiome.org (2015).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, Suppl 1 4680-4687 (2011).
- Srinivasan, S., et al. Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PloS one. 7, e37818(2012).
- Caporaso, J. G., et al. QIIME allows analysis of high-throughput community sequencing data. Nature methods. 7, 335-336 (2010).
- Werner, J. MacQIIME. , Available from: http://www.wernerlab.org/software/macqiime (2015).
- Schloss, P. D., et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and environmental microbiology. 75, 7537-7541 (2009).
- Edgar, R. C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature. 10, 996-998 (2013).
- NanoDrop 2000/2000c Spectrophotometer, V1.0 User Manual. Thermo Fisher Scientific. , Available at: http://www.thermoscientific.com/content/dam/tfs/ATG/CAD/CAD Documents/Product Manuals & Specifications/Molecular Spectroscopy/UV Visible Spectrophotometers/Spectrophotometer Systems/NanoDrop/NanoDrop-2000-User-Manual-EN.pdf (2009).
- AllPrep DNA/RNA Mini Kit. Qiagen. , Available from: https://http://www.qiagen.com/us/shop/sample-technologies/rna-sample-technologies/dna-rna-protein/allprep-dnarna-mini-kit/ - orderinginformation (2015).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of visualized experiments. , (2012).
- UltraClean PCR Clean-Up Kit Instruction Manual. MoBio. , Available from: http://www.mobio.com/images/custom/file/12500(1).pdf (2013).
- Quant-iT PicoGreen dsDNA Reagent. Invitrogen. , Available at: https://tools.thermofisher.com/content/sfs/manuals/mp07581.pdf (2008).
- Quality Scores for Next-Generation Sequencing. Illumina. , Available from: http://www.illumina.com/documents/products/technotes/technote_Q-Scores.pdf (2011).
- split_libraries_fastq.py. QIIME. , Available from: http://qiime.org/scripts/split_libraries_fastq.html (2015).
- DeSantis, T. Z., et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB. Applied and environmental microbiology. 72, 5069-5072 (2006).
- pick_open_reference_otus.py. QIIME. , Available from: http://qiime.org/scripts/pick_open_reference_otus.html (2015).
- summarize_taxa_otus.py. QIIME. , Available from: http://qiime.org/scripts/summarize_taxa.html (2015).
- Vazquez-Baeza, Y., Pirrung, M., Gonzalez, A., Knight, R. EMPeror: a tool for visualizing high-throughput microbial community data. GigaScience. 2, 16(2013).
- Comparing categories. QIIME. , Available from: http://qiime.org/tutorials/category_comparison.html (2015).
- Eren, A. M., et al. Exploring the diversity of Gardnerella vaginalis in the genitourinary tract microbiota of monogamous couples through subtle nucleotide variation. PloS one. 6, e26732(2011).
- Diagnosing and preventing flow cell overclustering on the MiSeq system. Illumina. , Available from: http://support.illumina.com/content/dam/illumina-marketing/documents/products/other/miseq-overclustering-primer-770-2014-038.pdf (2015).
- Langille, M. G., et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature biotechnology. 31, 814-821 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유