Method Article
Ratiometric кальция изображений отдельных нейронов в себя Caenorhabditis Elegans
В этой статье
Резюме
Этот протокол описывает использование генетически закодированный Ca2 + репортеров, чтобы записывать изменения в нервной деятельности в себя червей Caenorhabditis elegans .
Аннотация
Она становится все более очевидным, что нейронные цепи деятельность в себя животных существенно отличается от видели на наркотизированных или подвижности животных. Высокочувствительный, генетически закодированный флуоресцентные Репортеры Ca2 + революционизировали записи ячейки и синаптической активности с помощью неинвазивных оптических подходов в поведения животных. При сочетании с генетические и молекулярные механизмы, optogenetic методы, модулируют активность клеток и цепи во время государства могут быть определены по-разному.
Здесь мы описываем методы для ratiometric Ca2 + изображений одного нейронов в свободно себя червей Caenorhabditis elegans . Мы демонстрируем простой монтаж технику, которая мягко оверлеи червей, растущих на стандартных медиа роста нематода (НГМ) агар блок с coverslip стекла, позволяя животных регистрируется в с высоким разрешением во время неограниченное движение и поведение. С этой техникой мы используем чувствительных Ca2 + репортер GCaMP5 для записи изменений в внутриклеточного Ca2 + в серотонинергической гермафродита определенных нейронов (HSNs), как они управляют яйцекладка поведение. Выражением совместного mCherry, Ca2 +-нечувствительным флуоресцентный белок, мы можем отслеживать положение HSN в течение ~ 1 мкм и правильным для колебания в флуоресцировании, вызванных изменениями в фокус или движения. Синхронный, инфракрасный brightfield изображения позволяет для записи поведение и животных отслеживания с помощью моторизованного столика. Интегрируя эти микроскопические методы и потоки данных, мы можем записать Ca2 + деятельность в C. elegans яйцекладка цепи мере между государствами активные и неактивные поведение более десятки минут.
Введение
Центральная цель неврологии — понять, как Нейроны общаются в цепи для привода поведение животных. Нейронных цепей интегрировать широкий спектр разнообразных сенсорные сигналы с целью изменения схемы активности, таким образом управляя поведенческие изменения, необходимые для животных ответить на их условиях. Нематода, C. elegans, имеет простой нервной системы с 302 нейронов, чьи синаптических связей были полностью сопоставленных1. Кроме того гены, которые кодируют белки, участвующие в синапсах высоко консервируют между2 C. elegans и млекопитающих. Несмотря на анатомические простоту его нервной системы он отображает комплекс репертуар поведения сохраняется, предоставление плодородной платформы, чтобы понять, как нейроны регулировать поведение3.
C. elegans поддаются применению широкого круга подходов, таких как генетические манипуляции, лазерной абляции клеток, электрофизиологические методы, а также в vivo оптических изображений4,5. Недавние исследования подготовили подробные карты крупных нейромедиатора, сигнализации систем в C. elegans включая холинэргические и ГАМК нейронных сетей. Эти исследования, а также текущих исследований для сопоставления выражение всех нейронов рецепторов G-протеин место этой модели в уникальном положении, чтобы использовать весьма подробные структурные и функциональные нейрональных подключения карты в полной мере понять как эти различных нейромедиаторов сигнал через различные рецепторы и сроками для привода различных аспектов поведения животных.
С целью изучения моделей динамической активности нейронов в любой системе, необходимым условием является развитие надежной методологии для записи деятельности в отдельных нейронов или всей цепи во время поведения. Особенно важное значение имеет ответственность таких оптических подходов к визуализации Пресинаптический активность, что диски синтеза синаптических пузырьков. Быстро и чувствительный флуоресцентные Репортеры внутриклеточных Ca2 +, а также повышение доступности чувствительные фотодетекторы, революционизировали запись ячейки и синаптической активности в awake, живых животных во время поведение. Потому, что главным результатом синаптического электрической активности заключается в регулировании Ca2 + каналы, изменения в внутриклеточного Ca2 + считается добросовестно доклад поведенчески соответствующие изменения в активности клеток.
В этом исследовании мы представляем подход для выполнения ratiometric Ca2 + изображений в серотонинергической HSN двигательных нейронов, которые способствуют яйцекладка поведение в C. elegans6,7. Этот подход опирается на предыдущие усилия для визуализации Ca2 + активности в C. elegans и яйцекладка контура во время поведения5,8,9,10,11 . Метод позволяет соотнести одновременно наблюдаемые изменения в активности клеток/цепи с яйцекладка события, а также изменения в состоянии животных опорно. Хотя мы используем этот подход для изучения деятельности взрослых червей, неопубликованные работы от нашей лаборатории показывает, что этот подход может быть расширен для несовершеннолетних животных на четвертый личиночной стадии (L4) также. Вполне вероятно, что деятельность других C. elegans нейронов, которые функционируют в различных схем и поведение должно быть аналогичным образом доступны с этой техникой. Другие недавно разработал быстрый Ca2 + индикаторы с non перекроя выбросов спектры12,13,14,15,16, optogenetic инструменты17 и генетически закодированный оптических показателей мембраны напряжения18, должен позволить нам выполнять проникающая «все оптические» расследования как изменения в активности нейронные цепи привода различных поведение государств.
протокол
1. штаммов, культура, средства массовой информации и монтаж животных
- Растут черви нематоды Caenorhabditis elegans при 20 ° C на стандартных 60-мм нематода среднего роста (НГМ) агар пластины семенами с ОР50 кишечной бактериальной продовольствия19.
- Подготовка двух плазмиды для каждой ячейки конкретных промоутер интерес: один, вождение выражение GCaMP5 для записи внутриклеточных Ca2 +, и во-вторых, вождение выражение mCherry для ratiometric количественный GCaMP5 флуоресценции изменений и Упростите Поиск объектов и измерения.
Примечание: GCaMP5:mCherry ratiometric изображений корректирует колебания в флуоресцировании GCaMP5, которые в результате изменения в направленности и животных движения, не фактические изменения в внутриклеточного Ca2 +. - Внедрить выражения GCaMP5 и mCherry плазмиды наряду с pL15EK видна спасательных маркер плазмида в гонад LX1832 lite-1(ce314), lin-15(n765ts) X мутанта животных и восстановления не Muv lin-15(+) животных, выражая GCaMP5 и mCherry от21,высокой копия трансген в20,22. Используйте lite-1 мутант фон для уменьшения синий свет избежания поведение23,24.
- Интегрируйте трансгенов в хромосомах мозаичностью сократить и упростить создание составных мутантных штаммов25.
Примечание: Штамм LX2004, описанные здесь носит комплексный высокой копия трансген, который выражает GCaMP5 и mCherry в HSNs от промоутера НЛП-3 (см. Таблицу материалов)26,27, 28 , 29. промоутер НЛП-3 было установлено диск сильное выражение в HSNs конце L4 и взрослых животных, не вызывая значительных дефектов развития HSN или яйцекладка поведение, по сравнению с другими промоутеров тестирование (e.g.,tph-1, EGL-6и unc-86). Этот штамм и другие, которые выражают GCaMP5 и mCherry в вентральной шнур (VC) двигательных нейронов, вульвы мышц и uv1 нейроэндокринные клетки доступны из центра генетики Caenorhabditis и были описаны детали их конструкции 27. - Применить ОР50, выбрать бактериальный питания от посеян плита агара NGM нижней части платины червя и использовать его для передачи ~ 20 конце L4 LX2004 животных, которые выражают GCaMP5 и mCherry в HSNs от промоутера НЛП-3 . Убедитесь что развивающихся вульвы в стереомикроскопом как ясно тёмное пятно, окруженный белый полумесяц. Инкубируйте животных при 20 ° C для 24-40 ч.
- После инкубации, применить ОР50 для подбора и передачи ~ 3 червей для несеяных NGM пластины, оставив небольшое количество пищи за для черви питаются во время визуализации. Обеспечение достаточного питания, как слишком мало бактерий еда будет поощрять Черви бродят от центра пластины в то время как слишком много пищи увеличит фон флуоресценции и привести к гипоксии.
- Лопаточкой плоский округлый вырезать ~ 20 мм х 20 мм кусок от пластины, перевозящих червей и передача блока лицом вниз на центр чистого 24 x 60 мм #1.5 coverslip (рис. 1). Запустите приложение из одной стороны сохранить пузырьки от захваченных под coverslip и мешая с изображениями. Применение coverslip #1 22 x 22 мм в верхней части блока уменьшить прилипание и испарения.
2. оборудование и установки приборов
- Место поставил, трансгенных червей на сцену инвертированным микроскопом с ≥ 0,7 числовой апертуры план-Апохромат 20 x объективной, моторизованные Ху этап управляемый с джойстиком, изображения разделителя и флуоресценции фильтры для одновременного GCaMP5 и mCherry возбуждения и выбросов, камеры для флуоресценции и инфракрасные brightfield изображений и triggerable системой освещения светодиодами (LED)(Рисунок 2).
Примечание: 80/20 splitter луча отправляет 80% сигнала изображения на камеру флуоресценции и 20% в brightfield камеру. Вертикальном положении микроскопа можно также использовать, но NGM кусок должен находиться между стеклянное скольжение и большой coverslip в этом случае.- Используйте бинокль окуляры для выбора червь для воображения. Если выбран животное, слайд инфракрасный фильтр на место выше конденсатора.
- Транзисторно транзисторная логика (ТТЛ) триггеры
- Прикрепите коаксиальные кабели от каждого из трех TTL триггер вывода линий на камеру флуоресценции. Подключите первый выход на вход BNC #3 Светодиодные системы освещения.
- Подключите второй выход к BNC адаптер «банан» с зеленым и коричневый провода от 8-контактный разъем GPIO, работает GPIO input #3 (контактный 4) и земли (контакт 5) инфракрасной камеры, соответственно.
- Соедините третий выход BNC адаптер «банан» с перемычки проводов работает на #8 цифровой вход и в цифровой приобретения устройства (рис. 2B).
- Приобретение цифрового устройства (DAQ)
- Подключите DAQ микроконтроллер Совет (см. Таблицу материалов) к компьютеру с помощью кабеля USB. Обновление микропрограммы с стандартом Firmata протокола (см. Таблицу материалы) и настройте USB-порт для связи 57600 бод.
- Светодиоды
- Запуск программного обеспечения LED контроллер (см. Таблицу материалы). Переключите режим триггера из «непрерывной «Условный» и выберите канал триггера ' 3' для 470 и 590 нм светодиоды.
- Включите и введите светодиод питания для каждого светодиода (например, набор 470 нм светодиодные до 20% и 590 нм светодиодные до 40%).
- Запустите сценарий «XY-этап финал» Бонсай (см. Таблицу материалы) серийный этап связи30. Щелкните на узле серый «CsvWriter» и выберите папку для сохранения записанного X и Y этап информацию (рис. 3). Нажмите зеленую стрелку на панели инструментов для инициализации DAQ.
Примечание: Скрипт начнет запись стадии позиции X и Y, когда флуоресценции камеры TTL сигналом. Этот сценарий выводит четыре столбца данных: рама номер X позиции (мкм), позиция Y (мкм) и интервал между кадрами (s). - В инфракрасной камеры, программное обеспечение для записи (см. Таблицу материалы) в разделе «Пользовательские режимы видео,» выберите «Режим 1» (2 x 2 биннинга; 1 024 x 1 024 пикселей), и «Raw формат пикселей 8». Под ' триггер / строб ', установите входной линии триггера (GPIO) «3», полярность «Высокий», «Режим», «14». Тумблер, «Разрешить», чтобы остановить кадр приобретения до получения сигнала TTL триггер.
- Оставляя открытым окно, нажмите на красную кнопку «Запись» на панели инструментов вид главной камеры. Выберите папку для последовательности изображений для сохранения. Выберите режим записи «Buffered» и сохранить «Изображения» в формате JPEG. Нажмите кнопку «Начать запись» для инициализации приобретения.
- Флуоресценции камеры и изображений разделителя
Примечание: GCaMP5 и mCherry флуоресценции каналы должны быть собраны одновременно для обеспечения правильного изображения регистрации для ratiometric количественный. Сплиттер изображения позволяет приобретение 2 канальный GCaMP5 и mCherry люминесценции на один датчик.- В закладке «Захват» программного обеспечения получения изображений (см. Таблицу материалы), установить выдержка до 10 мс, биннинг 4 x, и глубина изображения для 16-разрядных. Выберите по центру камеры подмассив 512 пикселей в ширину и 256 пикселей в высоту. Нажмите кнопку «Показать параметры вывода триггера» и установите все триггеры «Положительных».
Примечание: DAQ иногда может пропустить TTL триггеры, если они являются 10 мс или менее. - Убедитесь что «триггер 1' и «триггер 2' намерены «Экспозиции» а «триггер 3' имеет значение «Программируемое» с «Период» 25 г-жа во вкладке «Последовательность», выберите «Time Lapse» с «Delay1 поле» 50 мс для сбора изображений на 20 Гц. Выберите «Сохранить временный буфер.»
- В закладке «Захват» программного обеспечения получения изображений (см. Таблицу материалы), установить выдержка до 10 мс, биннинг 4 x, и глубина изображения для 16-разрядных. Выберите по центру камеры подмассив 512 пикселей в ширину и 256 пикселей в высоту. Нажмите кнопку «Показать параметры вывода триггера» и установите все триггеры «Положительных».
- ПЛТ получить и лазерной интенсивности в течение трех каналов конфокальная томография
- Установите ПЛТ выгоды, чтобы фон флуоресценции находится на уровне чуть выше минимума (черный уровень). Увеличивайте мощность (зеленый) лазера 561 Нм до тех пор, пока один пиксель насыщенных 12-бит или 16-битных наблюдается в пресинаптическом terminus в mCherry канале.
- Отрегулируйте 488 нм (синий) лазерной интенсивности, так что GCaMP5 флуоресценции просто видна в пресинаптическом terminus выше фона. Этот низкий параметр предотвращает насыщения GCaMP5 пикселей, когда флюоресценция увеличивается в ответ на сильный Ca2 + транзиентов. Откройте конфокальный обскуры вплоть до максимально легкий захват.
3. Ratiometric Ca2 + изображений и запись поведение
- На вкладке «Последовательность» флуоресценции приобретения программного обеспечения нажмите кнопку «Пуск», чтобы начать запись. Трек червь с джойстиком, сохраняя ячейки и синапсы интерес в центре внимания и в центре поля зрения (FOV). Нажмите кнопку «Stats» в окне гистограммы, чтобы показать статистику пиксела каждого канала.
- Отрегулируйте мощность LED обеспечить максимум один пиксель mCherry флуоресценции в пресинаптическом terminus ≥ 8000 графов (~ 4,000 фотоэлектронов), давая ~ 12-битный динамический диапазон выше фона (~ 100 фотоэлектронов). GCaMP5 сигналы в пресинаптическом terminus во время отдыха (низкая) Ca2 + должна быть около ~ 2500 подсчитывает - только видимые выше фона.
- Запись до тех пор, пока один из яиц активное состояние достигается; Обычно это происходит каждые 20-30 мин в червь одичал тип7. Сохранение подмножества 10-мин (12,001 кадров), 6000 кадров до и после событий первого яйцекладки (кадр 6,001). Не забудьте сохранить то же подмножество изображений brightfield червя, поведение и timepoints XY этапе позиции, или точной синхронизации потоков данных будут потеряны.
- Используйте ImageJ и BioFormats плагин (см. Таблицу материалы) для преобразования последовательности изображений в изображения Cytometry Стандартный (.ics) формат так, что он может быть импортирован в программное обеспечение Ratiometric Quantitation.
4. сегментации и количественный анализ изображений
- Импортировать последовательности изображений в Ratiometric Quantitation программного обеспечения (см. Таблицу материалы). Нажмите «Авто контраст» в меню «Сервис», а контраст каждого канала установить соответствующие черный (~ 1,800) и белый уровень (10 000). В меню Сервис для подтверждения, что mCherry и GCaMP5 канал цвета назначения являются правильным (рис. 4A - C) выберите «Изменить цвета...».
- Щелкните правой кнопкой мыши ряды в закладке «Последовательность» и установите его в 20 кадров/сек и 1,25 мкм/пиксель.
- Выберите «Отношения» из меню «Сервис» и выберите «GCaMP5» для «Канал А» и «mCherry» для «Канал B». Нажмите кнопку «Рассчитать» рядом с «Порог» вычитание фона от каждого изображения последовательности. Выберите «Применить Радуга LUT на соотношение канал».
Примечание: Для записи с средней базовой 0.3 (низкий Ca2 +) и коэффициента Макс 2-3 (высокая Ca2 +), таблица подходящей подстановки бы от 0 (синий) 1 (красный). - Создайте канал коэффициент модуляции интенсивности, с помощью mCherry канала (рис. 4D). Коэффициент модуляции интенсивности канал — миллионы цветов изображения, где соотношение цвет отображается на яркость mCherry канала.
- На вкладке «Измерения» создайте объект Поиск протокол, перетащив инструмент «Найти объекты с помощью интенсивности» панели «Протокол». Нажмите кнопку «cog» задать окно mCherry значения интенсивности и найти объекты.
- Выберите значения интенсивности ≥ 2 стандартных отклонений (SD) выше фона (например, нижний предел ~ 2500, верхний предел 65535). Убедитесь, что обнаруживается Пресинаптический конечной и что «автоматически обновлять обратная связь» выбран в меню измерения.
Примечание: Программное обеспечение могут идентифицировать объекты по их стандартное отклонение от фона, используя соответствующий протокол «SD интенсивности.» Однако если объект особенно ярко вводит FOV, он может кардинально изменить средней интенсивности в течение этих timepoints, влияющих на интенсивность предохранители, используется для поиска HSN. Эта изменчивость не произойдет, если сырье интенсивности значения используются для поиска объектов.
- Выберите значения интенсивности ≥ 2 стандартных отклонений (SD) выше фона (например, нижний предел ~ 2500, верхний предел 65535). Убедитесь, что обнаруживается Пресинаптический конечной и что «автоматически обновлять обратная связь» выбран в меню измерения.
- Добавьте дополнительные фильтры, таргетинг только канал mCherry (размер, Макс интенсивности и т.д.), если необходимо исключить нежелательные объекты, как голова, хвост и кишечнике флуоресценции. Выберите «Сделать измерения пункт» из меню измерения и выберите «Все Timepoints».
Примечание: Это будет выполнять протокол, писать все измерения в файл с разделителями-запятыми (.csv), которое должно быть экспортированно с помощью команды «Экспорт» в меню «файл». - Откройте файл exported.csv и скопируйте Timepoint, уголок (2мкм), среднее (соотношение канал), центроида X (мкм) и данные центроид Y (мкм) в новый лист. Файл экспорта a.csv без заголовков столбцов. Программное обеспечение Ratiometric Quantitation может классифицировать ячейки интерес как один или несколько объектов в timepoint.
- Чтобы перекомбинировать эти объекты, используйте пользовательский сценарий «AnalzyeGCaMP_2017.m».
Примечание: Сценарий также идентифицирует Ca2 + (соотношение) пики в данных и сохраняет файл a.csv их timepoints, пик амплитуд и максимальной ширины. Он также генерирует файлы postscript для сырья и аннотированный отношение трассировок. С этой информацией должны определяться Ca2 + временные амплитуды и между временной интервал.
- Чтобы перекомбинировать эти объекты, используйте пользовательский сценарий «AnalzyeGCaMP_2017.m».
- Добавление вывода X и Y средневзвешенные значения из каждого объекта флуоресценции к значениям X и Y, записанная XY-этап сценарий из бонсай. Используйте чистый XY позиция для получения червь локомоции трассировки и вычисления ячеек перемещения и скорость, которые сопровождают различные поведение государств31.
- Импорт изображения записанные brightfield в ImageJ как виртуальный стек. Аннотируйте яйцекладка события и другие поведения. Сравните время этих событий Ca2 + пики от соотношение трассировки.
Результаты
Простой монтаж метод, описанный здесь (рис. 1) вызывает минимальные изменения в среде культуры L4 и взрослых C. elegans обеспечивая высокое разрешение записи в себя животных через стекло coverslip (рис. 4). Синхронизация Светодиодных источников света, этап контроллеров и экспозиции камеры позволяет для сбора данных из нескольких потоков на 20 кадров/сек до 1 ч. среднего масштаба (20 x) с высокой числовая апертура целей (0,7-0,8) обеспечивает хорошее пространственное разрешение синаптических региона яйцекладка поведение цепи, даже с 4 x 4 пикселя биннинга (1,25 мкм/пиксель). Одновременное приобретение сигналов флуоресценции GCaMP5 и mCherry (рис. 4A, B) используется для создания канала пиксель в пиксель соотношение, который компенсирует изменения в движение животных и фокус (рис. 4D). HSN Пресинаптический конечной как большой, как многие нейрональных клеток органов в C. elegansи изменения в пресинаптическом HSN Ca2 + может четко визуализируется. Большой ПЗ камеры инфракрасного brightfield позволяет червю вручную отслеживаться во время записи (Рисунок 4E). Для каждого животного изменения в внутриклеточного Ca2 + может быть соотнесена с поведение проявляется в brightfield изображений, включая выпуск яйцо и изменения в двигательный аппарат (Рисунок 4E).
Количественный HSN Ca2 + и скорость подтверждает, что черви изменить их передвижения, как они перехода к поведение яйцекладки. Существуют значительные различия в скорости червя до, во время и после откладки активное состояние (рис. 5A). Это не вызвано шума присущего изображений или системы отслеживания. Масштабирование в одно событие яйцекладки, мы наблюдаем сильные изменения в флуоресцировании (ΔF/F) GCaMP5 до яйцекладки события при mCherry флуоресценции относительно неизменными (рис. 5B). Измеренные изменения в соотношении GCaMP5:mCherry (ΔR/R) ясно показывают HSN Ca2 + переходных ~ 4 s перед яйцо релиз (рис. 5B). Совпадающих с вульвы мышц, ясно замедление червь локомоции происходит, что концы с яйцом освобождения. Предыдущие результаты показали, что холинергических VC двигательных нейронов, которые иннервируются HSNs, показать пик активности во время схватки сильные мышцы вульвы и яйцо релиз 8,10,27. Мы также показали, что optogenetic активации нейронов VC диски немедленное замедления передвижения, предполагая, что VC нейроны могут активироваться вульвы мышц, тем самым замедляя передвижения до получения обратной связи яйцо релиз27 .
Изображений и описывается система отслеживания позволяет визуализации пространственной организации яйцекладка поведения (рис. 5C). Как уже показано, червей введите устойчивый бежит вперед локомоции накануне в активное состояние32. Черви тратят большую часть своего времени нагула на бактерии в центре кусок агар. До вступления в активное состояние черви отказаться от пищи, которая совпадает с появлением редко HSN Ca2 + транзиентов. HSN активность, затем переходит в всплеска стрельбе, с нескольких близко расположенных HSN Ca2 + транзиентов, которые поддерживают яйцекладка события. Черви затем часто развернуться, возобновить вперед локомоции и откладывают яйца на пути обратно к их начальную позицию вблизи ОР50 бактерий. Мы предполагаем, что изменения в местных O2 и/или концентрации CO2 может влиять на где черви решили заложить яйца33,34.
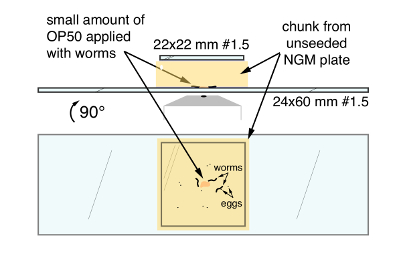
Рисунок 1. C. elegans монтажная техника для изображений с высоким разрешением яйцекладка цепи деятельности и поведения. Топ, окончательный горе со стороны. Внизу, окончательный горе как просмотренные через нижнюю часть большой coverslip. Стрелки показывают, ОР50 бактериальных продуктов питания, черви нематоды Caenorhabditis elegans и яйца, зажатой между кусок агар НГМ и coverslip большой 24 x 60 мм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
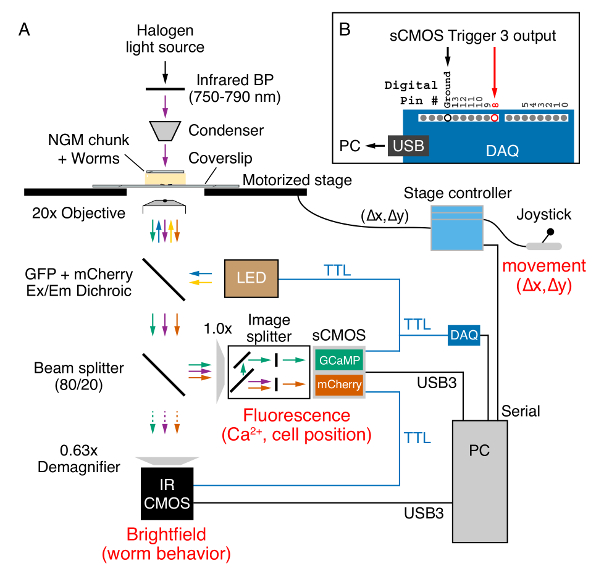
Рисунок 2 . Widefield ratiometric Ca2 + изображений и поведение, запись на Перевернутый эпифлуоресцентного микроскопа. (A) червь позицию и поведение фиксируется в brightfield через 20 x (0.8 NA) план-Апохромат цель с помощью инфракрасного (750-790 нм) свет (фиолетовые стрелки), излучаемый галогенная лампа через NGM кусок. Джойстик и моторизованных стадии контроллер используется для поддержания червя в поле зрения во время записи. Стадии позиции (Δx, Δy) отправляется на ПК, последовательный порт. GCaMP5 и mCherry белки, выраженные в червь рады с помощью 470 Нм (синие стрелки) и 590 Нм (Желтые стрелки) светодиодами диоды (LED). Излучаемого GCaMP5 (зеленые стрелки) и mCherry (оранжевые стрелки) флуоресценции наряду с инфракрасный свет проходит через многополосный дихроичное зеркало (см. Таблицу материалы). 80/20 splitter луча посылает 20% света через 0,63 x demagnifer для захвата на ИК чувствительных CMOS камера (фиолетовые стрелки). Оставшиеся 80% света отправляется через сторону порт микроскопа изображения разделителя, который отделяет GCaMP5 и mCherry флуоресцирования на отдельные половинки sCMOS камеры во время удаления brightfield инфракрасный свет. Данные из обеих камер передаются на ПК через кабели USB3. Порты триггера с флуоресценцией sCMOS камеры (синий) используются для отправки + 5В TTL запускает светодиодные системы освещения, камеры CMOS ИК brightfield и цифровой приобретения устройства (DAQ). (B) триггера 3 выходные сигналы TTL определяется DAQ на цифровой pin #8 и отправлены на компьютер через USB-соединение. Эти цифровые входы триггер ' где XY' серийный команду из сценария программного обеспечения Бонсай (XY-этап финал), который считывает X и Y этап позиции для каждого GCaMP5/mCherry флуоресценции и инфракрасного изображения захвачен. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
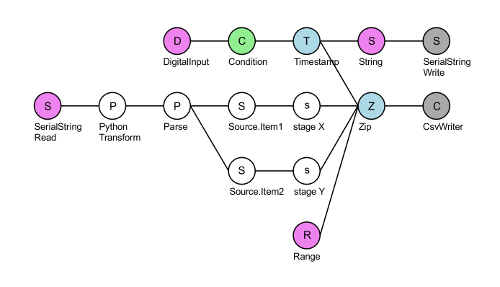
Рисунок 3 : Макет бонсай серийный стадия общения скрипта XY-этап финал. Топ DigitalInput узел (розовый) читает TTL триггеры, приходя в контакт #8 DAQ. Для каждого положительного напряжения TTL (зеленый) DAQ делает отметка (синий) и записывает строку «Где XY?» (розовый) на этапе контроллер через последовательный порт (серый). Узел SerialStringRead (розовый) читает ответ от стадии контроллера координат X и Y. Затем эта строка преобразуется в мкм и разделены на X и Y координаты этап. Наконец, эти четыре потоков объединяются с помощью zip узел (синий) и четыре column.csv файл записывается: рамка счетчик TTL сигналы (узел диапазона, розовый), координаты X и Y и интервал между последующими timepoints (обычно ~ 50 мс при запись при 20 Гц). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
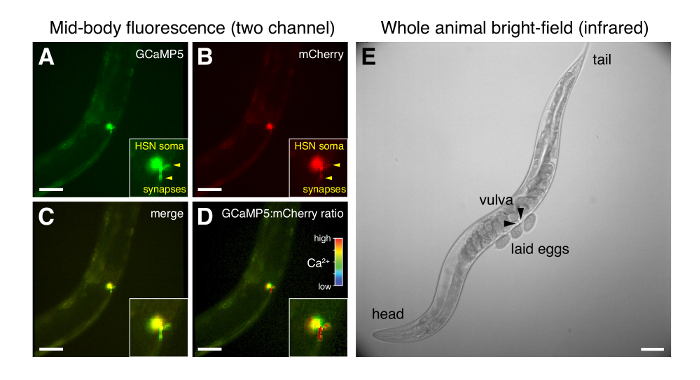
Рисунок 4 : Представитель микроскопии флуоресцирования HSN и весь животных brightfield во время откладки поведение. (DA–) Одновременно ratiometric изображений GCaMP5 и mCherry флуоресценции в HSNs просто до выхода яйцеклетки. HSN Пресинаптический Термини указаны с наконечниками. (C) объединить GCaMP5 и mCherry флуоресценции. (D) модуляции интенсивности GCaMP5:mCherry отношение; высокий коэффициент (красный) указывает высоких внутриклеточных Ca2 + в пресинаптическом terminus. (E) Brightfield изображение всего червя только после того, как были заложены яйца. Стрелки указывают на передней и задней половинок вульвы, с которого яйца откладываются. Линейки для всех изображений является 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Запись HSN Ca2 + и передвижения скорости во время откладки поведение. (A) следы GCaMP5:mCherry коэффициент изменения в ответ на внутриклеточные Ca2 + транзиентов (ΔR/R; красный) наряду с мгновенной червь скорость (микрон/сек, синий). Яйцекладка события обозначаются наконечники стрел. (B) следы флуоресценции HSN GCaMP5 (зеленый; ΔF/F), mCherry флуоресценции (красный; ΔF/F), соотношение флуоресценции GCaMP5:mCherry (черный; ΔR/R) и червь скорость (синий) вокруг момента выхода яйцеклетки. (C) пространственной организации яйцекладки и локомоции поведения во время всей записи 10-мин. Трек червь был получен от XY этапе информацию, которая была добавлена на центроид позицию HSN, полученные из записи флуоресценции mCherry. Указаны сроки HSN транзиентов (красные круги), яйцекладка события (черные стрелки), начала и конца записи (зеленый и синий алмазы). Линейки-1 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Трансгенов:
Потому что mCherry выражение была улучшена путем кодон оптимизация и Интрон вставки (и наиболее доступных GCaMP репортеры не имеют), инъекционные ~ 4 x количество GCaMP5-выражая плазмида обеспечить сопоставимые уровни флюоресценции GCaMP5 во время сильного Ca 2 + транзиентов. Спасение lin-15(n765ts) мутации позволяет легким восстановления трансгенных животных с минимальными последствиями для яйцекладки и других поведений35. Трансгенов должны быть интегрированы для обеспечения единообразного выражение и визуализации условий между25различных животных. Выбираемые маркеры, включая антибиотикорезистентности36,37 и спасение lethals чувствительных к температуре38 также должно работать, но, потому что не трансгенных животных мертвы, подтверждение трансген интеграции и homozygosity является более сложным по сравнению с маркерами, которые представляют видимые фенотип25. Доминирующей маркеров, которые нарушают нормальный двигательный аппарат и уменьшить фитнес, таких как rol-6(dm), следует избегать39. Изображений в lite-1 мутант фон имеет важное значение для уменьшения синий свет побег ответы во время визуализации23,40,41. Дополнительные мутация Гур-3, который действует параллельно с lite-1, может свести к минимуму остаточные поведение и физиологических изменений, вызванных синий свет42. Удобно Гур-3, lite-1и Лин-15 все расположены на правой половине хромосомы X, который должен упростить строительство новых штаммов для Ca2 + изображений и optogenetic экспериментов.
Потому что время экспозиции короткие и изображения собираются в 20 Гц, сигналы GCaMP5 и mCherry должны быть яркими. Наиболее вероятным объяснением для шумных Ca2 + записей — тусклый флуоресценции, вызванные слабым репортер выражения. Промоутеры, также должны быть достаточно конкретными для региона изображаемого. Потому что тело клетки HSN и синапсы на вульвы мышцы находятся в центре тела, дополнительное выражение из НЛП-3 промоутер в голову и хвост, как правило, вне поля зрения и могут быть исключены с помощью дополнительных фильтров в Программное обеспечение Ratiometric Quantitation. Обеспечить, чтобы наблюдаемые изменения в GCaMP5 результате флуоресценции в фактические изменения в внутриклеточного Ca2 +, управления трансгенов, выражая GFP вместо GCaMP5 следует самостоятельно подготовить и проанализированы26. Новые Ca2 + Репортеры с различными Ca2 + чувствительность, кинетика и цвета расширили выбор изображений инструменты доступны, но каждый новый репортер должны быть проверены с помощью Ca2 +-нечувствительным флуоресцентные вариант14 ,16.
СМИ:
НГМ пластины для изображений должны быть готовы с высоким качеством агар. Нижняя качества агар не будет полностью растворить после автоклавирования, оставляя небольшие частицы что рассеяния света во время визуализации и увеличение фонового флуоресценции. Вместо него может использоваться класс агарозы молекулярной биологии, но добавлена сумма должна быть сокращена до поддержания эквивалент плита твердость.
Сравнение с другими методами монтажа:
Предыдущие подходы к деятельности изображения в контуре яйцекладка поведение использовали червей, прикол с клеем на площадку агарозы. В этих условиях, схема активности и яйцекладка поведение не благоприятствует без уменьшения в культуре средств массовой информации осмолярности8,10,44,45. Последние данные свидетельствуют о том, что несколько поведений червь модулируются государством локомоции, поднимают вопросы о взаимосвязи клеточной активности наблюдается в подвижности животных к тому увиденному в свободно поведение животных. Недавно мы показали, что яйцекладка схемы активности неожиданно постепенно с локомоции26,27. Аналогичным образом разобщенным Ca2 + сигнализации в РИА межнейронного интегрирует деятельность от сенсорных нейронов и головы двигательных нейронов во время нагула движений46. Поведение дефекация сопровождается точным и стереотипные изменения в двигательный аппарат, что позволяет животных отойти от их нагула пятно до высылки отходов47. Вместе эти результаты показывают, что краткие записи схемы активности от подвижности животных могут быть принципиально отличаются от тех, полученные в свободно поведение животных.
Несмотря на то что непосредственно под coverslip, червя поведение напоминает, что видели на стандартных NGM пластины. Уложенный яйца пойдут люк, и небольшое количество пищи, хранение позволяет L1 личинки превращаются в взрослых (данные не показаны). Размер блока больших агар позволяет разумно газообмена и сопротивляется обезвоживания, хотя слишком много пищи будет увеличиваться фон флуоресценции. Хотя этот метод работает лучше всего для взрослых, метод может также использоваться для изображения L4 животных. Однако толщина водный слой между кусок и coverslip такова, что мелких личинок трудно ползать и часто может попасть в ловушку в результате движущихся взрослого.
Ограничением этой методики монтажа является сложным прямой стимуляции механические или химические для точных областей тела. Недавние события в узорными освещения методы позволяют отдельно возбуждением голову или хвост выразил микробной опсины с отдельного освещения и обнаружения флуоресценции GCaMP/mCherry в midbody48,49. В результате это может быть возможность преодолеть эту проблему с помощью optogenetic подходов.
Сравнение с другим ЦС 2 + Изображений подходы:
Этот метод работает очень хорошо для записи изменений в цитоплазматических Ca2 + от одного, решена клеток и их синаптических регионах. В реальном времени, объемных изображений нейронов в голову недавно был достигнут с помощью позиции клеточных ядер для идентификации клетки и quantitate изменения в nucleoplasmic кальция50,,5152. Отношения между ядерными и синаптическую Ca2 + остается неясным. Наши данные показывают, что наиболее заметные изменения в HSN внутриклеточных Ca2 + происходят на пресинаптическом Термини от клеток Сома (рис. 4 d). Пресинаптический Термини HSN и VC нейронов встраиваются в постсинаптической вульвы мышцы26. Не ясно, будет ли достаточным разрешением в измерении Z даже с вращением диска или света лист методы приписать Пресинаптический Ca2 + сигналы для конкретных ячеек не полагаясь в некотором роде на соматические кальция для идентификации ячейки . Используя методы, описанные здесь, каждый 10 мин, двухканальную запись с 12001 256 x 256 пикселей 16-битных TIFF изображений ~ 4 ГБ. Коэффициент соотношения и интенсивности модулированного каналы двойной размер файла ~ 8 ГБ. Типичная эксперимент, записи 10 животных от каждого из двух генотипов (одичал тип и экспериментальных) генерирует около 150 ГБ первичных данных и требует 20 h для сбора и анализа. Объемный анализ кусочками 10 Z за timepoint потребует на порядок больше данных и аналитических времени, объясняя, почему так мало такие исследования были завершены.
Аппаратное обеспечение:
Мы записывать и анализировать последовательности изображений на двухпроцессорных рабочих станциях с высокой производительностью (например, игровой) графических карт, 64 ГБ ОЗУ, и высокой производительности твердотельных дисков (см. Таблицу материалы). Данные должны хранится на сетевом избыточный массив независимых дисков (RAID) и резервное копирование в облако в центре внешних данных.
Мы рекомендуем с помощью мощных коллимированного светодиоды для импульсных флуоресценции возбуждения над галогенида металла или ртутных источников света. Доступны несколько коммерчески доступных многоцветные светодиодные системы. В то время как некоторые из этих Светодиодных систем имеют более высокие первоначальные затраты, они имеют Лонг жизнь (> 20 000 h), можно одновременно будоражат четыре или более различных флуорофоров и предлагают точный временной контроль с помощью серийного или TTL интерфейс с низкой задержкой (10-300 МКС переключатель время). Срабатывание гарантирует, что образец только горит, когда на самом деле осуществляется сбор данных. Мы обычно используют 10 мс экспозиции каждые 50 мс (20% пошлины). Это уменьшает Фототоксичность и размытия движения во время захвата изображения, как сообщалось ранее43.
Мы используем sCMOS камеры для их скорость и большой массив небольших, чувствительных точек. EM-CCD камера является альтернативой более дорогим, но «Блум» эффектов может привести к захватили фотоэлектронов, разлив в соседних пикселов. Новые sCMOS задней подсветкой камеры имеют аналогичные фоточувствительность EM-ПЗС по значительно сниженной стоимости. Независимо от того какой датчик используется, GCaMP5 и mCherry каналы должны быть получены одновременно. Последовательный захват в продвижении червей приведет к плохо зарегистрированные изображения непригодными для ratiometric quantitation. Двойной канал изображения может быть достигнуто на одной камеры после разделения каналов с помощью изображения разделителя (рис. 2) или две одинаковые камеры. Динамический диапазон 16-битные изображения рекомендуется 8-битных изображений для точного ratiometric quantitation. Для brightfield изображений червь поведения мы захватить с помощью 1 дюйма 4.1 МП ближней ИК-области USB3 захватить большие 2 x 2 сегментированием 1024 x 1024 8-битного изображения последовательности после сжатия JPEG. Больших ПЗ, доступных на более новых моделях микроскоп позволяет взрослого червя быть визуализированы на 20 x после 0,63 x demagnification с только небольшое виньетирование (Рисунок 4E).
Мы рекомендуем использовать стандартные сигналы напряжения TTL для синхронизации освещение и захвата кадра. Из-за потенциальных задержек в различных программах мы рекомендуем пользователям настроить камеру флуоресценции с выходами триггер как мастер с выхода TTL вождения все другие устройства. Таким образом brightfield и стадии позиции информация будет собираться для каждого Ca2 + измерения.
Щель - или резонансных точка сканирование конфокальные микроскопы, обычно встречаются в общей конфокальный зал также дают отличную производительность при ratiometric Ca2 + изображений. Такие инструменты могут использоваться для захвата двух или более каналов флуоресценции наряду с brightfield24. В этом случае конфокальный обскуры должны быть открыты для ее максимальный диаметр, и спектральных детектор должен использоваться для разделения сигналов инфракрасного brightfield, mCherry и GCaMP5. Это максимизирует светильники коллекции из толстых (~ 20 мкм) ломтик пока все еще позволяющ неприятие флуоресценции вне фокуса. Один недостаток-меньше ПЗ и больше ограничений для настройки оборудования и программного обеспечения.
Программное обеспечение:
Большинство производителей корабль и установить их камер и микроскопы с патентованного программного обеспечения, включая конфигурацию запуска входов и выходов. Возможности и производительность этого программного обеспечения во время записи может варьироваться. Поскольку для отслеживания может быть сложным быстроподвижные червей, изображение дисплея во время записи должна быть гладкой и стабильной частотой 20 Гц. Для повышения производительности, последовательности изображений могут быть временно сохранены в ОЗУ с поведенчески соответствующего подмножества, сохраненные в конце эксперимента. Эти 2 канальный изображение последовательности файлы могут быть преобразованы в открытые изображения Cytometry стандартный формат (.ics) для импорта в программное обеспечение Ratiometric Quantitation. Оме-TIFF — более поздние открытым исходным кодом изображения формат, хотя различные установки могут быть неспособны сохранить последовательности изображений TIFF, больше, чем 4 ГБ.
Ключевой особенностью количественный конвейера это поколение соотношение канала, и затем объективное изображение сегментации процедура с использованием mCherry флуоресценции найти клетки интереса. Каждый объект найден размер объекта, XY центроид позиции и минимум, означает, и вычисляются значения интенсивности максимальная флуоресценции для каждого канала (включая соотношение канал). Вместе эти значения используются для quantitate изменения внутриклеточной Ca2 + в каждом timepoint в записи. Объект измерений для каждого timepoint затем экспортируются как a.csv файл для последующего анализа.
Одним из основных ограничений протокола, описанные здесь является зависимость на перемещение данных в различных формах программных продуктов через лоскутное одеяло. Дополнительные раздражения является, что некоторые из программного обеспечения является открытым исходным кодом и бесплатно, в то время как другие являются закрытыми, дорого и неравномерно Обновлено. Значительное улучшение было бы использовать или разрабатывать один кусок программного обеспечения (в идеале открытым исходным кодом), который предоставляет аналогичные уровни производительности и простоты использования от приобретения для анализа. Как отмечалось выше, анализ ratiometric удваивает размер файла и время, необходимое для завершения эксперимента. Поколение драйвера камеры, которые могут быть интегрированы в настраиваемые пользователем рамки как бонсай позволит изображения и другие потоки данных, чтобы быть собраны и проанализированы в режиме реального времени, значительно улучшение пропускной способности.
Перспективы на будущее:
Хотя мы обычно отслеживать перемещения червь вручную, отслеживание центроид червь обнаружен в инфракрасной ярко - или темно поле записи должны позволить для обработки узлов, которые обеспечивают замкнутого цикла корректировки стадии позиции и автоматизированных дополнительных изображений Отслеживание (рис. 3 и данные не показаны). Большинство записей флуоресценции, полученные с помощью этого метода, темно и лишенный биологически интересные данные. На датчик или реального времени обработки методов которые обрезать изображение последовательности к соответствующим объектам после приобретения изображений позволит для увеличения пространственного разрешения и ускорить конвейер данных анализа, особенно если дополнительные Z-ломтики собираются для каждого timepoint для визуализации деятельности в рамках всех предварительно и постсинаптических клетки в контуре.
Раскрытие информации
Авторы заявляют, что существуют не конкурирующие интересы.
Благодарности
Эта работа финансировалась грант от NINDS на КМК (R01 NS086932). LMN была поддержана грант от программе КПУР NIGMS (R25 GM076419). Штаммы используемые в данном исследовании C. elegans центр генетики, которая финансируется Управлением NIH инфраструктуры научно-исследовательских программ (P40 OD010440). Мы благодарим Джеймса Бейкера и Мейсон Кляйна за полезные дискуссии.
Материалы
| Name | Company | Catalog Number | Comments |
| C. elegans growth, cultivation, and mounting | |||
| Escherichia coli bacterial strain, OP50 | Caenorhabditis Genetic Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. Biosafety Level 1 |
| HSN GCaMP5+mCherry worm strain | Caenorhabditis Genetic Center | LX2004 | Integrated transgene using nlp-3 promoter to drive GCaMP5 and mCherry expression in HSN. Full genotype: vsIs183 [nlp-3p::GCaMP5::nlp-3 3'UTR + nlp-3p::mCherry::nlp-3 3'UTR + lin-15(+)], lite-1(ce314), lin-15(n765ts) X |
| lite-1(ce314), lin-15(n765ts) mutant strain for transgene preparation | author | LX1832 | Strain for recovery of high-copy transgenes after microinjection with pL15EK lin-15(n765ts) rescue plasmid. Also bears the linked lite-1(ce314) mutation which reduces blue-light sensitivity. Available from author by request |
| pL15EK lin-15a/b genomic rescue plasmid | author | pL15EK | Rescue plasmid for recovery of transgenic animals after injection into LX1832 lite-1(ce314), lin-15(n765ts) X strain. Available from author by request |
| pKMC299 plasmid | author | pKMC299 | Plasmid for expression of mCherry in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| pKMC300 plasmid | author | pKMC300 | Plasmid for expression of GCaMP5 in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| Potassium Phosphate Monobasic | Sigma | P8281 | For preparation of NGM plates |
| Potassium Phosphate Dibasic | Sigma | P5655 | For preparation of NGM plates |
| Magnesium Sulfate Heptahydrate | Amresco | 0662 | For preparation of NGM plates |
| Calcium Chloride Dihydrate | Alfa Aesar | 12312 | For preparation of NGM plates |
| Peptone | Becton Dickinson | 211820 | For preparation of NGM plates |
| Sodium Chloride | Amresco | 0241 | For preparation of NGM plates |
| Cholesterol | Alfa Aesar | A11470 | For preparation of NGM plates |
| Agar, Bacteriological Type A, Ultrapure | Affymetrix | 10906 | For preparation of NGM plates |
| 60 mm Petri dishes | VWR | 25384-164 | For preparation of NGM plates |
| 24 x 60 mm micro cover glasses, #1.5 | VWR | 48393-251 | Cover glass through which worms are imaged |
| 22 x 22 mm micro cover glasses, #1 | VWR | 48366-067 | Cover glass that covers the top of the agar chunk |
| Stereomicroscope with transmitted light base | Leica | M50 | Dissecting microscope for worm strain maintenance, staging, and mounting |
| Platinum iridium wire, (80:20), 0.2mm | ALFA AESAR | AA39526-BW | For worm transfer |
| Calcium imaging microscope | |||
| Anti-vibration air table | TMC | 63-544 | Micro-g' Lab Table 30" x 48" anti-vibration table with 4" CleanTop M6 on 25mm top |
| Inverted compound microscope | Zeiss | 431007-9902-000 | Axio Observer.Z1 inverted microscope |
| Sideport L80/R100 (3 position) | Zeiss | 425165-0000-000 | To divert 20% of output to brightfield (CMOS) camera, 80% to fluorescence (sCMOS) camera |
| Tilt Back Illumination Carrier | Zeiss | 423920-0000-000 | For infrared/behavior imaging |
| Lamphousing 12V/100W w/ Collector | Zeiss | 423000-9901-000 | For infrared/behavior imaging |
| Halogen lamp 12V/100W | Zeiss | 380059-1660-000 | For infrared/behavior imaging. White-light LEDs do not emit significant infrared light, so they will not allow brightfield imaging after the infrared bandpass filter |
| 32 mm Infrared bandpass filter (750-790 nm) for Halogen lamp | Zeiss | 447958-9000-000 | BP 750-790; DMR 32mm, for infrared illumination for brightfield and behavior |
| 6-filter Condenser Turret (LD 0.55 H/DIC/Ph), Motorized | Zeiss | 424244-0000-000 | For infrared/behavior imaging |
| Condenser & Shutter | Zeiss | 423921-0000-000 | For infrared/behavior imaging |
| Binocular eyepiece with phototube for infrared CMOS camera | Zeiss | 425536-0000-000 | For infrared/behavior imaging |
| Eyepiece 10x, 23mm | Zeiss | 444036-9000-000 | For worm localization on the agar chunk |
| C-Mount Adapter 2/3" 0.63x demagnifier | Zeiss | 426113-0000-000 | Mount for infrared CMOS camera |
| CMOS camera for infrared brightfield and behavior (1" sensor) | FLIR (formerly Point Grey Research) | GS3-U3-41C6NIR-C | Camera for brightfield imaging |
| USB 3.0 Host Controller Card | FLIR (formerly Point Grey Research) | ACC-01-1202 | Fresco FL1100, 4 Ports |
| 8 pins, 1m GPIO Cable, Hirose HR25 Circular Connector | FLIR (formerly Point Grey Research) | ACC-01-3000 | Cable for TTL triggering. The green wire connects to GPIO3 / Pin 4 and the brown wire connects to Ground / Pin 5 |
| Plan-Apochromat 20x/0.8 WD=0.55 M27 | Zeiss | 420650-9901-000 | Best combination of magnification, numerical aperture, and working distance |
| 6-cube Reflector Turret, Motorized | Zeiss | 424947-0000-000 | For fluorescence imaging |
| Fluorescence Light Train, Motorized | Zeiss | 423607-0000-000 | For fluorescence imaging |
| Fluorescence Shutter | Zeiss | 423625-0000-000 | For fluorescence imaging |
| GFP and mCherry dual excitation and emission filter cube (for microscope) | Zeiss | 489062-9901-000 | FL Filter Set 62 HE BFP+GFP+HcRed for fluorescence imaging |
| LED illumination system | Zeiss | 423052-9501-000 | Triggerable Colibri.2 LED system for fluorescent illumination |
| GFP LED module (470 nm) | Zeiss | 423052-9052-000 | Colibri.2 LED for GFP fluorescence excitation |
| mCherry LED module (590 nm) | Zeiss | 423052-9082-000 | Colibri.2 LED for mCherry fluorescence excitation |
| Iris stop slider for incident-light equipment | Zeiss | 000000-1062-360 | Field aperture iris to limit LED illumination to the camera field of view |
| C-Mount Adapter 1" 1.0x | Zeiss | 426114-0000-000 | Adapter for image-splitter and sCMOS fluorescence camera |
| Image splitter | Hamamatsu | A12801-01 | Gemini W-View, other image splitters may be used, but they may not be optimized for the large sensor size of the sCMOS cameras |
| GFP / mCherry dichroic mirror (image splitter) | Semrock | Di02-R594-25x36 | Splitting GCaMP5 from mCherry and infrared signals |
| GFP emission filter (image splitter) | Semrock | FF01-525/30-25 | Capturing GCaMP5 fluorescence |
| mCherry/ emission filter (image splitter) | Semrock | FF01-647/57-25 | This filter is necessary to exclude the infrared light used for brightfield imaging |
| sCMOS camera for fluorescence (1" sensor) | Hamamatsu | A12802-01 / C11440-22CU | Orca FLASH 4.0 V2. Newer models allow for separate image acquisition settings on separate halves of the sensor, allowing acquisition of two-channel images in combination with an image splitter |
| Motorized XY Stage | Märzhäuser | SCAN IM 130 x 100 | Stage movement; the XY resolution of this stage is 0.2µm per step |
| XY Stage controller with joystick | LUDL | MAC6000, XY joystick | Manual tracking of worms. MAC6000 controller should be connected to the PC through the serial (RS-232) port configured to 115200 baud |
| Digital Acquisition board (DAQ) | Arduino | Uno | Receiving TTL triggers from sCMOS camera. The Uno should be loaded with the standard Firmata package, and the computer USB port configured to 57600 baud |
| BNC Male to BNC Male Cable - 6 ft | Hosa Technology | HOBB6 | BNC connectors for TTL triggering |
| Gold-Plated BNC Male to SMA male coaxial cable (8.8") | uxcell | 608641773651 | To connect the fluorescence camera trigger outputs |
| BNC turn head adapter | Hantek | RRBNCTH21 | BNC to Banana Plug Adapter (4mm) |
| BNC female to female connector | Diageng | 20130530009 | Female to female BNC adapter to connect the BNC output from the camera to the Banana Plug |
| Solderless flexible breadboard jumper wires | Z&T | GK1212827 | To connect the BNC trigger outputs to the Arduiono DAQ. Male to male. |
| High performace workstation | HP | Z820 | Windows 7, 64GB RAM, Dual Xeon processor, solid state C: drive, serial (RS-232) port, multiple PCIe3 slots for ethernet connectivity, USB 3.0 cards, and additional solid state drives |
| M.2 Solid state drive | Samsung | MZ-V5P512BW | High-speed streaming and analysis of image data |
| M.2 Solid state drive adapter for workstations | Lycom | DT-120 | M.2 to PCIe 3.0 4-lane adapter |
| Network attached storage | Synology | DS-2415+ | Imaging data storage and analysis |
| Hard disk drives | Western Digital | WD80EFZX | RED 8 TB, 5400 RPM Class SATA 6 Gb/s 128MB Cache 3.5 Inch. Storage of imaging data (10 drives + 2 drive redundancy) |
| Software | |||
| Fluorescence Acquisition | Hamamatsu | HCImage DIA | Recording of two channel (GCaMP5 and mCherry) fluorescence image sequences at 20 fps |
| Brightfield Acquisition | FLIR (formerly Point Grey Research) | Flycapture | Recording of brightfield JPEG image sequences |
| Stage Serial Port Reader | Bonsai | https://bitbucket.org/horizongir/bonsai | Facilitates tracking of worms during behavior |
| LED controller software | Zeiss | Micro Toolbox Test 2011 | To set up the intensity and trigger inputs for the different LEDs in the Colibri.2 unit |
| ImageJ | NIH | https://imagej.net/Fiji/Downloads | Simple review of image sequences and formatting changes for import into Ratiometric Quantitation software |
| Excel | Microsoft | 2002984-001-000001 | For generating subsets of comma-separated value data from Volocity for MATLAB analysis |
| Peak Finding | MATLAB | R2017a | Script used for Ratio peak feature calculations |
| Ratiometric Quantitation | Perkin Elmer | Volocity 6.3 | Facilitates calculation of ratiometric image channels, image segmentation for object finding, and ratio measurement of found objects |
| Scripts | |||
| XY-stage-final.bonsai | Bonsai | TTL-triggered DAQ and stage position serial port reader | Records X and Y stage position (in microns) when the attached Arduino receives a positive TTL signal from sCMOS camera during frame exposure. Script writes a .csv file with four columns: frame number, X position (microns), Y position (microns), and the time elapsed between frames (typically ~50 msec when recording at 20 fps). X and Y stage position from this output (columns 2 and 3, respectively) are added to the X and Y centroid positions from the AnalyzeGCaMP_2017.m MATLAB script (columns 4 and 5, respectively), to give the final X and Y position of the fluorescent object for the recording. |
Ссылки
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Phil Trans R. Soc. 314, 1-340 (1986).
- Bargmann, C. I. Neurobiology of the Caenorhabditis elegans genome. Science. 282, 2028-2033 (1998).
- Piggott, B. J., Liu, J., Feng, Z., Wescott, S. A., Xu, X. Z. S. The neural circuits and synaptic mechanisms underlying motor initiation in C. elegans. Cell. 147, 922-933 (2011).
- Chung, S. H., Sun, L., Gabel, C. V. In vivo neuronal calcium imaging in C. elegans. J. Vis. Exp. JoVE. , (2013).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C. elegans egg-laying behavior. Curr. Biol. CB. 18, 1445-1455 (2008).
- Shyn, S. I., Kerr, R., Schafer, W. R. Serotonin and Go modulate functional states of neurons and muscles controlling C. elegans egg-laying behavior. Curr. Biol. CB. 13, 1910-1915 (2003).
- Zhang, M., Schafer, W. R., Breitling, R. A circuit model of the temporal pattern generator of Caenorhabditis egg-laying behavior. BMC Syst. Biol. 4, 81 (2010).
- Kerr, R. A., Schafer, W. R. Intracellular Ca2+ imaging in C. elegans. Methods Mol. Biol. Clifton NJ. 351, 253-264 (2006).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. Off. J. Soc. Neurosci. 32, 13819-13840 (2012).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nat. Methods. 12, 64-70 (2015).
- Oheim, M., et al. New red-fluorescent calcium indicators for optogenetics, photoactivation and multi-color imaging. Biochim. Biophys. Acta. 1843, 2284-2306 (2014).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Kim, C. K., Adhikari, A., Deisseroth, K. Integration of optogenetics with complementary methodologies in systems neuroscience. Nat. Rev. Neurosci. 18, 222-235 (2017).
- Storace, D., et al. Toward Better Genetically Encoded Sensors of Membrane Potential. Trends Neurosci. 39, 277-289 (2016).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J. Vis. Exp. JoVE. , (2008).
- Clark, S. G., Lu, X., Horvitz, H. R. The Caenorhabditis elegans locus lin-15, a negative regulator of a tyrosine kinase signaling pathway, encodes two different proteins. Genetics. 137, 987-997 (1994).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6, 198 (2008).
- Thapaliya, E. R., et al. Bioimaging with Macromolecular Probes Incorporating Multiple BODIPY Fluorophores. Bioconjug. Chem. 28, 1519-1528 (2017).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. J. Vis. Exp. JoVE. , e50773 (2013).
- Collins, K. M., Koelle, M. R. Postsynaptic ERG Potassium Channels Limit Muscle Excitability to Allow Distinct Egg-Laying Behavior States in Caenorhabditis elegans. J. Neurosci. Off. J. Soc. Neurosci. 33, 761-775 (2013).
- Collins, K. M., et al. Activity of the C. elegans egg-laying behavior circuit is controlled by competing activation and feedback inhibition. eLife. 5, e21126 (2016).
- Li, P., Collins, K. M., Koelle, M. R., Shen, K. LIN-12/Notch signaling instructs postsynaptic muscle arm development by regulating UNC-40/DCC and MADD-2 in Caenorhabditis elegans. eLife. 2, 00378 (2013).
- Banerjee, N., Bhattacharya, R., Gorczyca, M., Collins, K. M., Francis, M. M. Local neuropeptide signaling modulates serotonergic transmission to shape the temporal organization of C. elegans egg-laying behavior. PLoS Genet. 13, 1006697 (2017).
- Lopes, G., et al. Bonsai: an event-based framework for processing and controlling data streams. Front. Neuroinformatics. 9, 7 (2015).
- Flavell, S. W., et al. Serotonin and the neuropeptide PDF initiate and extend opposing behavioral states in C. elegans. Cell. 154, 1023-1035 (2013).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. J. Neurobiol. 49, 303-313 (2001).
- Ringstad, N., Horvitz, H. R. FMRFamide neuropeptides and acetylcholine synergistically inhibit egg-laying by C. elegans. Nat. Neurosci. 11, 1168-1176 (2008).
- Hallem, E. A., et al. Receptor-type guanylate cyclase is required for carbon dioxide sensation by Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 108, 254-259 (2011).
- Tanis, J. E., Moresco, J. J., Lindquist, R. A., Koelle, M. R. Regulation of serotonin biosynthesis by the G proteins Galphao and Galphaq controls serotonin signaling in Caenorhabditis elegans. Genetics. 178, 157-169 (2008).
- Giordano-Santini, R., et al. An antibiotic selection marker for nematode transgenesis. Nat. Methods. 7, 721-723 (2010).
- Semple, J. I., Garcia-Verdugo, R., Lehner, B. Rapid selection of transgenic C. elegans using antibiotic resistance. Nat. Methods. 7, 725-727 (2010).
- Granato, M., Schnabel, H., Schnabel, R. pha-1, a selectable marker for gene transfer in C. elegans. Nucleic Acids Res. 22, 1762-1763 (1994).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C.elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Gong, J., et al. The C. elegans Taste Receptor Homolog LITE-1 Is a Photoreceptor. Cell. 167, 1252-1263 (2016).
- Liu, J., et al. C. elegans phototransduction requires a G protein-dependent cGMP pathway and a taste receptor homolog. Nat. Neurosci. 13, 715-722 (2010).
- Bhatla, N., Horvitz, H. R. Light and hydrogen peroxide inhibit C. elegans Feeding through gustatory receptor orthologs and pharyngeal neurons. Neuron. 85, 804-818 (2015).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 110, 4266-4273 (2013).
- Zang, K. E., Ho, E., Ringstad, N. Inhibitory peptidergic modulation of C. elegans serotonin neurons is gated by T-type calcium channels. eLife. 6, (2017).
- Branicky, R., Miyazaki, H., Strange, K., Schafer, W. R. The voltage-gated anion channels encoded by clh-3 regulate egg laying in C. elegans by modulating motor neuron excitability. J. Neurosci. Off. J. Soc. Neurosci. 34, 764-775 (2014).
- Hendricks, M., Ha, H., Maffey, N., Zhang, Y. Compartmentalized calcium dynamics in a C. elegans interneuron encode head movement. Nature. 487, 99-103 (2012).
- Nagy, S., Huang, Y. -. C., Alkema, M. J., Biron, D. Caenorhabditis elegans exhibit a coupling between the defecation motor program and directed locomotion. Sci. Rep. 5, 17174 (2015).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nat. Methods. 8, 147-152 (2011).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nat. Methods. 8, 153-158 (2011).
- Kato, S., et al. Global brain dynamics embed the motor command sequence of Caenorhabditis elegans. Cell. 163, 656-669 (2015).
- Nguyen, J. P., et al. Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 113, 1074-1081 (2016).
- Toyoshima, Y., et al. Accurate Automatic Detection of Densely Distributed Cell Nuclei in 3D Space. PLOS Comput. Biol. 12, 1004970 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены