Method Article
꼬마 선 충 을 행동에 개별 뉴런의 비율 칼슘 이미징
요약
이 프로토콜 꼬마 선 충 벌레 행동에 신경 활동에 기록 변화 유전자 인코딩된 캘리포니아2 + 기자의 사용을 설명 합니다.
초록
그것은 행동 하는 동물에서 신경 회로 활동 마 취 또는 움직이지 동물에 본에서 실질적으로 차이가 점점 더 분명 되었다. 매우 민감한, 유전자 인코딩된 형광 기자 캘리포니아2 + 의 세포와 동작 동물에 비-침략 적 광학 접근을 사용 하 여 시 냅 스 활동의 기록을 혁명 있다. 유전자와 결합 될 때 optogenetic 기술, 분자 메커니즘을 다른 동작 상태를 확인할 수 있습니다 동안 셀 및 회로 활동을 조절 하 고.
여기는 자유롭게 행동 하는 꼬마 선 충 벌레에 단일 뉴런의 비율 캘리포니아2 + 이미징 방법에 설명 합니다. 동물에서 기록 허용 부드럽게 오버레이 웜 표준 선 충 류 성장 미디어 (NGM) agar에 유리 coverslip로 차단 간단한 설치 기술 시연 무제한 움직임과 동작 동안 고해상도. 이 기술을 사용 하 여 민감한 Ca2 + 기자 GCaMP5 그들은 드라이브를 낳는 행동으로 세포내 캘리포니아2 + serotonergic 자웅 동체 특정 신경 (HSNs)에 있는 변화를 기록. MCherry, Ca2 +공동 표현으로-구분 형광 단백질, 우리 내 HSN의 위치를 추적할 수 있습니다 ~ 1 µ m 및 변동 변화 초점 또는 운동에 의해 발생 하는 형광에 대 한 올바른. 동시, 적외선 관찰법 이미징 동작 기록 및 동물 추적 전동된 스테이지를 사용 하 여 수 있습니다. 이러한 미세한 기술 및 데이터 스트림 통합, 비활성 및 활성 동작 상태 이상 수만 분의 진행으로 C. 선 충 계란-누워 회로 캘리포니아2 + 활동 기록할 수 있다 우리.
서문
신경 과학의 중앙 목표는 신경 회로 드라이브 동물 행동에 통신 하는 방법을 이해 하는 것입니다. 신경 회로 회로 활동, 그로 인하여 행동 변화 그들의 환경에 대응 하는 동물에 필요한 운전 변경 하려면 다양 한 감각 신호의 범위를 통합 합니다. 선 충 류, C. 선 충, 있다 302 뉴런의 시 냅 스 연결 되어 완전히 매핑된1와 간단한 신 경계. 또한, 인코딩할 neurotransmission에 관련 된 단백질을 위한 유전자는 매우 C. 선 충 및 포유류2사이 보존 됩니다. 신경 시스템의 해 부 단순에도 불구 하 고 신경 행동3를 조절 하는 방법을 이해 하는 비옥한 플랫폼을 제공 하는 보존된 행동의 복잡 한 레 퍼 토리를 표시 합니다.
C. 선 충 은 다양 한 유전자 조작, 레이저 셀 절제, electrophysiological 기법 뿐만 아니라 vivo에서 광학 이미징4,5등 접근의 적용 의무가. 최근 연구는 주요 신경 전달 물질 신호 C. 선 충 등은 해와 GABAergic 신경 네트워크 시스템의 상세한 지도 생산 했습니다. 모든 신경 G-단백질 결합 수용 체의 표현 지도에 지속적인 연구와 이러한 연구가이 모델 매우 상세한 구조를 활용 하 여 독특한 위치에 놓고 기능 신경 연결 지도 완벽 하 게 이해 하는 것이 다른 수용 체 그리고 드라이브 동물 행동의 다양 한 측면에 날짜 표시줄을 통해 신호를 다른 신경 전달 물질.
어떤 시스템에서 동적 신경 활동 패턴을 공부 하기 위해 필수적인 전제 조건 동작 중 개별 뉴런 또는 전체 회로에 활동을 기록 하기 위해 강력한 방법론을 개발 하는 것입니다. 특히 중요 한 시 냅 스 소포 융해는 연 접 활동 시각화 같은 광학 접근법의 순종이입니다. 세포내 캘리포니아2 +, 민감한 검출기의 증가 가용성 함께 신속 하 고 매우 민감한 형광 기자 동작 시 세포와 시 냅 스 활동이 깨어 있는, 살아있는 동물에서의 녹음을 혁명 있다. 시 냅 스 전기 활동의 주요 결과 Ca2 + 채널을 조절 하는, 때문에 세포내 캘리포니아2 + 에서 변경 셀 활동에 충실 하 게 보고서 행동 관련 변화 생각 된다.
이 연구에서 우리는 C. 선 충6,7에 낳는 행동을 촉진 serotonergic HSN 모터 신경에 있는 비율 캘리포니아2 + 이미지를 수행 하는 방법을 제시. 동작5,,89,10,11 동안 캘리포니아2 + C. 선 충 에서 활동과 계란-누워 회로 시각화 하는 이전 노력을 바탕으로이 접근 . 메서드를 사용 하면 동시에 계란-누워 이벤트와 셀/회로 활동에서 관찰 된 변화 뿐만 아니라 동물 운동 상태에서 변화를 상관 관계를 수 있습니다. 이 방법을 사용 하 여 어른 벌레의 활동을 공부 우리가 우리의 실험실에서 게시 되지 않은 작업이 이렇게 네 번째 애벌레 (L4) 단계에서 뿐만 아니라 청소년 동물 확장할 수 있습니다 보여 줍니다. 그것은 가능성이 뚜렷한 회로 및 동작에 기능 다른 선 충 C. 뉴런의 활동 마찬가지로이 기술 접근 해야한다. 다른 최근 빠른 Ca2 + 지표 겹치지 방출 스펙트럼12,13,,1415,16, optogenetic 도구17 개발 , 유전자 인코딩 막 전압18광학 지표, 변화 신경 회로 활동에 뚜렷한 동작 상태를 드라이브 하는 어떻게에 관통 ' 모든 광학 ' 조사를 수행 하기 위해 우리를 허용 해야 합니다.
프로토콜
1. 긴장, 문화 미디어, 그리고 동물의 장착
- 성장 OP50 대장균 세균성 음식19시드 표준 60 m m 선 충 류 성장 매체 (NGM) 한 접시에 20 ° C에 C. 선 충 벌레.
- 관심의 각 세포 특정 발기인에 대 한 두 개의 플라스 미드 준비: 하나, 운전 기록 세포내 캘리포니아2 +, GCaMP5 및 운전 mCherry GCaMP5 형광 변화의 비율 정량 수 있도록의 식을 두 번째 식과 개체 찾기 및 측정을 단순화 합니다.
참고: GCaMP5:mCherry 비율 영상 초점 및 동물 운동 변화, 세포내 캘리포니아2 +에서 실제 변화에 기인 하는 GCaMP5 형광에 변동에 대 한 해결 합니다. - LX1832 lite-1(ce314), lin-15(n765ts) X 돌연변이 동물의 생식 기에 pL15EK 표시 구조 마커 플라스 미드와 함께 GCaMP5 및 mCherry 표현 플라스 미드를 주입 하 고 복구 비 Muv lin-15(+) 동물 GCaMP5을 표현 하 고 높은 복사 transgene20,,2122에서 mCherry. 라이트-1 돌연변이 백그라운드를 사용 하 여 블루 빛 회피 행동23,24를 줄이기 위해.
- Transgenes 염색체 mosaicism을 복합 돌연변이 체 긴장25의 생성을 단순화를 통합 합니다.
참고: 여기에 설명 된 LX2004 변형 운반 GCaMP5 및 nlp-3 발기인에서 HSNs에 mCherry을 표현 하는 통합 된 높은 복사 transgene (참조 테이블의 재료)26,27, 28 , 29. (e.g.,tph-1, 테스트 HSN 개발 또는 달걀 누워 동작 다른 발기인에 비해 상당한 결함을 일으키는 없이 nlp-3 모터 드라이브 강한 표현 하는 HSNs에 늦게 L4 및 성인 동물 발견 egl-6, 그리고 unc-86). 이 긴장 및 다른 GCaMP5 및 mCherry 복 부 코드 (VC) 모터 신경, 외 음부 근육, 그리고 uv1 신경 내 분 비 세포에서 표현 하는 꼬마 유전학 센터에서 사용할 수 있습니다 그리고 그들의 건설의 세부 사항 설명 27. - OP50 백 금 벌레의 아래 시드 NGM 천 배지에서 세균성 음식 선택, 적용 하 고 그것을 사용 하 여 전송 ~ 20 후반 L4 LX2004 동물을 GCaMP5과 nlp-3 발기인에서 HSNs에 mCherry. 개발 외 음부는 stereomicroscope에 둘러싸인 하얀 초승달 분명 어두운 반점으로 나타나는지 확인 합니다. 동물 24-40 h 20 ° C에서 품 어.
- 부 화 후 선택에 OP50 적용 및 전송 ~ unseeded NGM 플레이트, 영상 동안에 먹이를 벌레에 대 한 뒤에 음식의 작은 금액을 떠나 벌레의 3. 너무 작은 세균 음식 음식을 너무 많이 배경 형광을 증가 하 고 산소를 발생 하는 동안 접시의 중심에서 방황 벌레 격려로 충분 한 음식, 확인 합니다.
- 평평한 둥근된 주걱을 사용 하 여 잘라는 ~ 20 m m x 20 m m 벌레를 들고 접시에서 청크와 덩어리 얼굴-다운 깨끗 한 24 m m x 60 m m #1.5 coverslip (그림 1)의 센터에 전송. 한쪽에 coverslip 아래 갇혀 영상과 간섭에서 거품을 유지 하는 응용 프로그램을 시작 합니다. 22 x 22 mm #1 coverslip 고집과 증발을 줄이기 위해 덩어리의 상단에 적용 됩니다.
2. 하드웨어 및 계측 설정
- 무대, ≥ 0.7는 거꾸로 한 현미경의 스테이지에 유전자 변형 웜 숫자 조리개 계획-Apochromat 20 객관적인, 전동 XY 스테이지와 조이스틱, 이미지 분할, 형광 제어 x 동시 GCaMP5에 대 한 필터 및 mCherry 여기 및 방출, 카메라 영상, 형광 및 적외선 관찰법 및 트리거 발광 다이오드 (LED) 조명 시스템 (그림 2A).
참고: 80/20 빔-스플리터 형광 카메라 이미지 신호의 80%와 20%를 보냅니다 명시 카메라. 똑바로 현미경을 사용하실 수 있습니다, 하지만 NGM 덩어리가 경우 유리 슬라이드와 큰 coverslip 배치 되어야 합니다.- 쌍 안 접 안 렌즈를 사용 하 여 선택 이미징에 대 한 웜. 동물을 선택 하면 콘덴서 위의 장소에 적외선 필터를 슬라이드.
- 트랜지스터-트랜지스터 논리 (TTL) 트리거
- 각 형광 카메라에 3 개의 TTL 트리거 출력 라인의 동축 케이블을 연결 합니다. 첫 번째 출력 LED 조명 시스템의 BNC 입력 # 3에 연결 합니다.
- 두 번째 출력 녹색 BNC '바나나' 어댑터에 연결 하 고 GPIO를 실행 하는 8 핀 GPIO 커넥터에서 갈색 전선 입력 #3 (4 핀) 및 적외선 카메라의 지상 (핀 5) 각각.
- #8 디지털 입력을 실행 하는 점퍼 와이어와 세 번째 출력 BNC '바나나' 어댑터에 연결 하 고 디지털 수집 장치 (그림 2B)에서.
- 디지털 수집 장치 (DAQ)
- DAQ 마이크로컨트롤러 보드 연결 ( 재료의 표참조) USB 케이블을 통해 PC에. Firmata ( 테이블의 자료를 참조) 프로토콜 및 57600 보드에서 USB 포트를 통신 구성 표준 펌웨어를 업데이트 합니다.
- Led
- LED 컨트롤러 소프트웨어 실행 ( 재료의 표참조). 모두 470 및 590 nm Led에 대 한 '연속 '제어'를 선택 합니다 트리거 채널 ' 3'에서 트리거 모드를 전환 합니다.
- 설정 하 고 각 LED에 대 한 LED 전원 입력 (예를 들면, 세트는 470 nm LED 590 nm LED을 20% ~ 40%).
- 직렬 단 통신 스크립트 ' XY-단계-최종 ' 분재 ( 재료의 표참조)에서30을 실행 합니다. 회색 'CsvWriter' 노드를 클릭 하 고 기록 된 저장 폴더 선택 X 및 Y 무대 정보 (그림 3). 초기화는 DAQ를 도구 모음에서 녹색 화살표를 누릅니다.
참고: 스크립트 형광 카메라는 TTL 신호를 보낼 때 X 및 Y 무대 위치를 녹음을 시작 합니다. 이 스크립트의 출력 데이터의 4 열: 프레임 번호를 위치 (µ m) X, Y 위치 (µ m), 프레임 (s) 사이의 간격. - 적외선 카메라 레코딩 소프트웨어에서에서 ( 재료의 표참조) ' 사용자 정의 비디오 모드,' 선택 "모드 1" (2 x 2 비 닝, 1024 x 1024 픽셀), 및 "픽셀 형식 Raw 8". 아래 ' 트리거 / 스트로브 ', "3", "높음", '14"'모드'를 극성 트리거 입력된 라인 (GPIO)를 설정. '사용' TTL 트리거 신호를 받을 때까지 프레임 수집을 중지 하려면 전환 합니다.
- 그 창을 열어두고, 메인 카메라 보기 도구 모음에서 빨간색 "기록" 버튼을 클릭 합니다. 이미지 시퀀스에 저장할 폴더를 선택 합니다. 'Buffered' 기록 모드를 선택 하 고 '이미지' JPEG 형식으로 저장. 인수를 초기화 "녹화 시작"을 클릭 합니다.
- 형광 카메라와 이미지 분배기
참고: GCaMP5 및 mCherry 형광 채널 비율 정량에 대 한 적절 한 이미지 등록 되도록 동시에 수집 될 해야 합니다. 이미지 분할 한 센서에 GCaMP5 및 mCherry 형광의 2 채널 인수 수 있습니다.- 이미지 수집 소프트웨어의 '캡처' 탭에서 4 배, 및 16 비트 이미지 깊이 binning 10 ms ( 재료의 표참조) 설정된 노출 시간. 512 x 256 픽셀 높이의 중심으로 카메라 하위를 선택 합니다. ' 출력 트리거 옵션 보기 '를 클릭 하 고 '긍정적인.'를 모든 트리거 설정
참고: DAQ는 그들은 10ms 이하의 TTL 트리거를 놓칠 수 가끔. - ' 트리거 1'과 ' 방 아 쇠 2'는 설정 확인 '노출' ' 방 아 쇠 3' '풀 그릴'로 설정 하는 동안 '시퀀스' 탭 아래 25 양의 '기간', 20 Hz. 선택 '저장 임시 버퍼를 합니다.'에서 이미지를 수집 50 ms의 ' 필드 Delay1'와 ' 시간의 경과 '를 선택합니다
- 이미지 수집 소프트웨어의 '캡처' 탭에서 4 배, 및 16 비트 이미지 깊이 binning 10 ms ( 재료의 표참조) 설정된 노출 시간. 512 x 256 픽셀 높이의 중심으로 카메라 하위를 선택 합니다. ' 출력 트리거 옵션 보기 '를 클릭 하 고 '긍정적인.'를 모든 트리거 설정
- PMT 고 3 채널 confocal 영상 중 강도 레이저
- 배경 형광은 최소 (블랙 레벨) 바로 위에 수준에서 PMT 이득 설정. 단일 포화 12-비트 또는 16 비트 픽셀 mCherry 채널에는 연 접에 관찰 될 때까지 561 nm (녹색) 레이저 파워를 증가.
- GCaMP5 형광은 그냥 배경 위에 연 접에 보이는 488 nm (블루) 레이저 강도 조정 합니다. 이 낮은 설정은 강한 캘리포니아2 + 과도 응답에는 형광 증가할 때 GCaMP5 픽셀의 채도 방지 합니다. 빛 캡처를 최대화 하기 위해 모든 방법을 confocal pinhole을 엽니다.
3. 비율 캘리포니아2 + 이미징 및 동작 녹화
- 형광 수집 소프트웨어에 '시퀀스' 탭에서 녹음을 시작 하려면 "시작" 클릭 합니다. 조이스틱, 초점에서 및 시야 (FOV)의 중심에 셀과 관심의 시 냅 스를 유지와 함께 벌레를 추적 합니다. 각 채널의 픽셀 통계를 표시 하려면 막대 그래프 창에서 '통계' 버튼을 클릭 합니다.
- LED 전원 ≥의 연 접 종점에 최대 단일 픽셀 mCherry 형광 8000 카운트 되도록 조정 (~ 4000 photoelectrons), 주는 한 ~ 배경 위에 12 비트 동적 범위 (~ 100 photoelectrons). GCaMP5 신호 연 접는 휴식 (낮은) 캘리포니아2 + 주위 되어야 동안에 ~ 2500 계산-그냥 배경 위에 표시.
- 레코드에 도달할 때까지 한 계란-누워 활성 상태; 일반적으로 야생-타입 웜7에서 20-30 분 마다 발생합니다. 10 민 하위 집합 (12,001 프레임), 첫 번째 계란-누워 이벤트 (프레임 6,001) 전후 6000 프레임을 저장 합니다. 동작 및 XY 스테이지 위치의 timepoints 벌레의 명시 이미지의 동일한 하위 집합을 유지 해야 합니다. 또는 데이터 스트림의 정확한 동기화 손실 됩니다.
- ImageJ BioFormats 플러그인을 사용 하 여 ( 재료의 표참조) 비율 정량 소프트웨어에 가져올 수 있도록 이미지 시퀀스 이미지 Cytometry 표준 (.ics) 형식으로 변환 하려면.
4. 이미지 세분화 및 정량 분석
- 비율 정량 소프트웨어에 이미지 시퀀스 가져오기 ( 재료의 표참조). '도구' 메뉴에서 ' 자동 대비 '를 클릭 하 고 적절 한 블랙을 설정 하는 각 채널의 명암 조정 (~ 1800) 수준 (10000) 흰색. MCherry 및 GCaMP5 채널 색상 지정 올바른그림 4(A-C)을 확인 하려면 도구 메뉴에서 ' 색상 변경...'을 선택 합니다.
- '시퀀스' 탭에서 시계열을 마우스 오른쪽 단추로 클릭 하 고 20 프레임/s 및 1.25 µ m/픽셀을 설정 합니다.
- '도구' 메뉴에서 '비율'을 선택 하 고 ' 채널 B'에 대 한 '채널 A'와 "mCherry" "GCaMP5"를 선택 합니다. 각 이미지 시퀀스에서 배경 빼기 '임계값' 옆 "계산"을 클릭 합니다. "무지개 LUT 비율 채널에 적용"을 선택 합니다.
참고: 0.3 (낮은 캘리포니아2 +)의 평균 초기 계획 비율 및 2-3 (높은 캘리포니아2 +)의 최대 비율 기록에 대 한 적절 한 코드 체계표 것 0 (파란색)에서 1 (빨간색). - (그림 4D) mCherry 채널을 사용 하 여 강도 변조 비율 채널을 생성 합니다. 강도 변조 비율 채널은 비 색 mCherry 채널의 밝기에 매핑되는 수백만의 색상 이미지입니다.
- '측정' 탭에서 '프로토콜' 창에 ' 찾을 개체 사용 하 여 강도 ' 도구를 드래그 하 여 개체 검색 프로토콜을 만듭니다. MCherry의 창에 강도 값을 설정 하 고 개체를 찾을 수를 '장부'를 클릭 합니다.
- 강도 값 ≥ 2 선택 배경 위에 표준 편차 (SD) (의예, 한 ~ 65535의 2500, 상한). 연 접 종점 검출 되 고 측정 메뉴에서 선택 하는 '자동으로 업데이트 피드백' 다는 것을 확인 하십시오.
참고: 소프트웨어 식별할 수 있습니다 또한 개체 ' SD 강도.' 관련된 프로토콜을 사용 하 여 백그라운드에서 그들의 표준 편차 그러나, 특히 밝은 개체는 FOV를 입력 하면, 그것은 변경할 수 있습니다 극적으로 평균 강도 HSN을 찾는 데 사용 되는 강도 대진표에 영향을 미치는 그 timepoints 동안. 이 변화는 원시 강도 값 개체를 찾는 데 사용 하는 경우 발생 하지 않습니다.
- 강도 값 ≥ 2 선택 배경 위에 표준 편차 (SD) (의예, 한 ~ 65535의 2500, 상한). 연 접 종점 검출 되 고 측정 메뉴에서 선택 하는 '자동으로 업데이트 피드백' 다는 것을 확인 하십시오.
- 머리, 같은 원치 않는 개체를 제외 하는 데 필요한 경우만 mCherry 채널 (크기, 최대 강도, 등)을 대상으로 하는 추가 필터 꼬리, 및 형광 직감을 추가 합니다. 측정 메뉴에서 ' 측정 항목 만들기 '를 선택합니다 하 고 ' 모든 Timepoints'를 선택합니다
참고:이 쉼표로 구분 된 값 (.csv) 파일을 파일 메뉴에서 '내보내기' 명령을 사용 하 여 내보낼 수 해야 모든 측정을 쓰기 프로토콜을 실행 됩니다. - Exported.csv 파일을 열고 새로운 시트로 Timepoint, 지역 (µ m2), 평균 (비율 채널), 중심 X (µ m), 및 중심 Y (µ m) 데이터를 복사. 열 머리글 없이 a.csv 파일을 내보냅니다. 비율 정량 소프트웨어 timepoint 당 하나 이상의 개체로 관심의 셀을 분류할 수 있습니다.
- 'AnalzyeGCaMP_2017.m' 사용자 지정 스크립트를 사용 하 여 이러한 개체를 재결합.
참고: 스크립트 또한 캘리포니아2 + (비율) 봉우리는 데이터에서를 식별 하 고 그들의 timepoints, 피크 진폭 및 피크 폭의 a.csv 파일을 저장 합니다. 그것은 또한 원시와 주석 비율 추적에 대 한 포스트 스크립트 파일을 생성합니다. 이 정보와 함께, 캘리포니아2 + 과도 진폭 및 간 과도 간격을 결정 합니다.
- 'AnalzyeGCaMP_2017.m' 사용자 지정 스크립트를 사용 하 여 이러한 개체를 재결합.
- 출력 X, Y 값은 중심 각 형광 개체에서 분재에서 XY 스테이지 스크립트에 의해 기록 된 X 및 Y 값을 추가 합니다. Net XY 위치를 사용 하 여 웜 운동 추적을 생성 하 고 셀 변위와 속도 다른 동작 상태31를 계산.
- 가상 스택으로 ImageJ로 기록 된 대물 이미지를 가져옵니다. 계란-누워 이벤트 및 기타 주석을. 캘리포니아2 + 봉우리에 이러한 이벤트의 타이밍을 비교 하 여 비율 추적에서.
결과
간단한 설치 기술 설명 (그림 1) 유리 coverslip (그림 4)를 통해 동물 행동에 기록 하는 높은 해상도 허용 하면서 L4와 성인 C. 선 충 의 문화 환경에 최소한의 변경 발생 합니다. LED 광원, 무대 컨트롤러 및 카메라 노출의 동기화 수 20 프레임/s에서 여러 스트림에서 데이터 수집에 대 한 최대 1 h. 중간에 높은 수 가늠 구멍 목표 (0.7-0.8)와 배율 (20 x) 제공 좋은 4 x 4 픽셀 비 닝 (1.25 µ m/픽셀)와 계란-누워 동작 회로에 시 냅 스 영역의 공간 해상도. 동시 취득은의 GCaMP5 및 mCherry 형광 신호 (그림 4A, B)는 동물 운동에 초점 (그림 4D) 변화에 대 한 보상으로 픽셀 비율 채널을 생성 하는 데 사용 됩니다. HSN 연 접 종착역은 큰 C. 선 충에 많은 신경 셀 시체와 연 접 HSN 캘리포니아2 + 에서 변화 명확 하 게 구상 될 수 있다. 적외선 관찰법 카메라의 큰 FOV 웜을 (그림 4E)을 기록 하는 동안 수동으로 추적할 수 있습니다. 각 동물에 대 한 세포내 캘리포니아2 + 에서 변경 동작 명시 이미징 등 계란 자료 변화 운동의 (그림 4E) 분명 상관 될 수 있다.
HSN 캘리포니아2 + 그리고 속도의 정량 확인 벌레에 그들의 운동 변경 그들은 계란-누워 동작을 전환 합니다. 전에, 하는 동안, 그리고 계란-누워 활성 상태 (그림 5A) 후 웜 속도에 큰 차이가 있다. 이 영상 또는 추적 시스템에 내재 된 잡음에 의해 발생 하지 않습니다. 우리는 강한 관찰 한 계란-누워 이벤트로 확대, 계란-누워 이벤트 mCherry 형광은 상대적으로 이전 GCaMP5 형광 (δ/F)에 변화 (그림 5B) 변경. GCaMP5:mCherry 비율 (ΔR/R)에 측정된 변화 명확 하 게 표시는 HSN 캘리포니아2 + 과도 ~ 달걀 출시 (그림 5B) 4 s 사전. 외 음부 근육 수축과 일치, 웜 운동의 분명 둔화 발생 합니다 계란 끝 출시. 이전 결과 강한 외 음부 근육 수축 그리고 계란 릴리스 8,,1027는 HSNs에 의해 innervated 있습니다 해 VC 모터 뉴런 피크 활동을 보여 것으로 나타났습니다. 우리는 또한 표시 VC 뉴런의 optogenetic 활성화 운동의 즉시 감속 드라이브 VC 신경 외 음부 근육 수축에 의해 활성화 될 수 있습니다 제안, 그로 인하여 달걀 출시27의 피드백을 받을 때까지 운동 속도 .
영상과 추적 시스템 설명 계란-누워 동작 (그림 5C)의 공간 조직의 시각화 수 있습니다. 이전 표시, 웜 입력 활성 상태로32직전 앞으로 운동의 지속적인된 실행. 웜 한 천 덩어리의 센터에서 박테리아에 구하고 그들의 시간의 대부분을 보내는. 항목이 활성 상태로, 이전 웜 드문 HSN Ca2 + 과도의 모양을 일치 음식을 멀리 이동 합니다. HSN 활동 다음 여러 간격이 HSN 캘리포니아2 + 과도 낳는 이벤트를 유지 하는로 버스트 발사에 전환 합니다. 벌레 종종 돌아서, 다시 앞으로 운동, 그리고 다시 그들의 시작 위치 OP50 박테리아 근처 쪽으로는 길에 알. 우리는 로컬 O2 와 CO2 농도 변화 벌레 계란33,34을 결정 좌우 수 추정 한다.
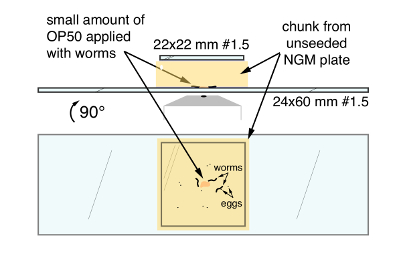
그림 1. C. 선 충 계란-누워 회로 활동 및 행동의 고해상도 이미징 기술을 장착. 상단, 측면에서 마지막 마운트입니다. 바닥, 큰 coverslip의 바닥을 통해 본으로 최종 마운트. 화살표는 OP50 세균성 음식, C. 선 충 벌레 및 계란, NGM 한 천 덩어리와 큰 24 m m x 60 m m coverslip 사이 끼여 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
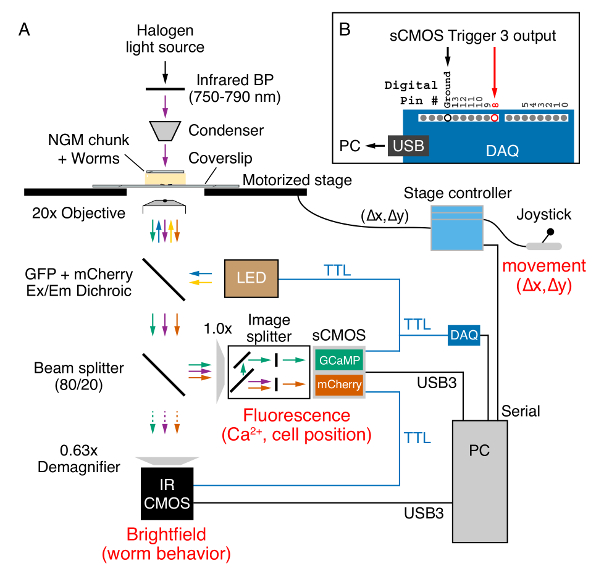
그림 2 . Widefield 비율 캘리포니아2 + 이미징 및 거꾸로 epifluorescence 현미경에 기록 하는 동작. (A) 웜 위치 및 행동 (0.8 없음) x 20 통해 명시에서 캡처한 계획 Apochromat 목표 NGM 청크를 통해 할로겐 램프에서 발산 되는 적외선 (750-790 nm) 빛 (보라색 화살표)를 사용 하 여. 조이스틱 및 전동된 스테이지 컨트롤러 보기의 필드에 벌레 기록 하는 동안 유지 하는 데 사용 됩니다. 단계 위치 (δ x, δ y) PC 직렬 포트에 의해 보내집니다. 470을 사용 하 여 벌레에 표현 하는 GCaMP5 및 mCherry 단백질 흥분 (파란색 화살표) 및 590 nm (노란색 화살표) 발광 다이오드 (LED). GCaMP5 방출 (녹색 화살표) 적외선 빛 함께 mCherry (주황색 화살표) 형광 멀티 밴드 dichroic 거울을 통해 전달 ( 재료의 표참조). 80/20 빔-스플리터 적외선-민감한 CMOS 카메라 (보라색 화살표)에 캡처 0.63 x demagnifer 통해 빛의 20%를 전송합니다. 빛의 나머지 80%는 GCaMP5를 분리 하는 이미지 분배기를 현미경의 측면 포트를 통해 전달 되 고 mCherry 형광에 적외선 관찰법 빛을 제거 하는 동안 sCMOS 카메라의 반쪽을 분리. 둘 다 카메라에서 데이터는 u s b 3 케이블을 통해 PC에 전송 됩니다. 트리거 포트 (파란색) 형광 sCMOS 카메라에서 보내는 데 사용 됩니다 + 5V TTL LED 조명 시스템, 적외선 관찰법 CMOS 카메라와 디지털 수집 장치 (DAQ)을 트리거합니다. (B) 트리거 3 출력 TTL 신호를 DAQ 디지털 핀 # 8에 의해 검색 하 여 USB 연결을 통해 PC로 전송. 이러한 디지털 입력 방 아 쇠는 ' 어디 XY' X 및 Y 위치 각 GCaMP5/mCherry 형광/적외선 이미지 캡처에 대 한 단계를 읽고 분재 소프트웨어 스크립트 (XY-단계-최종) 직렬 명령. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
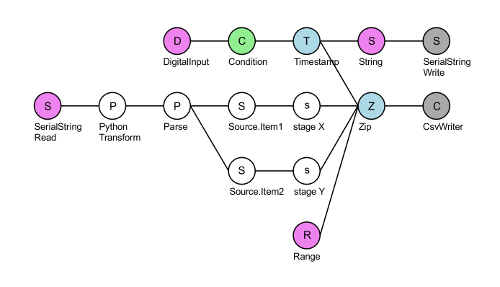
그림 3 : 분재 직렬 단 통신 스크립트 XY 스테이지 최종 레이아웃. 탑 (핑크) DigitalInput 노드는 DAQ의 핀 # 8에 TTL 트리거 읽습니다. 각 긍정적인 TTL 전압 (녹색)는 DAQ (파란색)는 타임 스탬프를 만드는 및 직렬 포트 (회색)를 통해 무대 컨트롤러 (핑크) ' 어디 XY?' 문자열을 씁니다. (핑크) SerialStringRead 노드 X 및 Y 좌표 응답 무대 컨트롤러에서 읽습니다. 이 문자열은 다음 미크론으로 변환 하 고 구분으로 X 및 Y 좌표를 무대. 마지막으로,이 4 개의 스트림 zip 노드 (파란색)를 사용 하 여 결합 하 고 4 column.csv 파일은 작성: TTL 신호 수신 (범위 노드, 핑크)의 프레임 수, X 및 Y 좌표 및 후속 timepoints 사이의 간격 (일반적으로 ~ 50 ms 때 20 Hz에 기록)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
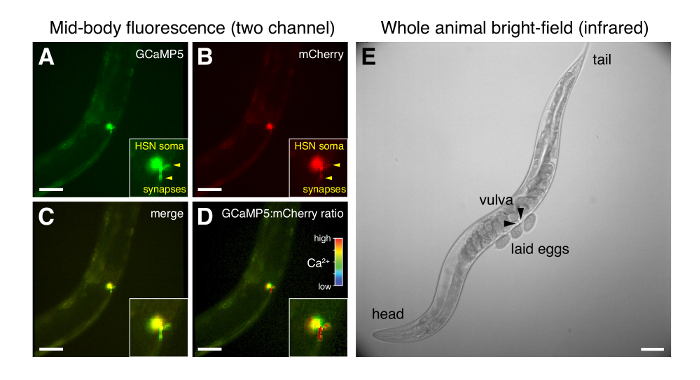
그림 4 : HSN 형광 및 계란-누워 동작 동안 전체 동물 명시의 대표적인 현미경. (A-D) 그냥 계란 릴리스 이전 HSNs에서 GCaMP5 및 mCherry 형광의 동시 비율 이미지입니다. HSN 연 접 테르미니 화살촉으로 표시 됩니다. (C) GCaMP5의 병합 및 mCherry 형광 (D) GCaMP5:mCherry 강도 변조 비율; 높은 비율 (빨간색) 높은 세포내 캘리포니아2 + 는 연 접에 나타냅니다. (E) 전체 웜 계란 해 고 직후의 명시 이미지. 화살촉 있는 달걀 누워 외 음부의 앞쪽 및 후부 반쪽을 나타냅니다. 모든 이미지에 대 한 눈금 막대는 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 계란-누워 동작 동안 HSN 캘리포니아2 + 그리고 운동 속도의 기록. (A) 세포내 캘리포니아2 + 과도 (ΔR/R; 레드) 즉각적인 웜 속도 (µ m/s; 블루) 함께 대 한 응답에서 GCaMP5:mCherry 비율 변경의 자취. 계란-누워 이벤트 화살촉으로 표시 됩니다. HSN GCaMP5 형광 (그린, δ/F), mCherry 형광 (레드, δ/F), GCaMP5:mCherry 형광 비율 (블랙; ΔR/R), 그리고 벌레의 (B) 추적 속도 계란 릴리스 순간 주위 (파란색). (C) 전체 10 분 녹화 하는 동안 계란-누워 및 운동 동작의 공간 조직 벌레 추적 mCherry 형광 기록에서 얻은 HSN의 중심 위치에 추가 했다 XY 스테이지 정보에서 얻은 것입니다. HSN 과도 (빨간 원)의 타이밍, 계란-누워 이벤트 (검은 화살표), 시작 및 녹음 (녹색과 블루 다이아몬드)의 끝이 표시 됩니다. 눈금 막대는 1 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
Transgenes:
MCherry 식 코 돈 최적화 및 intron 삽입을 통해 개선 되었습니다 (그리고 대부분의 사용 가능한 GCaMP 기자 하지 않은), 때문에 주사 ~ 강한 Ca 중 GCaMP5 형광의 유사한 수준을 지키기 위하여 GCaMP5 표현 플라스 미드의 금액 x 4 2 + 과도입니다. Lin-15(n765ts) 돌연변이의 구조 유전자 변형 동물 계란-누워 다른 동작35에 대 한 최소한의 효과와 손쉬운 복구 할 수 있습니다. 균일 한 식 및 다른 동물25사이 조건 이미징 Transgenes는 통합 한다. 항생제 저항36,를 포함 하 여 선택 가능한 마커37 및 온도 민감한 lethals38 의 구조 또한 작동 한다, 그러나, 비-유전자 변형 동물 죽은, 때문에 transgene 통합의 확인 및 homozygosity 마커를 표시 형25제시에 비해 더 어려운입니다. 지배적인 마커 정상적인 운동을 방해 하 고 피트 니스, rol-6(dm), 같은 감소 피할된39이어야 한다. 라이트 1 이미징 돌연변이 배경 영상23,,4041동안 블루 빛 탈출 응답을 줄이기 위해 필수적 이다. Gur-3, 라이트-1 병렬에서 역할의 추가 돌연변이 잔여 동작과 푸른 빛42에 의해 발생 하는 생리 적 변화 최소화 추가 수 있습니다. 편리 하 게, gur-3, 라이트-1, 린-15 는 모두 하 고 있으며 캘리포니아2 + 이미징 및 optogenetic 실험에 대 한 새로운 긴장의 건설을 단순화 한다 염색체 X의 오른쪽 절반에.
때문에 노출 시간이 짧은 20 Hz에서 이미지 수집, GCaMP5 및 mCherry 신호 밝은 되어야 합니다. 시끄러운 캘리포니아2 + 녹음에 대 한 가장 가능성이 설명은 약한 기자 식으로 발생 하는 희미 한 형광 이다. 발기인은 또한 합리적으로 되 고 몇 군데 지역에 대 한 특정 해야 합니다. HSN 셀 몸과 외 음부 근육에 시 냅 스 인 바디의 중심에 있기 때문에 머리와 꼬리에 nlp-3 발기인에서 추가 식을 일반적으로 시야 밖에 서 이며에 추가 필터를 사용 하 여 제외할 수는 비율 정량 소프트웨어입니다. 되도록 세포내 캘리포니아2 +에서 GCaMP5 형광 결과 실제 변화에서에 변화를 관찰, GCaMP5 대신 GFP 표현 제어 transgenes 독립적으로 준비 해야 하 고26을 분석. 새로운 Ca2 + 기자와 다른 Ca2 + 감도, 속도, 색상 확대 이미징 도구를 사용할 수의 선택 하지만 각 새로운 기자 유효성을 검사 해야 사용 하 여 Ca2 +-구분 형광 변종14 ,16.
미디어:
고품질 한 천으로 이미징 NGM 접시를 준비 한다. 낮은 품질 agar 압력가 마로 소독, 떠나는 작은 입자는 분산형 이미징, 및 증가 배경 형광 빛에 완전히 분해 하지 됩니다. 분자 생물학 학년 agarose를 대신 사용할 수 있습니다 하지만 추가 금액 등가 플레이트 견고를 유지 하기 위해 감소 되어야 한다.
다른 설치 방법에 대 한 비교:
계란-누워 동작 회로에 이미지 활동에 이전 접근 agarose 패드 접착제로 움직일 웜 사용. 이러한 조건, 회로 활동 및 계란-누워 동작 문화 미디어 osmolarity8,10,,4445감소 없이 선호 하지 않습니다. 최근 기록은 몇 가지 웜 동작 자유롭게 행동 하는 동물에서 본 고정된 동물에서 관찰 된 세포 활동의 관계에 대 한 질문을 제기 운동 상태에 의해 변조 된 것은 제안 합니다. 우리는 최근 계란-누워 회로 활동 운동26,27와 위상 예기치 않게 나타났습니다. 마찬가지로, compartmentalized 캘리포니아2 + 에서 RIA interneuron 신호 통합 감각 신경 및 맨 위 모터 신경에서 활동 움직임46를 구하고 하는 동안. 배변 행동은 또한 정확 하 고 틀에 박힌 변화 폐기물47를 추방 하기 전에 그들의 꼴을 준 자리에서 이동 하는 동물을 허용 하는 운동에 의해 동반 됩니다. 함께, 이러한 결과 움직이지 동물에서 회로 활동의 간략 한 녹음 자유롭게 행동 하는 동물에서 얻은 그 근본적으로 다를 수 있습니다 것이 좋습니다.
바로 아래는 coverslip 임에도 불구 하 고 벌레의 동작은 표준 NGM 접시에 본 비슷합니다. 누워 계란 해치로 이동 하며 작은 양의 음식 입금 L1 애벌레 성인 (데이터 표시 되지 않음)으로 성장 하 큰 한 청크 크기 적당 한 가스 교환 가능 하며 탈수, 비록 음식을 너무 많이 배경 형광을 증가할 것 이다 저항. 이 방법은 성인을 위한 최고 동안, 기술은 이미지 L4 동물도 사용할 수 있습니다. 그러나, 청크 사이 coverslip 수성 층의 두께 더 작은 애벌레 어려움이 크롤 링, 그리고 자주 움직이는 성인에 갇혀 얻을 수 있습니다.
이 설치 기술 한계 시체의 정확한 지역 직접 기계적 또는 화학적 자극은 어렵다는 것입니다. 최근 개발 패턴된 조명 기술에 머리 또는 꼬리 표현 미생물 opsins 별도 조명 별도 여기 및 midbody48,49에 GCaMP/mCherry 형광의 탐지에 대 한 허용. 그 결과, optogenetic 접근을 사용 하 여이 문제를 극복 하기 위해 가능한 수 있습니다.
다른 Ca에 대 한 비교 2 + 이미징 접근:
이 메서드는 세포질 캘리포니아2 + 에서 단일 변경 기록에 대 한 아주 잘 작동, 세포와 그들의 시 냅 스 영역을 해결 합니다. 머리에 신경의 실시간, 체적 영상 최근 quantitate nucleoplasmic 칼슘50,,5152에 변화 하는 세포 핵의 위치 셀 식별에 대 한 사용 하 여 달성 되었습니다. 핵과 시 냅 스 캘리포니아2 + 사이 관계는 불분명 남아 있습니다. 우리의 데이터 HSN 세포내 캘리포니아2 + 에서 가장 눈에 띄는 변경 셀 소마 (그림 4D)에서 연 접 테르미니에서 발생 하는 것이 좋습니다. HSN와 VC 신경의 연 접 테르미니26postsynaptic 외 음부 근육 포함 됩니다. 회전 하는 디스크 또는 체세포 칼슘 셀 식별에 대 한 몇 가지 방법으로 의존 하지 않고 특정 셀에 연 접 캘리포니아2 + 신호를 돌리다 빛 시트 기술을 함께 Z 차원에서 충분 한 해상도 것 여부는 확실 하지 않습니다. . 여기 설명 된 기술을 사용 하 여 각 10 분, 2 채널 12,001와 녹음 256 x 256 픽셀 16 비트 TIFF 이미지는 ~ 4 GB. 비율과 강도 변조 비율 채널을 두 번 파일 크기 ~ 8GB. 두 genotypes (야생 형 및 실험)의 각각에서 10 동물을 기록 하는 전형적인 실험 거의 150 GB의 기본 데이터를 생성 하 고 수집 하 고 분석 20 h를 요구 한다. 더 많은 데이터와 같은 몇 가지 연구 완료 왜 설명 하는 분석 시간 volumetric 분석 timepoint 당 10 Z 조각 가진 크기 순서 필요 합니다.
하드웨어:
우리는 기록 하 고 분석 하는 높은-성능 듀얼 프로세서 워크스테이션에서 이미지 시퀀스 (예: 게임) 그래픽 카드, 64 GB의 RAM, 그리고 고성능 솔리드 스테이트 드라이브 ( 재료의 표참조). 데이터 네트워크 중복 배열의 독립 디스크 (RAID)에 저장 하 고 오프 사이트 데이터 센터에 클라우드로 백업 해야 합니다.
금속 할로겐 또는 수은 기반 광원 펄스 형광 여기 Led 조명을 사용 하 고 출력 하는 것이 좋습니다. 몇몇 상업적으로 사용 가능한 멀티 컬러 LED 시스템을 사용할 수 있습니다. 이러한 LED 시스템의 일부는 더 높은 초기 비용, 그러나 그들은 긴 수명 (> 20000 h), 수 동시에 4 개 이상의 다른 fluorophores 자극 있고 낮은 대기 시간 (10-300 µs 스위치 직렬 또는 TTL 인터페이스를 사용 하 여 정확한 시간적 제어를 제공 시간)입니다. 때 데이터가 실제로 수집 되는 샘플만 조명 하면 트리거링. 우리는 일반적으로 10 ms 노출 모든 50 밀리초 (20% 듀티 비율)를 사용합니다. 이 phototoxicity 고 이미지 캡처, 이전에 보고 된43동안 모션 흐림.
우리는 그들의 속도 및 작은, 중요 한 픽셀의 큰 배열에 대 한 sCMOS 카메라를 사용합니다. EM-CCD 카메라는 더 비싼 대안 이지만 '블 룸' 효과 캡처된 photoelectrons 인접 한 픽셀에 흘리 고에서 발생할 수 있습니다. 새로운 백 조명 sCMOS 카메라 비용 크게 절감된에 EM CCDs의 비슷한 햇빛이 있다. 관계 없이 어떤 센서를 사용 하는 GCaMP5 및 mCherry 채널 가져와야 합니다 동시에. 벌레의 이동에 순차 캡처는 제대로 등록 된 이미지 비율 정량에 적합으로 이어질 것입니다. 듀얼 채널 영상 분한 후 하나의 카메라에 달성 될 수 있다 이미지 분배기 (그림 2)를 사용 하 여 또는 두 개의 동일한 카메라를 사용 하 여 채널의. 16 비트 이미지의 동적 범위는 정확한 비율 정량에 대 한 8 비트 이미지에 권장 됩니다. 대물 웜 동작의 이미지, 우리 JPEG 압축 후 큰 2 x 2 범주화 된 1024 x 1024 8 비트 이미지 시퀀스를 캡처하는 1 인치 4.1 MP 근처-적외선 u s b 3 카메라를 사용 하 여 캡처. 새로운 현미경 모델에서 사용할 수 있는 더 큰 FOV 0.63 x demagnification만: 약간의 vignetting (그림 4E) 후 20 x에서 시각을 성인 웜 수 있습니다.
표준 TTL 전압 신호를 사용 하 여 조명 및 프레임 캡처를 동기화 하는 것이 좋습니다. 다른 소프트웨어 프로그램에서 잠재적인 대기 시간 때문에 사용자가 형광 카메라 트리거 출력 마스터와 구성 TTL 출력 다른 모든 장치를 운전 하는 것이 좋습니다. 이 방법에서는, 명시 및 위치 정보는 각 Ca2 + 측정에 대 한 수집 됩니다.
슬릿-또는 공 진 포인트 검사 confocal 현미경 confocal 공유 시설에서 일반적으로 발견 또한 비율 캘리포니아2 + 이미징 동안 우수한 성능을 제공 합니다. 그런 계기는 대물24함께 여러 형광 채널 캡처를 사용할 수 있습니다. 이 경우에, confocal pinhole의 최대 직경에 열 한다 그리고 GCaMP5, mCherry, 및 적외선 관찰법 신호를 분리 하는 스펙트럼 검출기를 사용 해야 합니다. 이 두께에서 가벼운 컬렉션을 극대화 (~ 20 µ m) 밖으로의 초점 형광의 거부 하면서 슬라이스. 하나의 단점은 작은 FOV와 하드웨어 및 소프트웨어 사용자 지정에 대 한 더 많은 제한입니다.
소프트웨어:
대부분의 제조 업체는 발송 하 고 독점 소프트웨어를 포함 하 여 입력 및 출력을 트리거링의 구성 그들의 카메라와 현미경을 설치. 기능 및 녹음 하는 동안이 소프트웨어의 성능 달라질 수 있습니다. 빨리 움직이는 벌레 추적 하기 어려울 수 있습니다, 때문에 이미지 표시 해야 원활 하 고 안정적인 20 Hz에서 기록 하는 동안. 성능 향상을 위해 이미지 시퀀스 저장할 수 있습니다 일시적으로 RAM에 실험의 끝에 저장 하는 행동 관련 하위 집합으로. 이러한 2 채널 이미지 시퀀스 파일 비율 정량 소프트웨어로 가져오기 위한 오픈 이미지 Cytometry 표준 형식 (.ics)으로 변환할 수 있습니다. 오메-TIFF는 최근 오픈 소스 이미지 형식, 비록 다른 설치 수 있습니다 4 GB 보다 더 큰 TIFF 이미지 시퀀스를 저장할 수 없습니다.
정량 파이프라인의 주요 기능은 비율 채널 그리고 관심사의 세포를 찾을 수 mCherry 형광을 사용 하 여 편견된 이미지 세분화 절차의 세대입니다. 각 발견 개체에서 개체 크기, XY 중심 위치 및 최소, 의미, 그리고 각 채널 (를 포함 하 여 비율 채널)에 대 한 최대 형광 강도 값은 계산 됩니다. 함께, 이러한 값 quantitate 세포내 캘리포니아2 + 녹음에서 각 timepoint에 변경 하는 데 사용 됩니다. 각 timepoint에 대 한 개체 측정 다음 후속 분석을 위한 a.csv 파일로 내보내집니다.
여기에 설명 된 프로토콜의 주요 한계는 소프트웨어 제품의 패치워크를 통해 다양 한 형태의 데이터 이동에 대 한 의존 이다. 추가 자극 그 소프트웨어의 일부 오픈 소스와 무료 이며 다른 폐쇄 하는 동안, 비싼, unevenly 업데이트입니다. 주요 개선 사용 하거나 비슷한 수준의 성능 및 용이성-사용의 수집에서 분석을 제공 하는 소프트웨어 (이상적으로 오픈-소스)의 한 조각을 개발 하는 것입니다. 위에서 설명 했 듯이, 비율 분석 파일 크기와 실험을 완료 하는 데 필요한 시간을 두 배로. 분재 실시간, 크게 개선 처리량에서 이미지 및 기타 데이터 스트림을 수집 하 여 분석 수 같은 사용자 지정이 가능한 프레임 워크에 통합 될 수 있는 카메라 드라이버의 세대.
미래 전망:
우리는 일반적으로 수동으로 웜 움직임을 추적, 하는 동안 추적 적외선 밝은 또는 어두운-필드 녹음에서 감지 웜 중심의 자동 폐쇄 루프 조정 단계 위치를 제공 하는 노드를 처리 하는 추가 이미지에 대 한 허용 해야 추적 (그림 3 및 데이터 표시 되지 않음). 이 방법으로 얻은 형광 기록의 대부분은 어둡고 생물학 데이터를 재미 없는. 에 센서 또는 실시간 포스트 수집 이미지 처리 기술 관련 개체에 이미지 시퀀스를 자르기 것 증가 공간 해상도 대 한 허용 하 고 각 추가 Z-조각 수집 하는 경우에 특히 데이터 분석 파이프라인을 신속 하 게 timepoint 회로에 모든 사전 및 postsynaptic 세포 내에서 활동을 시각화.
공개
저자는 아무 경쟁 관심사 존재 선언 합니다.
감사의 말
이 작품은 KMC (R01 NS086932)에 NINDS에서 교부 금에 의해 투자 되었다. LMN은 NIGMS IMSD 프로그램 (R25 GM076419)에서 교부 금에 의해 지원 되었다. 변종 C. 선 충 유전학 센터, 연구 인프라 프로그램 (P40 OD010440)의 NIH 사무실에 의해 투자 되는이 연구에 사용. 우리 유용한 토론에 대 한 제임스 베이커와 메이슨 클라인 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| C. elegans growth, cultivation, and mounting | |||
| Escherichia coli bacterial strain, OP50 | Caenorhabditis Genetic Center | OP50 | Food for C. elegans. Uracil auxotroph. E. coli B. Biosafety Level 1 |
| HSN GCaMP5+mCherry worm strain | Caenorhabditis Genetic Center | LX2004 | Integrated transgene using nlp-3 promoter to drive GCaMP5 and mCherry expression in HSN. Full genotype: vsIs183 [nlp-3p::GCaMP5::nlp-3 3'UTR + nlp-3p::mCherry::nlp-3 3'UTR + lin-15(+)], lite-1(ce314), lin-15(n765ts) X |
| lite-1(ce314), lin-15(n765ts) mutant strain for transgene preparation | author | LX1832 | Strain for recovery of high-copy transgenes after microinjection with pL15EK lin-15(n765ts) rescue plasmid. Also bears the linked lite-1(ce314) mutation which reduces blue-light sensitivity. Available from author by request |
| pL15EK lin-15a/b genomic rescue plasmid | author | pL15EK | Rescue plasmid for recovery of transgenic animals after injection into LX1832 lite-1(ce314), lin-15(n765ts) X strain. Available from author by request |
| pKMC299 plasmid | author | pKMC299 | Plasmid for expression of mCherry in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| pKMC300 plasmid | author | pKMC300 | Plasmid for expression of GCaMP5 in the HSNs from the nlp-3 promoter. Has nlp-3 3' untranslated region |
| Potassium Phosphate Monobasic | Sigma | P8281 | For preparation of NGM plates |
| Potassium Phosphate Dibasic | Sigma | P5655 | For preparation of NGM plates |
| Magnesium Sulfate Heptahydrate | Amresco | 0662 | For preparation of NGM plates |
| Calcium Chloride Dihydrate | Alfa Aesar | 12312 | For preparation of NGM plates |
| Peptone | Becton Dickinson | 211820 | For preparation of NGM plates |
| Sodium Chloride | Amresco | 0241 | For preparation of NGM plates |
| Cholesterol | Alfa Aesar | A11470 | For preparation of NGM plates |
| Agar, Bacteriological Type A, Ultrapure | Affymetrix | 10906 | For preparation of NGM plates |
| 60 mm Petri dishes | VWR | 25384-164 | For preparation of NGM plates |
| 24 x 60 mm micro cover glasses, #1.5 | VWR | 48393-251 | Cover glass through which worms are imaged |
| 22 x 22 mm micro cover glasses, #1 | VWR | 48366-067 | Cover glass that covers the top of the agar chunk |
| Stereomicroscope with transmitted light base | Leica | M50 | Dissecting microscope for worm strain maintenance, staging, and mounting |
| Platinum iridium wire, (80:20), 0.2mm | ALFA AESAR | AA39526-BW | For worm transfer |
| Calcium imaging microscope | |||
| Anti-vibration air table | TMC | 63-544 | Micro-g' Lab Table 30" x 48" anti-vibration table with 4" CleanTop M6 on 25mm top |
| Inverted compound microscope | Zeiss | 431007-9902-000 | Axio Observer.Z1 inverted microscope |
| Sideport L80/R100 (3 position) | Zeiss | 425165-0000-000 | To divert 20% of output to brightfield (CMOS) camera, 80% to fluorescence (sCMOS) camera |
| Tilt Back Illumination Carrier | Zeiss | 423920-0000-000 | For infrared/behavior imaging |
| Lamphousing 12V/100W w/ Collector | Zeiss | 423000-9901-000 | For infrared/behavior imaging |
| Halogen lamp 12V/100W | Zeiss | 380059-1660-000 | For infrared/behavior imaging. White-light LEDs do not emit significant infrared light, so they will not allow brightfield imaging after the infrared bandpass filter |
| 32 mm Infrared bandpass filter (750-790 nm) for Halogen lamp | Zeiss | 447958-9000-000 | BP 750-790; DMR 32mm, for infrared illumination for brightfield and behavior |
| 6-filter Condenser Turret (LD 0.55 H/DIC/Ph), Motorized | Zeiss | 424244-0000-000 | For infrared/behavior imaging |
| Condenser & Shutter | Zeiss | 423921-0000-000 | For infrared/behavior imaging |
| Binocular eyepiece with phototube for infrared CMOS camera | Zeiss | 425536-0000-000 | For infrared/behavior imaging |
| Eyepiece 10x, 23mm | Zeiss | 444036-9000-000 | For worm localization on the agar chunk |
| C-Mount Adapter 2/3" 0.63x demagnifier | Zeiss | 426113-0000-000 | Mount for infrared CMOS camera |
| CMOS camera for infrared brightfield and behavior (1" sensor) | FLIR (formerly Point Grey Research) | GS3-U3-41C6NIR-C | Camera for brightfield imaging |
| USB 3.0 Host Controller Card | FLIR (formerly Point Grey Research) | ACC-01-1202 | Fresco FL1100, 4 Ports |
| 8 pins, 1m GPIO Cable, Hirose HR25 Circular Connector | FLIR (formerly Point Grey Research) | ACC-01-3000 | Cable for TTL triggering. The green wire connects to GPIO3 / Pin 4 and the brown wire connects to Ground / Pin 5 |
| Plan-Apochromat 20x/0.8 WD=0.55 M27 | Zeiss | 420650-9901-000 | Best combination of magnification, numerical aperture, and working distance |
| 6-cube Reflector Turret, Motorized | Zeiss | 424947-0000-000 | For fluorescence imaging |
| Fluorescence Light Train, Motorized | Zeiss | 423607-0000-000 | For fluorescence imaging |
| Fluorescence Shutter | Zeiss | 423625-0000-000 | For fluorescence imaging |
| GFP and mCherry dual excitation and emission filter cube (for microscope) | Zeiss | 489062-9901-000 | FL Filter Set 62 HE BFP+GFP+HcRed for fluorescence imaging |
| LED illumination system | Zeiss | 423052-9501-000 | Triggerable Colibri.2 LED system for fluorescent illumination |
| GFP LED module (470 nm) | Zeiss | 423052-9052-000 | Colibri.2 LED for GFP fluorescence excitation |
| mCherry LED module (590 nm) | Zeiss | 423052-9082-000 | Colibri.2 LED for mCherry fluorescence excitation |
| Iris stop slider for incident-light equipment | Zeiss | 000000-1062-360 | Field aperture iris to limit LED illumination to the camera field of view |
| C-Mount Adapter 1" 1.0x | Zeiss | 426114-0000-000 | Adapter for image-splitter and sCMOS fluorescence camera |
| Image splitter | Hamamatsu | A12801-01 | Gemini W-View, other image splitters may be used, but they may not be optimized for the large sensor size of the sCMOS cameras |
| GFP / mCherry dichroic mirror (image splitter) | Semrock | Di02-R594-25x36 | Splitting GCaMP5 from mCherry and infrared signals |
| GFP emission filter (image splitter) | Semrock | FF01-525/30-25 | Capturing GCaMP5 fluorescence |
| mCherry/ emission filter (image splitter) | Semrock | FF01-647/57-25 | This filter is necessary to exclude the infrared light used for brightfield imaging |
| sCMOS camera for fluorescence (1" sensor) | Hamamatsu | A12802-01 / C11440-22CU | Orca FLASH 4.0 V2. Newer models allow for separate image acquisition settings on separate halves of the sensor, allowing acquisition of two-channel images in combination with an image splitter |
| Motorized XY Stage | Märzhäuser | SCAN IM 130 x 100 | Stage movement; the XY resolution of this stage is 0.2µm per step |
| XY Stage controller with joystick | LUDL | MAC6000, XY joystick | Manual tracking of worms. MAC6000 controller should be connected to the PC through the serial (RS-232) port configured to 115200 baud |
| Digital Acquisition board (DAQ) | Arduino | Uno | Receiving TTL triggers from sCMOS camera. The Uno should be loaded with the standard Firmata package, and the computer USB port configured to 57600 baud |
| BNC Male to BNC Male Cable - 6 ft | Hosa Technology | HOBB6 | BNC connectors for TTL triggering |
| Gold-Plated BNC Male to SMA male coaxial cable (8.8") | uxcell | 608641773651 | To connect the fluorescence camera trigger outputs |
| BNC turn head adapter | Hantek | RRBNCTH21 | BNC to Banana Plug Adapter (4mm) |
| BNC female to female connector | Diageng | 20130530009 | Female to female BNC adapter to connect the BNC output from the camera to the Banana Plug |
| Solderless flexible breadboard jumper wires | Z&T | GK1212827 | To connect the BNC trigger outputs to the Arduiono DAQ. Male to male. |
| High performace workstation | HP | Z820 | Windows 7, 64GB RAM, Dual Xeon processor, solid state C: drive, serial (RS-232) port, multiple PCIe3 slots for ethernet connectivity, USB 3.0 cards, and additional solid state drives |
| M.2 Solid state drive | Samsung | MZ-V5P512BW | High-speed streaming and analysis of image data |
| M.2 Solid state drive adapter for workstations | Lycom | DT-120 | M.2 to PCIe 3.0 4-lane adapter |
| Network attached storage | Synology | DS-2415+ | Imaging data storage and analysis |
| Hard disk drives | Western Digital | WD80EFZX | RED 8 TB, 5400 RPM Class SATA 6 Gb/s 128MB Cache 3.5 Inch. Storage of imaging data (10 drives + 2 drive redundancy) |
| Software | |||
| Fluorescence Acquisition | Hamamatsu | HCImage DIA | Recording of two channel (GCaMP5 and mCherry) fluorescence image sequences at 20 fps |
| Brightfield Acquisition | FLIR (formerly Point Grey Research) | Flycapture | Recording of brightfield JPEG image sequences |
| Stage Serial Port Reader | Bonsai | https://bitbucket.org/horizongir/bonsai | Facilitates tracking of worms during behavior |
| LED controller software | Zeiss | Micro Toolbox Test 2011 | To set up the intensity and trigger inputs for the different LEDs in the Colibri.2 unit |
| ImageJ | NIH | https://imagej.net/Fiji/Downloads | Simple review of image sequences and formatting changes for import into Ratiometric Quantitation software |
| Excel | Microsoft | 2002984-001-000001 | For generating subsets of comma-separated value data from Volocity for MATLAB analysis |
| Peak Finding | MATLAB | R2017a | Script used for Ratio peak feature calculations |
| Ratiometric Quantitation | Perkin Elmer | Volocity 6.3 | Facilitates calculation of ratiometric image channels, image segmentation for object finding, and ratio measurement of found objects |
| Scripts | |||
| XY-stage-final.bonsai | Bonsai | TTL-triggered DAQ and stage position serial port reader | Records X and Y stage position (in microns) when the attached Arduino receives a positive TTL signal from sCMOS camera during frame exposure. Script writes a .csv file with four columns: frame number, X position (microns), Y position (microns), and the time elapsed between frames (typically ~50 msec when recording at 20 fps). X and Y stage position from this output (columns 2 and 3, respectively) are added to the X and Y centroid positions from the AnalyzeGCaMP_2017.m MATLAB script (columns 4 and 5, respectively), to give the final X and Y position of the fluorescent object for the recording. |
참고문헌
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Phil Trans R. Soc. 314, 1-340 (1986).
- Bargmann, C. I. Neurobiology of the Caenorhabditis elegans genome. Science. 282, 2028-2033 (1998).
- Piggott, B. J., Liu, J., Feng, Z., Wescott, S. A., Xu, X. Z. S. The neural circuits and synaptic mechanisms underlying motor initiation in C. elegans. Cell. 147, 922-933 (2011).
- Chung, S. H., Sun, L., Gabel, C. V. In vivo neuronal calcium imaging in C. elegans. J. Vis. Exp. JoVE. , (2013).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C. elegans egg-laying behavior. Curr. Biol. CB. 18, 1445-1455 (2008).
- Shyn, S. I., Kerr, R., Schafer, W. R. Serotonin and Go modulate functional states of neurons and muscles controlling C. elegans egg-laying behavior. Curr. Biol. CB. 13, 1910-1915 (2003).
- Zhang, M., Schafer, W. R., Breitling, R. A circuit model of the temporal pattern generator of Caenorhabditis egg-laying behavior. BMC Syst. Biol. 4, 81 (2010).
- Kerr, R. A., Schafer, W. R. Intracellular Ca2+ imaging in C. elegans. Methods Mol. Biol. Clifton NJ. 351, 253-264 (2006).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J. Neurosci. Off. J. Soc. Neurosci. 32, 13819-13840 (2012).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nat. Methods. 12, 64-70 (2015).
- Oheim, M., et al. New red-fluorescent calcium indicators for optogenetics, photoactivation and multi-color imaging. Biochim. Biophys. Acta. 1843, 2284-2306 (2014).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Kim, C. K., Adhikari, A., Deisseroth, K. Integration of optogenetics with complementary methodologies in systems neuroscience. Nat. Rev. Neurosci. 18, 222-235 (2017).
- Storace, D., et al. Toward Better Genetically Encoded Sensors of Membrane Potential. Trends Neurosci. 39, 277-289 (2016).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J. Vis. Exp. JoVE. , (2008).
- Clark, S. G., Lu, X., Horvitz, H. R. The Caenorhabditis elegans locus lin-15, a negative regulator of a tyrosine kinase signaling pathway, encodes two different proteins. Genetics. 137, 987-997 (1994).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biol. 6, 198 (2008).
- Thapaliya, E. R., et al. Bioimaging with Macromolecular Probes Incorporating Multiple BODIPY Fluorophores. Bioconjug. Chem. 28, 1519-1528 (2017).
- Mariol, M. -. C., Walter, L., Bellemin, S., Gieseler, K. A rapid protocol for integrating extrachromosomal arrays with high transmission rate into the C. elegans genome. J. Vis. Exp. JoVE. , e50773 (2013).
- Collins, K. M., Koelle, M. R. Postsynaptic ERG Potassium Channels Limit Muscle Excitability to Allow Distinct Egg-Laying Behavior States in Caenorhabditis elegans. J. Neurosci. Off. J. Soc. Neurosci. 33, 761-775 (2013).
- Collins, K. M., et al. Activity of the C. elegans egg-laying behavior circuit is controlled by competing activation and feedback inhibition. eLife. 5, e21126 (2016).
- Li, P., Collins, K. M., Koelle, M. R., Shen, K. LIN-12/Notch signaling instructs postsynaptic muscle arm development by regulating UNC-40/DCC and MADD-2 in Caenorhabditis elegans. eLife. 2, 00378 (2013).
- Banerjee, N., Bhattacharya, R., Gorczyca, M., Collins, K. M., Francis, M. M. Local neuropeptide signaling modulates serotonergic transmission to shape the temporal organization of C. elegans egg-laying behavior. PLoS Genet. 13, 1006697 (2017).
- Lopes, G., et al. Bonsai: an event-based framework for processing and controlling data streams. Front. Neuroinformatics. 9, 7 (2015).
- Flavell, S. W., et al. Serotonin and the neuropeptide PDF initiate and extend opposing behavioral states in C. elegans. Cell. 154, 1023-1035 (2013).
- Hardaker, L. A., Singer, E., Kerr, R., Zhou, G., Schafer, W. R. Serotonin modulates locomotory behavior and coordinates egg-laying and movement in Caenorhabditis elegans. J. Neurobiol. 49, 303-313 (2001).
- Ringstad, N., Horvitz, H. R. FMRFamide neuropeptides and acetylcholine synergistically inhibit egg-laying by C. elegans. Nat. Neurosci. 11, 1168-1176 (2008).
- Hallem, E. A., et al. Receptor-type guanylate cyclase is required for carbon dioxide sensation by Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 108, 254-259 (2011).
- Tanis, J. E., Moresco, J. J., Lindquist, R. A., Koelle, M. R. Regulation of serotonin biosynthesis by the G proteins Galphao and Galphaq controls serotonin signaling in Caenorhabditis elegans. Genetics. 178, 157-169 (2008).
- Giordano-Santini, R., et al. An antibiotic selection marker for nematode transgenesis. Nat. Methods. 7, 721-723 (2010).
- Semple, J. I., Garcia-Verdugo, R., Lehner, B. Rapid selection of transgenic C. elegans using antibiotic resistance. Nat. Methods. 7, 725-727 (2010).
- Granato, M., Schnabel, H., Schnabel, R. pha-1, a selectable marker for gene transfer in C. elegans. Nucleic Acids Res. 22, 1762-1763 (1994).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C.elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Gong, J., et al. The C. elegans Taste Receptor Homolog LITE-1 Is a Photoreceptor. Cell. 167, 1252-1263 (2016).
- Liu, J., et al. C. elegans phototransduction requires a G protein-dependent cGMP pathway and a taste receptor homolog. Nat. Neurosci. 13, 715-722 (2010).
- Bhatla, N., Horvitz, H. R. Light and hydrogen peroxide inhibit C. elegans Feeding through gustatory receptor orthologs and pharyngeal neurons. Neuron. 85, 804-818 (2015).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 110, 4266-4273 (2013).
- Zang, K. E., Ho, E., Ringstad, N. Inhibitory peptidergic modulation of C. elegans serotonin neurons is gated by T-type calcium channels. eLife. 6, (2017).
- Branicky, R., Miyazaki, H., Strange, K., Schafer, W. R. The voltage-gated anion channels encoded by clh-3 regulate egg laying in C. elegans by modulating motor neuron excitability. J. Neurosci. Off. J. Soc. Neurosci. 34, 764-775 (2014).
- Hendricks, M., Ha, H., Maffey, N., Zhang, Y. Compartmentalized calcium dynamics in a C. elegans interneuron encode head movement. Nature. 487, 99-103 (2012).
- Nagy, S., Huang, Y. -. C., Alkema, M. J., Biron, D. Caenorhabditis elegans exhibit a coupling between the defecation motor program and directed locomotion. Sci. Rep. 5, 17174 (2015).
- Leifer, A. M., Fang-Yen, C., Gershow, M., Alkema, M. J., Samuel, A. D. T. Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nat. Methods. 8, 147-152 (2011).
- Stirman, J. N., et al. Real-time multimodal optical control of neurons and muscles in freely behaving Caenorhabditis elegans. Nat. Methods. 8, 153-158 (2011).
- Kato, S., et al. Global brain dynamics embed the motor command sequence of Caenorhabditis elegans. Cell. 163, 656-669 (2015).
- Nguyen, J. P., et al. Whole-brain calcium imaging with cellular resolution in freely behaving Caenorhabditis elegans. Proc. Natl. Acad. Sci. U. S. A. 113, 1074-1081 (2016).
- Toyoshima, Y., et al. Accurate Automatic Detection of Densely Distributed Cell Nuclei in 3D Space. PLOS Comput. Biol. 12, 1004970 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유