Method Article
Изоляция и характеристика опухолевых клеток от саркомы пациента полученных Xenografts
В этой статье
Резюме
Мы описываем подробный протокол для изоляции опухолевых клеток от человека саркомы пациента полученных ксенотрансплантатов флуоресценции активированных клеток сортировки, используя человеческий лейкоцитов антигена-1 (HLA-1) в качестве отрицательного маркера, а также для дальнейшей проверки и характеристика этих HLA-1-отрицательных опухолевых клеток.
Аннотация
Существование и важность опухолевых клеток (ТИЦ) были подтверждены растущими доказательствами в течение последнего десятилетия. Эти TICs было показано, что ответственность за инициацию опухоли, метастази, и лекарственной устойчивости. Поэтому важно разработать конкретные TIC-таргетинга терапии в дополнение к текущим стратегиям химиотерапии, которые в основном сосредоточены на основной части не-TICs. Для дальнейшего понимания механизма злокачественности ТИКов мы описываем метод изоляции и характеристики ТИКов в саркомах человека. В этом случае мы показываем подробный протокол для генерации ксенотрансплантов (PDX) саркомы человека и изоляции ТИКов с помощью флуоресценции активированных клеток сортировки (FACS) с использованием человеческого лейкоцита антигена класса I (HLA-1) в качестве отрицательного маркера. Кроме того, мы описываем, как функционально охарактеризовать эти ТИКи, в том числе проверки формирования сферы и проверки формирования опухоли, и вызвать дифференциацию вдоль мезенхимальных путей. Изоляция и характеристика ТИКОВ PDX дают подсказки для открытия потенциальных реагентов терапии таргетинга. Кроме того, все больше данных свидетельствует о том, что этот протокол может быть расширен, чтобы изолировать и охарактеризовать ТИКоты от других видов рака человека.
Введение
Внутриопухолевая клеточная неоднородность рака человека была поддержана увеличением доказательств в течение последнего десятилетия1. Подобно нормальной ткани, раковая ткань состоит из небольшой субпопуляции TIC (также называемых раковыми стволовыми клетками), которые обладают опухолевой способностью; между тем, основная часть раковых клеток экспонат дифференцированных фенотипов2. Эти TIC показывают стволовые клетки, как свойства, в том числе выражение маркера стволовых клеток и способность как самообновления и асимметричного деления клеток, и, таким образом, может инициировать формирование клеточной неоднородной опухоли3. Недавние исследования показали, что TICs не только ответственны за инициирование опухоли, но также связаны с агрессивностью опухоли4,метастазировать5,и лекарственной устойчивостью6. Поэтому важно понимать биологию ТИКов и, таким образом, разрабатывать конкретную стратегию лечения, ориентированную на эти ТИК.
Методы на основе FACS используются для идентификации TICs с помощью маркеров TICs, включая CD133, CD24 и CD441. Большинство из этих маркеров также выражены в нормальных стволовых клетках7. Тем не менее, ни один из этих маркеров не только знак TICs. Роль этих молекул в злокачественности ТИКов до сих пор не ясна. Например, CD133 часто может быть инактивирован метилированием ДНК, и, таким образом, эта межопухолевая неоднородность может сделать точность этих маркеров8. ALDH1 является маркером, который также функционирует для поддержания стебли TICs9. Это, кажется, более эффективным в выявлении рака молочной железы TICs, но по-прежнему сомнительна в других типах опухоли9. Некоторые сигнальные пути играют важную роль в биологии стволовых клеток, в том числе Wnt (сайт интеграции, связанный с крылом), TGF-я (преобразование фактора роста бета), и Ежик1. Но трудно доказать, что эти пути являются TIC-специфических и использовать активность этих путей, чтобы изолировать TICs от первичных опухолей. Таким образом, надежный новый маркер TIC срочно необходим.
Человек MHC класса I, также называемый HLA-1, является белка поверхности клетки, выраженных почти во всех нуклеированных клеток10. HLA-1 функционирует как антиген, представляющий молекулу, которая специально распознается CD8 Т-клетками10. Цитотоксический эффект CD8 Т-клеток может быть активирован, когда раковые клетки представляют антиген опухоли HLA-1. Таким образом, отсутствие HLA-1 на поверхности клеток раковых клеток может привести к иммунной побег из цитотоксических CD8 Т-клеток. Снижение HLA-1 было описано в различных типах рака человека и коррелирует с плохим прогнозом, метастазами и лекарственной устойчивостью11. Мы показали, что потеря экспрессии HLA-1 на поверхности клетки может быть использована для идентификации ТИКов в саркомах, а также при раке предстательной железы6,12.
Здесь мы описываем подробный протокол для изоляции TICs от человека саркомы PDXs по FACS, используя HLA-1 в качестве отрицательного маркера, а также для дальнейшей проверки и характеристики этих HLA-1-отрицательных TICs.
протокол
Все протоколы для экспериментов с мышью, обсуждаемые здесь, были в соответствии с институциональными руководящими принципами и одобрены Медицинским центром Маунт-Синай институциональным комитетом по исследованию человека и Комитетом по уходу за животными и использованию.
1. Обработка образца саркомы ткани, и ОБРАЗОВАНИЕ PDX
- В соответствии с утвержденным Институциональным наблюдательным протоколом сотрудники патологической службы готовят образцы саркомы из образцов хирургии и сразу же кладут каждый образец на лед в 100-мм чашке Петри.
- Поместите образец в 15 мл полистирола конической трубки с 6 мл холодной Розуэлл Парк Мемориальный институт (RPMI) 1640 культуры среды дополнены 10% плода бычьей сыворотки (FBS) и 1% пенициллин / стрептомицин. Немедленно обработайте образец ткани.
-
(Необязательно) Для остеосаркомы только, следуйте следующим шагам, которые могут быть пропущены для саркомы мягких тканей.
- Разрежьте ткань на 20 мм3 кусочки с помощью скальпеля. Перенесите кусочки ткани в трубку 15 мл, содержащую 3 мл коллагеназного раствора (RPMI 1640 с коллагеназой 1 мг/мл).
- Положите трубку в водяную баню при 37 градусах по Цельсию в течение 30 минут.
- Тщательно вихрь трубки, а затем, добавить 3 мл RPMI 1640 дополнены 10% FBS, чтобы нейтрализовать активность коллагеназы.
- Центрифуга в течение 5 мин при температуре в комнате 350 х г. Удалите супернатант.
- Работая в стерильном шкафу биобезопасности, поместите образец ткани в 100 мм чашку Петри. Добавьте в ткани 500 л стерильного 1x фосфатно-буферного солей (PBS). С помощью стерильного скальпеля механически тритуруирует ткань на мелкие кусочки, пока ни одна видимая часть ткани не будет больше 0,1 мм.
- Перенесите суспензию 500 л клеток на 35-мм ячеек и соберите фильтрованную подвеску с помощью трубки полистирола мощностью 50 мл. Положите эту трубку из 50 мл полистирола с клеточной подвеской на лед.
- Добавьте в ткани еще 500 л ПБС. Triturate во второй раз, передача подвески через ячейку ситечко, и собрать его в тот же 50 мл трубки.
- Повторите эти шаги (шаги 1,5-1,6) до тех пор, пока секция ткани полностью не разобщена, обычно 6x - 8x.
- Пеллетите клеточную подвеску центрифугированием при температуре 350 х г в течение 10 мин при комнатной температуре. Откажитесь от супернатанта, отостановите гранулы с помощью 5 мл буфера гемолиза (0,15 М НМ4Cl, 10 мМ KHCO3,и 0,1 мМ EDTA), и инкубировать раствор в течение 5 минут при комнатной температуре для удаления красных кровяных телец.
- Центрифуга в течение 5 мин при температуре 350 х г при комнатной температуре и удалите буфер гемолиза. Вымойте гранулы с 5 мл PBS. Центрифуге снова в течение 5 мин при 350 х г и удалить супернатант.
- Отрежь гранулы с 1 мл PBS и рассчитывать жизнеспособный номер ячейки с помощью гемоситометра или любой другой альтернативный метод. Разбавить клетки до конечной концентрации 1 х 107 клеток в 200 Л Л PbS. Оставьте подвеску клетки на льду.
- Оставьте подвальную мембранную матрицу на льду, чтобы она растаяла. Добавьте 200 зл и подвальной мембранной матрицы к 200-й клеточной подвеске. Аккуратно перемешайте и держите на льду.
- Подкожно вводят клеточную подвеску: мембранную матрицу (1:1) в две мышки NOD scid gamma (NSG) на их фланги. Используйте 200 л для каждой инъекции.
- Мониторинг формирования PDX, проверяя место инъекции мышей 2x в неделю. Удалить опухоль ксенотрансвтат, когда она достигает 1 см в диаметре.
2. Изоляция опухолевых клеток FACS от PDX
- Хирургически удалить PDX от мышей, как описано ранее12.
- Разрежьте опухоль пополам. Исправить половину ксенотранспланта с 4% параформальдегида в одночасье. Это для гистологического анализа. Обработайте другую половину ткани, как описано выше (шаги 1.3-1.8), чтобы получить суспензию опухолевых клеток.
- Resuspend гранулы с PBS и рассчитывать жизнеспособный номер ячейки.
- Разбавить клеточной суспензии в PBS дополнили 5% FBS до концентрации 2 х 106 клеток/мл. Оставьте суспензию клетки на льду на 30 мин. Разделите суспензию клетки на две трубки. Отметьте трубки изотопным контролем и антителами, соответственно. Обратите внимание на количество клеток в каждой трубке.
- Подготовка 2x HLA-1-PE антитела путем разбавления антитела с PBS дополнены 5% FBS (1:250). Разбавить отрицательный изотип контроля антитела с тем же условием. Смешайте суспензию клеток из трубки «антитела» с разбавленным антителом (1:1), чтобы сделать окончательное разбавление антител 1:500. Смешайте суспензию клеток из трубки «изотопного управления» с изотопным управлением (1:1). Положите клеточные суспензии на льду на 90 мин.
- Центрифуга в течение 5 мин при 350 х г при 4 градусах по Цельсию и удалите супернатант. Добавьте 10 мл PBS для мытья гранул 2x.
- Добавьте 4',6-диамидино-2-фенилиндол (DAPI) в PBS до конечной концентрации 10 мкг/мл. Добавьте этот раствор DAPI в клеточные гранулы, чтобы сделать клеточную подвеску 107 ячеек/мл (с помощью номеров клеток от шага 2.4).
- Фильтр яточной подвески через 35 мкм крышки ситечко в 12 мм х 75 мм полистирола труб.
- Используйте цитометр потока для сортировки HLA-1-негативной субпопуляции TIC6. Ворота жизнеспособных клеток (DAPI-отрицательный) и собирать как HLA-1-отрицательных и -положительных субпопуляций в двух 15 мл коллекционных труб, каждая из которых содержит 4 мл RPMI 1640 культуры среды.
3. Характеристика опухолевых клеток
- Формирование саркосферы
- Сделайте среду роста саркосферы, используя среду культуры клеток альфа-MEM. Добавить добавки, чтобы сделать окончательную концентрацию B-27 добавки (1x), N2 добавки (1x), основной фактор роста фибробластов (bFGF) (20 нг/мл), и эпидермальный фактор роста (EGF) (20 нг/мл) и пенициллин / стрептомицин (100 МЕ/мл). Фильтр среды с 0,2 мкм фильтр культуры клеток перед использованием.
- Пеллет сортированное HLA-1-отрицательное и -положительное субпопуляция от шага 2.9 и подсчитывает номера клеток каждой субпопуляции.
- Разбавить 1,5 х 106 клеток в 15 мл среды роста саркосферы, чтобы сделать разбавление клеток 1 х 105 клеток/мл.
- Последовательно разбавить клетки со свежей саркосферной среды роста, чтобысделать 15 мл каждой клетки разбавления 10 4, 103,и 102 клетки / мл. Затем приготовьте четыре 96-ну хорошо ультра-низкие пластины культуры клеток вложения, каждый для разбавления клеток.
- Передача 100 л клеточной подвески от 105 клеток/мл разбавления к каждой скважине из первого 96-хорошо ультра-низкой пластины культуры клеток вложения. Эта пластина имеет 104 клеток в каждом колодце.
- Используйте другие три 96-хорошо ультра-низкий вложения клеточнойкультуры пластин для других трех клеток разбавления: 10 4, 103,и 102 клетки / мл. Передача 100 л клеточной подвески к каждой скважине 96-хорошо ультра-низких пластин культуры вложений. Эти три культурные пластины имеют 1000 клеток/ ну, 100 клеток/ну и 10 клеток/ну, соответственно.
- Положите пластины в 37 градусов по Цельсию, 5% CO2 культуры клеток инкубатора.
- Добавляйте новые bFGF и EGF непосредственно в среду клеточной культуры (окончательная концентрация 20 нг/мл) каждые три дня без изменения среды, чтобы избежать потери клеток в культуре подвески.
- Используя легкий микроскоп, следите за формированием саркосферы каждый день в течение трех недель, как показано на рисунке 2A.
- Через три недели подсчитайте количество саркосферно-положительных скважин и саркосферно-отрицательных скважин каждой клеточной разбавления как для HLA-1-отрицательных, так и для HLA-1-положительных клеток.
- Рассчитайте частоту шарообразующих клеток на основе распределения вероятности Пуассона13. Сравните HLA-1-отрицательные TICs с HLA-1-положительных навалочных ячеек.
- Серийное разбавление опухолевого образования
- Подсчитайте HLA-1-отрицательные и -положительные субпопуляции от шага 2.9.
- Сделать серийное разбавление клеток сPBS до концентраций 10 6, 105,104,и 103 клеток /мл. Используйте 1 мл каждого разбавления для формирования опухоли у 10 мышей.
- Добавьте 1 мл мембранной матрицы в 1 мл клеточной подвески каждого разбавления (1:1). Держите 2 мл каждой смеси на льду.
- Подкожно вводят 200 зЛ клеточной: мембранной матричной смеси в фланги мышей NGS, используя HLA-1-отрицательные клетки для одного фланга и HLA-1-положительные клетки для другого фланга той же мыши. Для каждого разбавления используйте 10 мышей. Используйте шприцы 25G с иглой для инъекций.
- Мониторинг образования опухоли у мышей в течение четырех-восьми недель, в зависимости от скорости роста опухоли.
- Рассчитайте частоту клеток, испотянувщих опухоль, по проценту формирования опухоли при различных числах входных клеток. Сравните HLA-1-отрицательные TICs с HLA-1-положительных навалочных ячеек.
- Индуцированная дифференциация вдоль мезенхимальных путей
- Используйте саркосферы, сформированные во время предыдущих шагов (шаг 3.1.9). Перенесите саркосферы на новую 6-колодую пластину. Культура саркосферы с 2,5 мл альфа-MEM дополнены 10% FBS, чтобы клетки прикрепляются к поверхности пластины культуры.
- После вложения в течение двух дней, переключить культуры среды от альфа-MEM дополняется 10% FBS на 1:1 смесь альфа-MEM дополняется 10% FBS и человека мезенхимальной стволовых клеток (hMSC) среды роста.
- Через два дня переключитесь на полную среду роста HMSC.
- Когда клетки достигают 90% всблючи, аспирировать среды HMSC и добавить дифференциации среды. Для остеогенной дифференциации добавьте остеогенную дифференциацию среды (среда роста HMSC дополнена 10 нм дексаметазоном, 5 ММ-глицерофосфатом, 50 мкг/мл L-аскорбиновой кислоты и 10 мм хлорид лития). Для липогенной дифференциации добавьте среду дифференциации адипоцитов (среда роста HMSC дополнена 0,5 мкм дексаметазоном, 0,5 мкм изобутилметилксантином и 50 мкм индометацином).
- Изменяйте среду дифференциации каждые три дня.
- После трех-четырех недель, остановить дифференциацию и мыть клетки с PBS. Затем, аспирировать PBS и добавить 2 мл 10% формалин в клетки для фиксации. Пусть клетки сидят в течение 45 минут при комнатной температуре. Вымойте их деионизированной водой. Клетки теперь готовы к окрашиванию Alizarin Red S (шаг 3.3.6.1) или окрашиванию маслом Red O (шаг 3.3.6.2).
- Чтобы обнаружить остеогенную дифференциацию, выполните окрашивание Ализарин омичи. Аспирировать воду и добавить 2 мл Ализарин Красный S рабочий раствор (2% Ализарин Красный S, рН 6.0) в клетки, и пусть они сидят в течение 5 минут для окрашивания. Вымойте клетки деионизированной водой и наблюдайте за реакцией микроскопически.
- Чтобы обнаружить адипогенную дифференциацию, выполните масляное красное окрашивание.
- Сделать масло Красный O решение. Подготовьте бульонный раствор, добавив 300 мг порошка Oil Red O в 100 мл изопропанола.
- В течение 2 ч перед использованием смешайте три части (30 мл) масляного раствора Сепарт с двумя частями (20 мл) деионированной воды. Разрешить смесь сидеть в течение 10 минут при комнатной температуре.
- Фильтр рабочего решения, используя перед использованием.
- Удалите воду из клеток, подготовленных в соответствии с шагом 3.3.6. Добавьте 2 мл 60% изопропанола, чтобы покрыть монослой клетки и клетки сидят в течение 2 минут.
- Удалить изопропанол и добавить 2 мл масла Красный O рабочего решения. Разрешить клеткам сидеть в течение 5 минут при комнатной температуре.
- Промыть клетки деионизированной водой и наблюдать за реакцией под световым микроскопом.
Результаты
Человеческая саркома PDX была создана и окрашены. Внутриопухолевая неоднородность была показана иммуногистохимией с помощью антитела HLA-1. Ксенотрансплантат состоял из двух различных субпопуляций, а именно HLA-1 положительных и отрицательных(рисунок 1A)12. Саркома PDX показал гистологическое сходство с родительской первичной опухоли(рисунок 1A). Саркома PDX TICs были изолированы FACS. Используя метод двойной сортировки, HLA-1-отрицательные клетки были сильно обогащены от родительской популяции клеток(рисунок 1B)12.
Гены, выраженные в стволовых клетках (например, Oct4, Nanog и Myc), были признаны высоко выраженными в изолированных HLA-1-отрицательных клетках по сравнению с их HLA-1-положительным аналогом(рисунок 1C). Sox-9, ген развития сообщил играть важную роль в других стволовых клеток рака, таких как в рак молочной железы, были конкретно выражены в HLA-1-отрицательных клеток(Рисунок 1D).
Для проверки изолированной HLA-1-негативной субпопуляции, саркосфера формирования ассее было проведено для изучения способности самообновления клеток. HLA-1-отрицательные клетки смогли сформировать сферы с первоначальным ввоза всего 10 клеток(рисунок 1E)12. Для изучения опухолеобразной способности был проведен серийный разбавления опухолево-образования. Те же количества HLA-1-отрицательных и -положительных клеток были введены подкожно в каждый фланг одной и той же мыши. HLA-1-отрицательные клетки показали значительно более высокую способность образования опухоли(Рисунок 1F)12, в то время как ксенотрансплантаты, образованные как HLA-1-отрицательными, так и положительными субпопуляциями, были клеточные неоднородные опухоли (рисунок1H).
Мы провели анализ экспрессии генов изолированных HLA-1-отрицательных TICs12. Гены, связанные с нормальной мезенхимальной дифференциации клеток, были повышены в ТИКах12. Таким образом, мы также проверили ли HLA-1 TICs могут быть вызваны к терминальной дифференциации и привести к снижению способности формирования опухоли. Результаты показали, что HLA-1-отрицательные клетки могут быть индуцированы дифференцировать вдоль липогенных и остеогенных путей и показать сильные нефть Красный O и Ализарин Красный S окрашивания (Рисунок 1G). В отличие от этого, HLA-1-положительные клетки не дифференцируются в тех же условиях. Таким образом, эти результаты указывают на перспективную дифференцированную стратегию терапии, которая может быть использована для таргетинга НА ТИК с саркомой.
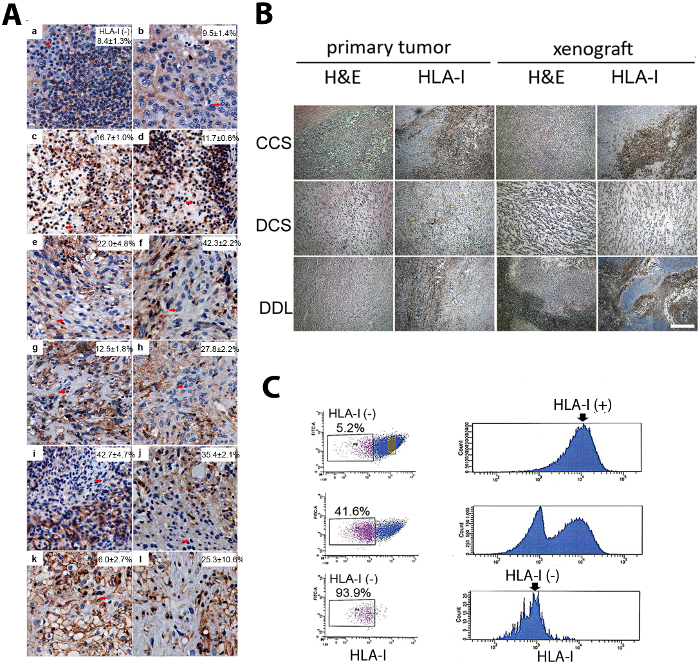
Рисунок 1: Изоляция HLA-1-отрицательных клеток от внутриопухолевой неоднородной саркомы PDXs. (A) HLA-1-отрицательные клетки (стрелки) были найдены в различных подтипах человеческих сарком иммуногистохимии (IHC). (a и b) Чистая клеточная саркома. (c и d) Плеоморфная липосаркома. (e и f) Лейомиосаркома. (g и h) Злокачественная периферическая опухоль нервной оболочки. (i и j) Липосаркома, иное не указано. (k и l) Дедифференцированная липосаркома. Шкала бар No 100 мкм. (B) Саркома PDXs были гистологически похожи на родительской опухоли (гематоксилин и эосин "H и E" пятно) и показал клеточной неоднородности в HLA-1 выражение IHC. Здесь показаны репрезентативные фотографии саркомы PDXs, в том числе ясная саркома клеток (CCS), дедифференцированной хондросаркомы (DCS), и дедифференцированной липосаркомы (DDL). Шкала бар 100 мкм. (C) Субпопуляция HLA-1-отрицательных клеток была выделена цитометрии потока с двойным сортировкой метода. Сверху вниз: первый сорт, второй сорт и проверка чистоты. Изолированные HLA-1-отрицательные и HLA-1-положительные клетки были подвергнуты последующему функциональному анализу, включая анализ образования опухоли. Результаты этой цифры взяты из предыдущей публикации12. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
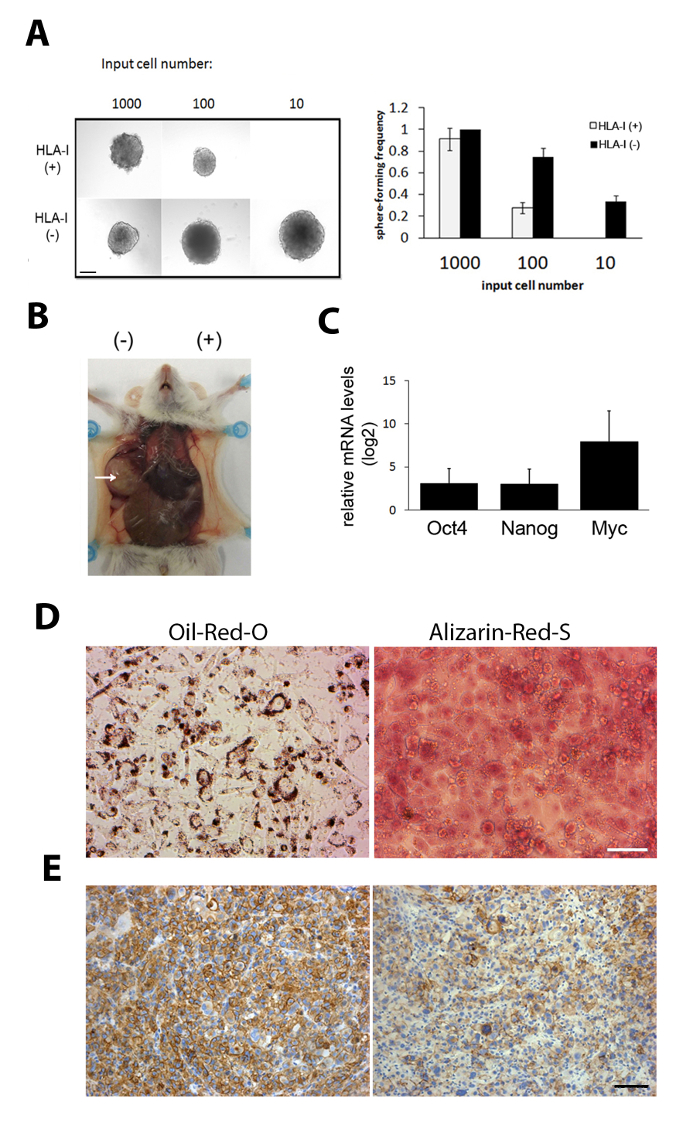
Рисунок 2: Характеристика HLA-1-отрицательных TICs с помощью функциональных анализов. (A) Сфер формирования ассеев показали, что всего лишь 10 HLA-1-отрицательных клеток были в состоянии образовывать саркомы сфер. Слева: репрезентативные фотографии саркома сфер. Справа: частота формирования сферы; означает SD. Шкала бар 100 мкм. (B) HLA-1-отрицательные клетки, изолированные от саркомы PDX были очень опухолевыми. Здесь показаны репрезентативные снимки опухоли, образованной HLA-1-отрицательными и -положительными клетками из DDL. Тысяча клеток HLA-1-отрицательных и HLA-1-положительных DDL-клеток были введены в отдельных флангах одной мыши. (C) Уровни мРНК генов стволовых клеток Oct4, Nanog, и Myc были выражены на более высоких уровнях в HLA-1-отрицательных клеток по сравнению с HLA-1-положительных клеток. Данные представляют среднее sD(n No 5). (D) Сильное положительное окрашивание Oil Red O и Alizarin Red S показывает терминальную дифференциацию вдоль липогенных и остеогенных путей, которые индуцируются из САРкомы TICs. (E) HLA-1 иммуно-пятно PDXs формируется HLA-1-положительных (слева) и -отрицательных (справа) субпопуляций. Шкала бар 100 мкм. Результаты этой цифры взяты из предыдущей публикации12. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Есть несколько критических шагов, которые ограничивают успех этого протокола, чтобы изолировать и охарактеризовать опухолевые клетки, инициирующих от саркомы человека PDXs. Мы заметили, что образование PDX сильно зависит от подтипов саркомы. Клинические агрессивные саркомы с гистологически недифференцированным фенотипом (например, плеоморфные недифференцированные саркомы (коэффициент успеха 100%, n No 2), дедифференцированные липосаркомы (коэффициент успеха 100%, n no 2) и синовиальные саркомы коэффициент успеха 100%, n no 3) имеют высокий уровень успеха формирования PDX. Между тем, саркомы с дифференцированными фенотипами (например, хорошо дифференцированные липосаркомы «коэффициент успеха 0%, n no 3) показывают более низкие показатели формирования PDX. Вполне возможно, что опухолевые клетки присутствуют в более злокачественных подтипах с более высоким процентом, чем в менее злокачественных, дифференцированных подтипов. Кроме того, мы рекомендуем закончить процедуру изоляции клеток, исследующих опухоль, в течение одного дня без каких-либо остановок, чтобы свести к минимуму потерю жизнеспособности клеток.
Мы определили, что HLA-1-отрицательные клетки существуют широко в человеческих саркомах. Но процент HLA-1-отрицательных клеток может варьироваться между образцами от разных пациентов. С помощью этого метода, мы успешно изолированы опухоли инициирующих клеток из образцов, которые HLA-1 отрицательных клеток, начиная от менее 0,5% до более чем 30%12. Важно, чтобы охарактеризовать HLA-1-отрицательных клеток функционально формирования сферы и опухолевых анализов формирования для подтверждения опухоли инициирующих клеточной идентичности изолированных HLA-1-отрицательных клеток.
Однако представленный здесь протокол также имеет ограничения. Предыдущие данные показали, что экспрессия HLA-1 эпигенетически регулируется, что согласуется с наблюдением клеточной неоднородности экспрессии HLA-1 в пределах той же опухоли12. Геномные мутации HLA-1 были обнаружены при саркомах и других типах рака. Мутации в генах HLA-1 могут привести к полной потере HLA-1 на поверхности клетки во всей опухоли или к выражению нефункционального мутировавого HLA-1. В любом случае, HLA-1 негатив не может быть использован для выявления TICs в опухоли.
Используя HLA-1 в качестве отрицательного маркера, мы успешно изолировали ТИК от различных подтипов саркомы человека и подтвердили наши результаты с помощью функционального анализа. Таким образом, мы смогли провести молекулярные исследования, включая анализ экспрессии генов на ТИКах, чтобы разработать специфическое лечение, ориентированное на эти ТИК.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано NCI-P01-CA087497 (к C.C.-C. и D.H.) и NIH-U 54-0OD020353 (в C.C.-C., D.H., и J.D.-D.), Agilent Thought Leader Award (c.C.-C.), и Фонд Martel (к C.C.-C. и J.D.-D.).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 μm cell culture filter | ThermoFisher | 450-0020 | |
| 100 mm Petri dish | Falcon | 353003 | |
| 15 mL conical tube | Falcon | 352196 | |
| 35 μm cell strainer | Falcon | 352340 | |
| 50 mL polystyrene tube | Falcon | 352070 | |
| 96-well ultra-low attachment cell culture plate | Corning | 7007 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| B-27 | Gibco | 08-0085SA | |
| bFGF | Invitrogen | PHG0021 | |
| dexamethasone | Sigma-Aldrich | D4902 | |
| EGF | Invitrogen | PHG0311 | |
| HLA-1-PE antibody | Abcam | ab43545 | |
| hMSC growth medium | ATCC | PCS-500-030 | |
| indomethacin | Sigma-Aldrich | I7378 | |
| isobutylmethylxanthine | Sigma-Aldrich | I5879 | |
| isopropanol | Sigma-Aldrich | W292907 | |
| Isotype Control Antibody | Abcam | ab103534 | |
| L-ascorbic acid | Sigma-Aldrich | A5960 | |
| lithium chloride | Sigma-Aldrich | 62476 | |
| Matrigel basement membrane matrix | Corning | 354230 | |
| MEM Alpha | Gibco | 12571-063 | |
| N2 | Gibco | 17502-048 | |
| NSG mice | The Jackson Lab | 005557 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| PBS | Corning | 21-040-CM | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Syringe with needle | BD | 309626 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Ссылки
- Medema, J. Cancer stem cells: the challenges ahead. Nature Cell Biology. 15 (4), 338-344 (2013).
- Jordan, C., Guzman, M., Noble, M. Cancer stem cells. The New England Journal of Medicine. 355 (12), 1253-1261 (2006).
- Jordan, C. Cancer stem cells: controversial or just misunderstood?. Cell Stem Cell. 4 (3), 203-205 (2009).
- Bapat, S., Mali, A., Koppikar, C., Kurrey, N. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer Research. 65 (8), 3025-3029 (2005).
- Charafe-Jauffret, E. Breast cancer cell lines contain functional cancer stem cells with metastatic capacity and a distinct molecular signature. Cancer Research. 69 (4), 1302-1313 (2009).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22 (3), 373-388 (2012).
- Reya, T., Morrison, S., Clarke, M., Weissman, I. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Yi, J., et al. Abnormal DNA methylation of CD133 in colorectal and glioblastoma tumors. Cancer Research. 68 (19), 8094-8103 (2008).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Garrido, F., et al. Natural history of HLA expression during tumour development. Immunology Today. 14 (10), 491-499 (1993).
- Chang, C. C., Campoli, M., Ferrone, S. Classical and nonclassical HLA class I antigen and NK cell-activating ligand changes in malignant cells: current challenges and future directions. Advances in Cancer Research. 93, 189-234 (2005).
- Han, D., et al. Targeting sarcoma tumor-initiating cells through differentiation therapy. Stem Cell Research. 21, 117-123 (2017).
- Hu, Y., Smyth, G. K. ELDA: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunology. 347, 70-78 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены