Method Article
Поколения родной, расставленными гентингтина Exon1 мономера и фибрилл, используя стратегию Fusion сумо
В этой статье
Резюме
Здесь мы представляем надежные и оптимизированные протокол для производства количествах миллиграмм родной, тег бесплатные мономеров и фибриллами exon1 белок гентингтин (Httex1) на основе переходных слияние мелких убиквитин соответствующий модификатор (сумо).
Аннотация
Болезнь Гентингтона (HD) является унаследованным смертельным нейродегенеративных заболеваний, вызванных расширением CAG (≥36) в первом экзона гена HD, что приводит к экспрессии белка гентингтина (НТТ) или N-терминальный фрагменты их с расширенной Хантингтона ( участок polyQ).
Exon1 белок гентингтин (Httex1) — маленький фрагмент Htt, который повторяет многие из особенностей HD в сотовых и животных моделей и является одним из наиболее широко изучены фрагментов Htt. Маленький размер Httex1 делает его экспериментально более пригодным для биофизические характеристики с использованием стандартного и высокого разрешения методов по сравнению с больше фрагментов или полноразмерные Htt. Однако высокая агрегации склонность мутант Httex1 (mHttex1) с повышенной polyQ содержание (≥42) стало трудно развивать эффективное выражение и систем очистки для производства этих белков в достаточных количествах и сделать их доступными для Ученые из различных дисциплин без использования синтеза белков и других стратегий, которые изменяют родной последовательности белка. Мы представляем здесь надежную и оптимизированный метод для производства количество миллиграмм в родной, тег бесплатная Httex1 на основании переходных слияние мелких убиквитин соответствующий модификатор (сумо). Простота и эффективность стратегии позволит устранить необходимость использования неместных последовательности Httex1, таким образом делая этот белок более доступным для исследователей и улучшения воспроизводимость экспериментов в различных лабораториях. Мы считаем, что эти достижения будут также способствовать будущих исследований, направленных на разъяснение связи структура функция Htt, так развивающихся роман средств диагностики и терапии для лечения или замедлить прогрессирование HD.
Введение
HTT — 348 kDa белок и был вовлечен в несколько физиологических функций1. Когда Htt содержит расширенный polyQ региона более чем 36 остатков в его N-отель terminus, это вызывает HD2,3. HD патологии характеризуется клеточных включений в полосатом теле и коры головного мозга, что приводит к гибели нейронов и атрофией пораженных тканей4,5. Несколько фрагментов N-терминальный Htt, которые содержат повторить урочище polyQ были обнаружены в post-mortem мозги от HD пациентов и подуманы быть порождена протеолитических обработки белка гентингтина6. Последние исследования показывают, что Httex1 также может быть сформирован из-за ошибочной сплайсинга мРНК. Httex1 содержит патологических polyQ мутации и его гиперэкспрессия в животных можно резюмировать многие из ключевых особенностей HD7, таким образом подчеркнув возможной центральную роль этого фрагмента в HD патологии и болезнь прогрессии6, 8,9.
Из-за высокой агрегации склонность мутант Httex1 (mHttex1) с расширенной polyQ тракта, большинство существующих систем выражения основаны на переходных фьюжн Httex1 белков (например, глутатион S-трансферазы (GST), thioredoxin (TRX) или мальтоза привязки белка (MBP) и/или пептиды (поли гистидин), которые дифференцировано улучшить ее выражение, стабильность, очистки или растворимость10,11,12,,13,14 ,,1516,,1718,19,20,21,22,23 ,24,25,26,27,28. Fusion партнером связан с Httex1 с короткой последовательность, содержащую сайт расщепления для протеаз например трипсина, табачные etch протеазы вируса (TEV) или PreScission для расщепления и выпуска Httex1 до начала агрегации или очистки. Недостатки этих методов включают возможность оставить дополнительные остатки из-за не бесследного расщепления и создание усеченного фрагментов из-за miscleavage в пределах последовательности Httex1, помимо неоднородности вследствие неполного расщепления) см Vieweg et al. для более углубленного обсуждения на преимущества и недостатки этого подхода)10. Чтобы устранить эти ограничения, мы недавно разработала стратегию выражение, позволяя Генерация тегов бесплатно родной Httex1 в первый раз, используя переходных N-терминальный слияние Synechocystis sp. (Ssp) DnaB intein Httex110. В то время как intein расщепление бесследного и конкретными и дает мг количество белков, он все еще страдает два недостатка, которые могут уменьшить урожайность: а именно, преждевременной расщепление intein, которые могут произойти во время выражения и тот факт, что раскол происходит через несколько часов, которые могут привести к потери белка благодаря агрегации, особенно для Httex1 с расширенной polyQ повторяется.
Для устранения этих недостатков и совершенствовать нашу стратегию для производства родной, тег свободный Httex1, мы разработали новую систему выражение на основе переходных фьюжн сумо, более точно гомолога дрожжи СМТ3 к Httex1. Применение системы сумо для производство рекомбинантных белков был впервые опубликован в 2004 году29, где было продемонстрировано повышенную ставку выражения и растворимость сумо синтез белка. СУМО тег может быть расщепляется помощью убиквитин как белка конкретных протеазы 1 (ULP1), который не требует признания сайт, но признает Третичная структура сумо и практически исключает возможность miscleavage30. Кроме того ULP1-опосредованной расщепления быстро и бесследное и не оставляют дополнительные остатки. Преждевременная расщепления фьюжн тега, как заметил с автокаталитических intein10, полностью избежать требование внешней протеазы. В то время как стратегия сумо в настоящее время широко используется для рекомбинантных белков производство31,,3233, мы демонстрируем в настоящем документе, что это особенно полезно для поколения неразрывно расстройствами, агрегирование подверженных, amyloidogenic белков, таких как Httex1. Мы считаем, что простота, эффективность и надежность нашего метода на основе сумо фьюжн сделает родной, тег бесплатные Httex1 более доступным для исследователей из различных дисциплин и устранить необходимость использования неместных последовательности Httex1 в пробирке . Это важный шаг вперед, что облегчит будущие исследования для прояснения связи структура функция Httex1.
Протокол описывает очистка Httex1 от 12 Л бактериальной культуры, но протокол могут быть легко адаптированы для меньшего или большего масштаба производства. Протокол описывает производства дикого типа Httex1 (wtHttex1) с polyQ повторить Длина ниже (23Q) и мутанта Httex1 (mHttex1) с polyQ повторить длина выше (43Q) патогенных порог (36Q).
протокол
1. выражение рекомбинантных Httex1 23Q и 43Q
- Подготовьте необходимые буферы и решения. Подготовка 1000 x Стоковый раствор ампициллин (AMP, 100 мг/мл), фильтр (0,2 мкм), аликвота и хранить при-20 ° C. Подготовка среднего lysogeny бульон (LB) (25 g LB Миллер за 1 L H2O), автоклав. Подготовить 1 M изопропиловый β-D-1thiogalactopyranoside (IPTG) раствор, фильтр (0,2 мкм), Алиготе и хранить при температуре от-20 ° C.
- Преобразуйте химические компетентным E. coli B ER 2566 с pTWIN1 вектор, содержащий сливается с тега N-терминальный His6-сумо с тепловой шок метод34человека Httex1.
Примечание: Штамм E. coli BL21 DE3 также используется. Однако в этом случае было отмечено увеличение количества усечения. - Инокуляции 200 мл с 1 LB-среды x AMP в 1 Л коническую колбу путем добавления одной колонии от плиты агара с наконечником стерильной пипеткой. Инкубируйте культуры при 30 ° C и 180 rpm для 20 h (на ночь) в бактериальных инкубатора.
- Взять образец 1 мл культуры с стерильной пипеткой. Измеряют оптическую плотность на 600 Нм (600OD) образца с одноразовые пластиковые кювет и фотометр (уважение, диапазон измерения от 0,1 до 1, разбавляют LB-средний, в случае необходимости). Рассчитать количество preculture, что приведет к отправной ОД600 0,05 в культуре 3 Л (с preculture ОД600 = 3, что будет означать 50 мл).
- Прививать четыре культур (каждый 3 Л LB-среды с 1 x AMP в колбе 5 Л), путем добавления вычисляемых количество preculture с стерильной пипеткой. Инкубируйте культур при 37 ° C и 180 об/мин в бактериальных инкубатора.
- Каждые 30 мин, взять 1 мл образец культуры с стерильной пипеткой. Измерьте ОД600 образца с одноразовые пластиковые кювет и фотометра. Когда ОД600 достиг 0,1 (обычно после 1-2 ч), установите температуру бактериальной инкубатора до 14 ° C и продолжают инкубацию при охлаждении. Каждые 30 мин, взять 1 мл образец культуры с стерильной пипеткой. Измерьте ОД600 образца с одноразовые пластиковые кювет и фотометра.
Примечание: Время для охлаждения культур может варьироваться с инкубатора используется, поэтому время начала охлаждения могут быть адаптированы в зависимости от типа используемых инкубатора. Однако изменение градиента температуры должен быть только незначительное влияние на урожайность как сумо синтез белка, как представляется, довольно стабильной. - Когда ОД600 достиг 0,3-0,4 (обычно после 1-2 ч), взять образец предварительно индукции культуры для анализа гиперэкспрессия SDS-PAGE. Рассчитать размер выборки, который дает сопоставимых количество клеток и хороший сигнал на Кумасси окрашенных SDS-PAGE: хорошо гель для 10: объем = 0,2 мл/OD600; Возьмите половину для 15 хорошо геля.
- Для бактериальной культуры с ОД600= 0,4, взять 500 мкл. Возьмите расчетный объем бактериальной культуры с стерильной пипеткой. Спин вниз образца (18000 x g, 4 ° C, 2 мин) и удалить супернатант. Держите гранул при-20 ° C до готовых к использованию для анализа (шаг 1.11).
- Вызвать выражение протеина, дозирования 1,2 мл IPTG Стоковый раствор 1 М для каждой культуры 3 Л раствора (конечная концентрация 0,4 мм). Далее, инкубации культуры на 14 ° C для 16 h (на ночь).
Примечание: Температура будет обычно достигли ~ 20 ° C к моменту IPTG добавляется, в зависимости от производительности инкубатора. - Взять образец после индукции культуры для анализа SDS-PAGE гиперэкспрессия, следуя процедуре, описанной в шаге 1.7.
- Урожай клетки центрифугированием в 1 Л трубы (3993 x g, 4 ° C, 10 мин). Отменить супернатанта, держите клетки гранул на льду и перейти непосредственно к очищению.
- Проанализируйте гиперэкспрессия SDS-PAGE35,36. Ресуспензируйте образцов до и после индукции в 20 мкл буфера и 20 мкл 2 x загрузки красителя. Нагрейте образцы для 5 мин при 95 ° C в блоке тепла и загрузить 20 мкл на 15% гель, пока все еще горяче. Побегите гель для 90 мин на 180 V. пятно гель с Кумасси красителя согласно инструкциям производителя. Сравните результаты с результатами представителя в Рисунок 1C.
Примечание: Протокол может быть остановлено здесь, клетки гранулы могут быть заморожены и хранятся при температуре-80 ° C в течение нескольких недель. Для получения оптимальных результатов рекомендуется использовать свежие бактериальных гранулы и избежать замораживания. Замораживания оттаивания может привести к лизис клеток и деградации Httex1. Это может уменьшить урожайность и качество белка.
2. ячейки Lysis и очистка его6-сумо Httex1 синтез белка, изъятые из металла аффинной хроматографии (ИАЦ)
- Приготовить 2 Л буфера A в стеклянной бутылке (50 мм (гидроксиметил) трис-aminomethan (Tris), 500 мм NaCl, имидазола 15 мм). Подготовка 1 Л буфера B (50 мм трис, 500 мм NaCl, 500 мм имидазола рН 7,4) в стеклянной бутылке. После растворения соли, скорректировать рН с 10 N HCl и фильтровать решения в свежие бутылки с фильтром Топ бутылку (0,65 мкм). Подготовка 1000 x phenylmethylsulfonyl фторид (PMSF, 0,3 М) сток решение, кратные 100 мкл и хранить при-20 ° C.
Примечание: Протокол предназначен для включения завершить все шаги от лизиса бактериальных гранул вспять фазы высокой производительности жидкостной хроматографии (RP-ВЭЖХ) очистки и лиофилизации в течение 8-9 h. Чтобы ограничить агрегации и протеолиза, он рекомендуется работать быстро, без приостановку и выполнить все действия при температуре 4 ° C или на льду. - Добавить 100 мкл PMSF Стоковый раствор и пять таблеток (1 30 мл окончательного объема) ингибитора протеазы в 100 мл, предварительно охлажденный буфера A. Добавить бактериальных гранулы в буфер и гомогенизации подвеска путем перемешивания с баром магнитные перемешать и закупорить вверх и вниз, wi Th 10 мл стерильной пипеткой (~ 30 мин).
- Подвеска бактерии разделите на аликвоты 40 мл в одноразовые пластиковые трубы 50 мл. Sonicate каждый Алиготе в ледяной воде пакете для лизиса клеток (70% амплитуда, время всего sonication 5 мин, интервалы 30 s sonication, 30 s паузы).
Примечание: Важно, что образец не нагреваются во время шага sonication. Рекомендуется добавить немного воды в ледяной ванне для улучшения отвода тепла во время sonication. Sonication процедура может должны быть адаптированы, если используется другой инструмент. Другие методы лизис как французской прессе или microfluidizer должны работать также и может быть полезно избежать нагрева образца и белка агрегации. Эти устройства не были доступны в нашей лаборатории, и мы получили хорошие результаты с нашей sonication протокола. - Взять образец 50 мкл lysate натрия Додециловый сульфат геля полиакриламида электрофореза (SDS-PAGE) анализа. Центрифугуйте образцы (18000 x g, 4 ° C, 2 мин) и Пипетка растворимая фракция в новой пробиркой. Ресуспензируйте нерастворимых фракция в 50 мкл буфера A с пипеткой. Образцы на льду сохранять до SDS-PAGE анализ (шаг 2.6).
- Уточнить lysate центрифугированием (39191 x g, 4 ° C, 60 мин.).
- Во время шага центрифугирования анализируйте шаг лизис клеток, SDS-PAGE. Добавьте 50 мкл 2 x загрузки красителя на растворимые и нерастворимые долю lysate соответственно. Тепла для 5 мин при 95 ° C и нагрузке 2 мкл на 15% гель, пока все еще горяче. Побегите гель для 90 мин на 180 V. пятно гель с Кумасси красителя согласно инструкциям производителя. Сравните результаты с результатами представителя в Рисунок 1C.
- Фильтр супернатант (0,45 мкм, шприц фильтры). Взять образец 20 мкл отфильтрованных супернатант SDS-PAGE анализа (шаг 2.11).
Примечание: Как правило, объем 90-100 мл уточнены и отфильтрованных супернатант получается. Как правило 3 шприца фильтры являются достаточными. Если фильтрация является громоздким, попробуйте увеличить скорость центрифугирования и/или время. - Изолируйте His6-сумо Httex1 синтез белка из уточнены бактериальных lysate, иммобилизованных металла аффинной хроматографии (ИАЦ) на систему жидкостной хроматографии (ПСОК) производительность на 4 ° C-37.
- Заполните осветленный lysate superloop и нагрузки на столбце Ni-НТА (удалены, очищены и перезагрузка согласно инструкции производителя, предыдущий пробел запустить рекомендуется) в 2 мл/мин проходят 10 столбцов томов (CV, 200 мл) буфера A на 10 мл/мин для стирки из unbound протеины.
- Элюировать синтез белка с 2,5 CV (50 мл) 100% буфера B в 2 мл/мин использовать фракции размером 50 мл для загрузки и мойки и 5 мл для элюции. Сравните результаты с результатами представителя на рис. 1D.
- Взять образец каждой фракции для анализа SDS-PAGE (20 мкл) и бассейн фракций, содержащих протеин сплавливания согласно пик Хроматограмма IMAC. Добавить (2S, 3S) - 1,4 - бис (sulfanyl) Бутан-2,3-диол (DTT) и L-цистеина (конечная концентрация 100 мм) как порошок и растворить, нежно инвертирование трубки.
Примечание: В нашем опыте сопоставима чистоту синтез белка в различных фракций. В качестве меры предосторожности фракций очищенного синтез белка должны быть объединены быстро после IMAC для предотвращения агрегации высококонцентрированных фракций. Кроме того рекомендуется приступить непосредственно к расщепления сумо тега и ВЭЖХ очистки. При необходимости, протокол может быть остановлено здесь. Разбавленный раствор синтез белка был заморожен в жидком азоте, хранятся при температуре-80 ° C и очищается после оттаивания без значительного снижения урожайности. Хранения разбавленного раствора синтез белка на 4 ° C для 24 h также дает аналогичные результаты. - Анализируйте IMAC, SDS-PAGE. 20 мкл загрузки краситель для каждого образца. Загрузка 2 мкл сырого материала (2.7), несвязанных фракции, мыть дроби и каждой фракции элюции пик на 15% гель. Побегите гель для 90 мин на 180 V. пятно гель с Кумасси красителя согласно инструкциям производителя. Сравните результаты с результатами представителя на рис. 1D.
3. расщепление его6-сумо-тег и ВЭЖХ очистки
Предупреждение: Trifluoroacetic кислота (TFA) является летучие жидкости и может причиной тяжелых ожогов, так обращаться с осторожностью. Выполнять все обращения в зонта и носить адекватных средств индивидуальной защиты (то есть, Одноразовые нитриловые перчатки, защитные очки и лаборатории пальто).
- В 5 Л бутылку добавьте 5 мл TFA с Пластиковый шприц в 5 Л воды (растворителей A: H2O, 0,1% (TFA). Добавьте 2.5 мл TFA с Пластиковый шприц 2,5 Л бутылку Ацетонитрил (растворителей B: ацетонитриле, 0.1% TFA).
- Подготовка ВЭЖХ системы как предлагается заводом-изготовителем. Выполните пустой перспективе для обеспечения чистой столбец.
- Взять образец 100 мкл синтез белка перед добавлением ULP1 для мониторинга реакции расщепления по UPLC (шаг 3.5).
- Передать новый Тюбик 50 мл 20 мл синтез белка и добавить 0,4 мл ULP1 раствор, инкубировать на льду. Держите оставшиеся синтез белка на льду.
Примечание: Его меткой каталитического фрагмент 403-621 убиквитин как конкретных протеазы 1 (здесь называют «ULP1») был использован для расщеплять сумо тег. Синтез белка является более стабильным, чем рассеченного Httex1. Рекомендуется не прилепится сумо тег всей партии. Вместо этого продолжите аликвоты размер, который может непосредственно и полностью применяться к столбцу ВЭЖХ. - Каждые 10 минут, взять образец 100 мкл реакции расщепления для мониторинга прогресса на ультра производительность жидкостной хроматографии (UPLC). Центрифугуйте образцы (18000 об/мин, 4 ° C, 2 мин) и анализировать 2 мкл супернатанта, UPLC (градиент от 10% до 90% растворителем B в A 0,25-3 мин, 10% B за 1 мин, обратитесь к инструкциям производителя для использования инструмента). Сравните хроматограм, полученные для образца перед добавлением ULP1 и образцах, взятых. Сравните результаты с представителем результаты в рисунке 2B.
- После завершения сумо расщепления (пик синтез белка исчезла в Хроматограмма UPLC и полностью преобразуется в недавно появившемся сумо и Httex1 пик), фильтр образец с помощью шприца фильтра (0.22 мкм).
Примечание: Расщепление сумо обычно очень быстро (10-20 минут при температуре 4 ° C) поэтому UPLC анализ с время выполнения 4 мин является ценным инструментом для мониторинга реакции. Фильтрация образца до ВЭЖХ очистки является главным образом превентивной мерой для увеличения жизни столбца. Образец не должен превратить мутная. - Очистить отфильтрованных образца, RP-ВЭЖХ (градиент растворителя B 25-35% растворителем a, свыше 40 мин в 15 мл/мин (0-10 мин: 5%; 10-12,5 мин: от 5 до 25%; 12,5-52,5 мин: 25 – 35%; 52,5-57,5 мин 35 до 95%; обратитесь к инструкциям производителя для использования инструмента). Сравните результаты с результатами представителя в рисунке 2C.
Примечание: Httex1 и его6-сумо отдельный хорошо, RP-ВЭЖХ. Однако может быть небольшое количество усеченных Httex1 в начале и конце пик. Сбор мелких фракций, чтобы получить максимальное количество чистого материала.
Предупреждение: Используйте оборудование безопасности (например, лаборатории пальто, изолированные перчатки и щит) когда обработки криогенных жидкостей. - Анализировать HPLC фракций, электро спрей ионизационная масс-спектрометрия (ESI-МС, Автоматический пробоотборник, придать 10 мкл, поток 0,6 мл/мин, растворителей: 20% B в A, столбец отсутствует, обратитесь к инструкциям производителя для использования инструмента) и UPLC (градиент от 10% до 90% Растворитель B в A 0,25-3 мин, 10% B за 1 мин, обратитесь к инструкциям производителя для использования инструмента). Бассейн фракций аналогичной чистоты в 50 мл пластиковых труб, замораживание в жидком азоте и lyophilize. Весят и передача лиофилизированные белка в 2 мл пластиковых трубок и хранить при температуре от-20 ° C.
- Характеризуют очищенный материал UPLC, ESI-MS и SDS-PAGE. Растворите 100 мкг лиофилизированные Httex1 в 8 мкл аккуратные TFA в 1,5 мл трубку и проинкубируйте втечение 20 мин при комнатной температуре в закрытой трубе тестирования. Тщательно испаряются TFA под зонт с потоком азота или аргона. Чтобы избежать потери образца используйте низкого давления азота/аргона.
- Растворите белка в 100 мкл H2O. анализировать 2 мкл, UPLC и 5 мкл как шаг 3,8, ESI-MS. Микс 20 мкл раствора белка с 20 мкл 2 x загрузки красителя.
- Анализ количества 1 мкг 10 мкг на SDS-PAGE. Побегите гель для 90 мин на 180 V. пятно гель с Кумасси красителя согласно инструкциям производителя. Сравните результаты с результатами представителя в рисунке 2D.
4. дезагрегирование и Resolubilization Httex1 белков
Предупреждение: TFA это летучие жидкости и может причиной тяжелых ожогов, так обращаться с осторожностью. Выполнять все обращения в зонта и носить надлежащего личного защитного оборудования (т.е. Одноразовые нитриловые перчатки, защитные очки и лаборатории пальто).
- Подготовка 10 мл Дульбекко фосфатный буфер (DPBS) (137 мм NaCl, 2,7 мм KCl, 10 мм Na2HPO4, 2 мм х2PO4, рН 7,4) от готовые порошок в 50 мл трубки. Фильтр DPBS решение через 0,2 мкм фильтр перед каждым использованием.
- Распустить 150 мкг лиофилизированные Httex1 в 12 мкл аккуратные TFA в 1,5 мл трубку и проинкубируйте втечение 20 мин при комнатной температуре в закрытой трубе тестирования. Тщательно испаряются TFA под зонт с потоком азота или аргона. Использование низкого давления азота/аргона во избежание потери образца38.
Примечание: В общем, используйте 4 мкл TFA распустить и дезагрегировать 50 мкг белка. Эта процедура создаст фильм белка на внутренней стены пробирку. Чтобы предотвратить немедленное агрегации Httex1 в следующих шагах, работы с предварительно охлажденным буферов, держать белок всегда на льду и избежать высоких концентрациях. - Распустить дезагрегированных белка в 1 мл раствора предварительно охлажденным DPBS и отрегулировать pH 7,2-7.4 с 1 M NaOH. Фильтр раствор белка через 100 кДа центробежного фильтра в 1,5 мл пластиковых труб (20000 x g, 4 ° C, 20 минут).
Примечание: Вычисляемый теоретические концентрация Httex1 выше, чем требуемый конечная концентрация для учета возможных потерь. Фильтрации шаг необходим для удаления любых агрегатов, которые могли бы сформировались во время распада белка. - Определить концентрацию Httex1 с помощью UPLC калибровочной кривой, на основе анализа аминокислот (обнаружение на λ214) и отправить 2 мкг белка аминокислота анализ для проверки концентрации10. Рассчитать количество DPBS, которые необходимо добавить для получения концентрации 3 мкм Httex1.
- Разбавьте белка до 3 мкм, добавив вычисленное количество DPBS в пробирке. Держите трубку на льду до начала осуществления протокола агрегации.
Примечание: Httex1, 43Q не должны храниться в растворе. Всегда готовят свежий белка раствор на основе протокола выше. Httex1 белки лучше всего хранятся в виде лиофилизированный порошок при-20 ° C.
5. Мониторинг из агрегации кинетика Httex1 43Q с использованием UPLC и круговой дихроизма (CD) спектроскопии и характеристика агрегатов передачи электронной микроскопии (ТЕА)
- Готовят раствор уранилнитрата формате для ТЕА как сообщалось ранее39.
- Инициировать объединение Httex1 43Q по инкубации раствором 3 мкм в DPBS при 37 ° C (использование 1 мл раствора, подготовленных как описано выше, в протоколе дезагрегации).
Примечание: Агрегирование Httex1 могут выполняться при более высоких концентрациях в зависимости от потребностей и целей эксперимента. - Подсчитать количество растворимого белка, с использованием UPLC в назначенное время точках (на 0, 1, 2, 4, 6, 8, 12, 24, 48 и 120 h). Чтобы сделать это, возьмите Алиготе 35 мкл и удаление нерастворимых агрегатов центрифугированием (20000 x g, 4 ° C, 20 мин). Inject 4 мкл супернатант в UPLC. Рассчитайте долю растворимых мономера, основанных на изменении площади пика, используя инструмент программного обеспечения 40. Сравните результаты с результатами представителя в рисунке 3A.
- Характерны изменения в вторичной структуре с помощью CD спектроскопии в 0 и 48 ч. Возьмите Алиготе 100 мкл и измерить эллиптичность (1 мм кварцевые кюветы, 195 Нм до 250 Нм, 20 ° C, данные точек каждый 0.2 Нм, скорость 10 Нм/мин, время 2 s цифровой интеграции, пропускная способность 1.0 Нм). Приобрести 6 спектры образца и среднем и гладкой, с помощью Биномиальное фильтр свертки шириной 99. Участок спектры как средний остаток Молярная эллиптичность (θMRE)41. Сравните результаты с результатами представителя в рисунке 3B.
- Охарактеризовать структурно-Морфологические свойства агрегатов по ТЕА. Положите 3 мкл раствора белка на Formvar/углерод покрытием 200-сетка, выписан свечение медной сетки для 1 мин мыть сетка дважды с 15 мкл воды, один раз с 15 мкл 0,7% (w/v) уранила Формиат и пятно на 30 s с 15 мкл 0,7% w/v уранила формате. Выполните анализ ТЕА сетки. Сравните результаты с результатами представителя на рис. 3C.
Результаты
Httex1 выражается в E. coli с N-терминальный его6-сумо тег. Представитель результаты выражения и очистки синтез белка приводится на рисунке 1. Последовательность Httex1 состоит из остатков 2-90 НТТ и начинается с Ala2, потому что Met1 полностью рассеченного в vivo42. Нумерация аминокислоты относится к 23Q вариант, полная последовательность выраженной синтез белка показано в рисунке 1A. Плазмиды будет депонироваться на Addgene в ближайшем будущем, чтобы быть совместно с сообществом. Схема плазмида и выраженной синтез белка показано в рисунке 1B. Httex1 His6-сумо выражает на среднем уровне (рис. 1C), и большинство синтез белка в растворимая фракция после лизиса, как для 23Q и 43Q вариант. Синтез белка выше, чем ожидалось, переносит, основанный на молекулярный вес. Это частично объясняется сильным лоно сумо, но главным образом из-за необычных последовательности состав Httex1, содержащие главным образом остатков глутаминовой и пролина. Wildtype (23Q) и мутанта (43Q) ~ 80% чистоты синтез белка может обогащаться IMAC (рис. 1D) можно объяснить присутствие совместно очищающая хоста белком сравнительно низкий уровень экспрессии Httex1 и большой образец объем, применяется к столбцу.
Расщепление его6-сумо тег и очистки Httex1 показано в рисунке 2A. UPLC является эффективным инструментом для мониторинга расщепление его6-сумо тег (рис. 2B). Оригинальные пик синтез белка потребляется и два новых и хорошо разделенных пики, соответствующие его6-появляются сумо тег и Httex1. Реакции расщепления закончена в 10-20 мин. Западной помарки (ВБ) слишком медленно, чтобы эффективно контролировать реакции расщепления, но он был включен в рисунке для справки и продемонстрировать полноты сумо расщепления. Оба Httex1 23Q и 43Q могут быть разделены с его6-сумо тег RP-ВЭЖХ (рис. 2C) и были получены в высокой степени чистоты, как показано на UPLC, MS и SDS-PAGE анализа (Рисунок 2D).
Чтобы проиллюстрировать, что Httex1 белков, подготовленный данным методом сохраняют свойства ожидаемый агрегации Httex1, мы оценивали кинетика fibrillization мутант Httex1 при 37 ° C по Пробирной седиментации, мониторинг изменений в вторичной структуре на CD спектроскопия и характеризуются морфология агрегатов по ТЕА. Репрезентативного набора данных агрегации кинетика mHttex1 фибриллярных формирования определяется седиментации пробирного показан нарисунке 3A. Потери растворимых Httex1 43Q со временем, из-за формирования фибриллярных была количественно оценена, UPLC. Мы наблюдаем полное истощение растворимого белка после 48 часов инкубации. Кроме того мы определяется вторичная структура белков CD спектроскопии (рис. 3B). Httex1 43Q переход от неструктурированных (λмин 205 Нм) в основном β-лист богатые конформацию (λмин 215 Нм) после 48 часов инкубации. Это структурное изменение сопровождается образованием долго фибриллярного агрегатов как наблюдаемый по ТЕА на 48 часов (рис. 3C).
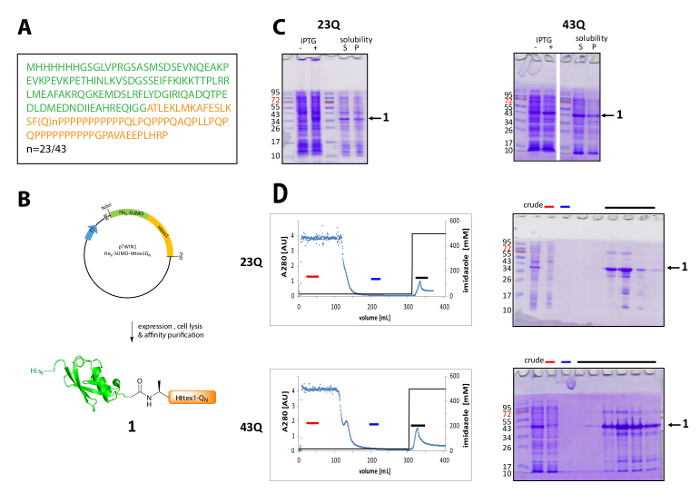
Рисунок 1 . Выражение и очистка его6-протеин сплавливания сумо Httex1.
(A) аминокислотной последовательности его6-сумо-Httex1-QN фьюжн конструкции (его6-сумо в зеленых и Httex1-QN в оранжевый); (B) Схематический обзор выражения и очистки синтез белка; (C) анализ SDS-PAGE выражения и растворимость синтез белка после лизиса; (D) Хроматограмма IMAC очистки синтез белка и анализа фракций, SDS-PAGE (красный бар: несвязанные дроби, Голубой бар: мыть дроби, черную полосу: фракций, содержащих элюции пик); Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 . Расщепление его очистки тегов свободной Httex1-QN белков и6 сумо тег.
Схематический обзор (A); (B) анализ расщепления сумо тега с ULP1 по UPLC (синий: перед добавлением ULP1; черный: 20 мин (23Q), соответственно 10 мин (43Q) после добавления ULP1) и Всемирный банк (MAB5492 1: 2000, вторичные коза анти мыши антител 1: 5000); (C) Хроматограмма препаративные RP-ВЭЖХ очистки Httex1; D: анализ очищенный Httex1, UPLC, SDS-PAGE и ESI-МС; Ожидаемые молекулярный вес составляет соответственно 9943 Да (23Q) и 12506 Да (43Q). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
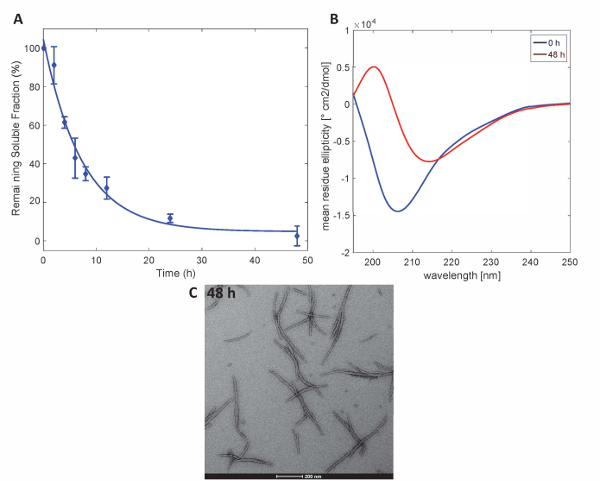
Рисунок 3 . Агрегат Httex1-43Q: (A) седиментации assay основанный на UPLC. (B) CD спектры вторичной структуры на 0 h и 48 ч. (C) ТЕА микроскопии агрегатов на 48 ч (Масштаб гистограммы являются 200 Нм). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В этом протоколе, мы наметили эффективной процедуры для получения количества миллиграмм родной, непомеченные Httex1 содержащий остатков глутаминовой 23 или 43. Это было достигнуто путем выражения Httex1 как C-терминал fusion его6-сумо тег, который используется для изоляции синтез белка от lysate клетки IMAC и расщепляется до ВЭЖХ очистки Httex1. В то время как стратегия сумо был использован в производстве ряда других белков, наш метод показывает, что уникальные свойства сумо также могут быть использованы для создания неразрывно расстройством, подверженных агрегации, amyloidogenic белок, который ранее оказались чрезвычайно трудно обрабатывать и производят4443,. Мы представляем протокол, простой, легкий в использовании и сопоставимых протокол для поколения «хорошо себя» белка. СУМО fusion solubilizes и стабилизирует Httex1 во время выражения и шаг очищение IMAC. Преждевременное расщепления тега, как заметил с intein стратегии10 и агрегации больше не были проблемой.
Неразрывно неупорядоченных белки являются особенно подвержены деградации. В то время как N-терминальный деградации в регионе N17 является не вопросом, используя этот протокол, усечения в ОД Httex1 может произойти. Как усеченный белки являются очень похож на Httex1, гидрофобность и размер, удаляя их газохроматографического средствами является сложной задачей, таким образом это лучше, чтобы предотвратить их образование в первую очередь. Отклонившись протокол, всегда работает на льду и с помощью достаточное количество ингибитора протеазы должны помочь сохранить уровень наблюдаемых усечения очень низкая. Применение тега сплавливание на C-конечная Httex1 может удалить усечения в ПДР легко как усеченный белка потеряет близости тег также. Однако если родной последовательности должна быть сохранена, что этот параметр не может применяться как Httex1 заканчивается пролина и в меру наших знаний есть теги Фьюжн не C-терминала, которые известны побудить бесследного и эффективного расщепления после пролина.
Наиболее важной частью протокола является обработка Httex1, освобожден после расщепления сумо тега ULP1. Протеин следует немедленно неразделимая RP-ВЭЖХ. К счастью это эффективной и быстрой реакции, которая завершается обычно в 10-20 мин при 4 ° C. В противоположность этому intein стратегия требуется несколько часов для полного расщепления intein, таким образом, требует компромисса между неполного расщепления и начало агрегации для того чтобы увеличить урожайность. Быстрой обработки требуется для мутантов Httex1, как он начнет агрегировать при сравнительно высокой концентрации в реакции расщепления, тогда как вариант 23Q стабильным в течение длительного времени. Во время очистки RP-ВЭЖХ, еще одно преимущество сумо становится очевидным: в то время как Ssp DnaB intein гидрофобных и сильно прилипает к столбцу, сумо более гидрофильных и полностью elutes в столбце обратная фаза C4. Хотя коммерческие ULP1 является довольно дорогостоящим, белок может выпускаться в высокодоходных после ранее опубликованные протоколы29легко.
Важное значение применения протокола дезагрегирования перед использованием Httex1 не может быть подчеркнуто достаточно. Лиофилизированные polyQ белков, таких как Httex1 являются стабильными и может быть хранимой длительных периодов, но не полностью растворим в воде и буферов. Наличие предварительно олигомеров или фибриллами может иметь значительное влияние на кинетику агрегации и биофизические свойства белка45. Протокол дезагрегирования, описанный здесь позволяет дезагрегирования белка, удаление предварительно агрегатов и поколения раствора мономерных Httex1 от лиофилизированные образца. Мы наблюдали аналогичные агрегации кинетики и фибриллярных морфологии для Httex1, полученные с сумо и intein стратегии.
По сравнению с предыдущими методами для производства Httex1, сумо стратегии, описанные здесь предлагает несколько преимуществ и расширяет спектр возможных исследований для изучения структуры и функциональных свойств этого белка в здоровье и болезни. СУМО-Httex1 синтез белка прост в обращении, может быть заморожен и хранится или хранится в решение для 24 ч при комнатной температуре, в то время как свободный mHttex1 бы агрегировать быстро. Стабильность и высокая растворимость белков фьюжн сумо-Httex1 обеспечивают большую гибкость для манипуляции белка и/или ферментативные и химические изменения в mHttex1, что в противном случае не будет возможно после расщепления. Это включает в себя введение столб-поступательные изменения, флуорофоров, спина этикетки, биотин Теги и т.д. авансы, представленные здесь должно 1) облегчить будущие исследования для выяснения отношений структура функция Httex1; 2) генерировать новые инструменты для расследования Htt агрегации и распространения патологии; 3) содействовать развитию новых анализов для выявления молекулы, которые стабилизируют мутант Httex1 и предотвратить его агрегирования; и 4) поощрять ученых из других областей довести работу на этот белок и присоединиться к нашей поиски, чтобы найти лекарства от болезни Гентингтона.
Раскрытие информации
Авторы заявляют, что они имеют без конфликта интересов с содержанием этой статьи.
Благодарности
Эта работа финансировалась главным образом за счет субсидий Фонд CHDI и Швейцарский Национальный научный фонд. Мы благодарим д-ра Софи Vieweg для полезных обсуждений при разработке этой новой системы выражения и другие члены группы Lashuel для обмена их опытом с этой системой выражение и для их ввода и ценную обратную связь. Мы также благодарим профессор Оливер моделях за предоставление ULP1 плазмиды. Авторы благодарят д-р Джон Уорнер и доктор Сентил K. Thangaraj для критического обзора манускрипта
Материалы
| Name | Company | Catalog Number | Comments |
| Uranyl formate (UO2(CHO2)2) | EMS | 22450 | |
| Formvar/carbon 200 mesh, Cu 50 grids | EMS | FCF200-Cu-50 | |
| High Precision Cell made of Quartz SUPRASIL 1 mm light path from Hellma Analytics | HellmaAnalytics | 110-1-40 | |
| Buffer Substance Dulbecco's (PBS w/o Ca and Mg) ancinne ref 47302 (RT) SERVA | Witech | SVA4730203 | |
| Ampicillin | AxonLab | A0839.0100 | |
| Luria Broth (Miller's LB Broth) | Chemie Brunschwig | 1551.05 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | AxonLab | A1008.0025 | |
| E. coli B ER2566 | NEB | NEB# E4130 | |
| Imidazole | Sigma | 56750-500G | |
| cOmplete Protease Inhibitor Cocktail | Roche | 4693116001 | |
| Anti-Huntingtin Antibody, a.a. 1-82 | Merck Millipore Corporation | MAB5492 | |
| IRDye 680RD Goat anti-Mouse IgG (H + L) | Licor | 925-68070 | |
| PMSF | AxonLab | A0999.0005 | |
| HisPrep 16/10 column | GE Healthcare | 28936551 | |
| C4 HPLC column | Phenomenex | 00G-4168.P0 | 10 µm C4 300 Å, LC Column 250 x 21.2 mm, Phenomenex, 19x10 mm guard column, not temperature jacketed |
| Acetonitrile HPLC | MachereyNagel | C2502 | |
| Filtre seringue Filtropur S 0,45 ul sans prefiltre sterile | Sarstedt AG | 83.1826 | |
| Spectrophotometer semi-micro cuvette | Reactolab S.A. | 2534 | |
| Superloop, 1/16" fittings (ÄKTAdesign), 50 ml | GE Healthcare | 18111382 | |
| Trifluoroacetic acid | Sigma | 302031 | |
| GREINER Tubes fo FPLC 16 x 100 mm, cap. 12.0 ml | Greiner Bio-One | 7.160 102 | |
| 100 kD Microcon fast flow filters | Merck Millipore Corporation | MRCF0R100 | |
| Vibra-cell VCX130 ultrasonic liquid processor | Sonics | ||
| Äkta 900 equipped with a fraction collector | GE Healthcare | ||
| Jasco J-815 Circular Dichroism | Jasco | ||
| Waters UPLC system | Waters | C8 BEH acquity 2.1x100 mm 1.7 micron column , preheated column (40 °C), flow rate of 0.6 mL/min, injection volume of 4 μL | |
| waters HPLC system | Waters | 2489 UV detector and 2535 quaternary gradient module, 20 mL loop in a FlexInject housing | |
| ESI-MS: Finnigan LTQ | Thermo Fisher Scientific | ||
| lyophylizer instrument | FreeZone 2.5 Plus | ||
| Tecnai Spirit BioTWIN | FEI | electron microscope equipped with a LaB6 gun and a 4K x 4K FEI Eagle CCD camera (FEI) and operated at 80 kV | |
| 37 °C shaking incubator | Infors HT multitron Standard | ||
| Biophotometer plus | Eppendorf |
Ссылки
- Saudou, F., Humbert, S. The Biology of Huntingtin. Neuron. 89 (5), 910-926 (2016).
- MacDonald, M. E., Gines, S., Gusella, J. F., Wheeler, V. C. Huntington's disease. Neuromolecular Medicine. 4 (1-2), 7-20 (2003).
- Li, S., Li, X. J. Multiple pathways contribute to the pathogenesis of Huntington disease. Molecular Neurodegeneration. 1, 19 (2006).
- DiFiglia, M. Aggregation of Huntingtin in Neuronal Intranuclear Inclusions and Dystrophic Neurites in Brain. Science. 277 (5334), 1990-1993 (1997).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Sathasivam, K., et al. Aberrant splicing of HTT generates the pathogenic exon 1 protein in Huntington disease. Proceedings of the National Academy of Sciences U S A. 110 (6), 2366-2370 (2013).
- Mangiarini, L., et al. Exon 1 of the HD gene with an expanded CAG repeat is sufficient to cause a progressive neurological phenotype in transgenic mice. Cell. 87 (3), 493-506 (1996).
- El-Daher, M. T., et al. Huntingtin proteolysis releases non-polyQ fragments that cause toxicity through dynamin 1 dysregulation. EMBO Journal. 34 (17), 2255-2271 (2015).
- Lunkes, A., et al. Proteases acting on mutant Huntingtin generate cleaved products that differentially build up cytoplasmic and nuclear inclusions. Molecular Cell. 10 (2), 259-269 (2002).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An Intein-based Strategy for the Production of Tag-free Huntingtin Exon 1 Proteins Enables New Insights into the Polyglutamine Dependence of Httex1 Aggregation and Fibril Formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Georgalis, Y., et al. Huntingtin aggregation monitored by dynamic light scattering. Proceedings of the National Academy of Sciences U S A. 95 (11), 6118-6121 (1998).
- Scherzinger, E., et al. Huntingtin-encoded polyglutamine expansions form amyloid-like protein aggregates in vitro and in vivo. Cell. 90 (3), 549-558 (1997).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proceedings of the National Academy of Sciences U S A. 96 (8), 4604-4609 (1999).
- Muchowski, P. J., et al. Hsp70 and hsp40 chaperones can inhibit self-assembly of polyglutamine proteins into amyloid-like fibrils. Proceedings of the National Academy of Sciences U S A. 97 (14), 7841-7846 (2000).
- Heiser, V., et al. Inhibition of huntingtin fibrillogenesis by specific antibodies and small molecules: implications for Huntington's disease therapy. Proceedings of the National Academy of Sciences U S A. 97 (12), 6739-6744 (2000).
- Bennett, E. J., Bence, N. F., Jayakumar, R., Kopito, R. R. Global impairment of the ubiquitin-proteasome system by nuclear or cytoplasmic protein aggregates precedes inclusion body formation. Molecular Cell. 17 (3), 351-365 (2005).
- Tam, S., et al. The chaperonin TRiC blocks a huntingtin sequence element that promotes the conformational switch to aggregation. Nature Structural & Molecular Biology. 16 (12), 1279-1285 (2009).
- Nekooki-Machida, Y., et al. Distinct conformations of in vitro and in vivo amyloids of huntingtin-exon1 show different cytotoxicity. Proceedings of the National Academy of Sciences U S A. 106 (24), 9679-9684 (2009).
- Wacker, J. L., Zareie, M. H., Fong, H., Sarikaya, M., Muchowski, P. J. Hsp70 and Hsp40 attenuate formation of spherical and annular polyglutamine oligomers by partitioning monomer. Nature Structural & Molecular Biology. 11 (12), 1215-1222 (2004).
- Legleiter, J., et al. Monoclonal antibodies recognize distinct conformational epitopes formed by polyglutamine in a mutant huntingtin fragment. Journal of Biological Chemistry. 284 (32), 21647-21658 (2009).
- Legleiter, J., et al. Mutant huntingtin fragments form oligomers in a polyglutamine length-dependent manner in vitro and in vivo. Journal of Biological Chemistry. 285 (19), 14777-14790 (2010).
- Nucifora, L. G., et al. Identification of novel potentially toxic oligomers formed in vitro. from mammalian-derived expanded huntingtin exon-1 protein. Journal of Biological Chemistry. 287 (19), 16017-16028 (2012).
- Dahlgren, P. R., et al. Atomic force microscopy analysis of the Huntington protein nanofibril formation. Nanomedicine. 1 (1), 52-57 (2005).
- Poirier, M. A., et al. Huntingtin spheroids and protofibrils as precursors in polyglutamine fibrilization. Journal of Biological Chemistry. 277 (43), 41032-41037 (2002).
- Duim, W. C., Chen, B., Frydman, J., Moerner, W. E. Sub-diffraction imaging of huntingtin protein aggregates by fluorescence blink-microscopy and atomic force microscopy. Chemphyschem. 12 (13), 2387-2390 (2011).
- Pieri, L., Madiona, K., Bousset, L., Melki, R. Fibrillar alpha-synuclein and huntingtin exon 1 assemblies are toxic to the cells. Biophysical Journal. 102 (12), 2894-2905 (2012).
- Monsellier, E., Redeker, V., Ruiz-Arlandis, G., Bousset, L., Melki, R. Molecular interaction between the chaperone Hsc70 and the N-terminal flank of huntingtin exon 1 modulates aggregation. Journal of Biological Chemistry. 290 (5), 2560-2576 (2015).
- Isas, J. M., Langen, R., Siemer, A. B. Solid-State Nuclear Magnetic Resonance on the Static and Dynamic Domains of Huntingtin Exon-1 Fibrils. Biochemistry. 54 (25), 3942-3949 (2015).
- Malakhov, M. P., et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins. Journal of Structural Function Genomics. 5 (1-2), 75-86 (2004).
- Mossessova, E., Lima, C. D. Ulp1-SUMO crystal structure and genetic analysis reveal conserved interactions and a regulatory element essential for cell growth in yeast. Molecular Cell. 5 (5), 865-876 (2000).
- Kumari, S., Pal, R. K., Gupta, R., Goel, M. High Resolution X-ray Diffraction Dataset for Bacillus licheniformis Gamma Glutamyl Transpeptidase-acivicin complex: SUMO-Tag Renders High Expression and Solubility. Protein Journakl. 36 (1), 7-16 (2017).
- Zhang, J., Sun, A., Dong, Y., Wei, D. Recombinant Production and Characterization of SAC, the Core Domain of Par-4, by SUMO Fusion System. Applied Biochemistry and Biotechnology. , (2017).
- Reif, A., et al. Semisynthesis of biologically active glycoforms of the human cytokine interleukin 6. Angewandte Chemie International Edition English. 53 (45), 12125-12131 (2014).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253 (2007).
- Smith, B. J. SDS Polyacrylamide Gel Electrophoresis of Proteins. Methods in Molecular Biology. 1, 41-55 (1984).
- Lawrence, A. M., Besir, H. U. Staining of proteins in gels with Coomassie G-250 without organic solvent and acetic acid. Journal of Visualized Experiments. (30), (2009).
- Block, H., et al. Immobilized-metal affinity chromatography (IMAC): a review. Methods in Enzymology. 463, 439-473 (2009).
- Chen, S. M., Wetzel, R. Solubilization and disaggregation of polyglutamine peptides. Protein Science. 10 (4), 887-891 (2001).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. Journal of Visualized Experiments. (58), (2011).
- O'Nuallain, B., et al. Kinetics and thermodynamics of amyloid assembly using a high-performance liquid chromatography-based sedimentation assay. Amyloid, Prions, and Other Protein Aggregates, Pt C. 413, 34-74 (2006).
- Greenfield, N. J. Analysis of circular dichroism data. Methods in Enzymology. 383, 282-317 (2004).
- Aiken, C. T., et al. Phosphorylation of threonine 3: implications for Huntingtin aggregation and neurotoxicity. Journal of Biological Chemistry. 284 (43), 29427-29436 (2009).
- Satakarni, M., Curtis, R. Production of recombinant peptides as fusions with SUMO. Protein Expression and Purification. 78 (2), 113-119 (2011).
- Davies, H. A., Wilkinson, M. C., Gibson, R. P., Middleton, D. A. Expression and purification of the aortic amyloid polypeptide medin. Protein Expression and Purification. 98, 32-37 (2014).
- Chen, S., Wetzel, R. Solubilization and disaggregation of polyglutamine peptides. Protein Science. 10 (4), 887-891 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены