Method Article
В реальном времени наблюдения опосредовано Rad51 реакции обмена Strand ДНК
В этой статье
Резюме
Флуоресценции резонанс энергии на основе передачи в реальном времени наблюдения системы ДНК прядь реакции обмена опосредовано Rad51 были разработаны. Используя протоколы, представленные здесь, мы способны обнаружить формирования интермедиатов реакции и их преобразования в продукции, а также анализа ферментативной кинетики реакции.
Аннотация
Реакции обмена нити ДНК, опосредовано Rad51 является важнейшим шагом гомологичная рекомбинация. В этой реакции Rad51 образует Нуклеопротеиды накаливания на одноцепочечной ДНК (ssDNA) и захватывает двуцепочечной ДНК (dsDNA) не специально, чтобы допросить его гомологичных последовательности. После возникновения гомологии, Rad51 катализирует ДНК пряди обмен выступить посредником, спаривание ssDNA с дополнительные нити dsDNA. Эта реакция высоко регулируется многочисленными вспомагательные белков в естественных условиях. Хотя обычные биохимических анализов успешно использовались для изучения роли таких аксессуаров белка в пробирке, кинетический анализ промежуточного формирования и ее прогрессии в конечный продукт оказался сложным из-за нестабильной и временной характер интермедиатов реакции. Соблюдать эти шаги реакции непосредственно в растворе, передачи энергии резонансной флюоресценции (ЛАДА)-на основе реального времени наблюдения были созданы системы этой реакции. Кинетический анализ в реальном времени наблюдений показывает, что реакции обмена нити ДНК, опосредовано Rad51 повинуется модель три шага реакции с участием формирования промежуточных 3 нить ДНК, созревания это промежуточное и выпуск ssDNA от зрелых промежуточных. Swi5-1 шв комплекс, вспомагательные белка, сохраняется у эукариот, сильно повышает второй и третий шаги этой реакции. ЛАД основе анализов, представленные здесь позволяют нам выявить молекулярные механизмы, через которые рекомбинации вспомагательные белки стимулируют активность обмена нити ДНК Rad51. Основная цель настоящего Протокола заключается в расширения репертуара методов, доступных для исследователей в области гомологичная рекомбинация, особенно тех, кто работает с белками от видов помимо Делящиеся дрожжи, так что Эволюционная сохранения результатов, представленных в настоящем документе могут быть определены.
Введение
Гомологичная рекомбинация (HR) облегчает перетасовки генетической информацией между двух различных молекул ДНК. HR необходим для двух основных биологических явлений: поколение генетического разнообразия во время гаметогенеза1 и ремонт ДНК двухнитевые разрывы (DSBs)2 в процессе митоза. DSBs наиболее тяжелой формой повреждения ДНК и представляют собой обрыв в хромосоме. Неправильный ремонт DSBs может вызвать обширные хромосомных перестроек и геномная нестабильность, которые оба клейма рака3.
Реакция обмен нити ДНК является центральной фазы HR. Rad51 белок, который является членом высоко сохранены RecA тип семьи recombinases, является ключевой белок, который катализирует этой реакции в эукариот4,5. В этой реакции Rad51 привязывается к одноцепочечной ДНК (ssDNA) порожденных nucleolytic обработка конца ОУС и форм винтовой Нуклеопротеиды комплекс называют Пресинаптический накаливания. Этот накаливания ловит нетронутыми двуцепочечной ДНК (dsDNA) nonspecifically для поиска гомологичных последовательности. Когда нить накала находит гомологичной последовательностью, промежуточные, содержащий три stranded дна реакции образуется и Rad51 накаливания опосредует стренги обмена в рамках этой структуры6,,78. Для эффективного выполнения этой реакции, Rad51 требует нескольких видов аксессуаров белков, таких как BRCA1 и BRCA2, изделия из груди Рак восприимчивость гены9,10.
Понимание как аксессуар факторы регулируют Rad51 является неотъемлемым шагом в выявлении причин геномной нестабильности в tumorigenesis. Хотя много исследований касается воздействия этих факторов на формирование Пресинаптический накаливания и стабильности11,12,13,14,15,16, вклад этих факторов формирования промежуточных 3 нить и его переработки в конечный продукт до сих пор неясно. Соблюдая эти реакции шаги через обычные биохимические эксперименты очень трудно потому, что 3 нить промежуточного нестабильной и склонной к краху общих экспериментальных манипуляций, например депротеинизация образцов или электрофорез.
Чтобы преодолеть эту проблему, мы адаптировали две ранее разработанной в реальном времени наблюдения системы реакции обмен нити ДНК, с помощью передачи энергии резонансной флюоресценции (ЛАДА): спаривание нити ДНК и ДНК прядь перемещения анализов17, 18 (рис. 1). В стренге дна, сопряжения пробирного, Rad51 формы Пресинаптический накаливания с флуоресцеин amidite (FAM) - меченых ssDNA и затем гомологичных карбоксильную x родамин (ROX) - помечены dsDNA добавляется инициировать реакции обмена стренги. Когда нить накала ловит ROX-меченых dsDNA и образует промежуточный 3 нить, два флуорофоров вступают в непосредственной близости и флуоресценции выбросов FAM закаленном по ROX (рис. 1A). В assay перемещение нити ДНК Пресинаптический накаливания, сформированные на неподписанных ssDNA является инкубировали с FAM и ROX двойной меченых dsDNA. После завершения обмена прядь и FAM, помечены ssDNA освобождается от 3 нить промежуточные, выбросов увеличивает FAM потому что FAM больше не находится в непосредственной близости от ROX (Рисунок 1B). Эти анализы позволяют нам наблюдать формирование 3 нить промежуточных продуктов и их обработки в конечные продукты в режиме реального времени без каких-либо беспорядков на реакцию.
С помощью этой системы в реальном времени наблюдения, мы обнаружили, что реакции обмена нити ДНК, опосредовано Rad51 протекает в три шаги, включая создание первой реакцией промежуточных (C1), переходит в второго промежуточного первым промежуточных (C2) и выпуск ssDNA C219. Мы также обнаружили, что деление дрожжи (S. pombe) Swi5-1 шв, который является эволюционно сохранены Rad51 аксессуар белка комплекс13,16,20,21,22, стимулирует C1-C2 переход и выпуска ssDNA от C2 в манере, которая является зависимой от гидролиза АТФ на Rad5119.
Ли эти выводы эволюционно консервируют остается неизвестным. Этот протокол предоставляется в надежде на то, что исследователи в области HR, особенно тех, кто работает с белками из организмов помимо S. pombe, могут применять эти методы, чтобы определить, в какой степени молекулярный механизм Rad51-driven прядь обмен сохраняется. Кроме того эти методы оказались весьма успешными в определении роли Swi5-1, S. pombe шв. Таким образом это рациональный предсказание, что эти методы будут иметь неоценимое значение в раскрытии конкретной роли других HR аксессуар факторов.
протокол
1. Подготовка белков и ДНК субстратов
- Очищайте S. pombe Rad51 и Swi5-1 шв белки до однородности (судить Окрашивание Кумасси), как сообщалось ранее,13,21.
- Подготовьте олигонуклеотида ДНК субстратов, перечисленных в таблице 118.
Примечание: Олигонуклеотиды были куплены (см. Таблицу материалы) и синтезированных в классе ВЭЖХ. Для сопряжения реакции, олигонуклеотиды strand ДНК 16FA(-), 16А _40bp (-) и 16Ар (+) _40bp не требуется. Для перемещения assay ДНК, олигонуклеотиды 16A(-), 16FA _40bp (-) и 16Ар (+) _40bp, требуется (рис. 1 и Таблица 1). Все концентрации ДНК в этом протоколе обратитесь к фрагмент концентрации в отличие от концентрации нуклеотидов. - Сформировать dsDNA доноров, смешать эквимолярных количествах дополнительных прядей в тонкостенных ПЦР-пробирку с отжига буфера (10 мм трис-HCl рН 7,5, 100 мм NaCl, 10 MgCl2), обеспечение общего объема больше чем 20 мкл. выполнить это смешивание на prechilled металлический стеллаж на мороженое (между 2 ° C и 4 ° C).
Примечание: Сочетание олигонуклеотиды для сопряжения assay, 16А _40bp (-) и 16Ар (+) _40bp. Для перемещения assay, отжиг олигонуклеотиды 16FA _40bp (-) и 16Ар (+) _40bp. - Тепло для отжига смесь при 90 ° C за 5 мин и остыть в течение 3 ч до 30 ° C с помощью ПЦР машины. Магазин отожженная ДНК при-20 ° C.
2. ДНК пряди сопряжения и перемещения анализов
- Выполняйте стренге дна, спаривание assay.
- Подготовить 1,6 мл реакции буфера A (30 мм HEPES-Кох pH 7.5, Дитиотреитол [DTT] 1 мм, 15 мм MgCl2, 0,25 мм АТФ, альбумина bovine сыворотки 0,1 мг/мл [BSA] и 0.0075% polyoxyethylenesorbitan monolaurate) содержащий 36 Нм 16FA(-) в микро центрифугу 2.0 мл Трубы пластиковые (полипропилен) и предварительной инкубации при 37 ° C за 5 мин.
- Чтобы сформировать Rad51-ssDNA нитей, добавить Rad51 белка в конечной концентрации 1,5 мкм в буфере предварительно инкубирован реакции и инкубировать при 37 ° C за 5 мин.
- Добавить белка Swi5-1 шв смесь до конечной концентрации 0,15 мкм и проинкубируйте его при 37 ° C для еще 5 мин.
- Возьмите 1,5 мл смеси и перевести его в Кюветы кварцевые 1,0 x 1,0 см, содержащие магнитную мешалку и кювета в spectrofluorometer. Настройка Пельтье контроллер температуры спектрофотометр до 37 ° C и установите магнитной мешалкой 450 об/мин для обеспечения быстрого смешивания введенного образца.
- Начать измерения флуоресценции выбросов FAM в 525 Нм (полосы пропускания: 20 Нм) после возбуждения 493 Нм (пропускная способность: 1 Нм). Сбор данных каждую секунду.
- После начала измерения для 100 s, придать dsDNA ROX-меченых доноров до конечной концентрации 36 Нм в смеси с помощью шприца и мера изменения выбросов на 1 s интервалы для дальнейшего 30 мин.
- Выполняйте Пробирной перемещение нити ДНК.
- Подготовить 1,6 мл реакции буфера A содержащих 36 Нм 16A(-) в пластиковые микро центрифуга 2.0 мл трубки и предварительной инкубации при 37 ° C за 5 мин.
- Форма Rad51-ssDNA нитей в присутствии Swi5-1 шв при 37 ° C, как описано в шагах 2.1.2. и 2.1.3.
- Взять 1,5 мл смеси и перевести его в кварцевые кюветы, содержащие магнитную мешалку и кювета в спектрофотометр, как описано в шаге 2.1.4.
- Начать измерения выбросов флуоресценции и после 100 s, придать FAM и ROX-меченных dsDNA доноров, как описано в шаге 2.1.6. Измерьте изменение выбросов флуоресценции интервалы 1 s еще 30 мин.
3. анализ экспериментальных данных от сопряжения и перемещения анализов
- Оценить максимальную эффективность ладу.
- Подготовка 16FA(-) стальная с 16Ар (+) _40bp и 16FA _40bp (-), стальная с 16Ар (+) _40bp использованием той же процедуры, описанной в шаге 1.3 и 1.4.
- Подготовка 130 мкл буфера реакции A содержащих 36 Нм или 16FA(-), 16FA(-) стальная с 16Ар (+) _40bp, 16FA _40bp (-), стальная с 16Ар (+) _40bp или 16FA (-) _40bp в кювет кварц 0,2 x 1,0 см.
- Установите кювета в spectrofluorometer и инкубировать при 37 ° C за 5 мин.
- Измерение спектров флуоресценции от 500 до 600 Нм после возбуждения 493 нм.
- Чтобы проверить влияние Rad51 на выброс FAM и охлаждение МВС по ROX, добавить Rad51 в конечной концентрации 1,5 мкм в смесь и инкубировать при 37 ° C за 5 мин.
- Измерение спектров флуоресценции от 500 до 600 Нм после возбуждения 493 нм.
- Рассчитайте максимальную эффективность ладу (EМаксимальная), используя уравнение, описанных ниже:
Eмаксимального = (интенсивность флуоресценции в 525 Нм dsDNA помечены FAM и ROX) / (интенсивности флуоресценции в 525 Нм FAM помечены ssDNA)
- Анализ экспериментальных данных от перемещения assay.
- Для преобразования изменения в флуоресцировании наблюдается в assay перемещения для изменения объема конечного продукта, нормализовать сырья экспериментальные данные, полученные из этот assay, используя уравнение, описанных ниже, где Fсырья является интенсивность флуоресценции от необработанные данные и Fнормализованных является изменение в флуоресцировании рассчитывается по следующей формуле.
Fнормализованных = ([Fсырья в момент x]-[Fсырья в момент времени 0]) / (([Fсырья в момент времени 0] / EМаксимальная)-[Fсырья в момент времени 0])
Fсырья в момент времени 0 является средняя флуоресценции, наблюдение за первые 5 секунд после мертвого времени (то есть, время, необходимое для смешивания после закачиваемой вводится в кювет). - Чтобы исключить последствия Фотообесцвечивание и спонтанное перемещение, вычтите Fнормализованных без белка от Fнормализованных образца для получения FD, который является изменения объема конечного продукта в этот assay.
FD = [Fнормализованных образца] - [Fнормализованных без белка]
- Для преобразования изменения в флуоресцировании наблюдается в assay перемещения для изменения объема конечного продукта, нормализовать сырья экспериментальные данные, полученные из этот assay, используя уравнение, описанных ниже, где Fсырья является интенсивность флуоресценции от необработанные данные и Fнормализованных является изменение в флуоресцировании рассчитывается по следующей формуле.
- Анализ экспериментальных данных из спаривания assay.
- Нормализовать сырья экспериментальные данные, полученные из спаривания пробу с помощью уравнения, описанные ниже, где Fсырья интенсивности флуоресценции от исходных данных и Fнормализованных является изменение в флуоресцировании рассчитывается по следующей формуле.
Fнормализованных = (Fсырья в момент x) / (Fсырья в момент времени 0)
Fсырья в момент времени 0 является средняя флуоресценции, наблюдение за последние 20 s до начала реакции путем инъекций dsDNA субстрата. - Чтобы преобразовать изменения в флуоресцировании изменения в количество субстрата и исключить последствия Фотообесцвечивание и спонтанное сопряжения, нормализовать Fнормализованных образца с помощью уравнения, описанных ниже, где FP это изменение в количество субстрат в этот assay.
FP = 1 - (([Fнормализовать без белка] - [Fнормализованных образца]) / [1-EМаксимальная]) - Для изучения кинетики реакции обмена нити ДНК, выполнить анализ нелинейной регрессии последний площадь сопряжения реакции, с помощью анализа программы23 (см. Таблицу материалы).
- Подготовьте файл в формате txt, содержащий данные времени курс FP.
- Запустите программу и вставьте этот сценарий в Дополнительный файл кода в окно программы:
- Начало-нелинейная последний площадь регрессионный анализ. Результаты этого анализа будут отображаться в том же окне.
- Нормализовать сырья экспериментальные данные, полученные из спаривания пробу с помощью уравнения, описанные ниже, где Fсырья интенсивности флуоресценции от исходных данных и Fнормализованных является изменение в флуоресцировании рассчитывается по следующей формуле.
Результаты
Для эффективного анализа экспериментальных данных из анализов сопряжения и перемещения, необходимо определить, как изменения в флуоресценции выбросов FAM соответствует преобразования ДНК субстратов в продукции. Для достижения этой цели, должен быть определен соответствующий диапазон интенсивности флуоресценции. Для сопряжения assay, флуоресценции эмиссии 16FA(-), которая соответствует ssDNA субстрата, сравнивается с выбросов 16FA(-) стальная с 16Ар (+) _40bp, который соответствует конечной продукции этой реакции (рис. 2A). Это приравнивается к максимальной эффективности ладу и следовательно максимальное снижение интенсивности флуоресценции что бы ожидать, если все ssDNA субстрат был преобразован в dsDNA продукт. Для перемещения assay излучение 16FA (-) _40bp стальная с 16Ар (+) _40bp, который соответствует подложке, сравнивается с эмиссией 16FA _40bp (-), что соответствует конечного продукта (рис. 2B). В этом случае максимальное увеличение интенсивности флуоресценции FAM передает сценарий, в котором все dsDNA субстрата преобразуется в ssDNA продукт. S. pombe Rad51 не влияет на флуоресценции выбросов FAM или тушения эффективности FAM по ROX в обоих анализов (рис. 2). Максимальная эффективность ладу должно быть повторному измерению с каждой новой подготовка олигонуклеотиды, как это зависит от маркировки эффективности олигонуклеотиды.
Репрезентативных данных ДНК пряди сопряжения и перемещения реакций показано на рисунке 3. Эффекты спонтанной реакции между субстрат ДНК и Фотообесцвечивание были малы в обоих анализов, как показал незначительное изменения, видел в излучении FAM без Rad51, по сравнению с существенные изменения, видел с Rad51 (Рисунок 3А и Рисунок 3B). На основе данных показано на рисунке 3A или 3B рисунок, изменения в флуоресцировании был преобразован в изменения в количество субстрата (PF) или конечного продукта (FD), соответственно, с помощью уравнений, описанные в шагах 3.2.2 или 3.3.2 ( Рисунок 3 c и 3D рисунок).
Спаривание реакции был смоделирован с помощью последовательного три шага реакции модель, состоящая из формирования первого промежуточного 3 нить (C1), переходит в втором промежуточном первым промежуточных (C1 C2) и выпуск ssDNA от второго промежуточного сформировать два продукта (D + E) (рис. 3E). Чтобы проверить ли моделирования с помощью последовательного три шага реакции модель fit экспериментальных данных, остатков между экспериментальных данных ДНК пряди, спаривание пробирного и теоретической кривой, полученные путем моделирования были рассчитаны (Рисунок 3F). Кроме того остатков между спаривания реакции и теоретической кривой, созданные с использованием последовательной двухэтапной модели реакции были вычисляемый (Рисунок 3 g). Остатки для спаривания реакции и двухэтапной модели показывают систематического отклонения на ранней стадии, в то время как остатков для сопряжения реакции и трехступенчатая модель не показывают такое отклонение. Это означает, что трехступенчатая модель является более лучшая пригонка чем двухэтапной модели для имитации спаривания реакции.
Чтобы проверить ли трехступенчатая модель соответствует реакции перемещения, которая обнаруживает конце шаг обмена нити ДНК, мы создали теоретической кривой реакции перемещения с помощью кинетических параметров, полученных от моделирования сопряжения реакции показано на рис. 3 c и сравнил его с экспериментальными данными реакции перемещения, показано на рисунке 3D (рис. 3 H). Теоретической кривой подходят экспериментальных данных перемещения assay. Из этих результатов мы заключаем, что моделирование с использованием модели трехэтапной возможность разумно оценивать реакции обмена нити ДНК, опосредовано Rad51.
Репрезентативных данных ДНК пряди сопряжения реакции, содержащий Rad51 и Swi5-1 шв комплекс, вспомагательные белка Rad51, показано на рисунке 4A. Комплекс Swi5-1 шв сильно стимулировала спаривания активность Rad51. Как было замечено в отсутствие Swi5-1 шв, спаривания реакция лучше подходят трехступенчатая модель чем двухэтапной модели в присутствии Swi5-1 шв (рис. 4B). Путем моделирования реакции с использованием модели три шага были рассчитаны константы равновесия реакции каждого шага реакции с или без Swi5-1 шв. Констант равновесия реакции указал, что в комплексе Swi5-1 шв не стимулируют первый шаг реакции (Рисунок 4 c, Группа), в котором средний 3 нить образуется, но сильно стимулирует C1-C2 переходит ( Рисунок 4 c, Группа b) и освобождение ssDNA из промежуточного C2 (рис. 4 c, Группа c).
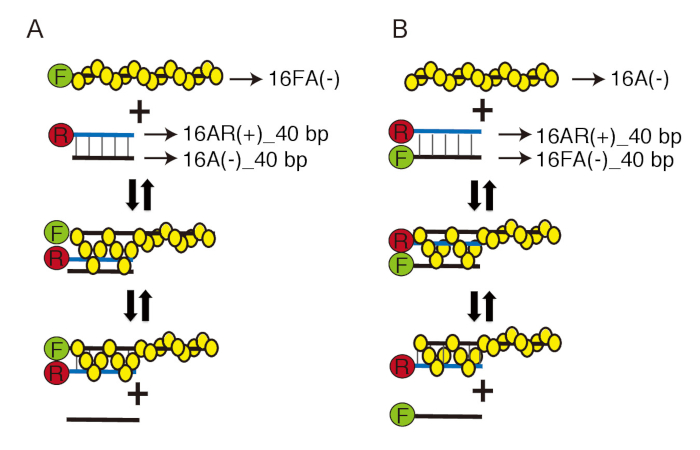
Рисунок 1: экспериментальный дизайн ДНК прядь сопряжения и перемещения assays. Схемы ДНК прядь сопряжения (A) и перемещения (B) assays. Желтые круги представляют Rad51 мономеров. Зеленые круги содержащие «F» и красные круги, содержащие «R» представляют флуоресцеин amidite (FAM) и карбоксильную X-родамин (ROX), соответственно. Нити ДНК черный идентичные последовательности и дополняют голубой нити ДНК. Тонкие черные линии со стрелками указывают на имя каждого олигонуклеотида, как показано в таблице 1. Эта цифра была адаптирована из Ito et al. 19 и изменение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
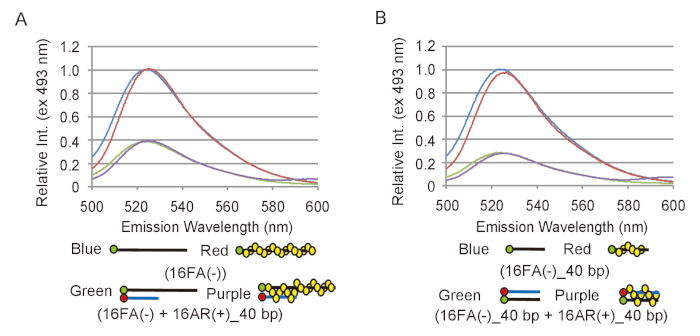
Рисунок 2: измерения максимальной эффективности ладу сопряжения и перемещения анализов. (A) сравнения спектров флуоресценции между ssDNA субстрата, 16FA(-) и dsDNA продукт, 16FA(-) в паре с 16Ар (+) _40bp, спаривания анализа. Голубые и красные линии представляют спектры флуоресценции подложки без и с Rad51, соответственно. Зеленый и фиолетовый линии показывают спектры флуоресценции конечного продукта без и с Rad51, соответственно. (B) сравнения спектров флуоресценции между dsDNA субстрата, 16FA _40bp (-) в паре с 16Ар (+) _40bp и ssDNA продукт, 16FA _40bp (-), анализа перемещения. Голубые и красные линии обозначают спектры флуоресценции конечного продукта без и с Rad51, соответственно. Зеленый и фиолетовый линии показывают спектры флуоресценции подложки без и с Rad51, соответственно. Эта цифра приспособлен от Ito et al. 19 и изменение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
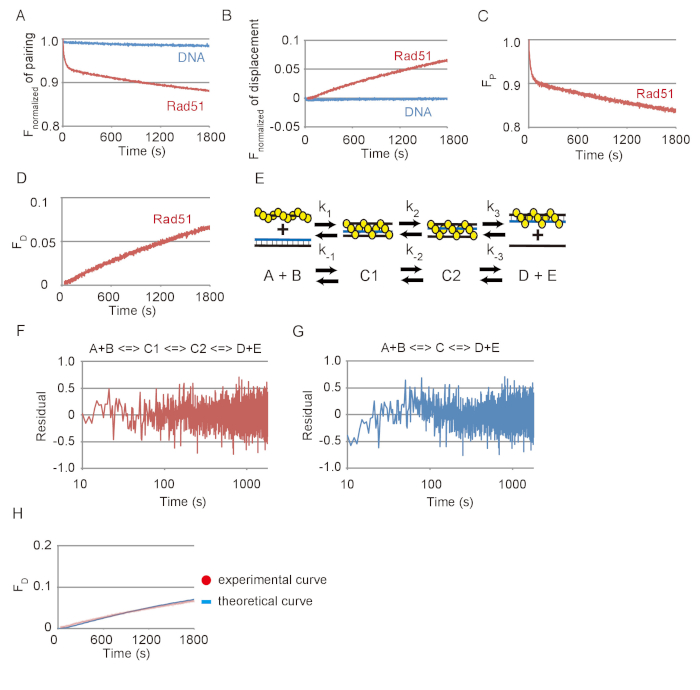
Рисунок 3: ДНК пряди сопряжения и перемещения реакции при посредничестве Rad51. (A) курс нормализованных флуоресценции спаривания реакции с или без Rad51. (B) время курс нормализованных флуоресценции перемещения реакции с или без Rad51. (C) Время курса изменения объема субстрат в сопряжении реакции с Rad51. (D) время курс изменения объема субстрат в реакции перемещения с Rad51. (E) A схема модели последовательно три шага реакции. A и B соответствуют Пресинаптический dsDNA накаливания и доноров. C1 соответствует первый промежуточный (незрелые) 3 нить. C2 соответствует второй промежуточный (зрелые) 3 нить. D и E соответствуют гетеродуплексного и ssDNA освобожден от C2. (F и G) остатков между экспериментальных данных ДНК пряди, спаривание пробирного и теоретической кривой, полученные путем моделирования с помощью двухступенчатый (G) модель или три шага (F). (H) красные точки обозначают экспериментальных данных от реакции перемещения с Rad51, отображаемые в панели D. Синяя линия показывает теоретической кривой конечной продукции. Моделирования с помощью константы скорости реакции, полученные из спаривания проба отбирается группа Cбыла порождена теоретической кривой. Эта цифра приспособлен от Ito et al. 19 и изменение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
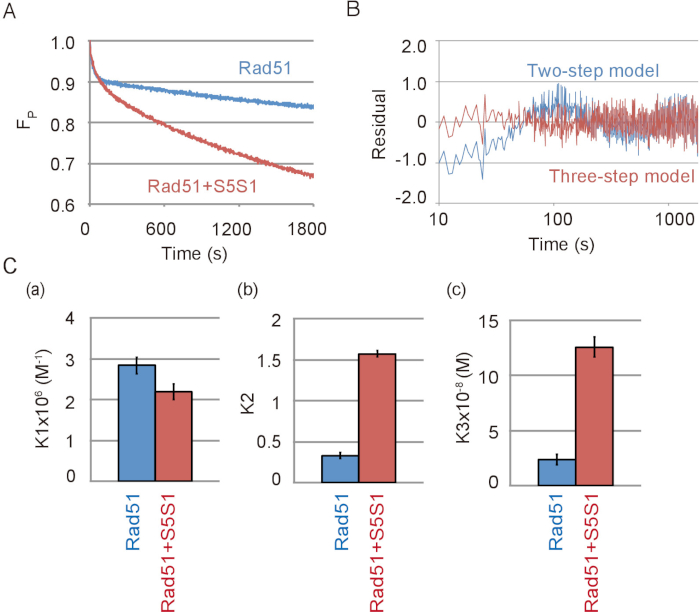
Рисунок 4: Swi5-1 шв стимулирует второй и третий шаги ДНК прядь реакции обмена. (A) время курс изменения объема субстрат в сопряжении реакции с или без Swi5-1 шв (S5S1). (B) остатков между экспериментальных данных ДНК пряди спаривания проба с Swi5-1 шв и теоретической кривой, полученные путем моделирования с использованием двухэтапного (синяя линия) или модель три шага (красная линия). (C) сопряжения реакции показано на Рисунок 4A был имитирован трехступенчатая модель, с помощью анализа программы23 (см. Таблицу материалы). Констант равновесия реакции каждого шага реакции, K1 (), (b) K2 и K3 (c), были получены от моделирования. Эта цифра приспособлен от Ito et al. 19 и изменение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Олигонуклеотиды для сопряжения пробирного стренге дна | ||||
| 16FA(-) | 5'-[FAM] - AAATGAACATAAAGTAAATAAGTATAAGGATAATACA AAATAAGTAAATGAATAAACATAGAAAATAAAGTAAAGGATAT AAA -3 ' | |||
| 16A (-) _40bp | 5'-AAATGAACATAAAGTAAATAAGTATAAGGATAATACAAAA-3' | |||
| 16Ар (+) _40bp | 5 '- TTTTGTATTATCCTTATACTTATTTACTTTATGTTCATTT-[ROX] -3' | |||
| Олигонуклеотиды для assay перемещение нити ДНК | ||||
| 16A(-) | 5'-AAATGAACATAAAGTAAATAAGTATAAGGATAATACAAAATA AGTAAATGAATAAACATAGAAAATAAAGTAAAGGATAT AAA -3 ' | |||
| 16FA _40bp (-) | 5'-[FAM] - AAATGAACATAAAGTAAATAAGTATAAGGATAATACAAAA-3' | |||
| 16Ар (+) _40bp | 5 '- TTTTGTATTATCCTTATACTTATTTACTTTATGTTCATTT-[ROX] -3' | |||
Таблица 1: список олигонуклеотиды, используемых в ДНК пряди сопряжения и перемещения анализов. Там, где это применимо, позиции флуорофоров (флуоресцеин amidite, FAM; карбоксильную x родамин, ROX) указаны в квадратных скобках.
Обсуждение
Здесь мы описали подробный протокол, который использует лад для измерения Rad51-driven ДНК пряди обмен в режиме реального времени. Важно отметить, что эти измерения позволяют для определения кинетики реакции. Хотя приведенные выше описания достаточно, чтобы воспроизвести нашего опубликованные результаты, существует несколько критических точек, которые будут описаны в этом разделе. Кроме того преимущества и недостатки на основе ладу методологий для изучения ДНК пряди обмен будет обсуждаться, наряду с применением таких методов для изучения других аспектов метаболизма ДНК.
Как с все биохимические эксперименты, обеспечение того, чтобы все реакции субстратов высокой чистоты имеет важное значение. Это небрежное предположить отсутствие загрязняющих видов деятельности, основанных исключительно на очевидной чистоту белка подготовка судить Окрашивание Кумасси. В частности наличие следов nucleases или Хеликазы может существенно повлиять на результаты анализов сопряжения и перемещения. Таким образом мы настоятельно рекомендуем тестирование для такой деятельности каждый раз, когда новая партия белка очищается. Кроме того это разумно, чтобы проверить чистоту синтезированных ДНК субстратов, родной полиакриламидный гель-электрофорез. Несмотря на многие компании, гарантируя чистоту олигонуклеотиды часто мы нашли через наши собственные тестирования, что чистоты синтезированных ДНК может варьироваться между сериями.
Важно рассмотреть следующие две точки при проведении экспериментов с кварцевые кюветы. Во-первых некоторые белки склонны связывать Кюветы кварцевые nonspecifically. Чтобы противостоять этому, BSA и polyoxyethylenesorbitan monolaurate, включены в реакции буферов. Во-вторых температура имеет большое влияние на скорость и флуоресценции интенсивность реакции. Чтобы свести к минимуму этот эффект, кварцевые кюветы должны быть предварительно инкубируют при 37 ° C перед использованием.
Хотя обычные биохимических анализов были чрезвычайно полезны в изучении обмен нити ДНК, они имеют ряд недостатков. В типичной эксперимент курс реакция инкубировали при определенной температуре и аликвоты снята в нужное timepoints и депротеинизированным лечение с моющим средством и протеазы прекратить реакции. По завершении времени-конечно образцы подвергаются затем электрофорез отделить субстратов ДНК от продуктов. Основным преимуществом метода, описанного здесь является, что она позволяет для реального времени наблюдения за реакцией без каких-либо нарушений. Любой timepoint во время реакции может быть проверены без нарушения реакции, сам, и нет необходимости deproteinize образцы или подвергнуть их потенциально разрушительных сил электрофореза. Это особенно актуально, когда мониторинг неустойчивые структуры ДНК.
Несмотря на эти преимущества над обычных анализов метод, описанный здесь есть некоторые недостатки. В то время как использование олигонуклеотидных ДНК субстратов для обмена стренги упрощает интерпретацию результатов, важно помнить, что такие субстраты не напоминают ДНК субстратов, участвующих в HR в ячейке. Некоторые обычные анализы используют размера плазмида ДНК подложках, которые более правоподобны для того отразить количество пар оснований, которые обменялись в vivo. Кроме того использование топологически ограничением круговой dsDNA субстратов в подмножестве обычных анализов по крайней мере частично можно воссоздать напряженность в физиологических ДНК.
Применение метода, описанного здесь начал разгадать молекулярных механизмов Rad51-driven ДНК пряди обмена. Тем не менее есть много интересных вопросов, которые остаются ответа. Нет четких доказательств того, что HR во время мейоза требует Rad51 и Dmc1, мейоз конкретных RecA тип рекомбиназа эукариот24. Однако отсутствие основных биохимических различий между этими двумя recombinases озадачен исследователей в области лет. Кроме того роль многочисленных отдельных групп рекомбинации аксессуар факторов была фокуса темой исследований в области HR. В дополнение к разъяснению биохимических различия между Rad51 и Dmc1, мы стремимся изучить и сравнить эффекты различных рекомбинации аксессуар факторов на кинетику ДНК пряди обмена в ближайшем будущем. Наконец важно подчеркнуть, что ладу на основе методологии, описанной здесь не ограничивается исследования ДНК пряди обмена. С относительно небольшими изменениями мы видим много видов приложений для этой техники в расследовании функционально различных белков, участвующих в ДНК метаболизм25,26,27,28. Мы надеемся, что события, описанные здесь будет предоставить дополнительные возможности исследователей, принадлежащих к много различных дисциплин.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа финансировалась дотаций для научных исследований (A) (18H 03985) и в инновационных областях (15H 05974) для HI, для молодых ученых (B) (17K 15061) Ба и для научных исследований (B) (18H 02371) к ХТ от японского общества для содействия развитию науки ( JSP).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 x 1.0 cm quartz cuvette | Hellma Analytics | 105-250-15-40 | |
| 1.0 x 1.0 cm quartz cuvette | Hellma Analytics | 101-10-40 | |
| adenosine triphosphate (ATP) | Sigma | A2383 | |
| DynaFit | BioKin, Ldt. | DynaFit is a program to analyze kinetics of biochemical reactions. | |
| Fluorescent labeled and non-labeled oligonucleotides | Eurofins Genomics | The sequences of oligos are listed in Table. 1. | |
| Magnetic stirrer | Aisis (Japan) | CM1609 | |
| PCR machine | TAKARA (Japan) | TP600 | TAKARA PCR Thermal Cycler Dice |
| Spectrofluorometer | JASCO | FP8300 | Contains a peltier temperature controller and magnetic stirrer system |
| Syringe | HAMILTON | 1702RN 25ul SYR (22s/2"/2) |
Ссылки
- Camerini-Otero, R. D., Hsieh, P. Homologous recombination proteins in prokaryotes and eukaryotes. Annual Review of Genetics. 29 (1), 509-552 (1995).
- Cromie, G. A., Connelly, J. C., Leach, D. R. Recombination at double-strand breaks and DNA ends: conserved mechanisms from phage to humans. Molecular Cell. 8 (6), 1163-1174 (2001).
- Pierce, A. J., et al. Double-strand breaks and tumorigenesis. Trends in cell biology. 11 (11), S52-S59 (2001).
- Haber, J. E. . Genome Stability. , (2013).
- Kowalczykowski, S. C. An Overview of the Molecular Mechanisms of Recombinational DNA Repair. Cold Spring Harbor perspectives in biology. 7 (11), a016410 (2015).
- Bianco, P. R., Tracy, R. B., Kowalczykowski, S. C. DNA strand exchange proteins: a biochemical and physical comparison. Frontiers in bioscience: a journal and virtual library. 3, D570-D603 (1998).
- Renkawitz, J., Lademann, C. A., Jentsch, S. Mechanisms and principles of homology search during recombination. Nature Reviews Molecular Cell Biology. 15 (6), 369-383 (2014).
- Greene, E. C. DNA Sequence Alignment during Homologous Recombination. The Journal of biological chemistry. 291 (22), 11572-11580 (2016).
- Sung, P., Krejci, L., Van Komen, S., Sehorn, M. G. Rad51 recombinase and recombination mediators. Journal of Biological Chemistry. 278 (44), 42729-42732 (2003).
- Prakash, R., Zhang, Y., Feng, W., Jasin, M. Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins. Cold Spring Harbor perspectives in biology. 7 (4), a016600 (2015).
- Sung, P. Function of yeast Rad52 protein as a mediator between replication protein A and the Rad51 recombinase. Journal of Biological Chemistry. 272 (45), 28194-28197 (1997).
- Sung, P. Yeast Rad55 and Rad57 proteins form a heterodimer that functions with replication protein A to promote DNA strand exchange by Rad51 recombinase. Genes & Development. 11 (9), 1111-1121 (1997).
- Kurokawa, Y., Murayama, Y., Haruta-Takahashi, N., Urabe, I., Iwasaki, H. Reconstitution of DNA strand exchange mediated by Rhp51 recombinase and two mediators. PLoS biology. 6 (4), e88 (2008).
- Jensen, R. B., Carreira, A., Kowalczykowski, S. C. Purified human BRCA2 stimulates RAD51-mediated recombination. Nature. 467 (7316), 678-683 (2010).
- Liu, J., et al. Rad51 paralogues Rad55-Rad57 balance the antirecombinase Srs2 in Rad51 filament formation. Nature. 479 (7372), 245-248 (2011).
- Lu, C. -. H., et al. Swi5-Sfr1 stimulates Rad51 recombinase filament assembly by modulating Rad51 dissociation. Proceedings of the National Academy of Sciences of the United States of America. , (2018).
- Bazemore, L. R., Takahashi, M., Radding, C. M. Kinetic analysis of pairing and strand exchange catalyzed by RecA. Detection by fluorescence energy transfer. Journal of Biological Chemistry. 272 (23), 14672-14682 (1997).
- Gupta, R. C., Bazemore, L. R., Golub, E. I., Radding, C. M. Activities of human recombination protein Rad51. Proceedings of the National Academy of Sciences. 94 (2), 463-468 (1997).
- Ito, K., Murayama, Y., Takahashi, M., Iwasaki, H. Two three-strand intermediates are processed during Rad51-driven DNA strand exchange. Nature Structural & Molecular Biology. 25 (1), 29-36 (2018).
- Akamatsu, Y., Dziadkowiec, D., Ikeguchi, M., Shinagawa, H., Iwasaki, H. Two different Swi5-containing protein complexes are involved in mating-type switching and recombination repair in fission yeast. Proceedings of the National Academy of Sciences. 100 (26), 15770-15775 (2003).
- Haruta, N., et al. The Swi5-Sfr1 complex stimulates Rhp51/Rad51- and Dmc1-mediated DNA strand exchange in vitro. Nature Structural & Molecular Biology. 13 (9), 823-830 (2006).
- Argunhan, B., Murayama, Y., Iwasaki, H. The differentiated and conserved roles of Swi5-Sfr1 in homologous recombination. FEBS Letters. 591 (14), 2035-2047 (2017).
- Kuzmic, P. Program DYNAFIT for the analysis of enzyme kinetic data: application to HIV proteinase. Analytical biochemistry. 237 (2), 260-273 (1996).
- Brown, M. S., Bishop, D. K. DNA strand exchange and RecA homologs in meiosis. Cold Spring Harbor perspectives in biology. 7 (1), a016659 (2014).
- Rudert, W. A., et al. Double-labeled fluorescent probes for 5' nuclease assays: purification and performance evaluation. BioTechniques. 22 (6), 1140-1145 (1997).
- Xiao, J., Singleton, S. F. Elucidating a key intermediate in homologous DNA strand exchange: structural characterization of the RecA-triple-stranded DNA complex using fluorescence resonance energy transfer. Journal of Molecular Biology. 320 (3), 529-558 (2002).
- Grimme, J. M., et al. Human Rad52 binds and wraps single-stranded DNA and mediates annealing via two hRad52-ssDNA complexes. Nucleic Acids Research. 38 (9), 2917-2930 (2010).
- Algasaier, S. I., et al. DNA and Protein Requirements for Substrate Conformational Changes Necessary for Human Flap Endonuclease-1-catalyzed Reaction. The Journal of biological chemistry. 291 (15), 8258-8268 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены