Method Article
Использование Наноплазмона-усиленного рассеяния и Низкоувеличенного микроскопа визуализации для количественной оценки опухоли-производные Exosomes
В этой статье
Резюме
Клинический перевод биомаркеров, полученных с помощью выделения экзосом, для больных и злокачественных клеток затруднен из-за отсутствия быстрых и точных методов количественной оценки. Этот отчет описывает использование изображений с низким увеличением темно-полевого микроскопа для количественной оценки конкретных подтипов выделения экзосом в малых объемах сыворотки или плазменных образцах.
Аннотация
Инфицированные или злокачественные клетки часто выделяют больше exosomes, что приводит к повышенному уровню заболеваний, связанных exosomes в обращении. Эти exosomes имеют потенциал служить в качестве биомаркеров для диагностики заболеваний и мониторинга прогрессирования заболевания и реакции на лечение. Однако, большинств выделения экзосом анализы требуют выделения экзосом изоляции и шаги очищения, которые обычно требующий много времени и трудоёмко, и таким образом лимитированное общее назначение в клинических установках. В этом отчете описывается быстрая процедура анализа специфических биомаркеров на внешней мембране exosomes без отдельной изоляции и шагов очищения. В этом методе, exosomes захвачены на поверхности слайда выделения экзосом-специфических антител и затем гибридизированный с нанозондами-пряные антитела датчики специфическая для болезни. После гибридизации, обилие целевого выделения экзосом населения определяется путем анализа низкочастотного микроскопа темного поля (LMDFM) изображений связанных наночастиц. Этот подход может быть легко принят для исследования и клинического использования для анализа мембранно-ассоциированные выделения экзосом Биомаркеры связаны с болезнью.
Введение
Exosomes выпускаются из большинства типов клеток и играют ключевую роль в связи между ячейками клеток, включая патофизиологические процессы, связанные с различными заболеваниями, так как они могут быть домом для определенных тканей или типов клеток, и содержат различные нуклеиновые кислоты , белки и липиды, которые отражают их ячейки происхождения и могут оказывать регламентационные эффекты на их клетках-реципиентов1,2,3,4. Exosomes часто секретируются на повышенном уровне в состояниях состояний, могут взаимодействовать как с соседними, так и с отдаленными клетками, и находятся при относительно высокой концентрации в обращении, а также в большинстве других жидкостей организма, включая слюну, мочу, поджелудочную и желчь сок, и бронкоальвеолярный промывание жидкость5,6,7,8,9,10,11. Это изобилие и устойчивость exosomes в жидкостях организма человека, в сочетании с их богатой информацией природы, делает их идеальными биомаркеров для диагностики заболеваний и мониторинга лечения.
Это включает в себя опухоль-производные exosomes (TDEs), которые содержат опухоль конкретных или селективных факторов, которые могут служить в качестве биомаркеров болезни, в том числе опухоль связанных мутантных аллелей. TDEs может участвовать в реконструкции микроокружения опухоли для облегчения развития опухоли и метастазов, и регулировать анти-опухолевые ответы12. Увеличение секреции TDE является распространенным фенотипом большинства видов рака, и некоторые особенности микроокружения опухоли, включая гипоксию, кислотный рН и воспаление, как известно, способствуют выделения экзосом секреции. Удивительно, учитывая количество клеток, которые выделяют exosomes, увеличение общего уровня выделения экзосом может, само по себе, функционировать в качестве биомаркера рака. Например, недавнее исследование показало, что общая концентрация EV в желчных соке дискриминирует злокачественные и незлокачественные в общих желчных протоков стеноза пациентов с 100% точность7. Аналогичные результаты были обнаружены в исследованиях с использованием других жидкостей организма, в том числе плазмы. Однако, из-за возможности для предмета к изменению предмета, и других смешанных факторов, большинство исследований, исследывающих exosomes как Биомаркеры болезни были сосредоточены на обнаружении биомаркеров, которые выборочно связаны с TDEs вместо полного выделения экзосом Номера.
Перевод выделения экзосом биомаркеров в клиническую практику, однако, остается сложной задачей, поскольку большинство зарегистрированных выделения экзосом методов анализа требуют трудоемких и трудоемких процедур изоляции 13. В настоящее время популярные методы выделения экзосом изоляции включают ультрагастрифугагации, градиенты плотности, размер-исключение, Co-высыпания, захват сродства, и микрофлюидная изоляция причаливает. Ультра«золотой стандарт» метод, и наиболее обыкновенно использован для выделения экзосом изоляций, но эта процедура отнимает много времени и приводит к в выделения экзосом повреждении и выделения экзосом мембране кластеризации, и производит выделения экзосом пробы которые загрязнены с белки, липопротеины и другие факторы, которые могут влиять на последующий анализ14. Наиболее выделения экзосом методы изоляции, включая ультрахризугации, не могут отделить exosomes (30 – 150 Нм) от микро-везикулы (100 – 1000 Нм) и апоптотических тел (100 – 5000 нм), которые возникают при помощи различных механизмов и имеют различные функции, из-за размера между этими группами и разнообразием выделения экзосом популяций15. Необходимы новые подходы для улучшения чувствительности и воспроизводимости выделения экзосом анализа путем улучшения выделения экзосом восстановления при одновременном снижении выделения экзосом повреждения и загрязнения, хотя любые исследования, основанные на таких методах также должны быть оптимизированы, чтобы сделать их подходит для перевода на приложения в клинических условиях.
Несколько недавних изучений предлагали использовать интегрированные платформы для того чтобы захватить и проанализировать exosomes сразу от жидкостей тела. Эти методы используют микрофлюидную, электрокинетическую, улавливание, и различные другие методы для выделения экзосом изоляции, и электрохимию, резонанс поверхности плазмона, и другие методы для того чтобы обнаружить захваченное exosomes. Не ясно, насколько осуществимо многие из этих подходов будут в клинических условиях, из-за их сложности, расход, низкая пропускная способность или другие вопросы.
Мы разработали быстрый и недорогой анализ, который может быть использован для чувствительной и конкретной количественной оценки общих exosomes и конкретных подтипов выделения экзосом, включая связанные с болезнью exosomes, такие как TDEs, который требует лишь небольшого количества образца и который использует Оптимизированный рабочий процесс, подходящий для клинической среды. В этом пробирке, скольжение покрыно с антителами которые связывают или выделения экзосом-специфически или заболевание-специфически маркер выраженное на поверхности выделения экзосом для того чтобы сразу захватить цель exosomes присутствующего в малом объеме пробы плазмы или сыворотки прилоёных к скваживам на Слайд. Захваченные exosomes затем гибридизированных с антитело-пряные нано, что признает биомаркеров интереса на этих exosomes, которые могут быть либо общий выделения экзосом маркер или фактор, специфичен для выделения экзосом подтипа интереса. Изображения этих образцов скважин затем захватили с помощью темного поля микроскопа (DFM) и проанализированы для измерения света, рассеянного от наночастиц, связанных с exosomes интерес захватили в каждом образце хорошо6,16,17. Примечательно, что визуализация всего образца также низким увеличением DFM (LMDFM) позволяет избежать смещения отбора, с которым сталкиваются большие увеличения DFM-анализа, когда пользователи должны непосредственно выбирать, какие поля захватить для последующего анализа изображения. LMMFM анализ изображений подлежит свет рассеяния артефакты от поверхностных нарушений, в том числе царапины и образец мусора, но этот фон может быть уменьшена с помощью простого шумоподавления алгоритм, который мы разработали для работы на анализ изображения низ программы, Имиджей (https://imagej.nih.gov/ij/). Этот алгоритм сначала применяет порог контура ввода, используемый для обнаружения границ образца и для определения области изображения для последующего анализа. Область, определяемая этой области контура, затем делится на отдельный сигнал, присутствующий в красных, синих и зеленых каналах изображения, а синий канал вычитается из красного канала для удаления сигнала, возникающего из поверхностных артефактов и неравномерного освещения из наноода Сигнал.
В этой статье описывается, как использовать этот анализ для быстрой количественной оценки либо полного, либо специфического уровня выделения экзосом в образцах плазмы или сыворотки.
протокол
1. Подготовка нанозондов
Примечание: Этот анализ использует функционализированных золото Нанорды (Аунс; 25 Нм диаметром х 71 Нм длина), которые ковалентно сопрягается с неутравидин полимеров (AV) и имеют поверхностный плазмон резонансный пик, который производит красный (641 Нм пик) рассеяния сигнала на DFM Освещение.
- Промывание 40 мкл Аунр-АВ (2,56 х 1011 частиц) три раза с 200 мкл PBS (pH 7,0) путем центрифугирования и аспирации (8 500 x g при температуре 4 °c в течение 10 минут), а затем окончательный центрифугирования и аспирационной ступени, после чего аунр-AV гранулы приостановлено в 40 мкл PBS.
- Смешайте эту Аунр-AV подвеску с 10 мкл биотиницилated антитела (0,5 мг/мл) специфическая для антигена на поверхности выделения экзосом подтипа интереса и 150 мкл PBS, а затем смешать при температуре 4 ° c для 2 ч с помощью миксера, чтобы неутравидин-биотин связывание достичь завершения.
- Вымойте полученную антитело-сопряжения антител (УНР-IgG) три раза путем центрифугирования и аспирации (6 500 x g при температуре 4 °c в течение 10 минут), а затем приостановить их в 200 мкл PBS и хранить их при температуре 4 °c до использования.
Примечание: стерильная техника и короткое время хранения должны быть использованы, чтобы избежать загрязнения и деградации аур-IgG. Лучше всего использовать антитело-сопряжение УНС в течение 24 часов после их сопряжения.
2. Подготовка слайдов для захвата EV
- Развести выбранный выделения экзосом захвата антител к 0,025 mg/mL в PBS и добавить 1 мкл/well этого разбавления на мульти-хорошо белка A/G слайд, а затем инкубировать этот слайд при 37 ° c для 1 ч в увлажненный камере, чтобы захват антитела связывания с белком A/G обездвижен на слайда.
- Аспирационной скважины для удаления несвязанных антител, и мыть скважины в три раза путем добавления и стремление 1 мкл/колодец PBS, затем загрузить каждый хорошо с 1 мкл блокирующего буфера (см. таблицу материалов) и инкубировать слайд для 2 ч при температуре 37 ° c в увлажненный камеры b блокировки оставшихся сайтов связывания белка.
- Аспирационной скважины для удаления блокирующего буфера, мыть колодцы три раза путем добавления и стремление 1 мкл/колодец PBS, и сразу же использовать заблокированные слайды для выделения экзосом захвата и анализа.
3. Стандартная подготовка кривой
- Чтобы точно определить абсолютное или относительное изобилие специфического подтипа выделения экзосом, пользователь должен создать стандартную кривую с чистым выделения экзосом населением, которое равномерно выражает выделения экзосом поверхностный биомаркер интереса. Это исследование анализирует обилие exosomes, выражающих метастазов связанных белка мембраны, эфрин А2 рецептор, который сообщил связь с раком поджелудочной железы стадии и прогноз6,18.
Примечание: человек поджелудочный рак клетка линия PANC-1 и свои exosomes знаны, что выражают этот протеин и изолированные exosomes от этой линии клетки были использованы для того чтобы произвести стандартную кривую для того чтобы квантифицировать число exosomes которые выражают этот протеин в сложном выделения экзосом Образцы. - Клетки культуры на 48 часов на 37 °C в сыворотке-свободно средствах культуры для того чтобы позволить выделения экзосом накоплению в средствах, тогда изолируют культуры клетки supernatants путем центрифугирования культур суспензии или сразу устремленности средств культуры от культур придерживающихся клетки.
- Центрифуга собранных средств массовой информации на 2000 x g в течение 30 минут, чтобы удалить мусор и восстановить supernatant.
- Фильтр уточнены супернатант культуры через 0,45 мкм с низким содержанием белка связывающей фильтр единицу соответствующей емкости (например, 250 ml полесерсулфоне вакуумной фильтрации единицы).
- Концентрат результирующего фильтрата путем центрифугирования на 3200 x g с использованием 100 000 номинального молекулярного ограничения веса системы фильтр 250 мкл окончательный объем. Соберите сохраненная громкость из этого фильтра, затем промойте фильтр 200 мкл PBS, и объединить этот объем стирки с собранной выделения экзосом объема выборки.
- Центрифуга этот образец на 21 000 x g в течение 45 минут и тщательно восстановить supernatant, заботясь, чтобы не собирать любой осажденного материала.
- Центрифуга восстановленный супернатант на 100 000 x g в течение 3 часов, чтобы осадить exosomes. Аспирин от супернатант и собирать выделения экзосом гранулы в 100 мкл PBS.
- Храните получившиеся выделения экзосом суспензии при температуре 4 °C при использовании в течение 24 часов или при температуре-80 ° c для длительного хранения.
Примечание: не подлежат выделения экзосом образцов повторять циклы замораживания-оттаивания. - Квантифицировать Алиготе подвески выделения экзосом после смешивания прямым измерением выделения экзосом чисел (например, анализом наночастиц или перестраиваемый резистивный импульсный зондирования или путем измерения концентрации белка выделения экзосом лиятов микро-бицин-ниминовой кислотный анализ, или эквивалентный метод, как средство приблизительное количество выделения экзосом)16,19.
- Создать набор серийных разведений выделения экзосом подвески, чтобы позволить сравнение сигнала наноматериалов для ввода выделения экзосом номер или содержание белка.
- Перенос 1 мкл каждого выделения экзосом стандарта на каждый из его реплицируют скважин на пластинке пробирки.
Примечание: стандартные кривые могут использоваться для расчета уклона линии корреляции между сигналом наносигналов и выделения экзосом концентрацией к (1) оценке эффективности анализа и (2) определению относительной концентрации целевых exosomes в экспериментальных образцах.
4. обработка образцов плазмы или сыворотки человека
- Соберите пробы плазмы или сыворотки стандартными методами и храньте на-80 °C до тех пор пока необходимо для выделения экзосом анализа. Быстро оттепель образцов в комнатной температуре водяной бане. Многократно смешиваем размороженные пробы по инверсии, чтобы продвинуть однородную подвеску.
Примечание: результаты от проб сыворотки и плазмы не могут быть эквивалентны, так как есть значительное высвобождение exosomes во время реакции свертывания крови. - Центрифуги плазмы или сыворотки пробы в 500 x g в течение 15 мин для осаждения белковых агрегатов и других частиц мусора. Перенесите Алиготе образца плазмы или сыворотки к свежей трубке и добавьте PBS для того чтобы произвести разбавление 1:1. Смешайте разбавленный образец нежной вихрей или инверсии, по мере необходимости. Передача 1 мкл каждой плазмы или сыворотки суспензии на каждый из своих реплик скважин на пробирке.
5. захват и обнаружение выделения экзосом
- Нагрузка скважин заблокирован EV захвата слайд с 1 мкл/well выделения экзосом образца, используя 8 реплицирует на образец, и инкубировать слайд ночь на 4 ° c в увлажненный камеры. Ассплете все скважины образца и затем добавьте 1 мкл/колодец PBS для мытья колодцев и удаления несвязанных exosomes и других загрязняющих веществ из загруженного образца выделения экзосом.
- Нагружайте скважины с 1 мкл/скважинами предварительно подготовленной IgG подвески (см. раздел 1 выше) и Инкубируйте слайд для 2 ч при температуре 37 °C в увлажненный камере. Аспирин раствор наномин и мыть слайд в PBS дополнить 0,01% между-20 (PMSK) для 10 мин с помощью смесителя, затем АСС, и мыть все образцы скважин с обожинизированной воды в течение 10 мин с помощью вращающегося смесителя, и воздушно-сухой для последующего изображения LMDFM.
Примечание: Межпробирные коэффициенты вариации (CV) оцениваются с восьми реплицирует одного и того же образца. Образцы, которые демонстрируют резюме > 20% считаются неинформативными и должны повторяться, если имеется достаточный образец.
6. DFM захват изображения
- Захват изображений для выделения экзосом квантификации при последовательном освещении с помощью цифровой камеры, прикрепленной к микроскопу оснащен темным полем конденсатора (1,2 < NA < 1,4) и 4X цель используя 1/220 s экспозиции времени.
- Откройте программное обеспечение захвата изображения.
Примечание: мы используем NIS-элементы программного обеспечения для изображений микроскопа (см. таблицу материалов) для протокола, описанного ниже, но можно использовать другое программное обеспечение, которое может соответствовать его параметрам захвата изображения. NIS-элементы просмотра изображений программное обеспечение представляет собой бесплатную автономную программу для просмотра изображений файлов и наборов данных, которые содержат анализ, Визуализация и архивирования инструментов. Приведенные ниже параметры также для микроскопа с автофокусом и автоматизированной стадии, которая позволяет несколько изображений, которые будут автоматически захвачены и сшиты в единое изображение. - Поместите слайд с ног на голову на стадии микроскопа, Отрегулируйте позицию слайда и нанесите небольшую каплю масла погружения на заднюю часть слайда, где конденсаторный объектив связывается с горкой.
- Нажмите кнопку Live в программный интерфейс, и регулировать время экспозиции против высокой стандарт концентрации хорошо, чтобы обеспечить изображение не насыщен.
- Откройте сканирование большое окно изображения с вкладка приобрести и установите параметры интерфейса программного обеспечения следующим образом: макро Image оптический конф = тока; Цель: 2:10x, сканирование оптический конф = текущий, Цель: 2:10x; Наложение сшивания = 20%; Сшивание через = оптимальный путь.
- Выберите Создание большого изображения, закройте активный затвор во время движения сцены, подождите перед каждым захватом: 20 мс, Сосредоточьтесь вручную при запускеи Используйте шаг за шагом фокус каждые 20 полей. Эти настройки будут сохранены с отсканированных изображений.
- Переместите стадию микроскопа, чтобы определить левый верхний правый нижний предел целевого поля сканирования. Отрегулируйте фокус для достижения четкого изображения на мониторе и регулировать настройки конденсатора и экологического освещения, как это необходимо, чтобы свести к минимуму любые нарушения освещения в сфокусирован изображения.
- Назовите файл выходного файла в программном обеспечении. Щелкните кнопку сканирования и позвольте микроскопу сканировать и создавать и сохранять сшитые изображения всего слайда.
- Откройте сохраненный образ с помощью программного обеспечения захвата изображения, которое вы используете, и сохраните его в масштабе 1/8 для последующего анализа на плагине DSM в имидже.
7. Анализ изображений DFM
- Скачать программу Iiiej (https://imagej.nih.gov/ij/). Установите плагин алгоритм DSM в IIIj, используя инструкции, перечисленные в https://imagej.net/Plugins#Installing_plugins_manually.
- Откройте программное обеспечение, затем установите следующие входные параметры в алгоритме DSM: контур контура (CT) = 253,020, тип = красный, шкала центра (ы) = 0,8, низкий (lt)/High (HT) количественный предел = 0/62.
- Откройте сохраненный снимок из раздела 6,8 с Имажей. Выберите кнопку DSM сканирования из вкладки плагинов , а затем определите количество столбцов и строк в соответствии с открытым изображением. Программа может распознавать зоны обнаружения и анализировать интенсивность рассеивания наноза в соответствии с зонами автоматически. Установите следующие входные параметры в окне DSM-сканирования : Размер процента = 25, точечный диаметр (в пикселях) = 190 – 200, диаметр диапазона = 32, диаметр приращения (в пикселях) = 8, Настройка DSM-низкая предел = 0, высокий предел = 62, прилегающая дистанция = 100, вычитание смещения = 0.
Примечание: результаты рассеивания интенсивности нанораспыляют, отражают количество связанного exosomes на слайде.
Результаты
Multi-well протеин A/G покрыл скольжения (Диаграмма 1A) было функционализировано с антителом Anti-EphA2 и после этого использовано специфически для того чтобы захватить EphA2-положительное exosomes от образцов сыворотки пациентов с и без поджелудочного рака (1 мкл/наилучшим образом) и инкубировано с золотыми наносами, сопрягается с антителом Anti-CD9 (Рисунок 1B). DFM-изображения света, рассеянного от этих наночастиц были проанализированы с использованием плагина DSM в Iifiej программного обеспечения для количественной оценки связанного Эф-2 положительный exosomes в каждом хорошо. Алгоритм DSM автоматически определяет границу образца, отфильтровывает шум от артефактов, вычисляет рассеянный сигнал от каждого колодца и выводит эту информацию (рис. 2). Алгоритм DSM сильно ослабляет артефакты рассеяния света от царапин или мусора, присутствующих в образце и улучшает чувствительность и воспроизводимость наночастиц обнаружения и может автоматически обрабатывать партию слайдов изображений для высокой пропускной способностью Использовать. Этот алгоритм использует команды и параметры, вводимые пользователем, для вычитания фона изображения, расчета сигнала рассеяния от каждого колодца и вывода файла данных и изображений (Рисунок 3). Регионы, представляющие интерес, определяются высокой интенсивностью, а также границами в изображении захвата с использованием контура порога программы маидж макрос. Анализ изображений использует предопределенный порог контура и параметры изображения для вычисления интенсивности рассеяния наноматериалов для каждого колодца.
Как сообщалось в нашей предыдущей работы (дополнительная информация Лян et al.6), exosomes изолированы от Panc-1 клеточных культур, характеризующихся просвечивающей электронной микроскопии и Вестерн-блот выставлены размер диапазона, морфология, и белка маркер выражение согласуется с образцом высокой чистоты выделения экзосом. Exosomes PANC-1, подготовленный с той же процедурой, что и наша предыдущая работа, были использованы здесь для подтверждения нашего nPES анализа для выделения экзосом количественной оценки. Этот анализ использовал антитело anti-EphA2 для того чтобы захватить большую населенность exosomes от полного выделения экзосом населенности и антитела против вообще выделения экзосом протеина CD9 для того чтобы обнаружить захваченное exosomes. Результаты, полученные с использованием серийно разбавленных проб PANC-1 выделения экзосом, с концентрацией белка в диапазоне от 0,24 до 1,2 мкг/мкл, показали хорошую воспроизводимость в реплицирующихся скважинах (рис. 4A) и сильную линейную корреляцию между реакцией рассеивания и выделения экзосом концентрация белка (рис. 4B).
Для того чтобы продемонстрировать потенциальное применение этого метода, пробы сыворотки от пациентов с и без поджелудочного рака были проанализированы для того чтобы обнаружить обилие сыворотки exosomes выражая рак-связанный биомаркер EphA2, использующ антитело anti-EphA2 к сразу захват цели exosomes от сыворотки и наночастиц сопрягано с антителом Anti-CD9 для того чтобы обнаружить прыгнутого exosomes. Этот анализ показал что пробы сыворотки от поджелудочных больных рака имели значительно более высокие уровни EphA2 + exosomes (Диаграмма 5) чем их управления.
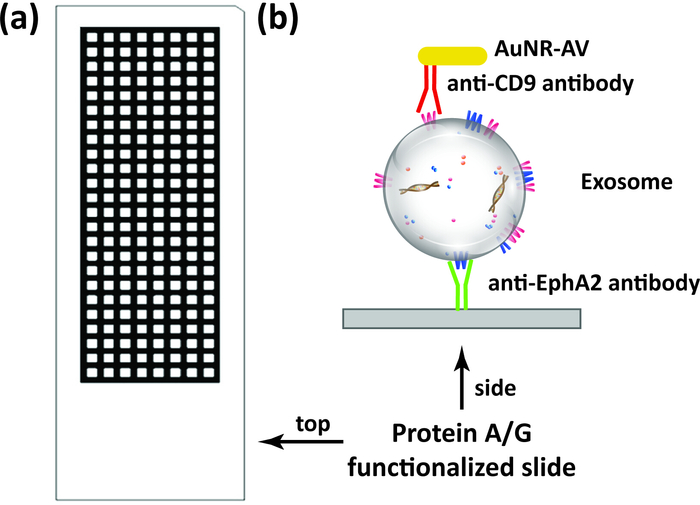
Диаграмма 1: схема выделения экзосом количественной оценки. A) схема с несколькими скважинами белка A/G слайды (192 скважин), используемых в этом анализа. (B) Целевая exosomes непосредственно захватили из образцов, в том числе сыворотки и плазмы, по поверхности иммобилизации на антитела захвата (например, анти-EphA2 антитела) связаны с слайда, а затем инкубировали с золотыми наносами сопрягается с обнаружением Антитело (например антитела anti-CD9) перед анализом анализом изображения DFM. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
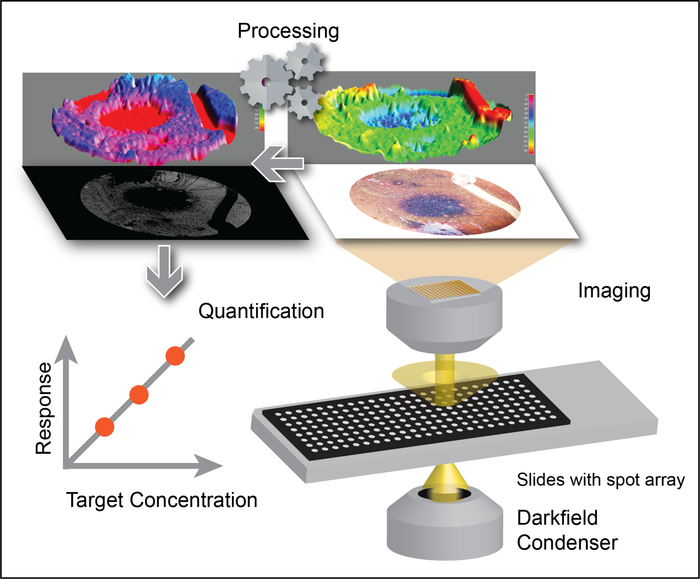
Рисунок 2: выделения экзосом квантификация путем применения АЛГОРИТМА DSM к изображениям LMDFM. Изображения с низким увеличением обрабатываются алгоритмом DSM для устранения артефактов фоновых сигналов и сигналов, которые могут возникать из-за царапин, смешивания пустот, мусора и неравномерного освещения образцов, что позволяет обеспечить надежное обнаружение сигнала золотого наноода, который коррелирует с выделения экзосом концентрацией. Эта цифра была адаптирована с разрешения ВС, D. et al. метод снижения шума для количественной Нанораспыленной рассеяния света в низком увеличении темно-полевой Микроскоп FAR-Field изображения. Аналитическая химия. 88 (24), 12001-12005 (2016). Авторское право (2016) Американское химическое общество. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
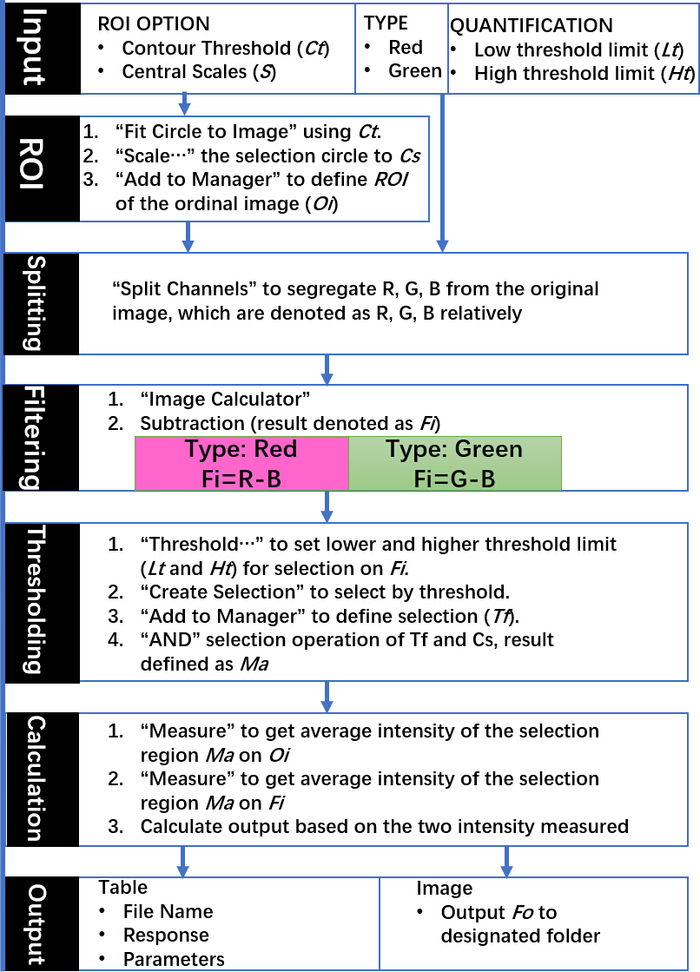
Рисунок 3: схема команд DSM-алгоритмов и выходов. Указанные шаги использовать родные команды из Iiiej и все входные параметры выбираются в соответствии с требованиями экспериментов с помощью графического пользовательского интерфейса. Эта цифра была адаптирована с разрешения ВС, D. et al. метод снижения шума для количественной Нанораспыленной рассеяния света в низком увеличении темно-полевой Микроскоп FAR-Field изображения. Аналитическая химия. 88 (24), 12001-12005 (2016). Авторское право (2016) Американское химическое общество. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
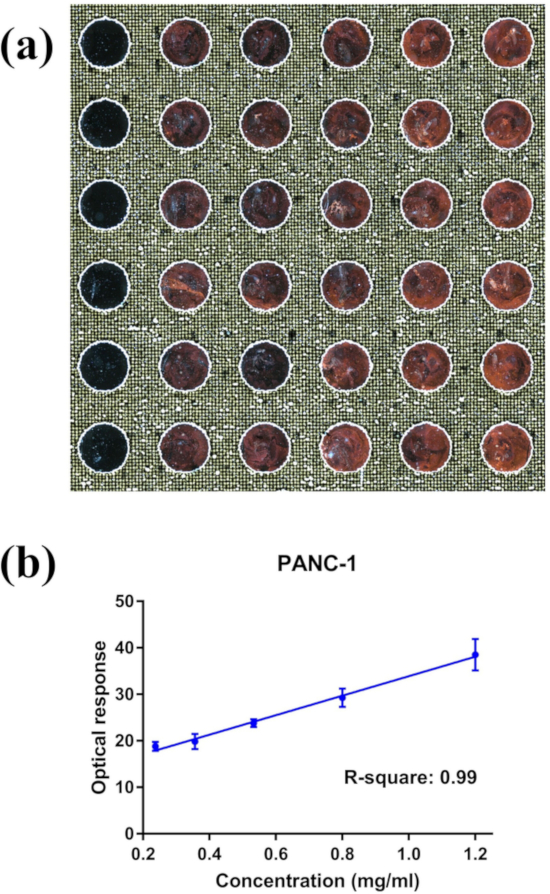
Рисунок 4: репрезентативные изображения nPES LMDFM и данные о выходе DSM. (A) изображение lmmfm-анализа NPES анализа градиента концентрации Panc-1 exosomes и (B) линейной корреляции оптического сигнала и выделения экзосом концентрации от этого слайда (слева направо: 0,24, 0,356, 0,53, 0,80, 1,20 мкг/мкл соответственно для каждой колонки). Данные представляются как среднее ± SE, n = 6, с коэффициентом корреляции Пирсона R2 = 0,99 и коэффициент вариации для реплицирует каждой концентрации < 0,2. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
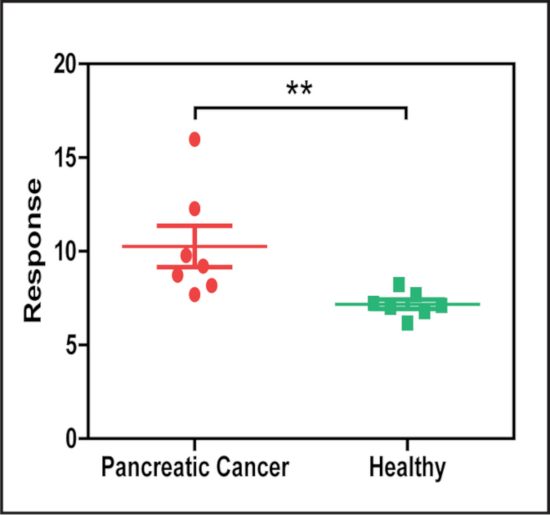
Рисунок 5: сигнал LMDFM EphA2+ exosomes отличается в сыворотке крови от пациентов с раком поджелудочной железы и без него. Пробы сыворотки проанализированные nPES использующ антитело anti-EphA2 захват (рак-Associated) и антитело anti-CD9 обнаружения (генералитет выделения экзосом маркер) показал существенную разницу в концентрации EphA2 + exosomes в образцах сыворотки пациентов с и без рака поджелудочной железы (N = 7/Группа). Результаты представлены как среднее ± SE. * *p = 0,002 Манн-Уитни U-Test (двусторонняя). Эта цифра была изменена с [ВС, D. et al. шумоподавления метод для количественного Нанораспыляющая рассеяние света в низком увеличении темно-полевой Микроскоп далеко-полевые изображения. Аналитическая химия. 88 (24), 12001-12005 (2016)]. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
Обсуждение
Exosomes возникают из-за регулируемых инвагивания внешней эндосомы мембраны, которые производят мультивезикулярные тела, специализированное подмножество эндосомов, которые содержат большое количество внутрилунальных пузырьков, которые проходят слияние с плазматической мембраной, чтобы выпустить Зрелые exosomes в внеклеточное пространство. Из-за этого пути биогенеза, exosomes может нести мембранные связанные факторы, связанные с мембранными фракциями, которые состоят или сливаются с эндозомой мембраной, а также несколько различных типов цитозолольных компонентов, и таким образом содержат грузы белков, ДНК и различные подтипы РНК (mRNAs, микроРНК, длинные Некодирующие RNAs), которые могут отражать фенотипа их ячейки происхождения20. В виду того что exosomes секретируются большинством если не всеми типами клетки, могут показать увеличрованную секретирование от больных или злокачественных клеток, и аккумулировать в большинств жидкостях тела, exosomes будут предметом всестороннего и систематического исследования как перспективнейший минимально инвазивные средства для выявления специфических условий заболевания и мониторинга их реакции на лечение21.
Выделения экзосом изоляция, которая необходима для большинств в настоящее время анализов выделения экзосом, Длинномерная и трудн-интенсивная процедура, ограничивая клинический перевод выделения экзосом-связанных биомаркеров с потенциальной медицинской релевантностью. Многие распространенные методы изоляции (ультрагастрифугация, размер-исключение, осадки и т.д.) часто недостаточно различают exosomes (30 – 100 Нм) от микро-пузырьков (100 – 1000 Нм) и апоптотических тел (100 – 5000 нм) из-за дублирования в их размерах или физические свойства или могут повредить выделения экзосом целостность15. Новые подходы находятся в стадии разработки, которые могут позволить более быстрого выделения экзосом анализа, но это не ясно, насколько это возможно для реализации многих из этих платформ в клинических условиях из-за.
В этом отчете мы представляем новый подход, который позволяет выделения экзосом квантификации на основе наностатей с использованием низких увеличенное изображение темного поля микроскопа. Этот метод не требует выделения экзосом очистки, дорогостоящего специального оборудования или новых технических знаний и, таким образом, должен поддаваться быстрому переводу в большинстве исследований и клинических условиях. Наш анализ может быть применен для точного количественного измерения концентрации целевого выделения экзосом населения подшипника конкретного биомаркера, когда результаты анализа сравниваются со стандартной кривой, так как наши результаты выставки есть сильная линейная корреляция (R2 = 0,99) между оптической реакцией и выделения экзосом концентрацией. Чтобы продемонстрировать реальный мировой потенциал этого подхода, мы предоставили данные, где мы использовали этот метод для количественной оценки концентрации выделения экзосом, связанного с раком поджелудочной железы в образцах сыворотки, полученных от пациентов с и без раком поджелудочной железы.
В LMMFM, весь образец хорошо отображаемого, чтобы избежать смещения отбора, найденных в высоком увеличении DFM-анализа, где пользователи должны непосредственно выбрать образец полей для захвата для последующего анализа изображения, но подлежит свету рассеяния артефакты с поверхности нарушения, включая царапины и образец мусора. Этот фон может быть сокращен до обнаружения целевого выделения экзосом-полученного сигнала с помощью нашего DSM шумоподавления алгоритм, который работает на анализ изображения низ программы, Iiieej, но следует по-прежнему следует принимать во избежание введения таких артефактов, которые могут уменьшить динамический диапазон анализа.
Материалы, используемые в этом анализа:
Многотонные Сверхпротеиновые слайды A/G, удерживаные 1 мкл/колодец, были приобретены у корпорации Arrayit (AGMSM192BC). Наночастицы были получены из наночастиц (C12-25 -650-TN-DIH-50-1, 6,4 x 1012/мл). DFM-изображения были захвачены с цифровой камерой Nikon DiR2, прикрепленной к микроскопу Nikon Ti-Eclipse, с последовательным освещением и временем экспозиции 1/220 s. Клеточная линия PANC-1, используемая в данном исследовании, была приобретена у американской коллекции культурного типа.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была в первую очередь поддерживается финансирования исследований, предоставляемых низ (U01CA214254, R01HD090927, R01AI122932, R01AI113725 и R21Al126361-01), Аризона биомедицинских исследований Комиссии (ABRC) молодой следователь награду.
Материалы
| Name | Company | Catalog Number | Comments |
| Eppendorf Repeater stream | Fisher Scientific | 05-401-040 | |
| Eppendorf Research plus | Eppendorf | 3120000011 | 0.1 – 2.5 µL, dark gray |
| Functionalized Gold Nanorods | Nanopartz | C12-25-650-TN-DIH-50-1 | In vitro neutravidin polymer functionalization |
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | |
| Incu-shaker 10L | Benchmark Scientific | H1010 | |
| Inverted Research Microscope | Nikon | Ti-DH | With Dark field condenser, DS-Ri2 camera, and Ti-SH-U universal holder, and motorized stage |
| NIS-Elements | Nikon | Microscope imaging software | |
| Phosphate Buffered Saline (1X) | GE Healthcare Life Sciences | SH30256.02 | HyClone |
| Protein A/G Treated Glass Substrate Slides | Arrayit Corp. | AGMSM192BC | Premium microarray substrate |
| Q500 Sonicator | Qsonica, LLC | Q500-110 | With standard probe (#4220) |
| Superblock blocking buffer | Thermo Scientific | ||
| TWEEN 20 | Sigma Life Sciences | 9005-64-5 |
Ссылки
- Andaloussi S, E. L., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Choi, D. S., Kim, D. K., Kim, Y. K., Gho, Y. S. Proteomics, transcriptomics and lipidomics of exosomes and ectosomes. Proteomics. 13 (10-11), 1554-1571 (2013).
- Schorey, J. S., Cheng, Y., Singh, P. P., Smith, V. L. Exosomes and other extracellular vesicles in host-pathogen interactions. EMBO Reports. 16 (1), 24-43 (2015).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Zaborowski, M. P., Balaj, L., Breakefield, X. O., Lai, C. P. Extracellular Vesicles: Composition, Biological Relevance, and Methods of Study. Bioscience. 65 (8), 783-797 (2015).
- Liang, K., et al. Nanoplasmonic Quantification of Tumor-derived Extracellular Vesicles in Plasma Microsamples for Diagnosis and Treatment Monitoring. Nature Biomedical Engineering. 1, (2017).
- Severino, V., et al. Extracellular Vesicles in Bile as Markers of Malignant Biliary Stenoses. Gastroenterology. 153 (2), 495-504 (2017).
- Osteikoetxea, X., et al. Detection and proteomic characterization of extracellular vesicles in human pancreatic juice. Biochemical and Biophysical Research Communications. 499 (1), 37-43 (2018).
- Bulacio, R. P., Nosetto, E. C., Brandoni, A., Torres, A. M. Novel finding of caveolin-2 in apical membranes of proximal tubule and first detection of caveolin-2 in urine: A promising biomarker of renal disease. Journal of Cellular Biochemistry. , (2018).
- Nair, S., Tang, K. D., Kenny, L., Punyadeera, C. Salivary exosomes as potential biomarkers in cancer. Oral Oncology. 84, 31-40 (2018).
- Kim, J. E., et al. Diagnostic value of microRNAs derived from exosomes in bronchoalveolar lavage fluid of early-stage lung adenocarcinoma: A pilot study. Thoracic Cancer. 9 (8), 911-915 (2018).
- Boussadia, Z., et al. Acidic microenvironment plays a key role in human melanoma progression through a sustained exosome mediated transfer of clinically relevant metastatic molecules. Journal of Experimental & Clinical Cancer Research. 37 (1), 245 (2018).
- An, M., Wu, J., Zhu, J., Lubman, D. M. Comparison of an Optimized Ultracentrifugation Method versus Size-Exclusion Chromatography for Isolation of Exosomes from Human Serum. Journal of Proteome Research. , (2018).
- Brenner, A. W., Su, G. H., Momen-Heravi, F. Isolation of Extracellular Vesicles for Cancer Diagnosis and Functional Studies. Methods in Molecular Biology. 1882, 229-237 (2019).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in Exosome Isolation Techniques. Theranostics. 7 (3), 789-804 (2017).
- Sun, D., et al. Noise Reduction Method for Quantifying Nanoparticle Light Scattering in Low Magnification Dark-Field Microscope Far-Field Images. Analytical Chemistry. 88 (24), 12001-12005 (2016).
- Sun, D., Hu, T. Y. A low cost mobile phone dark-field microscope for nanoparticle-based quantitative studies. Biosensors and Bioelectronics. 99, 513-518 (2018).
- Koshikawa, N., Minegishi, T., Kiyokawa, H., Seiki, M. Specific detection of soluble EphA2 fragments in blood as a new biomarker for pancreatic cancer. Cell Death & Disease. 8 (10), e3134 (2017).
- Clayton, A., Turkes, A., Navabi, H., Mason, M. D., Tabi, Z. Induction of heat shock proteins in B-cell exosomes. Journal of Cell Science. 118 (Pt 16), 3631-3638 (2005).
- Henne, W. M., Buchkovich, N. J., Emr, S. D. The ESCRT pathway. Developmental Cell. 21 (1), 77-91 (2011).
- Panagiotara, A., Markou, A., Lianidou, E. S., Patrinos, G. P., Katsila, T. Exosomes: a cancer theranostics road map. Public Health Genomics. 20 (2), 116-125 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены