Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Межфамальные молекулярные структуры полимеров и биомакромолекул, выявленные с помощью вибрационной спектроскопии генерации Sum
В этой статье
Резюме
Будучи всесторонне используется, сумма частоты генерации (SFG) вибрационная спектроскопия может помочь выявить цепной конформационного порядка и вторичных структурных изменений, происходящих на полимерных и биомакромолекулы интерфейсов.
Аннотация
В качестве нелинейной оптической спектроскопии второго порядка вибрационная спектроскопия генерации сумм (SFG) широко используется при исследовании различных поверхностей и интерфейсов. Этот неинвазивный оптический метод может обеспечить информацию местного молекулярного уровня с монослойной или субмонослойной чувствительностью. Здесь мы предоставляем экспериментальную методологию о том, как выборочно обнаружить похоронен интерфейс для макромолекулы и биомакромолекулы. Имея это в виду, межфамные вторичные структуры шелкового фиброина и водных структур вокруг модели короткоцепочечного олигонуклеотида дуплекс обсуждаются. Первый показывает цепной цепи перекрытия или пространственного заключения эффект, а второй показывает функцию защиты от Ионов Ca2 "в результате хиральной надстройки позвоночника воды.
Введение
Развитие генерации суммачастот (SFG) вибрационная спектроскопия может быть датировано работой, проделанной Shen et al. тридцать лет назад1,2. Уникальность межфалальной селективности и субмонослой чувствительности делает SFG колебателиальной спектроскопией, оцененной большим числом исследователей в области физики, химии, биологии и материаловедения, и т.д.3,4 ,5. В настоящее время с помощью SFG исследуется широкий круг научных вопросов, связанных с поверхностями и интерфейсами, особенно для сложных интерфейсов в отношении полимеров и биомакромолекул, таких как цепные структуры и структурное расслабление похоронен полимерных интерфейсов, белковых вторичных структур, и межлицевых водных структур9,10,11,12,13,14, 15,16,17,18,19,20,21,22,23, 24,25,26.
Для полимерных поверхностей и интерфейсов образцы тонкопленочных, как правило, готовятся путем спин-покрытия для получения нужных поверхностей или интерфейсов. Проблема возникает из-за сигнальных помех от двух интерфейсов как подготовленных пленок, что приводит к неудобствам для анализа собранных спектров SFG27,28,29. В большинстве случаев желательно использовать вибрационный сигнал только с одного интерфейса, пленки/субстрата или пленки/другой среды. На самом деле, решение этой проблемы довольно просто, а именно, экспериментально максимизировать световые поля на желательном интерфейсе и свести к минимуму световые поля на другом интерфейсе. Таким образом, коэффициенты Френеля или локальные коэффициенты поля должны быть рассчитаны с помощью тонкой модели пленки и должны быть проверены в отношении экспериментальных результатов3,9,10,11, 12,13,14,15,30.
С учетом вышеуказанного фона можно было бы исследовать некоторые полимерные и биологические интерфейсы, чтобы понять фундаментальную науку с молекулярного уровня. В следующем, принимая три межлицевых вопросов в качестве примеров: зондирование поли (2-гидроксиэтил метакрилат) (PHEMA) поверхности и похоронили интерфейс с субстратом9, образование шелкового фиброина (SF) вторичных структур на поверхности полистирола (PS) и водные структуры, окружающие модель короткоцепочечного олигонуклеотидного дуплекса16,21, мы покажем, как SFG вибрационная спектроскопия помогает выявить междефицитные молекулярного уровня структур в связи с основной наукой.
протокол
1. SFG экспериментальный
- Используйте коммерческую систему picosecond SFG(Таблица материалов), которая обеспечивает фундаментальный пучок 1064 нм с шириной импульса 20 с и частотой 50 Гц, на основе лазера Nd:YAG.
- Преобразуйте фундаментальный пучок 1064 нм в пучок 532 нм и 355 нм с помощью второго и третьего гармонических модулей. Непосредственно направлять 532 нм пучка в качестве входного луча света и генерировать другие входные середине инфракрасного (ИК) луч, охватывающий диапазон частот от 1000 до 4000 см-1 через оптический параметрической генерации (OPG)/оптический параметрическое усиление (OPA)/ процесс генерации частоты (DFG).
- Установите углы инцидента двух входных лучей на 53 "(IR) и 64 " (видимый), соответственно, по сравнению с поверхностью нормальной.
- Для обнаружения полимерных межфамальных структур (либо пленочную/субстратную интерфейс, либо пленочный/другой средний интерфейс) используйте ssp (s-поляризованный сумма-частотный луч, s-поляризованный видимый луч и p-поляризованный инфракрасный луч) и комбинации поляризации ppp.
- Для обнаружения межлицевных белковых вторичных структур и водных структур, окружающих ДНК, помимо ssp и ppp, были использованы комбинации хиральных шппов и psp поляризации.
- Чтобы убедиться, что образцы не были повреждены, контролируйте инфракрасные и видимые импульсные энергии, которые будут 70 и 30 мДж соответственно. Схема процесса SFG с диаграммой уровня энергии была показана на рисунке 1. На рисунке 2 показана система SFG в нашей чистой комнате.
2. Коэффициенты Френеля
- Используйте правоугольные призмы в качестве субстратов для всех экспериментов, обсуждаемых здесь. Существуют два интерфейса для полимерной пленки на твердом субстрате, т.е. полимерная поверхность в воздухе и полимерный/субстратный интерфейс. Оба могут генерировать сигналы SFG, так как инверсионная симметрия нарушается на обоих интерфейсах. Таким образом, собранный спектр SFG является вмешаться. Тем не менее, локальные коэффициенты поля или коэффициенты Френеля на двух интерфейсах могут быть регулируемыми, изменяя либо углы инцидента, либо толщину пленки по одному или одновременно31,32. Это дает нам возможность зондировать вибрационный сигнал SFG только из одного интерфейса. Здесь, pHEMA фильм на призму CaF2 был взят в качестве примера9.
- Как показано на рисунке 3, использовать прямоугольный призмы геометрии для обнаружения сигналов SFG, генерируемых из нижней пленки PHEMA. Интенсивность вывода SFG в отраженном режиме выражается как
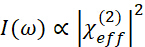 (1)
(1)
где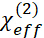 обозначает эффективный нелинейный тензор предостережения второго порядка.
обозначает эффективный нелинейный тензор предостережения второго порядка.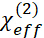 состоит из трех частей, а именно: интерфейса призмы/полимера, интерфейса полимерно-нижней среды (нижняя среда включает газ, жидкость или твердый.) и нерезонансный фон, как показано в следующем уравнении.
состоит из трех частей, а именно: интерфейса призмы/полимера, интерфейса полимерно-нижней среды (нижняя среда включает газ, жидкость или твердый.) и нерезонансный фон, как показано в следующем уравнении.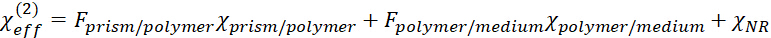 (2)
(2)
Здесь нижняя среда может быть воздух, вода или что-то еще. F представляет соответствующий коэффициент Френеля, ответственный за коррекцию локального поля. - Применяйте тонкую модель для расчета коэффициентов Френеля в этом случае. Здесь представлены только краткие процедуры расчета.
- Для интерфейса призмы/полимера используйте
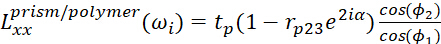 (3)
(3)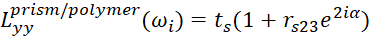 (4)
(4)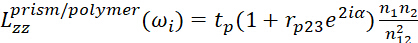 (5)
(5)
Значение каждого показанного параметра представлено ниже.- я обозначает частоту луча.
-
tp и ts обозначают общие коэффициенты передачи и могут быть выражены как
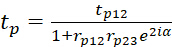 (6)
(6)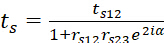 (7)
(7) - tp12 и ts12 обозначают линейные коэффициенты передачи луча света на интерфейсе призмы/полимера.
- rp23 и rs23 обозначают линейные коэффициенты отражения светового луча в полимерном/среднем интерфейсе.
-
представляет собой фазовую разницу между отражающим лучом и его вторичным отражающим лучом после того, как он распространяется по полимерной тонкой пленке, а затем отражается назад, что может быть выражено как
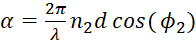 (8)
(8) - - длина волны луча света, а d - толщина полимерной пленки.
- No1 и No2 представляют углы инцидента на интерфейсе призмы/полимера и полимерно-среднем интерфейсе соответственно.
- n1 и n2 представляют собой рефракционные показатели призмы и полимерной пленки соответственно.
- n12 представляет рефракционные индексы полимерных межфамальных слоев для призмы/полимера.
- Для полимерного/среднего интерфейса используйте
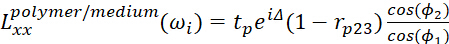 (9)
(9)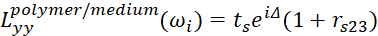 (10)
(10)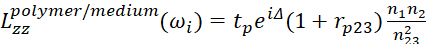 (11)
(11)- Представляет собой фазовое различие легких электрических полей на двух интерфейсах.
- Поскольку ширина импульса для наших входных балок составляет 20 с. Ошибка задержки времени, связанная с эффектом дисперсии, может быть проигнорирована.
- Выражение такой фазовой разницы для вывода SFG, видимый вход и вхотворные инфракрасные лучи могут быть написаны отдельно как
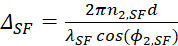 (12)
(12)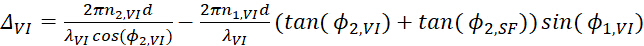 (13)
(13)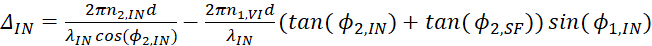 (14)
(14)
- Для интерфейса призмы/полимера используйте
- Из вышеупомянутого обсуждения, для призмо-полимерной пленки-средней (1-2-3) системы, выразить общий френеля коэффициенты для призмы / полимерных и полимерных / средних интерфейсов, как следующие уравнения, для ssp и PPP поляризации комбинаций . Конечно, оба интерфейса считаются азимутхолли изотропными.
- Для интерфейса призмы/полимера выражения общего коэффициента Френеля для комбинаций поляризации ssp и ppp представлены следующим образом.
- Для ssp, уравнение
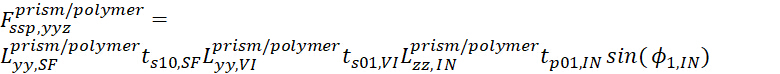 (15)
(15) - И для ppp, уравнение
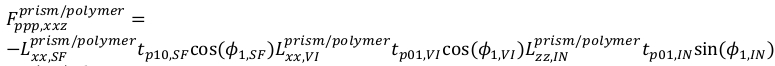 (16)
(16)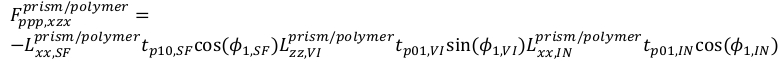 (17)
(17)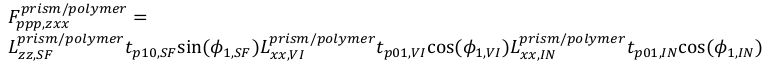 (18)
(18)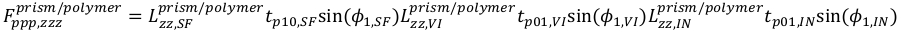 (19)
(19)
- t 10 и t01 обозначают линейные коэффициенты передачи на воздушных/призовых и призовых/воздушных интерфейсах соответственно.
- Для ssp, уравнение
- Для полимерно-среднего интерфейса выражения общих коэффициентов Френеля для комбинаций поляризации ssp и ppp описываются следующим образом.
- Для ssp, уравнение
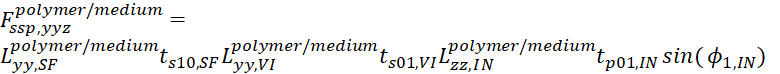 (20)
(20) - Для ppp,уравнения
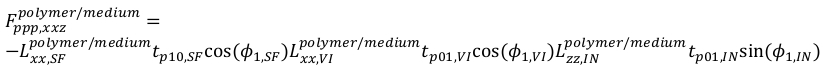 (21)
(21)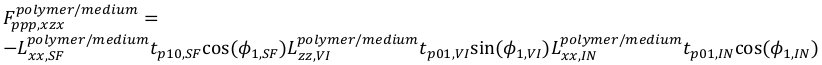 (22)
(22)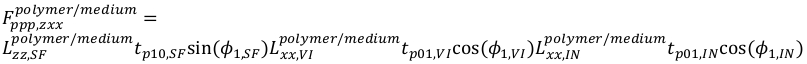 (23)
(23)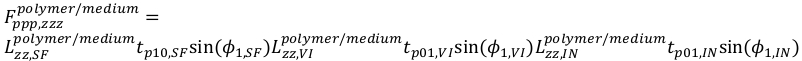 (24)
(24)
- Для ssp, уравнение
- Для интерфейса призмы/полимера выражения общего коэффициента Френеля для комбинаций поляризации ssp и ppp представлены следующим образом.
- После расчета коэффициентов Френеля с помощью зажатой модели, потяните их как функцию толщины пленки, как показано на рисунке 4.
ПРИМЕЧАНИЕ: В этом случае существует диапазон толщины для сбора сигнала SFG от интерфейса CaF2 prism/PHEMA с пренебрежительным вкладом другого интерфейса, который составляет около 150 нм. Аналогичным образом, подходящая толщина может быть выбрана для обнаружения интерфейса PHEMA/bottom medium с пренебрежительным вкладом интерфейса CaF2 prism/PHEMA.
3. Cхирал SFG поляризация комбинации
- Для нормального ахирального интерфейса, обычно, используйте симметрию Cqv с точки зрения среднего ансамбля33,34. При работе инверсионной симметрии можно вывести ненулевые компоненты нелинейной восприимчивости, которые являются cxxz,cxzx,czxx,cyyz,cyzy,czyy и czz существующие термины могут быть дополнительно сокращены, если предполагается изотропный интерфейс, что означает, что x и y одинаковы). Однако, для хирального интерфейса, ситуация будет иной. Хиральный интерфейс обладает симметрией СЗ, допускается только операция симметрии вращения. В этом случае, помимо обычных ахиральных терминов, более нелинейных susceptibilities второго порядка будет ненулевой, который можно назвать хиральными терминами, а именно, czyx,czxy и cyzx при рассмотрении неэлектронных Резонанс. Таким образом, с помощью PSP, pps и spp поляризации комбинаций, хиральные спектры SFG могут быть собраны33,34.
4. Подготовка образцов
- Подготовка пленки PHEMA
- Растворите порошок PHEMA (см. ТаблицуМатериалов) в ангидрусном этаноле, чтобы подготовить раствор с 2 вт% и 4 вт% соответственно.
- Перед осаждением пленок PHEMA сначала замочите призмы правого угла CaF2 в толуевом растворителе, а затем промойте их этанолом и ультрачистой водой (18,2 МЗсм).
- После этого, подвергать субстраты (CaF2 правоугольные призмы) в кислородной плазмы для удаления возможных органических загрязнительов плазменного очистителя (см. Таблица материалов).
- Сначала включите плазменный очиститель и положите в него субстраты.
- Затем включите вакуумный насос, чтобы пылесосить очиститель. Ввеки кислород в него.
- Наконец установить 4 минуты для очистки. После этого сохраните чистые субстраты для последовательной подготовки пленки PHEMA.
- Затем подготовьте pHEMA фильмы на CaF2 призмы спин-пальто (см. Таблица материалов). Отрегулируйте толщину пленки с помощью концентрации раствора и скорости вращения.
- Обездвижить призму CaF2 на сосание диска спин-пальто.
- Бросьте одну каплю раствора PHEMA, подготовленного ранее, на чистые субстраты при 1500 об/мин в течение 1 мин (толщина пленки 2 Вт% на 100 Нм и 4 вт% за 200 Нм).
- Аннал все подготовленные пленки PHEMA в вакуумной печи при температуре 80 градусов по Цельсию в течение ночи.
- Приготовление шелкового фиброина (SF)
ПРИМЕЧАНИЕ: Был принят протокол, предложенный Капланом и др.35.- Поместите 7,5 г шелковых коконов B. mori в кипящий карбонат натрия (Na2CO3,0.02 M) водиный раствор (3 л) на 30 мин. Удалите волокнистый SF в чистый контейнер.
- Вымойте полученные волокнистого SF с деионизированной водой в течение трех раз под перемешивание, чтобы удалить молекулы серицина и оставить только молекулы SF в волокнистого образца.
- Высушите волокнистого образца SF в вакуумной печи при температуре 60 градусов по Цельсию в течение ночи.
- После этого растворите дегмированный волокнистый образец SF в литий-бромистом (LiBr, 9.3 M) вакуционный раствор (1 г SF был решен в 4 мл раствора LiBr.) и инкубировать его при 60 градусах по Цельсию в течение 2 ч под перемешиванием.
- Диализ решение SF против деионизированной воды (3500 da диализ мешки) в течение 3 дней, чтобы удалить растворенный LiBr. Изменение новой деионизированной воды три раза в день. Наконец, храните обработанный раствор SF при 4-C для последующих экспериментов SFG.
- Приготовление короткоцепочечного олигонуклеотидного дуплекса
- Закажите одноцепочечный образец олигонуклеотида с его 3'конечным модифицированным холестерином-триэтиленгликоль (Chol-TEG) (5'-GCTCCGAAGGTCGA-3') от коммерческой корпорации (см. Таблицаматериалов), а также дополнительный. Для каждой отдельной нити растворите 10 нмоль пробного порошка в 0,5 мл ультрачистой воды. Затем смешайте их вместе, чтобы сформировать дуплексный олигонуклеотидный раствор (10 нмоль/мл).
- Смешайте 2 мг 1,2-Dipalmitoyl-sn-glycero-3-фосфохолин (DPPC) и 2 мг деuterated DPPC (d-DPPC) и растворите их в 1 мл хлороформа для подготовки липидного раствора.
- Приготовление монослойного истребителя DPPC и d-DPPC корытом Лангмуира-Блоджетта (LB)
- Прикрепите правую призму CaF2 к самодельному держателю образца с одной призмией лицо перпендикулярно окунутым в водную среду корыта LB.
- После этого вводят смешанный липидный раствор, приготовленный ранее, на поверхность воды дотех пор, пока давление поверхности не достигнет определенного значения ниже 34 мн.м.
- После выключения поверхностного давления используйте два тефлоновых барьера для сжатия липидного монослойа в соотношении 5 мм/мин до достижения поверхностного давления в 34 мн.м.
- Поднимите призму с липидным монослой из воды со скоростью 1 мм/мин вертикально.
- Подготовка другого липидного монослойного
- Для облегчения сборки дуплексного олигонуклеотида и липидных молекул через гидрофобное взаимодействие (холестерин и липидная алкиловая цепь) смешайте дуплексный олигонуклеотидный раствор с липидным раствором в молярном соотношении 1:100 (олигонуклеотид к лип).
- Введите смешанный липидный и дуплексный олигонуклеотидный раствор на поверхность воды в самодельном тефлоновой таре до достижения поверхностного давления в 34 мН-м1.
- Наконец, поместите липидный монослой в нижней части призмы в контакте с липидным монослой с вставленными дуплексными олигонуклеотидами на поверхности воды, чтобы сформировать окончательный образец для измерения SFG.
- Уравнение Лоренца
- Используйте уравнение Lorentz, чтобы соответствовать спектрам SFG, чтобы извлечь колебательную информацию для определенного колебательного режима.
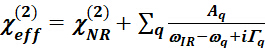 (25)
(25)
где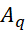 представляет собой интенсивность вибрационного режима
представляет собой интенсивность вибрационного режима 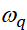 qth, представляет
qth, представляет 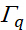 резонансную частоту, обозначает половину ширины на половину максимума (HWHM) и
резонансную частоту, обозначает половину ширины на половину максимума (HWHM) и 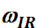 представляет частоту сканирования иК-луча инцидента.
представляет частоту сканирования иК-луча инцидента.
- Используйте уравнение Lorentz, чтобы соответствовать спектрам SFG, чтобы извлечь колебательную информацию для определенного колебательного режима.
Результаты
В части коэффициента Френеля В секции Протокола мы показали, что теоретически можно выборочно обнаружить только один интерфейс одновременно. Здесь, экспериментально, мы подтвердили, что эта методология в основном правильно, как показано на рисунке 5 и рисунк...
Обсуждение
Для изучения структурной информации с молекулярного уровня, SFG имеет свои преимущества (т.е. монослойную или субмонослойную чувствительность и межфалую селективность), которые могут быть применены для изучения различных интерфейсов, таких как твердые/твердые, твердые/ жидкостные, твер...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Это исследование было поддержано Государственной программой развития основных исследований Китая (2017YFA0700500) и Национальным фондом естественных наук Китая (21574020). Фундаментальные исследовательские фонды для центральных университетов, проект, финансируемый приоритетным академическим программой развития высших учебных заведений Цзянсу (PAPD) и Национальным демонстрационным центром экспериментальной биомедицинской инженерии Образование (юго-восточный университет) также были высоко оценены.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids, Inc. | 850355P-1g | |
| Anhydrous ethanol | Sinopharm Chemical Reagent Co., Ltd | 100092680 | ≥99.7% |
| CaF2 prism | Chengdu YaSi Optoelectronics Co., Ltd. | ||
| Calcium chloride anhydrous | Sinopharm Chemical Reagent Co., Ltd | 10005817 | ≥96.0% |
| deuterated DPPC (d-DPPC) | Avanti Polar Lipids, Inc. | 860345P-100mg | |
| Electromagnetic oven | Zhejiang Supor Co., Ltd | C21-SDHCB37 | |
| Langmuir-Blodgett (LB) trough | KSV NIMA Co., Ltd. | KN 2003 | |
| Lithium bromide anhydrous | Sinopharm Chemical Reagent Co., Ltd | 20056926 | |
| Milli-Q synthesis system | Millipore | Ultrapure water | |
| Plasma cleaner | Chengdu Mingheng Science&Technology Co., Ltd | PDC-MG | Oxygen plasma cleaning |
| Poly(2-hydroxyethyl methacrylate) (PHEMA) | Sigma-Aldrich Co., LLC. | 192066 MSDS | Mw = 300 000 |
| Polystyrene | Sigma-Aldrich Co., LLC. | 330345 MSDS | Mw = 48 kDa and Mn = 47 kDa |
| Silk cocoons | From Bombyx mori | ||
| Single complementary strand of oligonucleotide | Nanjing Genscript Biotechnology Co., Ltd. | H03596 | 5'-CGAAGGCTTCCAGCT-3' |
| Single strand of oligonucleotide | Nanjing Genscript Biotechnology Co., Ltd. | H04936 | 3¢-end modified by cholesterol-triethylene glycol(Chol-TEG) (5¢-GCTTCCGAAGGTCGA-3¢) |
| Sodium carbonate anhydrous | Sinopharm Chemical Reagent Co., Ltd | 10019260 | ≥99.8% |
| Spin-coater | Institute of Microelectronics of the Chinese Academy of Sciences | KW-4A | For the prepartion of ploymer films |
| Step profiler | Veeco | DEKTAK 150 | For the measurement of film thickness |
| Sum frequency generation (SFG) vibrational spectroscopy system | EKSPLA | A commercial picosecond SFG system |
Ссылки
- Shen, Y. R. Optical Second Harmonic Generation at Interfaces. Annual Review of Physical Chemistry. 40, 327-350 (1989).
- Shen, Y. R. Surface properties probed by second-harmonic and sum-frequency generation. Nature. 337, 519-525 (1989).
- Lu, X., et al. Studying Polymer Surfaces and Interfaces with Sum Frequency Generation Vibrational Spectroscopy. Analytical Chemistry. 89 (1), 466-489 (2017).
- Chen, X., Clarke, M. L., Wang, J., Chen, Z. Sum Frequency Generation Vibrational Spectroscopy Studies on Molecular Conformation and Orientation of Biological Molecules at Interfaces. International Journal of Modern Physics B. 19 (4), 691-713 (2005).
- Eisenthal, K. B. Liquid Interfaces Probed by Second-Harmonic and Sum-Frequency Spectroscopy. Chemical Reviews. 96 (4), 1343-1360 (1996).
- Richmond, G. L. Molcular Bonding and Interactions at Aqueous Surfaces as Probed by Vibrational Sum Frequency Spectroscopy. Chemical Reviews. 102 (8), 2693-2724 (2002).
- Wang, H., Gan, W., Lu, R., Rao, Y., Wu, B. Quantitative spectral and orientational analysis in surface sum frequency generation vibrational spectroscopy(SFG-VS). International Reviews in Physical Chemistry. 24 (2), 191-256 (2007).
- Shultz, M. J., Schnitzer, C., Simonelli, D., Baldelli, S. Sum frequency generation spectroscopy of the aqueous interface: Ionic and soluble molecular solutions. International Reviews in Physical Chemistry. 19 (1), 123-153 (2010).
- Li, X., et al. Detecting Surface Hydration of Poly(2-hydroxyethyl methacrylate) in Solution in situ. Macromolecules. 49, 3116-3125 (2016).
- Li, X., Lu, X. Evolution of Irreversibly Absorbed Layer Promotes Dewetting of Polystyrene Film on Sapphire. Macromolecules. 51, 6653-6660 (2018).
- Lu, X., Spanninga, S. A., Kristalyn, C. B., Chen, Z. Surface Orientation of Phenyl Groups in Poly(sodium 4-styrenesulfonate) and in Poly(sodium 4-styrenesulfonate): Poly(3,4-ethylenedioxythiophene) Mixture Examined by Sum Frequency Generation Vibrational Spectroscopy. Langmuir. 26 (17), 14231-14235 (2010).
- Lu, X., Clarke, M. L., Li, D., Wang, X., Chen, Z. A Sum Frequency Generation Vibrational Study of the Interference Effect in Poly(n-butyl methacrylate) Thin Films Sandwiched between Silica and Water. Journal of Physical Chemistry C. 115, 13759-13767 (2011).
- Lu, X., et al. Directly Probing Molecular Ordering at the Buried Polymer/Metal Interface 2: Using P-Polarized Input Beams. Macromolecules. 45, 6087-6094 (2012).
- Lu, X., Myers, J. N., Chen, Z. Molecular Ordering of Phenyl Groups at the Buried Polystyrene/Metal Interface. Langmuir. 30, 9418-9422 (2014).
- Li, B., Lu, X., Ma, Y., Han, X., Chen, Z. Method to Probe Glass Transition Temperatures of Polymer Thin Films. ACS Macro Letters. 4, 548-551 (2015).
- Li, X., Deng, G., Ma, L., Lu, X. Interchain Overlap Affects Formation of Silk Fibroin Secondary Structure on Hydrophobic Polystyrene Surface Detected via Achiral/Chiral Sum Frequency Generation. Langmuir. 34, 9453-9459 (2018).
- Kai, S., Li, X., Li, B., Han, X., Lu, X. Calcium-dependent hydrolysis of supported planar lipids was triggered by honey bee venom phospholipase A2 with the right orientation at the interface. Physical Chemistry Chemical Physics. 20, 63-67 (2018).
- Wang, J., Buck, S., Chen, Z. Sum Frequency Generation Vibrational Spectroscopy Studies on Protein Adsorption. Journal of Physical Chemistry B. 106, 11666-11672 (2002).
- Wang, J., et al. Detection of Amide I Signals of Interfacial Proteins in Situ Using SFG. Journal of American Chemical Society. 125, 9914-9915 (2003).
- Nguyen, K. T., et al. Probing the Spontaneous Membrane Insertion of a Tall-Anchored Membrane Protein by Sum Frequency Generation Spectroscopy. Journal of American Chemistry Society. 132, 15112-15115 (2010).
- Li, X., Ma, L., Lu, X. Calcium Ions Affect Water Molecular Structures Surrounding an Oligonucleotide Duplex as Revealed by Sum Frequency Generation Vibrational Spectroscopy. Langmuir. , (2018).
- Sartenaer, Y., et al. Sum-frequency generation spectroscopy of DNA monolayers. Biosensors & Bioelectronics. 22, 2179-2183 (2007).
- Asanuma, H., Noguchi, H., Uosaki, K., Yu, H. Metal Cation-induced Deformation of DNA Self-Assembled Monolayers on Silicon: Vibrational Sum Frequency Generation Spectroscopy. Journal of American Chemistry Society. 130, 8016-8022 (2008).
- Howell, C., Schmidt, R., Kurz, V., Koelsch, P. Sum-frequency-generation spectroscopy of DNA films in air and aqueous environments. Biointerphases. 3 (3), FC47 (2008).
- Walter, S. R., Geiger, F. M. DNA on Stage: Showcasing Oligonucleotides at Surfaces and Interfaces with Second Harmonic and Vibrational Sum Frequency Generation. Journal of Physical Chemistry Letters. 1, 9-15 (2010).
- Li, Z., Weeraman, C., Azam, M. S., Osman, E., Gibbs-Davis, J. The thermal reorganization of DNA immobilized at the silica/buffer interface: a vibrational sum frequency generation investigation. Physical Chemistry Chemical Physics. 17, 12452-12457 (2015).
- Lambert, A. G., Neivandt, D. J., Briggs, A. M., Usadi, E. W., Davies, P. B. Interference Effects in Sum Frequency Spectra from Monolayers on Composite Dielectric/Metal Substrates. Journal of Physical Chemistry B. 106, 5461-5469 (2002).
- Tong, Y., et al. Interference effects in the sum frequency generation spectra of thin organic films. I. Theoretical modeling and simulation. Journal of Chemical Physics. 133, 034704 (2010).
- McGall, S. J., Davies, P. B., Neivandt, D. J. Interference Effects in Sum Frequency Vibrational Spectra of Thin Polymer Films: An Experimental and Modeling Investigation. Journal of Physical Chemistry B. 108, 16030-16039 (2004).
- Li, B., et al. Interfacial Fresnel Coefficients and Molecular Structures of Model Cell Membranes: From a Lipid Monolayer to a Lipid Bilayer. Journal of Physical Chemistry C. 118, 28631-28639 (2014).
- Zhou, J., Anim-Danso, E., Zhang, Y., Zhou, Y., Dhinojwala, A. Interfacial Water at Polyurethane-Sapphire Interface. Langmuir. 31 (45), 12401-12407 (2015).
- Gautam, K. S., et al. Molecular Structure of Polystyrene at Air/Polymer and Solid/Polymer Interfaces. Physical Review Letters. 85 (18), 3854-3857 (2000).
- Yan, E. Y., Fu, L., Wang, Z., Liu, W. Biological Macromolecules at Interfaces Probed by Chiral Vibrational Sum Frequency Generation Spectroscopy. Chemical Reviews. 114, 8471-8498 (2014).
- Belkin, M. A., Kulakov, T. A., Ernst, K. H., Yan, L., Shen, Y. R. Sum-Frequency Vibrational Spectroscopy on Chiral Liquids: A Novel Technique to Probe Molecular Chirality. Physical Review Letters. 85, 4474 (2000).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6, 1612-1631 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены