Method Article
Без этикетки Иммунопрецитис Масса Спектромтертрия Рабочий процесс для крупномасштабного ядерного взаимодействия Профилирование
В этой статье
Резюме
Описанный является протеомикой рабочего процесса для выявления белковых партнеров взаимодействия из ядерной субклеточной фракции с использованием иммуноаффинити обогащения данного белка интерес и этикетки свободной масс-спектрометрии. Рабочий процесс включает в себя субклеточной фракционации, иммунопрецитистицитов, фильтр помощь подготовки образца, автономной очистки, масс-спектрометрии, и вниз по течению биоинформатики трубопровода.
Аннотация
Спектрометрия иммуноаффинционности очистки (IP-MS) стала надежным количественным методом выявления белково-белковых взаимодействий. Эта публикация представляет собой полное взаимодействие протеомики рабочий процесс, предназначенный для выявления низкого изобилия белка-белковых взаимодействий из ядра, которые также могут быть применены к другим субклеточным отсеков. Этот рабочий процесс включает в себя субклеточной фракционации, иммунопрецитистиция, подготовка образца, автономной очистки, одноразовой этикетки без спектрометрии, а также вниз по течению вычислительного анализа и визуализации данных. Наш протокол оптимизирован для обнаружения разрозненных, низкообильных взаимодействий, которые трудно определить из целых клеточных лизатов (например, транскрипционные факторы взаимодействия в ядре) путем иммунопроницания эндогенных белков из фракционные субклеточные отсеки. В описанном здесь трубопроводе подготовки образцов содержатся подробные инструкции по подготовке клеточного экстракта HeLa, очищению иммуноаффинити эндогенного белка приманки и количественному анализу масс-спектрометрии. Мы также обсуждаем методологические соображения для выполнения крупномасштабных иммунопрециционных действий в масс-спектрометрии на основе взаимодействия профилирования экспериментов и предоставить руководящие принципы для оценки качества данных, чтобы различать истинный положительный белок взаимодействия от неспецифических взаимодействий. Этот подход демонстрируется здесь, исследуя ядерный interactome из CMGC киназы, DYRK1A, низкое изобилие белка киназы с плохо определенными взаимодействиями в ядре.
Введение
Протеом человека обладает огромным структурным и биохимическим разнообразием путем формирования стабильных мультисубунитов и переходных белково-белковых взаимодействий. Соответственно, идентификация партнеров взаимодействия для белка интереса обычно требуется в исследованиях, чтобы разгадать молекулярный механизм. Недавние достижения в протоколах очистки сродства и появление приборов быстрого сканирования масс-спектрометрии с высоким разрешением позволили легко отображение ландшафтов взаимодействия белков в одном объективном эксперименте.
Протоколы взаимодействия протеина обыкновенно используют системы эктопического выражения с сродством-помеченными конструкциями сплавливания для того чтобы определить взаимодействия протеина без требовать высокое качество антитела узнавая протеин интереса1,2. Тем не менее, методы на основе эпитопных тегов имеют несколько недостатков. Физические взаимодействия с эпитопом могут привести к обнаружению неспецифических коочищенных белков3. Кроме того, слияние этих эпитопных тегов к N- или C-терминалу белка может блокировать взаимодействие родного белка-белка, или нарушить сворачивание белка, чтобы способствовать нефизиологическим конформациям4. Кроме того, эктопические системы экспрессии обычно переэкспрессируют белок приманки в надфизиологических концентрациях, что может привести к выявлению артистивных белковых взаимодействий, особенно для чувствительных к дозировке генов5. Чтобы обойти эти проблемы, эндогенный белок приманки может быть иммунопроцирован вместе с соответствующими взаимодействующих белков добычи, предполагая наличие высококачественного антитела, которое распознает родной белок.
Приведено здесь взаимодействие протеомики рабочего процесса для обнаружения ядерного взаимодействия эндогенного белка с использованием белка киназы CMGC DYRK1A в качестве примера. Нарушение номера копий DYRK1A, уровня активности или выражения может привести к тяжелой умственной неполноценности у людей, а эмбриональная летальность у мышей6,7,8,9. DYRK1A демонстрирует динамическую пространственно-временное регулирование10,и разрозненные белковые взаимодействия11,12, требующие подходов, способных обнаруживать низкое изобилие партнеров взаимодействия, специфичных для различных субклеточных отсеков.
Этот протокол использует клеточной фракции клеток человека HeLa в цитозол и нуклеоплазмы фракций, иммунопрециционности, образец подготовки к масс-спектрометрии, а также обзор биоинформатический трубопровод для оценки качества данных и визуализации результатов, с R скрипты, предусмотренные для анализа и визуализации (Рисунок 1) . Пакеты программного обеспечения Proteomics, используемые в этом рабочем процессе, находятся в свободном доступе для скачивания или могут быть доступны через веб-интерфейс. Для получения дополнительной информации о программном обеспечении и вычислительных методах, углубленные учебники и инструкции доступны по предоставленным ссылкам.
протокол
ПРИМЕЧАНИЕ: Все буферные композиции и смеси протеазы изложены в таблице 1.
1. Подготовка клеток
ПРИМЕЧАНИЕ: Для этого подхода иммунопрецитистной масс-спектрометрии (IP-MS) желательно исходный материал в размере 1,10 мг ядерного лисата на реплику. Количество клеток будет уделяться 1 мг ядерных иммунопрециаций в тройной плюс тройной контроль.
- При использовании линии клеток адепта, вырастите клетки до 90% в 3 х 15 см блюд на реплику до сбора урожая.
ПРИМЕЧАНИЕ: Рекомендуется выполнять как минимум три репликации иммунопреципций для приманки и условий контроля. Этот протокол будет предполагать использование "только бисера" элементы управления, которые контролируют для обильных неспецифических взаимодействий с бисером, начиная с раздела 4. Другие типы элементов управления могут быть полезны. Они подробно описаны в разделе обсуждения.- Вымойте пластины 2x с фосфатами буферного сольника (PBS) и trypsinize клеток с помощью 3 мл 0,25% трипсина на 15 см пластины. Спин вниз клетки на 1200 х г в течение 5 мин и decant трипсин.
- Для подвесных клеток, расти до аналогичной шкалы / плотности для достижения 70-80 мг общего белка.
- Клетки пеллет при 1200 х г и 4 кв. м в течение 5 мин. Декантированные средства массовой информации тщательно.
ПРИМЕЧАНИЕ: Пеллеты могут быть объединены во время этого шага, чтобы обеспечить эффективную обработку с использованием крупномасштабной субклеточной фракционации, изложенной в разделе 2.
- Клетки пеллет при 1200 х г и 4 кв. м в течение 5 мин. Декантированные средства массовой информации тщательно.
- Вымойте клеточные гранулы 2x с PBS 5 мМ MgCl2 дополнены ингибиторами протеазы (ИП) и ингибиторами фосфатазы (PhIs) (см. Таблица 1).
ПРИМЕЧАНИЕ: Клеточные гранулы могут быть заморожены в жидком азоте и храниться при -80 градусов по Цельсию до готовности к фракционации.
2. Подготовка ядерного экстракта
ПРИМЕЧАНИЕ: Ингибиторы протеазы и фосфатазы должны быть добавлены к буферам фракционирования в течение 30 минут использования.
- Если заморожены, разморозить клеточные гранулы в течение 15 минут в 1x пеллет объем холодного буфера A и ИП / PhIs. Поместите клетку гранулы на nutator на 4 кВ, чтобы помочь в повторной подвески при оттаивании. В противном случае, resuspend клетки гранулы от шага 1.3 в 1x объем гранул Буфер A и PIs /PhIs.
- Пеллетка на 2000 х г и 4 кв кв 10 мин. Декант буфер.
- Приостановить клетки с 5x упакованы объем клеток с буфером А и инкубировать на льду в течение 20 минут.
- Пеллетка на 2000 х г и 4 кс в течение 10 мин. Декант буфера и resuspend с 2x оригинальный объем упакованных клеток Buffer A и PIs / PhIs и dounce 7x с "A"/loose пестль.
- Центрифуге лизат в течение 10 мин при 2000 х г и 4 кв. C.
- Тщательно pipette от супернатанта и флэш заморозить с жидким азотом. Храните лизат при -80 градусах Цельсия. Супернатантом от этого шага является цитосоличная субклеточная фракция.
ПРИМЕЧАНИЕ: Ядерные гранулы могут быть сохранены во время этого шага путем флэш-замораживания с жидким азотом и хранения при -80 градусах Цельсия - Приостановите гранулы с 0,9-дюймовым объемом гранул буфера B и PIs/ PhIs и смешайте на nutator в течение 5 мин при 4 градусах Цельсия.
- Чтобы линзить ядра, выбросить 20x с более жесткой пестик "B".
- Смешайте ядерный лисат на nutator в течение 30 минут при 4 градусах Цельсия, чтобы он был однородным.
- Центрифуга ядерный лисат в течение 30 мин при 21000 х г при 4 градусах Цельсия. Pipette от supernatant и сохранить как растворимый ядерный экстракт белка.
ПРИМЕЧАНИЕ: Nuclease лечение в результате ядерных гранул позволяет для восстановления хроматин связанных белковой фракции. - Диализ растворимый ядерный экстракт против Буфер C и ИП в течение 3 ч при 4 градусах Цельсия.
- Вырежьте соответствующую длину 24 мм шириной диализа трубки с 8 kDa молекулярного веса отрезали. Зажимая одну сторону трубки и загрузите нуклеоплазму в трубку. После загрузки лизата, зажим другой конец и погрузиться в чистый стеклянный контейнер, содержащий Buffer C и ИП.
- Центрифуги диализированный ядерный экстракт / нуклеоплазма при 21000 х г при 4 градусах по Цельсию в течение 30 мин. Aliquot 3x 20 л объемов ядерного экстракта для фракционирования проверки западной помок. Ядерный экстракт, используемый для анализа IP-MS, может быть алицитирован и флэш-заморожен в жидком азоте и при необходимости храниться при -80 градусах Цельсия.
3. Проверка субклеточной фракционности
- Провести протеиновый анализ для определения концентрации белка ядерного лизата. Анализ белка bicinchoninic кислоты обеспечивает достаточную чувствительность для применения вниз по течению.
- Нагрузка 20 мкг как цитосолильных и ядерных фракций на SDS-PAGE гель для западного анализа подьение, как ранее описано13. Пропустить полосы движения при загрузке, чтобы избежать неправильной характеристики образца.
- Зонд западной помарка для p84 (THOC1) в качестве ядерного маркера, и GAPDH как цитосолик маркер. Определить степень фракции по соотношению цитосоликического маркера в ядерной фракции и наоборот.
ПРИМЕЧАНИЕ: Антитела для других ядерных и цитосоликовых маркеров могут быть использованы.
4. Иммунопрециция эндогенного белка ядерной приманки
ПРИМЕЧАНИЕ: Рекомендуется использовать трубки с низким уровнем удержания с этого момента. Это позволит уменьшить неспецифическую привязку к трубам во время обработки образцов и избежать ненужной потери образца. Кроме того, убедитесь, что LCMS класса H2O используется для подготовки буферов для остальных шагов.
- Приготовьте смесь бисера из белка A/G для каждой репликации, объединив 12,5 л объема бисера как для белка-А, так и для белка-G в микроцентрифуговых трубках. Храните запасы биса в виде суспензии, содержащей 20% этанола. Определите концентрацию бусин в суспензии %(v/v) и pipette необходимый том с помощью наконечника пипетки, которая была вырезана на кончике, чтобы гарантировать, что бусы могут войти в кончик.
- Вымойте белок A/ G бисовой смесь 2x с 300 зл ис. Спин бисерна на 1500 х г при 4 c в течение 1 мин и декант буфера.
- Приготовьте антитела-белок A/G шарики: Чтобы связать антитело с бисером, добавьте 300 зл ис. Разрешить смесь бис/антитела, чтобы покачать на nutator на 4 кв. C в одночасье. Для бис-только контроля, не добавляйте антитела.
ПРИМЕЧАНИЕ: В общей сложности 10 мкг антител на реплику может быть использован в качестве отправной точки, но точное количество должно быть оптимизировано для каждого отдельного антитела и масштаба лизата, используемого в эксперименте - Оттепель ядерных лисатов от шага 2.10 в водяной бане и aliquot соответствующие объемы в низкой удержания микроцентрифуговых труб для 1 мг белка ввода на реплику.
- Спин лизат на 16000 х г в течение 30 минут и передать супернатант в новую трубку.
- Добавьте 1 кЛ бензоназы (250 единиц/Л) на 1 мг ядерного лисата и покачали на nutator при 4 градусах по Цельсию в течение 10-15 мин.
- Подготовка бисера для предварительного очистки лизата. Добавьте 12,5 л каждого белка А и белковых бусин G в 1,5 мл низкоудерживающие трубки, как и в шаге 4.1. Вымойте 2x с IP Wash Buffer 1 и ИП и decant буфера.
- Добавьте 1 мг ядерного лисата к бисеру со ступени 4.5. Инкубировать во время раскачивания на nutator для 1 ч при 4 градусах Цельсия.
- Центрифуга предварительно расчищена лизатами на 1500 х г и 4 кв кв 1 мин.
- В то время как ядерные лисаты инкубируются бисером в шаге 4.5.1, промойте антитело-белок A/G бусы 2x с IP-буфером 1 и ИП. Центрифуга при 1500 х г и 4 кв. м в течение 1 мин и декантбуфер.
- Перенесите предварительно очищенный ядерный лисат со шага 4.6.1 на бусы антитела-белки A/G. Инкубировать во время раскачивания на nutator при 4 c для 4 h. Центрифуга после инкубации на 1500 x g и 4 c для 1 мин.
- Передача супернатанта в трубки помечены как поток через для каждого репликации.
- Вымойте антитела-белок A/G шарики с 1 мл IP буфера 2 и ИП. Центрифуга при 1500 х г и 4 кв. м на 1 мин, декант буфер, и повторить в общей сложности 3x.
- Вымойте бисер 2x с 1 мл IP буфера 1 "PIs центрифуги, как и в предыдущем шаге. Убедитесь, что весь буфер удаляется после последней стирки.
- Elute 2x с 20 л 0,1 М глицин (pH 2.75) для 30 мин каждый. Убедитесь, что трубы качается во время инкубации с elution буфера. Спин на 750 х г и 4 кв в течение 1 мин и пипетка от супернатанта после каждого 30 минут инкубации.
ПРИМЕЧАНИЕ: В то время как метод низкого рН глицин, описанный здесь, выясняет большинство белков приманки, некоторые антитела-антигенные взаимодействия требуют более строгих условий буфера. - Вспышка замерзает в жидком азоте и хранится при -80 градусах Цельсия.
5. Подготовка образцов
ПРИМЕЧАНИЕ: Инсулин шипами в иммунопреционно-элютиционных образцов помогает в восстановлении белков во время трихлороацетической кислоты (TCA) осадков и обработки образцов, что важно для низкого изобилия эндогенных белков приманки.
- Оттепель eluates при комнатной температуре, если замороженные.
- Поместите образцы на лед и добавьте 10 л инсулина по 1,0 мг/мл на каждые 100 л элюат. Вихрь, а затем сразу же добавить 10 Зл 1% дезоксихолата натрия. Vortex образца снова и добавить 30 л 20% TCA следуют один окончательный вихрь.
- Инкубировать образцы на льду в течение 20 мин, затем центрифуги при 21000 х г при 4 градусах по Цельсию в течение 30 мин.
- Аспирировать супернатант и добавить 0,5 мл ацетона, который был прехоперирован до -20 градусов по Цельсию. Vortex, а затем спина на 21000 х г и 4 кв к в течение 30 мин. Повторите этот шаг.
- Аспирируйте супернатант и просушите гранулы, оставшиеся в нижней части трубки.
- Подготовьте образец для масс-спектрометрии с помощью модифицированного метода Filter Aided Sample Prep (FASP), оптимизированного для уменьшения обработки образцов, как указано ниже14.
- Приостановить протеиновые гранулы со ступени 5.1.4 с 30 Зл SDS Алкилационный буфер (см. Таблица 1). Инкубируйте образец на теплоблоке 95 градусов по Цельсию в течение 5 мин. Дайте ему остыть при комнатной температуре в течение 15 минут до начала следующего шага.
- Добавьте 300 юаней раствора UA и 30 юл tCEP 100 мм к каждому образцу. Загрузите это решение на 30k центробежный фильтр. Закрутите центробежный фильтр при температуре 21 000 х г при комнатной температуре в течение 10 мин.
ПРИМЕЧАНИЕ: Белок приманки и его ориентировочных интерактеров должны быть привязаны к фильтру в этой точке. Тем не менее, поток через может быть сохранен, в случае, если есть проблемы с фильтром. - Вымойте фильтр с 250 л UA и центрифуги на 21000 х г в течение 10 мин. Декант потока через и повторить в общей сложности 3x.
- Вымойте фильтр с 100 мл 100 мм Tris pH 8,5 и центрифуги на 21000 х г в течение 10 мин. Декант поток через и повторить в общей сложности 3x.
- Добавьте 3 зЛ из 1 мкг/Л Lys C, вновь взвешенных по цельсию 0,1 м tris pH 8.5. Заполните фильтры до отметки 100 л и дайте переварить в течение 1 ч при 37 градусах Цельсия, пока качаясь на nutator.
- Добавьте 1 кЛ 1 мкг/ трипсин класса МС. Смешайте осторожно и дайте трипсину инкубировать с образцом на ночь при 37 градусах Цельсия, пока качаясь на nutator.
- Центрифуге при 21 000 х г в течение 20 мин, чтобы вывести пептид из фильтра.
ПРИМЕЧАНИЕ: Несколько раундов центрифугирования может потребоваться, чтобы восстановить все eluate. Если этого не сделать, существует вероятность серьезной потери образца.
- Обезсоль пептиды с помощью C18 спиновые столбцы. Следуйте протоколу, предоставленному производителем.
- Приостановите лиофилизированный пептид в 7 зЛ 0,1% TFA в 5% ацетонитрила. Снопсите образец в течение 3 минут, чтобы убедиться, что пептиды были повторно приостановлены. Спин вниз на 14000 х г в течение 10 мин.
- Перенесите переплетив пептид в соответствующий образец флакона для загрузки на систему жидкой хроматографии-масс-спектрометрии (LC/MS).
6. Пригодность системы LC/MS
ПРИМЕЧАНИЕ: Из-за небольшого масштаба и, как правило, более низкого изобилия белка из сродничества очищенных образцов, очень важно, чтобы платформа LC/MS работала с максимальной чувствительностью и надежностью.
- Добавьте 1 мл для LC/MS класса formic кислоты к 1 l воды класса LC/MS для мобильной фазы А и добавьте 1 мл для LC/MS класса formic кислоты к 1 l ацетонитрила класса LC/MS для мобильной фазы B.
- Подготовьте или установите 75 мкм сливки капиллярной колонки упакованы с lt;2 мкм обратной фазы C18 мизины, что составляет 250 мм в длину. Наилучшие результаты будут достигнуты при прямом впрыске образцов в колонку.
- Очистка системы Ultra Performance Liquid Chromatography (UPLC) со свежими передвижными фазами. С установленной колонкой C18 установите стабильную скорость потока и электроспрей с подходящим излучателем (т.е. 20 мкм ID x 360 мкм od вытащил на кончик е 10 мкм). Поддерживайте столбец на уровне 40–60 градусов по Цельсию.
- Проверьте общую производительность системы LC/MS, внедрив комплексный стандарт контроля качества, например 100-200нг в тризатном тризатном тризате HeLa. Elute с подходящим градиентом для сложного образца (т.е. 2'3 h градиента время выброса). Установить базовую систему идентификации пептида и белка.
ПРИМЕЧАНИЕ: Для достижения наилучших результатов, 3000-5000 или более идентификации белка из 20 000-35 000 уникальных пептидов обеспечат оптимальную производительность для экспериментальных образцов. - Для обычной пригодности системы LC/MS вводят 100–200 моль или менее одного стандарта дайджеста белка, например, Сыворотка для крупного рогатого скота (BSA). Выдолбсите с коротким градиентом (т.е. 20–30 мин).
ПРИМЕЧАНИЕ: Несколько инъекций белкового дайджеста помогут установить базовую производительность системы LC/MS, а повторные инъекции после каждого образца IP-MS обеспечивают меру производительности системы на протяжении всего эксперимента и позволяют обнаружить дрейф прибора, который может предусматривать эксперименты без этике. Базовая линия отдельных пиковых интенсивностей и пиковых форм будет информировать о производительности MS, LC и столбца. - Чтобы избежать перегрузки аналитической колонки, загрузите небольшую часть (15–30% от общего объема) экспериментального образца на столбец и разделите с помощью градита, пригодного для сложных образцов (т.е. 2–3 ч). Если количество идентификационных данных белка является неудовлетворительным, загрузите весь образец на столбец.
- Выполнить единый стандарт переваривания белка между образцами для мониторинга производительности системы LC/MS и переноса образцов. Для уменьшения переноса образцов может потребоваться несколько стандартов в зависимости от образцов.
7. Обработка данных
- Скачать proteomics пакет программного обеспечения Maxquant найти в https://www.maxquant.org/.
ПРИМЕЧАНИЕ: Это будет использоваться для обработки файла данных RAW MS от шага 6.6 в таблицы данных идентиверенных белков, имен генов и количественных значений, связанных с их идентификацией для анализа ниже по течению.- Выберите загрузку в подзаголовке данных ввода холостого вкладки Raw Data. Откройте местоположение файла, где хранятся необработанные файлы MS, и выберите необработанные файлы для каждого запуска MS/MS.
- Нажмите на вкладку Group-Specific и выберите Digestion. В списке ферментов выберите LysC и нажмите на правую стрелку, чтобы добавить этот фермент в список, который будет использоваться в поиске. Затем выберите инструмент и убедитесь, что правильный тип инструмента отображается в списке выпадающих вниз в верхней части экрана. Оставьте другие параметры поиска, специфичные для конкретной группы, на стандартных настройках.
- Нажмите на вкладку «Глобальные параметры» и выберите последовательности. Добавьте соответствующий файл FASTA для таксономии, который будет использоваться в этом поиске. Пептиды не будут назначены должным образом, если это не будет сделано. Для протеома человека, скачать файл FASTA от UniProt в https://www.uniprot.org/help/human_proteome.
- В рамках вкладки Global Parameters нажмите на количественификацию белка. В пептидах для количественного выпадения меню, выберите Уникальный й Razor.
ПРИМЕЧАНИЕ: Max Quant предлагает альтернативную количественную оценку белков через абсолютную количественную оценку на основе интенсивности (iBA) и квантитацию без этике (Lf). Тем не менее, информация о количестве пептидов достаточна для анализа вниз по течению в этом протоколе15. - В левом нижнем углу интерфейса Max'uant выберите количество процессоров, которые будут использоваться для поиска. Это напрямую повлияет на время, необходимое для выполнения, поэтому выберите как можно больше для этого. Нажмите "Старт" в левом нижнем углу экрана, чтобы запустить запуск. Выберите вкладку «Производительность» в верхней части экрана для просмотра хода поиска.
- Когда запуск завершен, откройте файл proteingroups.txt в Perseus, платформе вычислений протеомики или другой программе таблицы для просмотра данных16.
- Используйте Perseus для удаления общих загрязняющих веществ и хитов вспять белковых последовательностей. Следите за подробной документацией Персея в http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactions.
ПРИМЕЧАНИЕ: Открытие файла proteingroups.txt в программном обеспечении анализа (например, Excel) автоматически повредит определенные имена генов и белков.
- Используйте Perseus для удаления общих загрязняющих веществ и хитов вспять белковых последовательностей. Следите за подробной документацией Персея в http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactions.
- Анализ экспериментальных данных с помощью хранилища загрязняющих средств для очистки сродства (CRAPome). Зарегистрируйте учетную запись в этом репозитории http://crapome.org/ и следуйте учебнику по мере необходимости17,18.
- Используйте рабочий процесс «Анализ данных», найденный на главной странице CRAPome. Выберите внешние элементы управления, которые соответствуют системе очистки сродства, используемой в этом эксперименте взаимодействия.
ПРИМЕЧАНИЕ: Эти элементы управления могут быть использованы для расчета обогащения изменения второго раза, что полезно для обнаружения общих загрязняющих веществ. - Создайте входный файл из протеиновых групп.txt выход из Maxquant с помощью Perseus или подходящего приложения таблицы. Подробную информацию о ручном форматировании можно найти на http://crapome.org/?q=fileformatting. Кроме того, используйте предоставленный R-скрипт "export_CRAPomeSAINT_Input_File.R" для генерации вхотого файла SAINT/CRAPome. Смотрите README.txt в дополнительных файлах кодирования.
- Выполнить анализ, чтобы определить сложенное изменение обогащения и SAINT (Значение Анализ INTeractome) вероятность для каждого белка приманки в иммунопротеципиента. Убедитесь, что 'User Controls'выбран в выпадающем меню под FC-A, 'CRAPome управления' или 'Все элементы управления' выбраны в FC-B выпадения вниз и вероятность Оценка выбран для создания вероятности SAINT. По завершении выполнения просмотрите вывод, доступный в "Результаты анализа", а также идентификатор задания. Скачать матрицу данных из "Результаты анализа" для будущего построения и визуализации данных.
- Используйте рабочий процесс «Анализ данных», найденный на главной странице CRAPome. Выберите внешние элементы управления, которые соответствуют системе очистки сродства, используемой в этом эксперименте взаимодействия.
- Участок белков в качестве функции FC-A (IPs против управления пользователями) и SAINT вероятность, следуя R-Скрипты, как это предусмотрено в дополнительных файлов кодирования.
ПРИМЕЧАНИЕ: Набор R скриптов предоставляется для производства участков FC-A против SAINT вероятности и iBA' против журнала2 (белковое изобилие), окрашенных скорректированный диапазон значения р от эмпирического анализа Bayes без этикетки интенсивности. Подробная информация о дифференциальном статистическом анализе и построении данных содержится в README.txt и R script "main_differential_analysis. R" в дополнительных файлах кодирования. - Оцените, где известные взаимодействующие белки белка приманки ранжируются FC-A и SAINT. Сделать отсечение FC-A йgt; 3,00 и SAINT йgt; 0,7 для одной приманки экспериментов в тройной в качестве отправной точки.
ПРИМЕЧАНИЕ: Выбор отсечений для "высокой уверенности" взаимодействующих и "низкой уверенности" взаимодействующих должны быть проинформированы биологической информации.
8. Визуализация данных
ПРИМЕЧАНИЕ: Есть много программ, которые могут эффективно визуализировать данные протеомики (например, R, Персея, Cytoscape, STRING-DB). Анализ связи между хитами с высокой степенью достоверности и функциональное обогащение этих взаимодействующих может быть полезной стратегией для определения приоритетов хитов для дальнейшей проверки и функциональной характеристики.
- Скачать Cytoscape, инструмент визуализации сети с открытым исходным кодом в https://cytoscape.org/download.html19.
- Подготовьте файл ввода для данных взаимодействия в виде файла,делимитированного вкладки, отформатированного тремя столбцовами: приманка (источник), добыча (целевой узло), тип взаимодействия (тип края). Это можно сделать в Perseus или любой программе электронной таблицы по вашему выбору.
- Выберите таблицу импорта от значка файла к верхнему левому левому результату программы (обозначенный стрелкой вниз и матрицей в значке). Cytoscape будет автоматически заселять данные о взаимодействии в сеть, готовую к пользовательскому форматированию и дизайну.
- Выберите вкладку «Стиль» на панели управления для Cytoscape и нажмите на квадраты в столбце Def, чтобы настроить атрибут для всей сети. Выберите определенные узлы или края в сети, а затем выберите квадрат в столбце Byp. меню стиля, чтобы обойти настройки по умолчанию и настроить только выбранные объекты. Кроме того, нажмите на выпадающее меню в верхней части меню стиля, чтобы просмотреть предустановленные сетевые форматы.
ПРИМЕЧАНИЕ: STRING-db белка белка взаимодействия данные могут быть интегрированы в эту сеть в это время либо вручную через файл ввода или через различные инструменты обогащения доступны в качестве плагинов в Cytoscape, http://apps.cytoscape.org/20. Рекомендуемый плагин cytoscape для анализа обогащения находится вhttp://apps.cytoscape.org/apps/cluego 21. - Чтобы повысить достоверность данных, генерируемых в этом рабочем процессе, выполняйте взаимные IP-MS или IP-западные эксперименты, которые нацелены на интересующие добычу белки в качестве приманки.
Результаты
Большая часть белковой массы, идентифицированная в эксперименте IP-MS, состоит из неспецифических белков. Таким образом, одной из ключевых проблем эксперимента IP-MS является интерпретация того, какие белки являются высокодоверковаемыми интерактантами против неспецифических взаимодействующих. Чтобы продемонстрировать важнейшие параметры, используемые при оценке качества данных, в исследовании проанализированы тройные иммунопрециционные показатели из 5 мг ядерного экстракта HeLa, используя только контроль за бисом. Первая внутренняя проверка для того чтобы обеспечить что эксперимент IP-MS надежен ли протеин приманки выстраивает в ряд как один из самых высоки обогащенных протеинов определенных как сложить-изменение над управлением и вероятностью SAINT. В этом случае приманка DYRK1A входит в тройку обогащенных белков по контролю(рисунок 2A,B). В ядерном исследовании interactome DYRK1A с использованием четырех независимых антител, FC-A отсечения от йgt;3.00 и SAINT вероятность отсечения При применении к этому эксперименту, четкое разделение можно было увидеть между высокой достоверности взаимодействующих и йgt;95% социоренных белков, идентифицированных как неспецифические (Рисунок 2A,B) . Применение как обогащения изменения раза и порог аналогов увеличивает строгость, требуя последовательно высокого обогащения белковых идентипов через биологические репликации.
В дополнение к статистическому скорингу, рабочий процесс анализа CRAPome также отображает ранее сообщенные взаимодействия на данные добычи23. Хотя это отображение может быть полезно для порога высокой и низкой достоверности взаимодействий, ранее сообщалось взаимодействия могут оценка плохо FC-A и SAINT вероятности, потенциально указывая, что многие известные взаимодействия данной приманки может существовать только в конкретных типах клеток, контекстах, или органелл. Например, набор данных DYRK1A, значения iREF-взаимодействующих FC-A были столь же низкими, как 0,45, что представляет собой очень низкое обогащение над контролем(рисунок 2C) . Во избежание инфляции ложных срабатываний статистическое пороговое значение должно осуществляться таким образом, чтобы отоставлять приоритеты в отношении снижения числа ложных негативов. Следует отметить, что обнаружение этих взаимодействий не зависит от изобилия белка(рисунок 2C). Рассчитанное абсолютное количество копий каждого взаимодействия iREF в клетках HeLa не выявило корреляции с уровнями обнаружения партнера по взаимодействию IP-MS24.
Cytoscape служит эффективным инструментом для визуализации нескольких уровней данных взаимодействия19. В эксперименте dyRK1A иммунопреципсии описано здесь, комбинированное использование FC-A йgt; 3.0 и SAINT Тем не менее, при применении FC-A отсечения от 3,0 в изоляции, восемь дополнительных белков были добавлены в сеть. Эти дополнительные белковые интеркторы имеют высокую связь с уже вданными в сеть, что позволяет предположить, что они связаны с аналогичными комплексами или функциональными ролями. С этой целью, доказательства от STRING-DB белково-белковых взаимодействий был интегрирован в эту сеть, как синий пунктирной линии20. В то время как этот эксперимент с одной приманкой, тройной предоставляет ограниченный образец полной сети взаимодействия DYRK1A, использование дополнительных приманок, репликаций и интеграции больших общедоступных наборов данных может быть использовано для расширения сети взаимодействий с высоким уровнем доверия. Таким образом, статистические отсечения будут специфичны для каждого отдельного эксперимента и нуждаются в тщательной оценке.
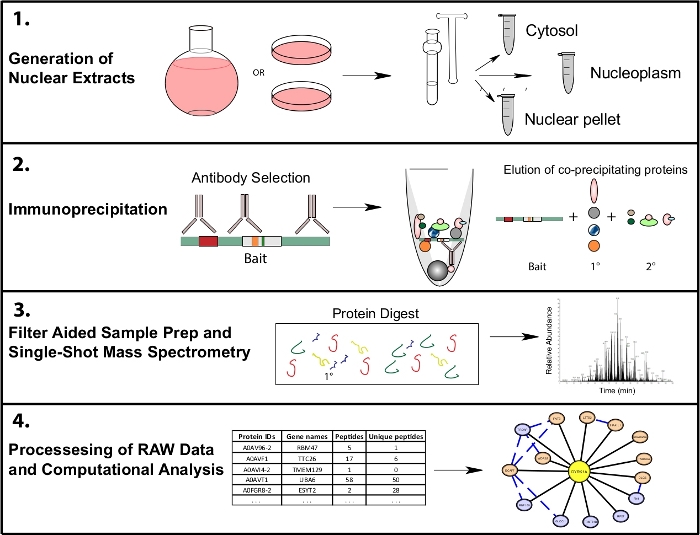
Рисунок 1: Представитель протеомики рабочего процесса для субклеточного IP-MS. Клетки выращиваются в 4 l круглых нижних колбах или 15 см ткани культуры блюда и собирают в то же время для субклеточной фракции. Клетки фракционируются в цитосолик, ядерный и ядерный гранулы, и иммунопрециционные данные делаются из 1,10 мг ядерного лисата с помощью одного или нескольких антител, распознающих одну и ту же приманку. Фильтр помощь образца подготовки (FASP) и автономной очистки образца выполняются до одного выстрела масс-спектрометрии. Вычислительный конвейер ниже по течению используется для обработки данных в интерпретируемые данные взаимодействия. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
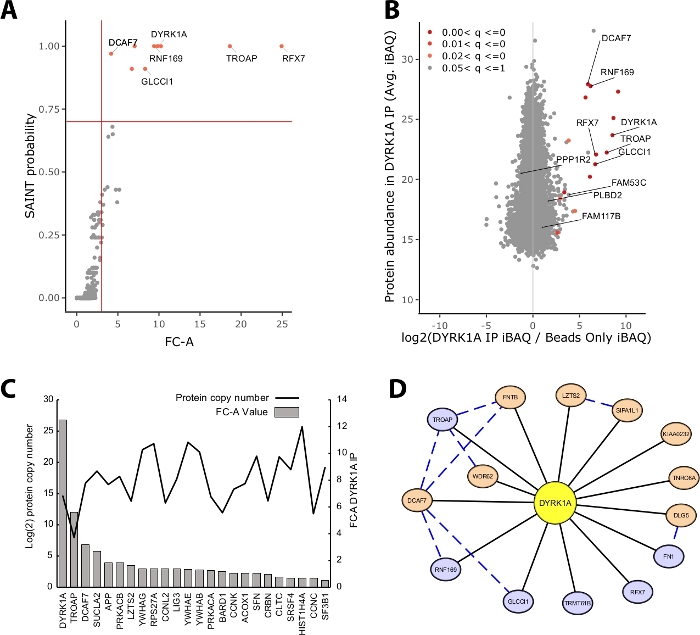
Рисунок 2: Репрезентативные данные для одноразового эксперимента IP-MS. (A)FC-A и SAINT выход вероятности из рабочего процесса анализа CRAPome для оптимального эксперимента с использованием одного антитела для киназы DYRK1A (n No 3). Для сравнения использовались только средства управления бисером. Красные твердые линии представляют отсечения, установленные на FC-A , 3,00 и SAINT (B) Макквант оценок изобилия белка (iBA) выход по сравнению с log2 соотношение белка изобилие в DYRK1A IP для контроля, окрашенные скорректированной р значение диапазона от эмпирического анализа Байес этикетки свободной интенсивности. (C) FC-A и предполагаемое количество копий белков, перечисленных в качестве взаимодействующих белков в базе данных iRef23,24. (D) Визуализация сети Cytoscape взаимодействующих DYRK1A. Синие узлы - FC-A - 3,00, SAINT Оранжевые узлы - FC-A - 3.00. Черные края и белки, идентифицированные как взаимодействуют в эксперименте IPMS. Синий пунктирный край - SAINT взаимодействие между хищным белком (уверенность в себе; .150). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Ингибитор протеазы (PI) смесь | |
| Реагента | Окончательная концентрация |
| Метабисульфит натрия | 1 мМ |
| Бензамин | 1 мМ |
| Дитиотрейтол (DTT) | 1 мМ |
| Фенилметанесульфонил фторид (PMSF) | 0,25 мМ |
| Ингибитор фосфатазы (PhI) смесь | |
| Реагента | Окончательная концентрация |
| Микроцист ЛР | 1 км |
| Ортованат натрия | 0,1 мм |
| Фтор натрия | 5 мМ |
| Субклеточные фракционные буферы: | |
| Буфер рН 7.9 | |
| Реагента | Окончательная концентрация |
| ГЕПЕС | 10 мМ |
| MgCl2 | 1,5 мМ |
| Kcl | 10 мМ |
| Буфер B рН 7,9 | |
| Реагента | Окончательная концентрация |
| ГЕПЕС | 20 мМ |
| MgCl2 | 1,5 мМ |
| Nacl | 420 мМ |
| Этиленедиаминететраацетическая кислота (ЭДТА) | 0,4 мМ |
| Глицерин | 25% (v/v) |
| Буфер C рН 7,9 | |
| Реагента | Окончательная концентрация |
| ГЕПЕС | 20 мМ |
| MgCl2 | 2 мМ |
| Kcl | 100 мМ |
| Этиленедиаминететраацетическая кислота (ЭДТА) | 0,4 мМ |
| Глицерин | 20% (v/v) |
| Иммунопрефферы: | |
| IP буфер 1 | |
| Реагента | Окончательная концентрация |
| ГЕПЕС | 20 мМ |
| Kcl | 150 мМ |
| Эдта | 0,1 мм |
| NP-40 | 0,1% (v/v) |
| Глицерин | 10% (v/v) |
| IP буфер 2 | |
| Реагента | Окончательная концентрация |
| ГЕПЕС | 20 мМ |
| Kcl | 500 мМ |
| Эдта | 0,1 мм |
| NP-40 | 0,1% (v/v) |
| Глицерин | 10% (v/v) |
| SDS Алкилация Буфер рН 8,5 | |
| Реагента | Окончательная концентрация |
| Sds | 4% (v/v) |
| Хлороацетамид | 40 мМ |
| TCEP | 10 мМ |
| Трис | 100 мМ |
| UA pH 8.5 | |
| Реагента | Окончательная концентрация |
| Мочевины | 8 М |
| Трис | 0,1 м |
| - использовать HPLC класса H2O | |
Таблица 1: Буферные композиции
Дополнительные файлы кодирования. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Рабочий процесс протеомики, изложенный здесь, является эффективным методом выявления высокодоверчивых белковых интеркторов для интересуемого белка. Этот подход уменьшает сложность выборки через субклеточные фракции и фокусируется на увеличении партнеров по взаимодействию идентификации за счет надежной подготовки к образцу, очистки образцов в автономном режиме и строгого контроля качества системы LC-MS. Анализ данных, описанный здесь ниже по течению, позволяет провести простую статистическую оценку белков, идентифицированных как коочищение с приманкой. Однако, из-за большого количества экспериментальных переменных (масштаб, клеточная линия, выбор антител), каждый эксперимент требует различных отсечений и соображений, касающихся визуализации данных и обогащения.
Первым проектным соображением в эксперименте IP-MS является выбор антител, которые будут использоваться для коочищения интересующего белка вместе со своими взаимодействующими партнерами. Хотя доступность коммерческих антител расширилась, чтобы охватить большую часть протеома человека за последние несколько десятилетий, Есть еще много белков, для которых реагенты ограничены. Кроме того, антитела, которые были проверены для таких приложений, как западное обнаружение побелки, могут быть неспособны к выборочному обогащению целевого белка в эксперименте по иммунопреционированию. Перед проведением крупномасштабного эксперимента протеомики взаимодействия предлагается завершить IP с 90% конфлеционную тарелку 10 см, или эквивалентное число клеток, и зонд для целевого белка, интересуемого западным и блеттингом. Если для иммунопреципиции доступно более одного антитела, рекомендуется дополнительно выбрать несколько антител, распознающих эпитопы в разных частях белка. Привязка антитела к белку приманки может заткнеть необходимый связывающий интерфейс для предполагающих взаимодействующих партнеров. Выбор вторичного эпитопа для белка приманки увеличит охват профиля взаимодействия, выявленного в ходе эксперимента на основе масс-спектрометрии.
Второе важное соображение заключается в выборе соответствующего контроля для разграничения взаимодействий с высокой достоверностью от низкой достоверности или неспецифических взаимодействий от тех, которые определены как коочищение с приманкой. Самый строгий контроль для эксперимента IP-MS заключается в завершении иммунопреципиции от CRISPR KO клеточной линии приманки. Такой контроль позволяет выявить и отфильтровать неспецифические белки, которые связываются непосредственно с антителом, а не с белками приманки. В тех случаях, когда генерация CRISPR KO клеточной линии каждого белка приманки не представляется возможным, IgG-бисер управления же изотип приманки антитела могут быть использованы. В экспериментах с использованием панели антител, представляющих несколько видов, использование бисера только контроль может быть целесообразным, но увеличит скорость ложных срабатываний определены как высокой уверенности взаимодействующих.
Выбор клеточной линии, используемой в эксперименте IP-MS, зависит от нескольких ключевых факторов. Выражение и локализация белка в значительной степени зависят от типа клеток. В то время как оценки экспрессии РНК можно найти для большинства генов во многих широко используемых клеточных линиях, экспрессия белка плохо коррелирует с экспрессией РНК и должна быть определена экспериментально25. Клеточные линии, в которых белок приманки выражается в очень низком количестве копий следует избегать, чтобы обойти проблемы, связанные с резким увеличением масштаба клеточной культуры, которые могут потребоваться. Следует отметить, однако, что подготовка образцов может быть оптимизирована для обнаружения очень низкого изобилия белков. Фильтр помогал метод подготовки образца (FASP), в то время как надежный, может привести к более чем 50% потере пептида в образце. Однопотно-поток твердых фазы расширенной подготовки образца (SP3) является эффективным методом генерации образцов для анализа масс-спектрометрии, что сводит к минимуму потери образца26. Увеличение восстановления, включенное методом SP3 подготовки образцов, может быть полезной альтернативой в этом рабочем процессе для количественной оценки белков, которые подпадают под предел обнаружения.
Этот рабочий процесс протеомики был применен во многих ядерных приманках, включая киназы, e3 убиквитин лигазы, и леса членов мультисубутных комплексов. Предполагая надлежащую проверку реагентов антител, успешное выполнение этого рабочего процесса приведет к обнаружению высокоуверенных белков ывателей партнеров по взаимодействию для белка, представляющих интерес.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Грантом Grand Challenge W.M.O. от Института Линды Крник по синдрому Дауна и соглашением о сотрудничестве DARPA 13-34-RTA-FP-007. Мы хотели бы поблагодарить Джесси Курланд и Киру Коццолино за их вклад в чтение и комментирование рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA | Thermo Fisher Scientific | 25200056 | |
| 1.5 ml low-rention microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| 4-20% Mini PROTEAN TGX Precast Protein Gels | Bio-Rad | 4561096 | |
| acetone (HPLC) | Thermo Fisher Scientific | A949SK-4 | |
| Amicon Ultra 0.5 ml 30k filter column | Millipore Sigma | UFC503096 | |
| Benzamidine | Sigma-Aldrich | 12072 | |
| benzonase | Sigma-Aldrich | E1014 | |
| Chloroacetamide | Sigma-Aldrich | C0267 | |
| Dialysis tubing closure | Caroline Biological Supply Company | 684239 | |
| DTT | Sigma-Aldrich | 10197777001 | |
| EDTA | Sigma-Aldrich | EDS | |
| GAPDH antibody | Santa Cruz Biotechnology | Sc-47724 | |
| Glycerol | Fisher Scientific | 887845 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HeLa QC tryptic digest | Pierce | 88329 | |
| HEPES | Fisher Scientific | AAJ1692630 | |
| insulin | Thermo Fisher Scientific | 12585014 | |
| iodoacetamide | Sigma-Aldrich | I1149 | |
| KONTES Dounce homogenizer 7 ml | VWR | KT885300-0007 | |
| Large Clearance pestle 7ml | VWR | KT885301-0007 | |
| Lysyl endopeptidase C | VWR | 125-05061 | |
| Magnesium Chloride | Sigma-Aldrich | 208337 | |
| Microcystin | enzo life sciences | ALX-350-012-C100 | |
| Nonidet P 40 Substitute solution | Sigma-Aldrich | 98379 | |
| p84 antibody | GeneTex | GTX70220 | |
| Phosphate Buffered Saline | |||
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23227 | |
| Pierce BSA Protein Digest, MS grade | Thermo Fisher Scientific | 88341 | LCMS QC |
| Pierce C18 spin columns | Thermo Fisher Scientific | PI-89873 | |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher Scientific | 90057 | For mass spectrometry sample prep |
| PMSF | Sigma-Aldrich | P7626 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Protein A Sepharose CL-4B | GE Healthcare Bio-Sciences | 17-0780-01 | |
| Protein G Sepharose 4 Fast Flow | GE Healthcare Bio-Sciences | 17-0618-01 | |
| SDS | Sigma-Aldrich | L3771 | |
| Silica emitter tip | Pico TIP | FS360-20-10 | |
| Small Clearance pestle 7ml | VWR | KT885302-0007 | |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium Fluoride | Sigma-Aldrich | 201154 | |
| Sodium metabisulfite | Sigma-Aldrich | 31448 | |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | |
| Spectra/ Por 8 kDa 24 mm dialysis tubing | Thomas Scientific | 3787K17 | |
| TC Dish 150, Standard | Sarstedt | 83.3903 | Tissue culture dish for adherent cells |
| TCA | Sigma-Aldrich | T9159 | |
| TCEP | Thermo Scientific | PG82080 | |
| TFA | Thermo Fisher Scientific | 28904 | |
| Thermo Scientific Orbitrap Fusion MS | Thermo Fisher Scientific | ||
| Trizma Base | Sigma-Aldrich | T6066 | |
| Urea | Thermo Fisher Scientific | 29700 | |
| Waters ACQUITY M-Class UPLC | Waters | ||
| Waters ACQUITY UPLC M-Class Column Reversed-Phase 1.7µm Spherical Hybrid (1.7 µm, 75 µm x 250 mm) | Waters | 186007484 | nanoflow C18 column |
Ссылки
- Varjosalo, M., et al. The protein interaction landscape of the human CMGC kinase group. Cell Reports. 3, 1306-1320 (2013).
- Kimple, M. E., Brill, A. L., Pasker, R. L. Overview of Affinity Tags for Protein Purification. Current Protocols in Protein Science. 73, (2013).
- Mahmood, N., Xie, J. An endogenous 'nonspecific' protein detected by a His-tag antibody is human transcription regulator YY1. Data in Brief. 2, 52 (2015).
- Zordan, R. E., Beliveau, B. J., Trow, J. A., Craig, N. L., Cormack, B. P. Avoiding the ends: internal epitope tagging of proteins using transposon Tn7. Genetics. 200, 47-59 (2015).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10, 715-721 (2013).
- Bronicki, L. M., et al. Ten new cases further delineate the syndromic intellectual disability phenotype caused by mutations in DYRK1A. European Journal of Human Genetics. 23, 1482-1487 (2015).
- Antonarakis, S. E. Down syndrome and the complexity of genome dosage imbalance. Nature Reviews Genetics. , (2016).
- Dowjat, W. K., et al. Trisomy-driven overexpression of DYRK1A kinase in the brain of subjects with Down syndrome. Neuroscience Letters. 413, 77-81 (2007).
- Fotaki, V., et al. Dyrk1A haploinsufficiency affects viability and causes developmental delay and abnormal brain morphology in mice. Molecular and Cellular Biology. 22, 6636-6647 (2002).
- Hämmerle, B., Elizalde, C., Tejedor, F. J. The spatio-temporal and subcellular expression of the candidate Down syndrome gene Mnb/Dyrk1A in the developing mouse brain suggests distinct sequential roles in neuronal development. European Journal of Neuroscience. 27, 1061-1074 (2008).
- Funakoshi, E., et al. Overexpression of the human MNB/DYRK1A gene induces formation of multinucleate cells through overduplication of the centrosome. BMC Molecular and Cell Biology. 4, 12 (2003).
- Yu, D., Cattoglio, C., Xue, Y., Zhou, Q. A complex between DYRK1A and DCAF7 phosphorylates the C-terminal domain of RNA polymerase II to promote myogenesis. Nucleic Acids Research. , 1-14 (2019).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76, 4350-4354 (1979).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6, 359-362 (2009).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11, 2301-2319 (2016).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13, 731-740 (2016).
- Mellacheruvu, D., et al. The CRAPome: A contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10, 730-736 (2013).
- Choi, H., et al. SAINT: Probabilistic scoring of affinity purificationg-mass spectrometry data. Nature Methods. 8, 70-73 (2011).
- Shannon, P., et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Research. 13, 2498-2504 (2003).
- Szklarczyk, D., et al. The STRING database in 2017: quality-controlled protein-protein association networks, made broadly accessible. Nucleic Acids Research. 45, 362-368 (2017).
- Bindea, G., et al. ClueGO: a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks. Bioinformatics. 25, 1091-1093 (2009).
- Guard, S. E., et al. The nuclear interactome of DYRK1A reveals a functional role in DNA damage repair. Scientific Reports. 9, 6539 (2019).
- Razick, S., Magklaras, G., Donaldson, I. M. iRefIndex: A consolidated protein interaction database with provenance. BMC Bioinformatics. 9, 405 (2008).
- Kulak, N. A., Pichler, G., Paron, I., Nagaraj, N., Mann, M. Minimal, encapsulated proteomic-sample processing applied to copy-number estimation in eukaryotic cells. Nature Methods. 11, 319-324 (2014).
- Liu, Y., Beyer, A., Aebersold, R. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell. 165, 535-550 (2016).
- Hughes, C. S., et al. Ultrasensitive proteome analysis using paramagnetic bead technology. Molecular Systems Biology. 10, 757 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены