Method Article
Нацеливание на тонкую кишку крысы: долгосрочная инфузия в верхнюю брыжеечную артерию
В этой статье
Резюме
Доступ для длительной инфузии в верхнюю брыжеечную артерию (СМА) крыс представляет собой хирургическую процедуру, которая состоит из канюляции проксимальной ветви СМА. Канюля выходит из брюшной раны и туннелируется через подкожное пространство обратно в межлопаточную складку.
Аннотация
Верхняя брыжеечная артерия может быть канюлятирована у человека посредством минимально инвазивной радиологической катетеризации бедренной или подмышечной артерии. Каннуляция СМА более сложна у крыс из-за небольших анатомических размеров. Целью исследования является описание хирургической методики канюляции СМА у крыс для выполнения длительной инфузии препаратов в сосудистое русло СМА у неограниченных животных, что приведет к высокой скорости проходимости катетера после послеоперационного восстановления в течение 24 часов.
Чтобы избежать риска тромбоза СМА или кровотечения от прямого доступа, проксимальную ветвь СМА выделяют, перевязывают дистально и каннулируют полиуретановой капиллярной трубкой толщиной 0,25 мм, кончик которой продвигается близко к происхождению СМА из аорты. Затем канюля туннелируется подкожно к задней части шеи животного и через кожу через искусственный клапан. Внешняя часть канюли вставлена в полужесткую опорную систему и подключена к непрерывному инфузионному насосу вне клетки, где крыса может свободно двигаться.
Правильное позиционирование канюли было продемонстрировано результатами послеоперационной ангиографии и вскрытия. Проходимость катетера после 24 часов инфузии физиологического раствора в область СМА была обеспечена у большинства крыс полным разрядом насоса и распознаванием функциональной канюли для забора крови или инфузии физиологического раствора.
Введение
Верхняя брыжеечная артерия (СМА) у человека, как и у крыс, берет свое начало из брюшной аорты и снабжает кишечник артериальной кровью от двенадцатиперстной кишки до проксимальной поперечной толстой кишки. СМА порождает многочисленные ветви.
После капиллярной перфузии брыжеечное кровообращение дренируется через воротную вену в печень, где она подвергается печеночному метаболизму перед повторным поступлением в системный кровоток. Каннуляция СМА полезна для диагностических целей, терапевтической эмболизации и лекарственной инфузии избирательным или непрерывным образом для оценки влияния на кишечник или, самое главное, на метаболизм печени и химический клиренс. У людей минимально инвазивная радиологическая катетеризация СМА выполняется для эндоваскулярного лечения1 или селективной лекарственной инфузии2 с использованием нескольких чрескожных подходов, таких как трансфеморальная или трансаксиллярная пункция и канюляция.
Имеются литературные сообщения о различных методах канюляции мелких брюшных сосудов: верхней брыжеечной вены (SMV)3, нижней брыжеечной артерии (IMA)4, брыжеечного лимфатического протока5, печеночной артерии6 или исследованиях ex vivo на перфузии кишечника7 у крыс. По сравнению с венозной стороной, канюляция СМА у крыс гораздо более требовательна из-за одновременных рисков тромбоза и кровотечения, при условии ее высокого давления. В частности, проблемы возникают в случае, если канюляция находится в действии, когда крыса просыпается от анестезии на хирургической кровати и больше, если эксперимент требует свободного животного в клетке после операции.
Недавняя статья описала каннуляцию СМА как часть эксперимента (измерение артериального давления) у животного под анестезией8. Тем не менее, не описана методика хирургической канюляции СМА для длительной инфузии у неограниченного животного. Целью данной рукописи является пошаговое описание хирургической техники для долгосрочной канюляции СМА через проксимальную ветвь, которая позволяет проводить селективную инфузию лекарств в брыжеечное русло в течение не менее 24 часов (и более). Поскольку устойчивая и прочная канюляция требует постоянной перевязки и закрытия сосуда, в который вставлен катетер, этот метод вместо этого позволяет избежать введения катетера непосредственно в SMA9 и приближается к сосуду через канюляцию проксимальной ветви, как можно ближе к самому происхождению СМА из аорты. Проксимальная инфузия позволяет инфузии инфузии достичь максимально широкого анатомического русла, не закрывая кровоток через основной сосуд.
Метод каннуляции СМА крыс имеет много применений. Можно было бы избирательно вводить препараты в брыжеечный артериальный компартмент для получения местного действия на желудочно-кишечном уровне и во избежание системных эффектов и метаболизма печеночных препаратов. Модель крыс с смоляной канюляцией имеет преимущества перед более крупными моделями животных: она дешевле, она этически приемлема, и ее легче выполнять и учиться. Операцию по канюляции СМА также легче выполнить на модели крысы по сравнению с моделью мыши.
протокол
Исследования, описанные в этой рукописи, были одобрены местным Комитетом по этике животных (Università Cattolica del Sacro Cuore, Roma) и были проведены в соответствии с Министерством здравоохранения Италии.
1. Подготовка канюли к введению в проксимальную ветвь СМА
- Вырежьте большую канюлю 0,93 мм O.D,0,5 мм I.D. до необходимой длины (около 30 см).
- Разрежьте меньшую канюлю (0,4 мм O.D., 0,25 мм I.D.) примерно до 5 см в длину и вставьте ее на 1 см в большую канюлю.
- Зафиксируйте две канюли вместе цианоакрилатным клеем, избегая окклюзии просвета.
- Подключите свободную конечность большой канюли к адаптеру заглушки Luer (23 Г), установленному на шприце объемом 1 мл, заполненном солевым раствором.
- Заточите свободный кончик маленькой канюли ножницами, чтобы облегчить введение катетера в ветвь СМА.
- Проверьте проходимость канюли, промыв солевым раствором.
ПРИМЕЧАНИЕ: Острый конец канюли не повредит артерию во время движения животного, потому что она будет зафиксирована и не будет скользить по сосуду.
2. Подготовка крысы к хирургическому вмешательству
- Проводят внутримышечную анестезию кетамином/ксилазином (100/10 мг/кг).
ПРИМЕЧАНИЕ: Достаточная анестезиологическая глубина оценивается по отсутствию или почти отсутствию рефлекса защемления лапы. - Сбрите мех из хирургических областей: живот для ветви СМА-канюляции и заднюю часть шеи для выхода из канюли.
- Очистите хирургические области асептически с помощью хирургического рефлекса защемления лапы.
ПРИМЕЧАНИЕ: Вся подготовка должна проводиться асептической техникой. - скраб или раствор наносят круговыми движениями с последующим стерильным физиологическим раствором или 70% этанолом, 3 раза.
- Поместите животное в лежачее положение, обездвижив четыре конечности.
3. Каннуляция проксимальной ветви СМА
- Обеспечьте надлежащую глубину анестезии, проверив рефлекс защемления лапы перед разрезом.
- Нанесите стерильную хирургическую, водостойкую драпировку.
- Лезвием скальпеля откройте брюшную стенку прямым разрезом 3 см по средней линии мезогастральной области через все брюшные плоскости в брюшину.
- Поместите марлю, смоченную солевым раствором, вокруг разреза лапаротомии поверх хирургической драпировки. Используйте швы, чтобы держать хирургический разрез открытым.
ПРИМЕЧАНИЕ: Все мазки и хирургические инструменты должны быть стерильными. - Используйте ватные палочки для выявления и обнажения тонкой кишки. Следуйте его естественному характеру, чтобы идентифицировать брыжейку. Извлеките брыжейку из лапаротомического разреза и уложите ее вниз на марлю (рисунок 1А).
- Определите СМА, почувствовав пульсацию.
- Используйте ватные палочки, чтобы «пробиться» между брыжеечным жиром и раскрыть СМА и 2-3 его проксимальных ветвей.
- Выбирайте проксимальную ветвь СМА, достаточно большую, чтобы обеспечить хирургические маневры канюляции. Свяжите эту ветвь (шелковым швом 4-0) на 3-4 см ниже по течению от ее начала, чтобы позволить ее расширению удерживать концы шва достаточно долго, чтобы ими можно было манипулировать позже.
- Поместите жесткую опору под ветвь СМА. Ручки хирургических щипцов здесь достаточно.
- Удерживайте конечность меньшей канюли (связанной с большей канюлей на противоположной конечности) доминирующей рукой с помощью щипцов и потяните концы шва другой рукой, чтобы напрячь сосуд и облегчить вход катетера (рисунок 1B).
- Держите кончик канюли под углом 20° от плоскости сосуда в направлении, противоположном кровотоку.
- Слегка прижмите наконечник, чтобы проникнуть в стенку артерии и вставить канюлю.
ПРИМЕЧАНИЕ: Канюляция выполняется без перерезания артерии; наконечник катетера сломает стенку сосуда и облегчит вход. Кровь, текущая обратно в канюлю, подтверждает правильное введение. - Продолжайте введение канюли еще на 1 см в артериальной ветви, близкой к источнику от СМА.
- Закрепите канюлю на артерии хирургическим узлом (4-0 шелка) и проверьте ее правильное функционирование, промыв 1 мл стерильного физиологического раствора или забором крови.
4. Туннелирование канюли и размещение в системе инфузионной поддержки
- Поместите стерильную хирургическую драпировку на разрез перед изменением положения животного.
ПРИМЕЧАНИЕ: Туннель из спины в брюшную полость создается путем оказания давления в подкожном пространстве с помощью заостренного хирургического инструмента. Следует использовать стерильную хирургическую драпировку на брюшной полости и спине. - Сделайте разрез 1 см задней области шеи и разместите сферический клапан.
- Пропустите канюлю из лапаротомического доступа к клапану, размещенному в шее, через подкожные ткани (рисунок 2А). Закройте дистальную конечность канюли пробкой катетера, чтобы избежать притока воздуха.
- Заменить тонкую кишку в брюшной полости. Закройте брюшную стенку и закройте разрезы кожи сплошным 3-0 шелковым швом.
- Закрепите клапан на коже шеи швами. Закройте разрезы кожи непрерывным 3-0 шелковым швом.
5. Послеоперационное управление
- Оденьте крысу в куртку, чтобы защитить клапан пуговицы. Защитите открытую часть канюли стальным стержнем во время инфузии и закрепите ее на клапане (рисунок 2B).
ПРИМЕЧАНИЕ: Поскольку операция проводится по асептической технике, антибиотики не показаны. НПВП следует вводить в предоперационном порядке для контроля боли (5 мг/мл Мелоксикама инъекционно, 1 мг/кг один раз в сутки в течение 3 дней). После операции стабилизируют крысу в метаболической клетке на время инфузии (24 ч). Затем повторно обезболивают крысу ингаляцией изофлурана на время, необходимое для разборки инфузионной системы. Впоследствии крысу можно поместить в обычную клетку с 12-часовым циклом свет/темнота и свободным доступом к пище и воде. - Стабилизируют крысу в метаболической клетке на время инфузии. Крыса теперь проснулась и может свободно двигаться и есть в клетке.
- Подключите дистальную конечность канюли к эластомерному насосу (объем 100 мл макс., скорость потока 5,0 мл/ч), заполненному 50 мл стерильного физиологического раствора. Продолжайте инфузию в течение 24 часов (рисунок 2C).
- В первые сутки вводят внутримышечные антибиотики (энрофлоксацин 10 мг/кг в течение первых 24 ч), а затем переходят на пероральный прием (энрофлоксацин 100 мг в 500 мл в питьевой воде). Назначают обезболивающую терапию внутримышечно во время пробуждения (кетопрофен 5,0 мг/кг) и в последующие дни перорально (парацетамол 200 мг в питьевой воде).
ПРИМЕЧАНИЕ: Разбавляйте пероральную терапию, вводимую в питьевую воду, чтобы получить терпимый вкус. Контролируйте измерение массы тела и гидратацию. - В конце инфузионного времени (24 часа) разберите внешнюю инфузионную систему животного, сняв с крысы насос, рубашку, стальной стержень и клапан. Закройте и отрежьте канюлю по мере ее выхода из шеи, оставив эту конечность под кожей шеи после раневого шва.
ПРИМЕЧАНИЕ: В этой фазе может потребоваться анестезия крыс в течение нескольких минут путем вдыхания изофторана. - Поместите крысу, индивидуально, в обычную клетку с 12-часовым циклом света / темноты и свободным доступом к пище и воде.
ПРИМЕЧАНИЕ: Базовое потребление пищи после операции составляет около 30 г / день Базовое потребление воды составляет около 50 мл / день. Средний вес должен составлять около 400 мг.
Результаты
В этом исследовании процедура проводилась на 15 крысах. В конце 24 часов инфузии физиологического раствора в метаболических клетках не наблюдалось никаких признаков потери физиологического раствора или кровопотери, а рана брюшной полости была чистой у всех животных, как и клетки.
В нормальных клетках крыс наблюдали в течение 5 дней с ежедневным мониторингом веса и потребления воды / пищи. В этот период общее состояние животных при грубом осмотре было хорошим без признаков поведенческих отклонений. Все крысы сразу после операции снова начали кормиться. Среднесуточное потребление пищи и воды постепенно увеличивалось до нормы через 3 дня, как показано на рисунке 3A и 3B соответственно. На рисунке 3С можно увидеть, что прибавка в весе была регулярной, постепенно увеличиваясь до конца периода наблюдения. Никаких изменений в дефекации не происходило, и ежедневные фекалии и диурез были нормальными.
Через 24 часа остатки физиологического раствора (соответственно, 40 мл и 20 мл) остались только в 2 насосах, заполненных 50 мл физиологического раствора, в то время как все остальные (86,7%) были пустыми. Кроме того, после этого периода инфузии 12 канюль (80%) все еще функционировали как для забора крови, так и для инфузии физиологического раствора (5 мл), в то время как 3 канюли больше не были запатентованы (2 из них были канюлами, соединенными с насосами с остатком) (таблица 1).
При некропсии 100% канюль (n=15) все еще находились в ветви СМА и ни у одной крысы не имели признаков ишемии кишечника (рисунок 4В) или внутрибрюшного кровотечения. 3 закупоренные канюли были найдены искривленными соответственно на 0,5 см, 1 см и 1,5 см от вставки в ветвь СМА. Это явление, вероятно, связано с перемещениями животных в клетках.
У 5 крыс сразу после процедуры и перед подключением насоса в брыжеечную канюлю вводили 2 мл йодированного контрастного вещества, для получения ангиографии через усилитель изображения (ангиография проводилась интраоперационно). У каждой крысы (n=5) было возможно увидеть брыжеечный артериальный круг и СМА и ее основные ветви без распространения контрастного вещества в брюшной полости, как показано на рисунке 4А. Это подтвердило, что канюля была хорошо размещена и закреплена на ветке СМА.

Рисунок 1: Экспериментальные фотографии. (А) тонкая кишка, следуя своему естественному расположению на марле (можно визуализировать СМА со всеми ветвями); (B) Оператор, вставляющий канюлю в ветвь СМА. Необходимо иметь прочную опору под сосудом, чтобы гарантировать вставку трубки. Дистальный шелковый шов закрывает сосуд, а проксимальный фиксирует катетер внутри ветви. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Система инфузионной поддержки. А) после туннелирования подкожно канюля выходит из задней области шеи через белый клапан; (B) Крыса, одетая в куртку для стабилизации белого клапана. Стальной стержень защищает катетер во время инфузии. (C) Диаграммное изображение крысы, содержащейся в метаболической клетке во время инфузии физиологического раствора с эластомерным насосом, соединенным с канюлей, выходящей из стального стержня. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Репрезентативные данные о потреблении пищи, потреблении воды и прибавке в весе крыс (n=15) в период наблюдения 5 дней. Среднесуточное потребление пищи (А) и воды (В) постепенно увеличивается, и оно стабилизируется на физиологическом уровне через 3 дня. Средняя прибавка в весе (С) постепенно увеличивается до конца периода наблюдения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
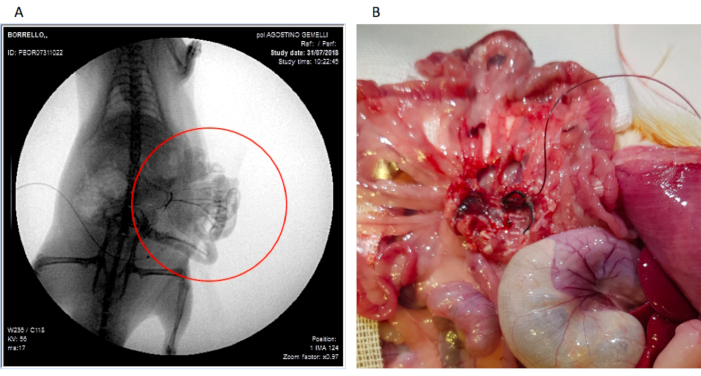
Рисунок 4: Фотографии (А) контрастной ангиографии брыжеечной артериальной области после контрастной инфузии через канюлю (доказательство адекватно расположенной канюли) и (В) канюли, все еще хорошо расположенной во время вскрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Эластомерный насос | Канюля | |||
| Пустой | С остатками | Патент | Не патентован | |
| n=15 | 13 | 2 | 12 | 3 |
| % | 86.7 | 13.3 | 80 | 20 |
Таблица 1: Разряд эластомерного насоса и проходимость канюли после 24 часов инфузии физиологического раствора. Проходимость проверяли путем взятия крови шприцем и введения 5 мл физиологического раствора в канюлю.
Обсуждение
Основным преимуществом этой модели инфузии СМА для крыс является ее стойкость и долговечность в течение не менее 24 часов у подавляющего большинства животных. Инфузия антикоагулянта может удлинить этот временной интервал. Модель позволяет проводить достоверную инфузию препаратов избирательно в брыжеечную область, нацеливаясь на тонкую кишку и проксимальную часть толстой кишки.
Несколько шагов имеют решающее значение для успеха техники. Для достижения канюляции в очень маленьком сосуде важно отбирать крыс весом не менее 400 г; пол и возраст не имеют значения. Также важно правильно выбрать хирургические инструменты и тип канюли. Здесь меньшая полиуретановая канюля (0,4 мм O.D, 0,25 мм I.D.) вставляется на 1 см в большую канюлю (0,93 мм O.D, 0,5 мм I.D.) для получения функционального и полезного катетера, позволяющего как соединения с малой артерией, так и с более крупной инфузионной системой.
Первым хирургическим критическим этапом является очистка СМА и ветви, идентифицированной для канюляции, из окружающей жировой ткани (этап 3.5). Это помогает избежать введения канюли между тканью и артерией, что является распространенной ошибкой. Однако этот этап очистки сложен, так как маленькая ветвь СМА хрупкая и легко повреждается. Если ветка травмирована, можно остановить кровотечение лигатурой и выбрать другую проксимальную ветвь, чтобы не тратить животное впустую.
Чтобы предотвратить образование пузырьков воздуха внутри канюли и избежать газовой эмболии, канюля должна быть заполнена физиологическим раствором до кончика перед введением в ветку. Чтобы закрепить канюлю на месте, нанесение хирургической нити (4-0 шелка) должно быть между точкой введения в артерию и кончиком канюли, непосредственно поверх сосуда вокруг катетера. Хирургический узел должен быть достаточно плотным, чтобы зафиксировать канюлю, но не слишком плотным, чтобы закрыть его (шаг 3.12).
Лучший способ обеспечить правильную каннуляцию - увидеть кровоток обратно через канюлю (шаг 3.10). С точки зрения устранения неполадок, если этого не происходит, это может быть связано со следующими причинами:
канюля была неправильно вставлена в артерию;
канюля находится внутри артерии, но закупорена узлом в неправильном положении;
канюля находится внутри артерии, а пузырь воздуха в канюле замедляет поток;
сгусток образовался внутри канюли.
Неправильное введение может быть связано с расположением канюли в пространстве между артерией и жировой тканью. В этом случае необходима повторная вставка. Когда узел над сосудом закупоривает канюлю, можно очень осторожно ее развязать и переделать. Небольшие пузырьки воздуха в катетере, как правило, не ставят под угрозу канюляцию и не опасны для жизни; но если в канюле есть большой пузырь воздуха, необходимо оттянуть канюлю с помощью шприца или перепозиционировать катетер в другой ветви. Обычно можно избежать образования сгустков и сохранить патент канюли, вливая болюсы физиологического раствора в 0,2 мл время от времени во время работы.
Ограничением этого исследования является недооценка проходимости канюли в более длительное время инфузии: здесь 24-часовая инфузия была выполнена, когда крысы были размещены в метаболической клетке. Для получения более длительного инфузионного периода может быть полезно использовать антикоагулянтную терапию, не назначаемую в данном исследовании. Однако во время инфузии крыса должна быть размещена в метаболической клетке, потому что она единственная, которая поддерживает инфузионную систему. Это место неудобно для животного, которое может испытывать стресс при лечении в течение более длительного периода. Кроме того, для инфузии использовался только физиологический раствор, поэтому нет никаких результатов о конкретном введении препарата. Одним из ограничений метода является невозможность вливания в артериальные ветви (если они присутствуют) выше того, что используется для катетера. По этой причине рекомендуется каннюлировать ближайшую ветвь от аорты.
Ни одна другая модель долгосрочной инфузии СМА крыс для неограниченных животных не присутствует в литературе. По сравнению с моделью канюляции IMA, описанной много лет назад4, описанный здесь метод имеет более широкую экспериментальную цель, поскольку он позволяет инфузию лекарств в области перфузии СМА и не ограничивается толстой кишкой. Недавно впервые селективная канюляция ветви СМА была использована для инфузии ботулотоксина непосредственно в артериальной брыжеечной области для изучения влияния на гладкую мускулатуру кишечника10, но многие другие препараты могут быть опробованы в будущем. Например, антикоагулянты могут быть введены для изучения брыжеечного тромбоза, или препараты с действием кишечной микробиоты11 или даже препараты от воспалительных заболеваний кишечника12. Внутриартериальная инфузия полезна, в частности, для исследований кишечного метаболизма, потому что эффект препарата оценителен до того, как кровь пройдет через портальное кровообращение, где она подвержена печеночному метаболизму.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы отметить Cen.Ri.S. (Centro di ricerche sperimentali) Католического университета Сакро Куоре в Риме для получения разрешений.
Материалы
| Name | Company | Catalog Number | Comments |
| Crile-Wood Needle Holder | 2Biological Instruments | Tip Shape: Straight; Tip Width: 2 mm; Clamping Length: 14 mm; Lock: Yes; Scissors: No; Alloy / Material: Stainless Steel; Length: 15 cm; Serrated: Yes | |
| Extra Fine Graefe Forceps | 2Biological Instruments | Tip Width: 0.5 mm; Tip Dimensions: 0.5 x 0.5 mm; Alloy / Material: Stainless Steel; Length: 10 cm | |
| Luer Stub Adapter | BD Intramedic | 23 gauge for use with 427410 tubing | |
| Membrane valve | Biomed | Mod 617 | |
| Poliurethane Catheter | ENKI | external diameter: 0.4 mm, internal diameter: 0.25 mm | |
| Silastic Catheter Laboratory tubing | Healthcare industries | 508-002 | |
| Spring Scissors | 2Biological Instruments | Tip Shape: Angled; Tips: Sharp; Alloy / Material: Stainless Steel | |
| Student Surgical Scissors | 2Biological Instruments | Tip Shape: Straight; Alloy / Material: Student Stainless Steel; Serrated: No; Feature: Student Quality |
Ссылки
- Zhang, Z., Chen, X., Zhu, R. Percutaneous mechanical thrombectomy treatment of acute superior mesenteric artery embolism. European Journal of Vascular and Endovascular Surgery Short Reports. 34, 17-20 (2017).
- Wang, M. Q., et al. Transradial approach for transcatheter selective superior mesenteric artery urokinase infusion therapy in patients with acute extensive portal and superior mesenteric vein thrombosis. Cardiovascular and Interventional Radiology. 33 (1), 80-89 (2010).
- Zammit, M., Toledo-Pereyra, L. H., Malcom, S., Konde, W. N. Long-term cranial mesenteric vein cannulation in the rat. Laboratory Animal Science. 29 (3), 364-366 (1979).
- Aguiar, J. L. A., et al. Technique for long-term infusion into the inferior mesenteric artery of unrestrained rats. Laboratory Animals. 22 (2), 173-176 (1988).
- Trevaskis, N. L., Hu, L., Caliph, S. M., Han, S., Porter, C. J. The mesenteric lymph duct cannulated rat model: application to the assessment of intestinal lymphatic drug transport. Journal of Visualized Experiments. (97), e52389 (2015).
- Leivestad, O., Malt, R. A. Continuous infusion into the hepatic artery and vena cava of the rat. Surgery. 74 (3), 401-404 (1973).
- Eloy, R., et al. Ex vivo vascular perfusion of the isolated rat small bowel. Importance of the intestinal brush border enzyme-release in basal conditions. European Surgical Research. 9 (2), 96-112 (1977).
- Liu, R. N., Wei, X. J., Li, S. P., Jiang, C., Zhao, Y. Comparison of invasive dynamic blood pressure between superior mesenteric artery and common carotid artery in rats. World Journal of Emergency Medicine. 11 (2), 102-108 (2020).
- Leung, F. W., et al. Superior mesenteric artery is more important than inferior mesenteric artery in maintaining colonic mucosal perfusion and integrity in rats. Digestive Diseases and Sciences. 37 (9), 1329-1335 (1992).
- Gui, D., et al. Mesenteric artery botulinum toxin (BoNT/A1) infusion selectively blocks bowel peristalsis in rats. Journal of the American Chemical Society. 231 (4), 19-20 (2020).
- Lecomte, V., et al. Changes in gut microbiota in rats fed a high fat diet correlate with obesity-associated metabolic parameters. PLoS One. 10 (5), 0126931 (2015).
- Hajj Hussein, I. A., et al. Inflammatory bowel disease in rats: bacterial and chemical interaction. World Journal of Gastroenterology. 14 (25), 4028-4039 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены