Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка клеточных экстрактов cryogrinding в автоматизированной морозильной мельницы
В этой статье
Резюме
Мы описываем надежный метод приготовления экстрактов целых клеток из дрожжей или других клеток с использованием криогенной морозильной мельницы, которая сводит к минимуму деградацию и денатурацию белков. Клеточные экстракты подходят для очистки функциональных белковых комплексов, протеомных анализов, исследований совместного иммунопреципиентации и обнаружения модификаций половых белков.
Аннотация
Легкость генетических манипуляций и сильное эволюционное сохранение эукариотических клеточных машин в начинающих дрожжей Saccharomyces cerevisiae сделал его выдающимся генетическим моделью организма. Однако, поскольку эффективная белковая изоляция зависит от оптимального нарушения клеток, использование дрожжей для биохимического анализа клеточных белков затрудняется его клеточной стеной, которая дорого усваивается энзиматично (с помощью литиказы или зимолязы), и трудно нарушить механически (с помощью традиционного биение бисера, французский пресс или кофемолка), не вызывая нагрева образцов, что, в свою очередь, вызывает белок денатурации. Хотя ручная шлифовка дрожжевых клеток под жидким азотом (LN2) с использованием раствора и пестика позволяет избежать перегрева образцов, она является трудоемкой и подвержена изменчивости в клеточном лизе между операторами. На протяжении многих лет мы успешно готовим высококачественные дрожжевые экстракты с использованием криогринда клеток в автоматизированной морозильной фабрике. Температура -196 градусов по Цельсию, достигнутая с использованием LN2, защищает биологический материал от деградации протеазами и ядрами, позволяя извлекать нетронутые белки, нуклеиновые кислоты и другие макромолекулы. Здесь мы описываем этот метод подробно для начинающих дрожжевых клеток, который включает в себя первое замораживание суспензии клеток в буфере лиза через его капельное добавление в LN2 для генерации замороженных капель клеток, известных как "попкорн". Этот попкорн затем распыляется под LN 2 в морозильной камеремельницы для создания замороженных "порошкообразных" экстракт, который тает медленно и уточняется центрифугации для удаления нерастворимого мусора. Полученные экстракты готовы к применению ниже по течению, такие как очищение белка или нуклеиновой кислоты, протеомные анализы или исследования совместной иммунопреципиентации. Этот метод широко применим для подготовки клеточного экстракта из различных микроорганизмов, тканей растений и животных, морских образцов, включая кораллы, а также изоляции ДНК/РНК от судебно-медицинских и вечной мерзлоты ископаемых образцов.
Введение
Дрожжи является популярной моделью организма для белковых исследований, так как это простой эукариотический организм с обилием генетических и биохимических инструментов, доступных дляисследователей 1. Из-за их прочной клеточной стенки, одна из проблем, с которыми сталкиваются исследователи, заключается в эффективном обливке клеток, не повреждая содержимое клеток. Различные методы доступны для получения белковых экстрактов путем нарушения дрожжевых клеток, которые включают в себя энзиматическийлиз (зимоляза)2,3,химическийлиз4,физическийлиз при замораживании оттепели5, давление на основе(французская пресса) 6,7 ,механические(стеклянные бусы, кофемолка)8,9, sonicationоснове 10 и криогенные2,11. Эффективность клеточного лиза и урожайность белка могут значительно варьироваться в зависимости от используемой техники, что влияет на конечный результат или пригодность для желаемого применения ниже по течению для лизата. При изучении нестабильных белков, которые имеют мимолетные посттрансляционные изменения или чувствительны к температуре, особенно важно использовать метод, который позволит свести к минимуму потерю или деградацию образца во время подготовки.
| Техника приготовления экстракта | Детали | Преимущества | Недостатки | Анализ вниз по течению | Ссылки |
| Французская пресса: Гомогенизатор высокого давления (он же Microfluidizer) с ферментативной предварительной обработкой с помощью зимолязы | Зимоляза-20Т, микрофлюидизатор с высоким давлением гомогенизатора. Разрушитель состоит из насоса высокого давления, управляемого воздухом (коэффициент 1:250; требуемое давление воздуха 0,6 л MPa) и специальной камеры нарушения с дополнительным блоком давления спины. Для обработки требуется минимальный размер выборки 20 мл. | Окончательное полное нарушение, полученное с помощью комбинированного протокола, приблизилось к 100% с 4 проходами под давлением 95 MPa, по сравнению с только 32% нарушением с 4 проходами на 95 MPa, используя только гомогенизацию без зимолязы. | Не подходит для небольших приложений. Ферменты могут стать дорогими для крупномасштабных препаратов. | Очищение белка | 6 |
| Бид заготовитель: ymolyase обработанные клетки lysed со стеклянными бусинками в fastprep инструмент | Примерно равный объем холодных, сухих, промытых кислотой стеклянных бусинок калибра 0,5 мм добавляется к данному объему клеточных гранул в буфере лиза, а клетки нарушаются энергичным ручным возбуждением. | Это особенно полезно при принятии экстрактов из различных малых культур дрожжей для анализа целей, а не для очистки белка. | Во время процедуры стеклянной шарика, белки обрабатываются жестко вызывая обширную пену, ведущую к денатурации белка. Количество поломки клеток варьируется, в то время как протеолиза, а также модификации белков может возникнуть в результате нагрева экстракта выше 4 градусов по Цельсию во время механической поломки. | Главным образом анализы дна и РНК, но также анализ протеина путем denaturing электрофеорез геля, или с или без западного blotting. | 8 |
| Лечение зимолязы с последующим лизом с использованием комбинации осмотического шока и гомогенизации Dounce | После энзиматического пищеварения клеточных стенок, сферопласты лизаются от 15 до 20 ударов плотно облегающего пестика (клиренс от 1 до 3 мкм) в гомогенизаторе Dounce. | Выгодно использовать штаммы с дефицитом протеазы, такие как BJ926 или EJ101. Это самый мягкий способ сломать дрожжевые клетки и, следовательно, он наиболее подходит для подготовки экстрактов, которые могут выполнять сложные энзиматические функции (например, перевод, транскрипция, репликация ДНК) и в которых целостность макромолекулярных структур (например, рибосомы, сращивания) должна быть сохранена. Он также полезен для изоляции нетронутых ядер, которые могут быть использованы для исследования хроматина (Bloom and Carbon, 1982) или для экстрактов ядерного белка (Lue and Kornberg, 1987). | Основными недостатками процедуры лиза сферопласта являются то, что она является относительно утомительной и дорогостоящей, особенно для крупномасштабных препаратов (10 литров), а длительные инкубационые периоды могут привести к протеолизу или модификации белка. Для препаратов хроматина, они, кажется, различного или более низкого качества, чем те, которые производятся дифференциальной центрифугации (на основе целостности нуклеосомной лестницы). | Изоляция нетронутых ядер для исследований хроматина, экстракты, которые могут выполнять сложные энзиматические функции, экстракты, требующие целостности макромолекулярные структуры, экстракты ядерного белка. | 2 |
| Нарушение клеток флэш-замороженных клеток путем измельчения в жидком азоте с помощью раствора / пестика или блендера | Клетки замораживаются сразу же в жидком азоте, а затем лися путем шлифования вручную в ступке с помощью пестика, или с помощью блендера Waring в присутствии жидкого азота. | Протокол быстрый и простой. Он может вместить различное количество дрожжевых клеток, включая очень большие культуры. Его основным преимуществом является то, что клетки сразу же принимаются из активно растущего состояния в жидкий азот (196 градусов по Цельсию), уменьшая деградативную активность ферментов, таких как протеазы и нуклеазы, а также действия, которые изменяют белки (например, фосфаты и киназы). Он особенно подходит для изготовления цельноклеточных экстрактов из одной дрожжевой культуры для крупномасштабной очистки белка. | Немного грязный и потенциально опасный для небрежного следователя. Небольшие образцы (т.е. от 10 до 100 мл дрожжевых культур) не легко обрабатываются, потому что не хватает массы замороженных клеточных комков, чтобы эффективно сломаться в блендере. Это занимает много времени для обработки отдельных образцов и очистки оборудования между использованиями. | Цельноклеточные экстракты из одной дрожжевой культуры для крупномасштабной очистки белка. | 2 |
| Автолиз, бисероплетенка | рН 5,0, 50 градусов по Цельсию, 24 ч, 200 об/мин / 0,5 мм, 5 × 3 мин/3 мин | Быстрый и эффективныйлиз, особенно для мелкомасштабной подготовки экстракта | Тепловая генерация приводит к денатурации и деградации макромолекул. Биб избиение оборудования требуется. | Анализ малых масштабов. | 10 |
| Автолиз, Соникация | рН 5,0, 50 градусов по Цельсию, 24 ч, 200 об/мин, 4 × 5 мин/2 мин, импульс 80%, мощность 80% | Оборудование Sonication обычно доступно в большинстве учреждений. | Тепловая генерация приводит к денатурации и деградации макромолекул. Требуется звуковое оборудование. Медленныйлиз может занять более 24 часов. | Препараты дрожжевой клетки стенки. | |
| Процесс кипения и замораживания оттепели | Никакое специализированное оборудование не требуется, кроме стандартной морозильной камеры и отопительного блока или горячей водяной ванны. | Эффективный, воспроизводимый, простой и недорогой. | Тепловая генерация приводит к денатурации и деградации макромолекул. | Анализ ДНК ПЦР. | 5 |
Таблица 1: Сравнение методов, доступных для приготовления дрожжевых экстрактов.
Криогриндирование (также известное как криогенное измельчение/криогенное фрезерование) обычно используется для извлечения нуклеиновых кислот, белков или химических веществ из чувствительных к температуре образцов надежным образом для количественного или качественного анализа. Он успешно используется для различных применений в различных областях, включая биотехнологии, токсикологии,судебно-медицинской экспертизы 12,13, экологическая наука,биология растений 14 и пищевой науки. Изоляция нетронутых биологических макромолекул обычно критически зависит от температуры. Чрезвычайно низкие температуры гарантируют, что протеазы и нуклеазы остаются неактивными, что приводит к надежной изоляции нетронутых белков, нуклеиновых кислот и других макромолекул для последующего анализа. Действительно, морозильная мельница обычно поддерживает температуру образца -196 градусов по Цельсию (точка кипения LN2), тем самым минимизируя ДНК/РНК или денатурацию и деградацию белка.
Морозильная мельница использует электромагнитную шлифовальную камеру, которая быстро перемещает твердый металлический бар или цилиндр туда и обратно в флаконе, содержащем образец, который будет распылен между пробками из нержавеющей стали. Инструмент создает и быстро меняет магнитное поле в шлифовальной камере. По мере того как магнитное поле смещает назад и вперед, магнит давит образец против штепсельной вилки таким образом достигая «криогриндировать» и pulverization попкорна. Морозильная мельница заменяет раствор и пестик и позволяет последовательной обработки нескольких образцов (или до 4 небольших образцов одновременно) с высокой воспроизводимости и позволяет избежать вариативности от пользователя к пользователю, связанные с ручной шлифовки. После обработки образцов экстракты клеток могут быть использованы для различных приложений ниже по течению.
протокол
1. Подготовка дрожжевого попкорна
- Выращиваем дрожжевые клетки в 0,5 л YPD-медиа с плотностью 1 х 107 клеток/мл. Подсчитайте ячейки с помощью счетчика Коултера или любых других средств.
- Центрифуги клетки в течение 10 мин при 2400 г и 4 градусов по Цельсию.
- Вымойте каждый образец один раз с 500 мл ледяной деионизированной 18 мега Ohm Милли-З воды.
- Resuspend гранулы в 15 мл ледяного Lysis Buffer No 20 мМ HEPES-KOH рН 7,5, 110 мМ ККл, 0,1% Tween, 10% глицерол, со свежеприложенным уменьшая агентом 10 мМ β-меркаптоэтанол, ингибитор протеазы коктейль, 10 ингибитор протеасомы МК-132, 1 мМ деацетилаза ингибитор ингибитора натрия бутират и ингибиторы фосфатазы (1 мМ натрия ванадат, 50 мМ фторид натрия, 50 мМ натрия β-глицерофосфат) . Дополнительную информацию можно посмотреть в таблице материалов. Храните повторно натучные ячейки на льду до тех пор, пока образцы не будут готовы к следующему шагу.
ПРИМЕЧАНИЕ: Широкий спектр буферов лиза, содержащих ряд неионных моющих средств, может быть использован с образцами и конкретными ингибиторами, включенными в него на основе применения ниже по течению. Включение протеазы и протеасомных ингибиторов имеет решающее значение для предотвращения деградации белка, особенно после размораживания экстрактов. - Сделать оснастки замороженных дрожжей попкорн, медленно добавляя клеточной подвески одну каплю за один раз с помощью предварительно охлажденной серологической пипетки в один или несколько 50 мл центрифуги трубки хранятся на сухом льду и заполнены LN2 до чуть ниже обода. Пополнить жидкий азот в трубке часто, чтобы компенсировать его потери из-за быстрого испарения. Работайте в хорошо проветриваемом помещении, чтобы избежать опасностей, связанных с удушьем азота.
- Вместо 50 мл трубки, использовать несколько 50 мл трубки связаны друг с другом (или любой контейнер с большим ртом, таких как большая пластиковая бутылка центрифуги, которые могут терпеть криогенные температуры) для поп-кукурузы подготовки (Рисунок 1A). Чем больше контейнер и его открытие, тем легче подготовка попкорна, так как это предотвращает слипание попкорна, чтобы сформировать большие агрегаты. Диапазон размеров 0,3-0,5 см для попкорна идеально подходит для достижения надлежащего измельчения / пульверизации с помощью морозильной мельницы (рисунок 1B).
- Убедитесь, что LN2 полностью испарился из трубок, содержащих попкорн до хранения их при -80 градусов по Цельсию. Можно остановиться после приготовления дрожжевого попкорна, так как они стабильны в течение нескольких лет при поддержке при -80 градусов по Цельсию.

Рисунок 1: Приготовление дрожжевого попкорна. (A) Дрожжи "попкорн" делается путем dropwise замораживания подвески клетки в LN2. Мы используем от одного до трех 50 мл труб, удерживаемых вместе с резинкой и помещенных в ведро со льдом, наполненное сухим льдом. Трубки заполнены LN2 до чуть ниже их диски и пополнен жидким азотом часто держать их почти полным, пока все ячейки подвески были сделаны в попкорн (B) Размер попкорна является важным фактором, определяющим оптимальную эффективность шлифования. Диапазон размеров попкорна должен быть от 0,3 до 0,5 см в диаметре. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Криогриндирование
- Для начала убедитесь, что существует достаточно LN2 доступны для охлаждения морозильной мельницы, шлифовальные флаконы, материалы и для работы машины для всех образцов. Менее чем для пяти образцов, 30-35 L LN2 должно быть достаточно. Заполните морозильную камеру мельницыс LN 2 до заполнения линии.
ВНИМАНИЕ: Все шаги с участием LN2 должны быть выполнены в хорошо проветриваемой области и морозильная мельница сама должна быть расположена в такой области, чтобы избежать риска удушья. Носите средства индивидуальной защиты, включая правильную обувь, лабораторное пальто, защитные очки, базовый слой нитриальных перчаток, затем тепловые перчатки, а затем еще пару нитриальных перчаток. Используйте крайнюю осторожность при обработке LN2. - Закройте крышку морозильной камеры мельницы медленно, избегая всплескаLN 2 и дайте несколько минут для машины, чтобы остыть. Возможно, необходимо пополнить камеру LN2, чтобы компенсировать потери из-за испарения, прежде чем приступить к следующему шагу.
ПРИМЕЧАНИЕ: Пополнить LN2 по мере необходимости только до заполнения линии. Не переполнять камеру, так как это может быть как опасным, так и вредным для машины. Автоматизированные системы заправки доступны для морозильной мельницы, которая может пополнить испаряющиеся LN2 по мере необходимости непосредственно из резервуара для хранения, подключенного к морозильной мельнице. - Предварительно охладить большие шлифовальные флаконы и магнитный ударный бар, dunking их в LN2 хранится в отдельной небольшой dewar. Decant все LN2, когда LN2 останавливается восходящей. Затем добавьте образец / дрожжевой попкорн в шлифовальный флакон и запечатать его плотно с двумя пробками конца из нержавеющей стали.
- Не заполнять более одной трети шлифовального флакона с образцом, так как это может снизить эффективность шлифования. Вместо этого, большие образцы могут быть обработаны путем деления их на два или более флаконов и шлифовальные их последовательно. Меньшие шлифовальные флаконы можно использовать для небольших образцов (до 3 мл).
- Поместите шлифовальный флакон в морозильную камеру мельницы и заблокив его на месте. Закройте крышку.
- Для начинающих дрожжей, молоть образцы в общей сложности три цикла в течение 2 мин / цикл (с 2 мин перерыва для охлаждения между циклами) с дробления скорость 14. Когда машина останавливается после завершения циклов, открыть крышку морозильной камеры мельницы медленно и тщательно разблокировать флакон с порошкообразной замороженной ячейки лизолировать и удалить его из морозильной камеры мельницы. Если используется несколько небольших флаконов, работайте быстро, чтобы удалить один флакон за один раз и поместить их в сухой лед.
ПРИМЕЧАНИЕ: Обычно нет необходимости корректировать параметры шлифования при использовании флаконов разных размеров с одним и тем же типом образца. Тем не менее, параметры шлифования, такие как количество циклов и скорость шлифования должны быть эмпирически определены для различных типов образцов, в зависимости от легкости, с которой они лиза. Большинство клеток млекопитающих и мягких тканей будут лизировать в 1-2 циклов с дробильной скоростью 10. Труднее лизировать образцы, такие как бактерии, дрожжи, личинки мух и взрослых плодовых мушек требуют 3-6 циклов с максимальной скоростью, в то время как твердые ткани, такие как кости, зубы и т.д. может потребоваться до 10 циклов. Небольшую алициту разморожевания образца можно просмотреть под микроскопом до и после измельчения, чтобы подсчитать количество нетронутых, неподозренных клеток для определения эффективности лиза. Отличный анализ влияния криогриндных параметров на высвобождение белков и ДНК из начинающих дрожжей был опубликован ранее15. - Работая быстро, чтобы не позволить образцу оттаять, тщательно отвинтить один из конечных частей (выбрать тот, который, как представляется, стали несколько свободно во время шлифования) с помощью инструмента открытия. Затем используйте пару длинных типсов (которые предварительно охлаждаются в ведро с сухим льдом), чтобы удалить ударный бар. Соберите распыленный образец путем инвертирования и нажав шлифовальный флакон на полистирол весом блюдо предварительно охлажденный с LN2 и хранится на сухом льду.
- После того, как все порошкообразные замороженные клетки ликат был извлечен из шлифовального флакона, залить порошкообразный лизат из взвешивания блюдо обратно в 50 мл трубки и немедленно приступить к медленной оттаивания шаг описан следующий для лучших результатов. Кроме того, хранить замороженные порошкообразные лисировать на ночь при -80 градусов по Цельсию, хотя это может привести к некоторой деградации.
- Приготовьте ведро со льдом с 50% суспензией льда и воды и поместите его на тарелку с магнитным мешалки. Погрузите проволочную стойку или другую подходящую стойку в ледяную суспензию, чтобы держать образцы.
- Затем медленно оттаивать образцы на ледяной ванне суспензии с постоянным возбуждением суспензии с помощью магнитного мешалки. Добавить больше льда, чтобы заменить таяние льда (некоторые воды, возможно, потребуется отказаться, чтобы предотвратить лед ведро от переполнения). Так как несколько ингибиторов имеют короткую половину жизни в аквеозных буферах, добавьте дополнительный ингибитор протеазы коктейль (см. Таблица материалов)и 10 МК протеасомный ингибитор MG-132 к лизате, как только образцы начинают оттаивать (примерно через 30 мин).
- Удалите лед, образоваваемый на внешней стороне труб каждые 5 минут, чтобы ускорить процесс оттаивания. Обратите внимание, что быстрое оттаивание образцов при комнатной температуре или выше может привести к значительной деградации.
- После того, как образцы полностью разморозятся (это может занять более часа в зависимости от количества образца), центрифуга лизатата на 3220 г в течение 20 мин в рефрижераторной центрифуге столешницы при 4 градусов по Цельсию, чтобы удалить большую часть клеточного мусора из лизата.
- Перенесите супернатант на поликарбонатные центрифуги 50 мл, предварительно охлажденные на льду, и центрифугировать образцы при 16 000 г в течение 20 мин при 4 градусах по Цельсию (см. таблицу материалов).
- Передача только ясного супернатанта, состоящего из очищенного экстракта всей клетки из центра жидкой колонки в трубке очень медленно и осторожно, не нарушая мутный липидныйслой (рисунок 2), в охлажденную трубку 15 мл с использованием предварительно охлажденных серологических пипеток. Избегайте удаления всех лисят в центрифуге трубки для предотвращения переноски липидов и мусора. Оставшийся лисат в центрифуге трубки может быть центрифугирован несколько раз, чтобы восстановить небольшое количество экстракта после каждого спина.
ПРИМЕЧАНИЕ: Липиды вместе с любыми денатурированными белками будут казаться облачными/молочными и расположены в верхней части жидко-воздушного интерфейса, а иногда и над самой гранулой, которая состоит из нерастворимого клеточногомусора (рисунок 2).
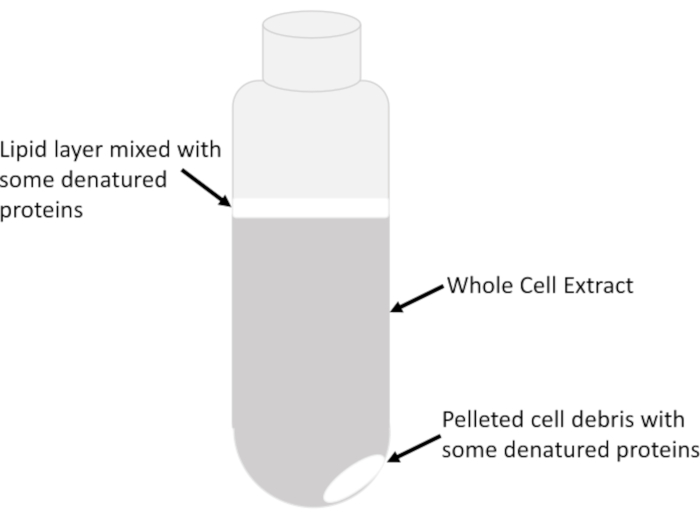
Рисунок 2: Экстракт слоев в центрифуге трубки. Показаны основные видимые особенности экстракта всей клетки в трубке после центрифугации в 16 000 г в течение 20 мин. Относительное изобилие каждой функции зависит от типа выборки, фазы роста ячеек (экспоненциальной по сравнению со стационарной), количества буфера лиза, используемого для повторного использования ячеек, и эффективности лиза. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Центрифуга любого оставшегося лизата в течение 5 минут, чтобы восстановить больше экстракта. Повторите это 5 мин центрифугации несколько раз, если это необходимо, чтобы восстановить как можно больше четкого экстракта, как это возможно. Отбросьте облачный лисат, содержащий липиды, близко к нижней части трубки рядом с гранулами.
- Используйте эти экстракты для нисходящего применения, таких как белковая комплексная очистка, иммунопреципиентация и протеомный анализ.
Результаты
Мы сравнили два различных метода для лиза дрожжевых клеток, а именно стеклянный бисер фрезерования при 4 градусов по Цельсию и автоматизированный метод криогринда при -196 градусов по Цельсию, чтобы оценить относительное восстановление белков в клеточных экстрактов, п?...
Обсуждение
Ограничением изучения местных белков из дрожжей является неэффективныйлиз дрожжевых клеток из-за их жесткой клеточной стенки. Хотя несколько методов были разработаны, наиболее последовательным и эффективным методом в наших руках является криогринирование дрожжевых клеток вспышки з...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Исследования в лаборатории Гунджана поддерживаются за счет средств Национальных институтов здравоохранения, Национального научного фонда и Департамента здравоохранения Флориды. Мы благодарим студента Джона Паркера за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 mL polycarbonate tubes with screw caps | Beckman | 357002 | Centrifuge tubes |
| BD Bacto Peptone | BD Biosiences | 211677 | Yeast YPD media component |
| BD Bacto Yeast Extract | BD Biosiences | 212750 | Yeast YPD media component |
| Beckman Avanti centrifuge | Beckman | B38624 | High speed centrifuge |
| Beckman JLA-9.1000 | Beckman | 366754 | Rotor |
| D-(+)-Dextrose Anhydrous | MP Biomedicals | 901521 | Yeast YPD media component |
| Eppendorf A-4-44 | Eppendorf | 22637461 | Swinging bucket rotor |
| Eppendorf refrigerated centrifuge 5810 R | Eppendorf | 22625101 | Refrigerated centrifuge |
| Glycerol | SIGMA-ALDRICH | G5150-1GA | Volume excluder and cryoprotectant |
| HEPES | FisherBiotech | BP310-100 | Buffer |
| HIS6 antibody | Novagen | 70796 | Antibody for HIS tag |
| KCl | SIGMA-ALDRICH | P9541-1KG | Salt for maintaining ionic strength |
| MG-132 | CALBIOCHEM | 474790 | Proteasome Inhibitor |
| Phosphatase inhibitor cocktail | ThermoFisher Scientific | A32957 | Phosphatase inhibitor cocktail |
| Ponceau S | SIGMA | P7170-1L | Protein Stain |
| Protease inhibitor cocktail | ThermoFisher Scientific | A32963 | Protease inhibitor cocktail |
| Rotor JLA 25.500 | Beckman | JLA 25.500 | Rotor |
| Sodium Butyrate | EM Science | BX2165-1 | Histone Deacetylase Inhibitor |
| Sodium Fluoride | Sigma-Aldrich | S6521 | Phosphatase Inhibitor |
| Sodium Vanadate | MP Biomedicals | 159664 | Phosphatase Inhibitor |
| Sodium β-glycerophosphate | Alfa Aesar | 13408-09-8 | Phosphatase Inhibitor |
| Spex Certiprep 6850 freezer mill | SPEX Sample Prep | 6850 | Freezer Mill |
| TALON Metal Affinity Resin | BD Biosiences | 635502 | For pulling down HIS tagged proteins |
| Tween 20 | VWR International | VW1521-07 | Non-ionic detergent |
| β-Mercaptoethanol | AMRESCO | M131-250ML | Reducing agent |
Ссылки
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Dunn, B., Wobbe, C. R. Preparation of protein extracts from yeast. Current Protocols in Molecular Biology. , (2001).
- Holm, C., Meeks-Wagner, D. W., Fangman, W. L., Botstein, D. A rapid, efficient method for isolating DNA from yeast. Gene. 42 (2), 169-173 (1986).
- Nandakumar, M. P., Marten, M. R. Comparison of lysis methods and preparation protocols for one- and two-dimensional electrophoresis of Aspergillus oryzae intracellular proteins. Electrophoresis. 23 (14), 2216-2222 (2002).
- Silva, G. A. D., Bernardi, T. L., Schaker, P. D. C., Menegotto, M., Valente, P. Rapid yeast DNA extraction by boiling and freeze-thawing without using chemical reagents and DNA purification. Brazilian Archives of Biology and Technology. 55, 319-327 (2012).
- Baldwin, C., Robinson, C. W. Disruption of Saccharomyces cerevisiae using enzymatic lysis combined with high-pressure homogenization. Biotechnology Techniques. 4 (5), 329-334 (1990).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hudspeth, M. E., Shumard, D. S., Tatti, K. M., Grossman, L. I. Rapid purification of yeast mitochondrial DNA in high yield. Biochimica et Biophysica Acta. 610 (2), 221-228 (1980).
- Szymanski, E. P., Kerscher, O. Budding yeast protein extraction and purification for the study of function, interactions, and post-translational modifications. Journal of Visualized Experiments. (80), e50921 (2013).
- Bzducha-Wróbel, A., et al. Evaluation of the efficiency of different disruption methods on yeast cell wall preparation for β-glucan isolation. Molecules. 19 (12), 20941-20961 (2014).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Smith, B. C., Fisher, D. L., Weedn, V. W., Warnock, G. R., Holland, M. M. A systematic approach to the sampling of dental DNA. Journal of Forensic Sciences. 38 (5), 1194-1209 (1993).
- Sweet, D., Hildebrand, D. Recovery of DNA from human teeth by cryogenic grinding. Journal of Forensic Sciences. 43 (6), 1199-1202 (1998).
- Lorenz, W. W., Yu, Y. S., Dean, J. F. An improved method of RNA isolation from loblolly pine (P. taeda L.) and other conifer species. Journal of Visualized Experiments. (36), e1751 (2010).
- Singh, M. R., Roy, S., Bellare, J. R. Influence of Cryogenic Grinding on Release of Protein and DNA from Saccharomyces cerevisiae. International Journal of Food Engineering. 5 (1), (2009).
- Singh, R. K., Kabbaj, M. H., Paik, J., Gunjan, A. Histone levels are regulated by phosphorylation and ubiquitylation-dependent proteolysis. Nature Cell Biology. 11 (8), 925-933 (2009).
- Liang, D., Burkhart, S. L., Singh, R. K., Kabbaj, M. H., Gunjan, A. Histone dosage regulates DNA damage sensitivity in a checkpoint-independent manner by the homologous recombination pathway. Nucleic Acids Research. 40 (19), 9604-9620 (2012).
- Singh, R. K., Gonzalez, M., Kabbaj, M. H., Gunjan, A. Novel E3 ubiquitin ligases that regulate histone protein levels in the budding yeast Saccharomyces cerevisiae. PLoS One. 7 (5), 36295 (2012).
- Gunjan, A., Verreault, A. A Rad53 kinase-dependent surveillance mechanism that regulates histone protein levels in S. cerevisiae. Cell. 115 (5), 537-549 (2003).
- Gill, P., et al. Identification of the remains of the Romanov family by DNA analysis. Nature Genetics. 6 (2), 130-135 (1994).
- Alain, K., et al. DNA extractions from deep subseafloor sediments: novel cryogenic-mill-based procedure and comparison to existing protocols. Journal of Microbiological Methods. 87 (3), 355-362 (2011).
- Mohammad, F., Buskirk, A. Protocol for Ribosome Profiling in Bacteria. Bio-Protocol. 9 (24), 3468 (2019).
- Liew, Y. J., et al. Identification of microRNAs in the coral Stylophora pistillata. PLoS One. 9 (3), 91101 (2014).
- Lopez de Heredia, M., Jansen, R. P. RNA integrity as a quality indicator during the first steps of RNP purifications: a comparison of yeast lysis methods. BMC Biochem. 5 (14), (2004).
- Grant, L. J., et al. Purified plant cell walls with adsorbed polyphenols alter porcine faecal bacterial communities during in vitro fermentation. Food & Function. 11 (1), 834-845 (2020).
- Lolo, M., et al. Cryogenic grinding pre-treatment improves extraction efficiency of fluoroquinolones for HPLC-MS/MS determination in animal tissue. Analytical and Bioanalytical Chemistry. 387 (5), 1933-1937 (2007).
- Santos, D., et al. Determination of Cd and Pb in food slurries by GFAAS using cryogenic grinding for sample preparation. Analytical and Bioanalytical Chemistry. 373 (3), 183-189 (2002).
- da Silva, E. G. P., et al. Fast method for the determination of copper, manganese and iron in seafood samples. Journal of Food Composition and Analysis. 21 (3), 259-263 (2008).
- Kamogawa, M. Y., Nogueira, A. R. A., Costa, L. M., Garcia, E. E., Nobrega, J. A. A new strategy for preparation of hair slurries using cryogenic grinding and water-soluble tertiary-amines medium. Spectrochimica Acta Part B-Atomic Spectroscopy. 56 (10), 1973-1980 (2001).
- Sillen, A., Hall, G., Richardson, S., Armstrong, R. Sr-87/Sr-86 ratios in modern and fossil food-webs of the Sterkfontein Valley: Implications for early hominid habitat preference. Geochimica Et Cosmochimica Acta. 62 (14), 2463-2473 (1998).
- Nielsen-Marsh, C. M., et al. Sequence preservation of osteocalcin protein and mitochondrial DNA in bison bones older than 55 ka. Geology. 30 (12), 1099-1102 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены