È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di estratti cellulari mediante criogrinding in un congelatore automatizzato
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un metodo affidabile per la preparazione di estratti interi di cellule da lievito o altre cellule utilizzando un congelatore criogenico che riduce al minimo la degradazione e la denaturazione delle proteine. Gli estratti cellulari sono adatti per la purificazione di complessi proteici funzionali, analisi proteomiche, studi di co-immunoprecipitazione e rilevamento di modifiche proteiche labili.
Abstract
La facilità della manipolazione genetica e la forte conservazione evolutiva dei macchinari cellulari eucarioti nel lievito in erba Saccharomyces cerevisiae ne hanno fatto un organismo modello genetico preminente. Tuttavia, poiché un efficiente isolamento proteico dipende da un'interruzione ottimale delle cellule, l'uso del lievito per l'analisi biochimica delle proteine cellulari è ostacolato dalla sua parete cellulare che è costosa da digerire enzimaticamente (usando liticase o zimolyasi) e difficile da interrompere meccanicamente (usando un battitore di perline tradizionale, una pressa francese o un macinino da caffè) senza causare il riscaldamento dei campioni, che a sua volta causa denaturazione e degradazione delle proteine. Sebbene la macinazione manuale di cellule di lievito sotto azoto liquido (LN2)utilizzando malta e pestello eviti il surriscaldamento dei campioni, è ad alta intensità di manodopera e soggetta a variabilità nella lisi cellulare tra operatori. Da molti anni prepariamo con successo estratti di lievito di alta qualità utilizzando il criogrinding delle cellule in un congelatore automatizzato. La temperatura di -196 °C raggiunta con l'uso di LN2 protegge il materiale biologico dalla degradazione mediante proteasi e nucleasi, consentendo il recupero di proteine intatte, acidi nucleici e altre macromolecole. Qui descriviamo questa tecnica in dettaglio per le cellule di lievito in erba che comporta prima il congelamento di una sospensione delle cellule in un tampone di lisi attraverso la sua aggiunta a goccia in LN2 per generare goccioline congelate di cellule note come "popcorn". Questo popcorn viene quindi polverizzato sotto LN2 in un congelatore per generare un estratto "in polvere" congelato che viene scongelato lentamente e chiarificato dalla centrifugazione per rimuovere i detriti insolubili. Gli estratti risultanti sono pronti per applicazioni a valle, come la purificazione di proteine o acidi nucleici, analisi proteomiche o studi di co-immunoprecipitazione. Questa tecnica è ampiamente applicabile per la preparazione di estratti cellulari da una varietà di microrganismi, tessuti vegetali e animali, campioni marini tra cui coralli, nonché per isolare DNA / RNA da campioni fossili forensi e permafrost.
Introduzione
Il lievito è un organismo modello popolare per gli studi sulle proteine, in quanto è un semplice organismo eucariotico con un'abbondanza di strumenti genetici e biochimici disponibili per iricercatori 1. A causa della loro robusta parete cellulare, una sfida che i ricercatori devono affrontare è quella di lysing efficiente le cellule senza danneggiare il contenuto cellulare. Sono disponibili diversi metodi per ottenere estratti proteici attraverso l'interruzione delle cellule di lievito che includono lisi enzimatica (zymolyase)2,3,lisichimica 4,lisi fisica mediante congelamento-disgelo5,a base di pressione (pressa francese)6,7,meccanica (perline di vetro, macinino da caffè)8,9,a base di sonicazione10 e criogenica2,11. L'efficienza della lisi cellulare e la resa proteica possono variare considerevolmente a seconda della tecnica utilizzata, influenzando così il risultato finale o l'idoneità all'applicazione a valle desiderata per il lisato. Quando si studiano proteine instabili, con fugaci modifiche posttraslazionali o sensibili alla temperatura, è particolarmente importante utilizzare un metodo che riduca al minimo la perdita o la degradazione del campione durante la preparazione.
| Tecnica di preparazione dell'estrazione | Dettagli | Vantaggi | Svantaggi | Analisi a valle | Riferimento |
| Stampa francese: Omogeneizzatore ad alta pressione (aka Microfluidizer) con pretrattamento enzimatico con Zymolyase | Zymolyase-20T, un omogeneizzatore ad alta pressione Microfluidizer. Il disgregatore è costituito da una pompa ad alta pressione azionata dall'aria (rapporto 1:250; pressione dell'aria richiesta 0,6-l MPa) e da una speciale camera di interruzione con un'unità di controtezione aggiuntiva. Per l'elaborazione è richiesta una dimensione minima del campione di 20 mL. | L'interruzione totale finale ottenuta utilizzando il protocollo combinato si è avvicinata al 100 % con 4 passaggi a una pressione di 95 MPa, contro solo il 32 % di interruzione con 4 passaggi a 95 MPa utilizzando solo l'omogeneizzazione senza Zymolyase. | Non adatto per applicazioni su piccola scala. Gli enzimi possono diventare costosi per i preparati su larga scala. | Purificazione delle proteine | 6 |
| Battitore di perline: Cellule trattate con zymolyase con perline di vetro in uno strumento fastprep | All'incirca un volume uguale di perline di vetro fredde, secche e lavate con acido da 0,5 mm viene aggiunto a un dato volume di pellet cellulare nel tampone di lysis e le cellule vengono interrotte da un'agitazione manuale vigorosa. | È particolarmente utile quando si realizzano estratti da molte piccole colture di lieviti diversi per scopi di dosaggio piuttosto che per la purificazione delle proteine. | Durante la procedura di perline di vetro, le proteine vengono trattate duramente causando un'ampia schiuma che porta alla denaturazione proteica. La quantità di rottura cellulare varia, mentre la proteolisi e la modifica delle proteine possono derivare dal riscaldamento dell'estratto sopra i 4 °C durante la rottura meccanica. | Principalmente analisi di DNA e RNA, ma anche analisi proteiche denaturando l'elettrofeoresi del gel, con o senza macchia occidentale. | 8 |
| Trattamento con zymolyase seguito da lisi usando una combinazione di shock osmotico e omogeneizzazione delle dounce | Dopo la digestione enzimatica delle pareti cellulari, gli sferoplasti vengono lalizzato con da 15 a 20 colpi di un pestello aderente (gioco da 1 a 3 μm) in un omogeneizzatore Dounce. | Vantaggioso utilizzare ceppi carenti di proteasi come BJ926 o EJ101. Questo è il modo più delicato per rompere le cellule di lievito e quindi è più adatto per preparare estratti che possono svolgere complesse funzioni enzimatiche (ad esempio, traduzione, trascrizione, replicazione del DNA) e in cui deve essere mantenuta l'integrità delle strutture macromolecolari (ad esempio ribosomi, splicesomes). È anche utile per isolare nuclei intatti che possono essere utilizzati per studi sulla cromatina (Bloom and Carbon, 1982) o per estratti di proteine nucleari (Lue e Kornberg, 1987). | I principali svantaggi della procedura di lisi sferoplasta sono che è relativamente noioso e costoso, specialmente per i preparati su larga scala (>10 litri), e i lunghi periodi di incubazione possono portare a proteolisi o modifica delle proteine. Per i preparati di cromatina, sembrano essere di qualità variabile o inferiore rispetto a quelli prodotti dalla centrifugazione differenziale (basata sull'integrità della scala nucleosoma). | Isolando nuclei intatti per studi sulla cromatina, estratti in grado di svolgere complesse funzioni enzimatiche, estratti che richiedono l'integrità di strutture macromolecolari, estratti di proteine nucleari. | 2 |
| Interruzione cellulare delle cellule congelate flash mediante macinazione in azoto liquido utilizzando una malta / pestello o un frullatore | Le cellule vengono congelate immediatamente in azoto liquido e quindi lisciviate macinando manualmente in un mortaio usando un pestello o utilizzando un frullatore Waring in presenza di azoto liquido. | Il protocollo è facile e veloce. Può ospitare diverse quantità di cellule di lievito tra cui colture molto grandi. Il suo principale vantaggio è che le cellule vengono prese immediatamente dallo stato di crescita attiva in azoto liquido (−196 °C), diminuendo le attività enzimatiche degradative come proteasi e nucleasi così come le attività che modificano le proteine (ad esempio fosfatasi e chinasi). È particolarmente adatto per la produzione di estratti interi da un'unica coltura di lievito per la purificazione di proteine su larga scala. | Un po' disordinato e potenzialmente pericoloso per l'investigatore disattento. Piccoli campioni (cioè colture di lievito da 10 a 100 ml) non sono facilmente lavorabili perché non c'è abbastanza massa di grumi cellulari congelati per fratturarsi efficacemente nel frullatore. È dispendioso in termini di tempo elaborare singoli campioni e pulire l'apparecchiatura tra un utilizzo e l'altro. | Estratti interi da una singola coltura di lievito per la purificazione proteica su larga scala. | 2 |
| Autolisi, Mulino perline | pH 5.0, 50 °C, 24 h, 200 giri/min / Ø 0,5 mm, 5 × 3 min/3 min | Lisi rapida ed efficiente, soprattutto per la preparazione di estratti su piccola scala | La generazione di calore porta alla denaturazione e alla degradazione delle macromolecole. È necessaria l'attrezzatura per il battito delle perline. | Analisi su piccola scala. | 10 |
| Autolisi, Sonicazione | pH 5,0, 50 °C, 24 h, 200 giri/min, 4 × 5 min/2 min, pulser 80%, potenza 80% | Le apparecchiature di sonicazione sono solitamente disponibili nella maggior parte delle istituzioni. | La generazione di calore porta alla denaturazione e alla degradazione delle macromolecole. Sono necessarie apparecchiature di sonicazione. La llisi lenta può richiedere più di 24 ore. | Preparazioni per pareti cellulari di lievito. | |
| Processo di ebollizione e congelamento-disgelo | Non sono necessarie attrezzature specializzate se non un congelatore standard e un blocco di riscaldamento o un bagno d'acqua calda. | Efficiente, riproducibile, semplice ed economico. | La generazione di calore porta alla denaturazione e alla degradazione delle macromolecole. | Analisi del DNA da parte della PCR. | 5 |
Tabella 1: Raffronto dei metodi disponibili per la preparazione degli estratti di lievito.
La criogrinding (nota anche come macinazione criogenica/fresatura criogenica) è comunemente utilizzata per recuperare acidi nucleici, proteine o sostanze chimiche da campioni sensibili alla temperatura in modo affidabile per analisi quantitative o qualitative. È stato utilizzato con successo per molteplici applicazioni in diversi campi tra cui biotecnologia, tossicologia, scienzeforensi 12,13,scienze ambientali, biologiavegetale 14 e scienze alimentari. L'isolamento delle macromolecole biologiche intatte di solito dipende criticamente dalla temperatura. Temperature estremamente basse assicurano che le proteasi e le nucleasi rimangano inattive, determinando un isolamento affidabile di proteine intatte, acidi nucleici e altre macromolecole per analisi successive. Infatti, un congelatore mantiene tipicamente una temperatura del campione di -196 °C (il punto di ebollizione di LN2), riducendo così al minimo la denaturazione e la degradazione del DNA/RNA o delle proteine.
Il congelatore utilizza una camera di rettifica elettromagnetica che sposta rapidamente una barra metallica solida o un cilindro avanti e indietro all'interno di un flaconcino contenente il campione da polverizzare tra tappi di estremità in acciaio inossidabile. Lo strumento crea e inverte rapidamente un campo magnetico all'interno della camera di rettifica. Mentre il campo magnetico si sposta avanti e indietro, il magnete schiaccia il campione contro le spine ottenendo così il "criogrinding" e la polverizzazione dei popcorn. Il congelatore sostituisce malta e pestello e consente la lavorazione sequenziale di più campioni (o fino a 4 campioni più piccoli contemporaneamente) con elevata riproducibilità ed evita la variabilità da utente a utente associata alla rettifica manuale. Una volta elaborati i campioni, le estrazioni di cellule possono essere utilizzate per una varietà di applicazioni downstream.
Protocollo
1. Preparazione dei popcorn di lievito
- Coltivare cellule di lievito in 0,5 L di media YPD ad una densità di 1 x 107 cellule/mL. Contare le celle usando un contatore Coulter o qualsiasi altro mezzo.
- Cellule centrifughe per 10 min a 2.400 g e 4 °C.
- Lavare ogni campione una volta con 500 mL di acqua di 18 mega Ohm Milli-Q deionizzata ghiacciata.
- Pellet di resuspend in 15 mL di tampone di lisi ghiacciato [20 mM HEPES-KOH pH 7,5, 110 mM KCl, 0,1% Tween, 10% glicerolo, con agente riducente appena aggiunto 10 mM β-mercaptoetanolo, cocktail inibitore della proteasi, inibitore del proteasome da 10 μM MG-132, 1 mM inibitore della deacetilasi butirato di sodio e inibitori della fosfatasi (1 mM di vanadato di sodio, fluoruro di sodio da 50 mM, β-glicerofosfato di sodio)]. Per ulteriori dettagli, vedere la tabella dei materiali. Mantenere le cellule rimorsi sul ghiaccio fino a quando i campioni non sono pronti per il passaggio successivo.
NOTA: Un'ampia varietà di tamponi di lisi contenenti un certo numero di detergenti non ionici può essere utilizzata con i campioni e gli inibitori specifici inclusi in esso in base all'applicazione a valle. L'inclusione di proteasi e inibitori proteasomali è fondamentale per prevenire la degradazione delle proteine, specialmente una volta scongelati gli estratti. - Fare popcorn di lievito congelato a scatto aggiungendo lentamente la sospensione cellulare una goccia alla volta utilizzando una pipetta sierologica pre-refrigerata in uno o più tubi di centrifuga da 50 ml tenuti su ghiaccio secco e riempiti con LN2 fino a poco sotto il bordo. Ricaricare frequentemente l'azoto liquido nel tubo per compensare la sua perdita a causa della rapida evaporazione. Lavorare in un'area ben ventilata per evitare i rischi associati all'asfissia da azoto.
- Invece di un tubo da 50 ml, utilizzare più tubi da 50 ml legati tra loro (o qualsiasi contenitore con una bocca grande, come una grande bottiglia di centrifuga di plastica che può tollerare temperature criogeniche) per la preparazione del pop-corn(Figura 1A). Più grande è il contenitore e la sua apertura, più facile è la preparazione dei popcorn in quanto ciò impedisce l'accumulo dei popcorn per formare grandi aggregati. Un intervallo di dimensioni di 0,3-0,5 cm per i popcorn è ideale per ottenere una corretta rettifica/polverizzazione utilizzando il mulino congelatore(Figura 1B).
- Assicurarsi che l'LN2 sia evaporato completamente dai tubi contenenti i popcorn prima di conservarli a -80 °C. È possibile fermarsi dopo aver preparato i popcorn di lievito in quanto sono stabili per diversi anni se mantenuti a -80 °C.

Figura 1: Preparazione dei popcorn di lievito. (A) Il lievito "popcorn" è prodotto dal congelamento dropwise della sospensione cellulare in LN2. Usiamo da uno a tre tubi da 50 ml tenuti insieme a un elastico e collocati in un secchio di ghiaccio pieno di ghiaccio secco. I tubi sono riempiti con LN2 fino a poco sotto i loro bordi e vengono riempiti frequentemente con azoto liquido per mantenerli quasi pieni fino a quando tutta la sospensione cellulare non è stata trasformata in popcorn(B) La dimensione dei popcorn è un importante fattore determinante dell'efficienza di macinazione ottimale. La gamma di dimensioni dei popcorn deve avere un diametro compreso tra 0,3 e 0,5 cm. Clicca qui per visualizzare una versione più grande di questa figura.
2. Criogrinding
- Per iniziare, assicurarsi che l'LN2 sia sufficiente per raffreddare il frantoio, macinare flaconcini, forniture e utilizzare la macchina per tutti i campioni. Per meno di cinque campioni dovrebbero essere sufficienti 30-35 L di LN2. Riempire la camera del mulino congelatore con LN2 fino alla linea di riempimento.
AVVERTENZA: Tutte le fasi che coinvolgono LN2 devono essere eseguite in un'area ben ventilata e il congelatore stesso deve trovarsi in tale zona per evitare il rischio di asfissia. Indossare dispositivi di protezione individuale tra cui calzature adeguate, camice da laboratorio, occhiali di sicurezza, uno strato base di guanti in nitrile, quindi guanti termici, seguiti da un altro paio di guanti in nitrile. Prestare estrema attenzione durante la manipolazione di LN2. - Chiudere lentamente il coperchio del frantoio, evitando lo spruzzo di LN2 e lasciare che la macchina si raffredda. Potrebbe essere necessario riempire la camera con LN2 per compensare la perdita dovuta all'evaporazione prima di procedere al passaggio successivo.
NOTA: Ricaricare LN2 in base alle esigenze solo fino alla linea di riempimento. Non riempire troppo la camera in quanto ciò può essere sia pericoloso che dannoso per la macchina. Sono disponibili sistemi di ricarica automatizzati per il congelatore in grado di rifornire l'LN2 evaporante in base alle esigenze direttamente da un serbatoio di stoccaggio collegato al congelatore. - Pre-raffreddare le grandi fiale di macinazione e la barra del dispositivo di impatto magnetico schiacciandole in LN2 tenute in un piccolo dewar separato. Decantare tutto l'LN2 quando l'LN2 smette di gorgogliare. Quindi aggiungere i popcorn campione/lievito al flaconcino di macinazione e sigillarlo saldamente con i due tappi di estremità in acciaio inossidabile.
- Non riempire più di un terzo della fiala di rettifica con il campione in quanto ciò può ridurre l'efficienza della rettifica. Invece, i campioni più grandi possono essere elaborati dividendoli in due o più flaconcini e macinandoli in sequenza. Fiale di rettifica più piccole possono essere utilizzate per campioni più piccoli (fino a 3 mL).
- Posizionare il flaconcino di macinazione nella camera del mulino congelatore e bloccarlo in posizione. Chiudi il coperchio.
- Per il lievito in erba, macinare i campioni per un totale di tre cicli per 2 min/ciclo (con 2 min di pausa per il raffreddamento tra i cicli) ad una velocità di frantumazione di 14. Quando la macchina si ferma dopo aver completato i cicli, aprire lentamente il coperchio del congelatore e sbloccare accuratamente il flaconcino con il lisato a celle congelate in polvere e rimuoverlo dal congelatore. Se vengono utilizzate più piccole fiale, lavorare rapidamente per rimuovere una fiala alla volta e posizionarle nel ghiaccio secco.
NOTA: Di solito non è necessario regolare i parametri di rettifica quando si utilizzano flaconcini di dimensioni diverse con lo stesso tipo di campione. Tuttavia, i parametri di rettifica come il numero di cicli e la velocità di rettifica devono essere determinati empiricamente per diversi tipi di campioni, a seconda della facilità con cui si lisciviano. La maggior parte delle cellule di mammifero e dei tessuti molli si liscirà in 1-2 cicli ad un tasso di schiacciamento di 10. Campioni più difficili da llyse come batteri, lieviti, larve di mosca e moscerini della frutta adulti richiedono 3-6 cicli alla velocità massima, mentre i tessuti duri come ossa, denti, ecc. possono richiedere fino a 10 cicli. Una piccola aliquota del campione scongelato può essere visualizzata al microscopio prima e dopo la macinazione per contare il numero di cellule intatte e non lese per determinare l'efficienza dellalisi. Un'eccellente analisi dell'impatto dei parametri di criogrinding sul rilascio di proteine e DNA dal lievito in erba è stata pubblicata in precedenza15. - Lavorando rapidamente in modo da non permettere al campione di scongelarsi, svitare con cura uno dei pezzi finali (scegliere quello che sembra essere diventato un po 'allentato durante la rettifica) utilizzando l'utensile di apertura. Quindi, utilizzare un paio di lunghe forcette (che sono pre-refrigerate in un secchio con ghiaccio secco) per rimuovere la barra del riflettore. Raccogliere il campione polverizzato invertendo e toccando il flaconcino di macinazione su un piatto di pesatura in polistirolo pre-refrigerato con LN2 e tenuto su ghiaccio secco.
- Una volta recuperato tutto il lisato di cellule congelate in polvere dalla fiala di macinazione, versare nuovamente il lisato in polvere dal piatto di pesatura nel tubo da 50 ml e procedere immediatamente alla lenta fase di scongelamento descritta successivamente per ottenere i migliori risultati. In alternativa, conservare il litolato in polvere congelato durante la notte a -80 °C, anche se ciò può causare una certa degradazione.
- Preparare un secchio di ghiaccio con un liquame al 50% di ghiaccio e acqua e posizionarlo su una piastra di agitazione con un agitatore magnetico. Immergere una griglia o un altro rack adatto nei liquami di ghiaccio per contenere i campioni.
- Quindi, scongelare lentamente i campioni su un bagno di liquami di ghiaccio con agitazione costante del liquame usando un agitatore magnetico. Aggiungere più ghiaccio per sostituire il ghiaccio che si scioglie (potrebbe essere necessario scartare un po 'd'acqua per evitare che il secchio di ghiaccio trabocca). Poiché diversi inibitori hanno una breve emivia in tamponi acquosi, aggiungere un cocktail inibitore della proteasi aggiuntivo (vedi Tabella dei materiali) e 10 μM inibitore del proteasome MG-132 al lysate una volta che i campioni iniziano a scongelarsi (dopo circa 30 minuti).
- Rimuovere il ghiaccio formato all'esterno dei tubi ogni 5 minuti per accelerare il processo di scongelamento. Si noti che il rapido scongelamento dei campioni a temperatura ambiente o superiore può portare a una degradazione significativa.
- Dopo che i campioni si sono scongelati completamente (può essere necessaria ben più di un'ora a seconda della quantità di campione), centrifugare il lysate a ~ 3.220 g per 20 minuti in una centrifuga refrigerata da tavolo a 4 °C per rimuovere la maggior parte dei detriti cellulari dal lysate.
- Trasferire il supernatante a tubi di centrifuga in policarbonato da 50 ml che sono stati pre-refrigerati sul ghiaccio e centrifugare i campioni a 16.000 g per 20 minuti a 4 °C (vedi Tabella dei materiali).
- Trasferire molto lentamente e con attenzione solo il supernatante trasparente costituito dall'estratto di cella intero chiarificato dal centro della colonna liquida nel tubo, senza disturbare lo strato lipidico torbido (Figura 2), in un tubo refrigerato da 15 ml utilizzando pipette sierologiche prerimorte. Evitare di rimuovere tutto il lysate nel tubo di centrifuga per prevenire il riporto di lipidi e detriti. Il lysate avanzi nel tubo di centrifuga può essere centrifugato più volte per recuperare piccole quantità di estratto dopo ogni giro.
NOTA: I lipidi insieme a qualsiasi proteine denaturate apparirebbero torbide/lattiere e si trovano nella parte superiore dell'interfaccia liquido/aria e occasionalmente sopra il pellet stesso costituito da detriti cellulari insolubili (Figura 2).
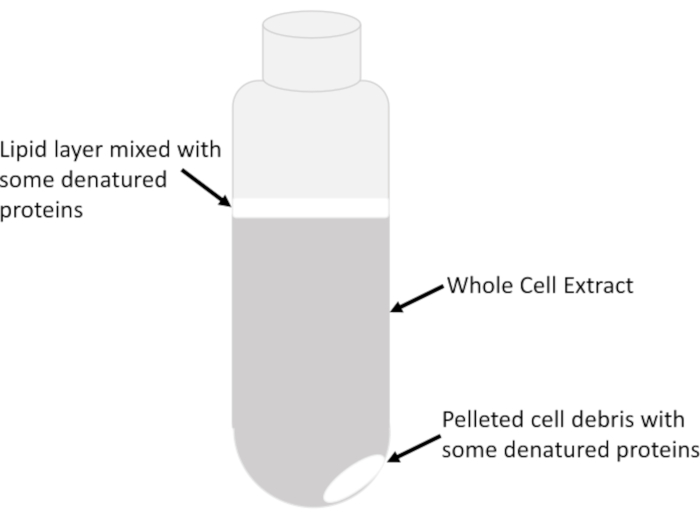
Figura 2: Estrarre gli strati in un tubo di centrifuga. Sono indicate le principali caratteristiche visibili dell'intero estratto cellulare in un tubo dopo la centrifugazione a 16.000 g per 20 min. L'abbondanza relativa di ogni feature dipende dal tipo di campione, dalla fase di crescita delle cellule (esponenziale contro stazionaria), dalla quantità di buffer dilisi utilizzato per rimescolare le cellule e dall'efficienza dellalisi. Clicca qui per visualizzare una versione più grande di questa figura.
- Centrifugare qualsiasi lysate rimanente per 5 minuti per recuperare più dell'estratto. Ripetere questa centrifugazione di 5 minuti più volte se necessario per recuperare il maggior numero possibile di estratto chiaro. Scartare il lisato torbido contenente lipidi vicino al fondo del tubo vicino al pellet.
- Utilizzare questi estratti per applicazioni a valle come la purificazione complessa delle proteine, l'immunoprecipitazione e l'analisi proteomica.
Risultati
Abbiamo confrontato due diversi metodi per la lisi cellulare del lievito, vale a dire la fresatura di perline di vetro a 4 °C e un metodo di criogrinding automatizzato a -196 °C, per valutare le proteine di recupero relative negli estratti cellulari preparati con entrambi i metodi. Per questo studio, abbiamo scelto di utilizzare un ceppo di lievito in erba YAG 1177 (MAT a lys2-810 leu2-3,-112 ura3-52 his3-Δ200 trp1-1[am] ubi1-Δ1::TRP1 ubi2-Δ2::ura3 ubi3-Δub-2 ubi4-Δ2::LEU2 [pUB39] ...
Discussione
Una limitazione dello studio delle proteine native dal lievito è lalisi inefficiente delle cellule di lievito a causa della loro dura parete cellulare. Sebbene siano stati sviluppati diversi metodi, il metodo più coerente ed efficiente nelle nostre mani è la criogrinding delle cellule di lievito che lampeggiano congelate come popcorn. Questo metodo consente la preparazione affidabile di estratti di cellule intere di alta qualità dal lievito in erba rispetto ad altri metodi dilisi. I risultati rappresentativi hanno di...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
La ricerca nel laboratorio di Gunjan è supportata dai finanziamenti del National Institutes of Health, della National Science Foundation e del Florida Department of Health. Ringraziamo lo studente universitario John Parker per l'assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| 50 mL polycarbonate tubes with screw caps | Beckman | 357002 | Centrifuge tubes |
| BD Bacto Peptone | BD Biosiences | 211677 | Yeast YPD media component |
| BD Bacto Yeast Extract | BD Biosiences | 212750 | Yeast YPD media component |
| Beckman Avanti centrifuge | Beckman | B38624 | High speed centrifuge |
| Beckman JLA-9.1000 | Beckman | 366754 | Rotor |
| D-(+)-Dextrose Anhydrous | MP Biomedicals | 901521 | Yeast YPD media component |
| Eppendorf A-4-44 | Eppendorf | 22637461 | Swinging bucket rotor |
| Eppendorf refrigerated centrifuge 5810 R | Eppendorf | 22625101 | Refrigerated centrifuge |
| Glycerol | SIGMA-ALDRICH | G5150-1GA | Volume excluder and cryoprotectant |
| HEPES | FisherBiotech | BP310-100 | Buffer |
| HIS6 antibody | Novagen | 70796 | Antibody for HIS tag |
| KCl | SIGMA-ALDRICH | P9541-1KG | Salt for maintaining ionic strength |
| MG-132 | CALBIOCHEM | 474790 | Proteasome Inhibitor |
| Phosphatase inhibitor cocktail | ThermoFisher Scientific | A32957 | Phosphatase inhibitor cocktail |
| Ponceau S | SIGMA | P7170-1L | Protein Stain |
| Protease inhibitor cocktail | ThermoFisher Scientific | A32963 | Protease inhibitor cocktail |
| Rotor JLA 25.500 | Beckman | JLA 25.500 | Rotor |
| Sodium Butyrate | EM Science | BX2165-1 | Histone Deacetylase Inhibitor |
| Sodium Fluoride | Sigma-Aldrich | S6521 | Phosphatase Inhibitor |
| Sodium Vanadate | MP Biomedicals | 159664 | Phosphatase Inhibitor |
| Sodium β-glycerophosphate | Alfa Aesar | 13408-09-8 | Phosphatase Inhibitor |
| Spex Certiprep 6850 freezer mill | SPEX Sample Prep | 6850 | Freezer Mill |
| TALON Metal Affinity Resin | BD Biosiences | 635502 | For pulling down HIS tagged proteins |
| Tween 20 | VWR International | VW1521-07 | Non-ionic detergent |
| β-Mercaptoethanol | AMRESCO | M131-250ML | Reducing agent |
Riferimenti
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Dunn, B., Wobbe, C. R. Preparation of protein extracts from yeast. Current Protocols in Molecular Biology. , (2001).
- Holm, C., Meeks-Wagner, D. W., Fangman, W. L., Botstein, D. A rapid, efficient method for isolating DNA from yeast. Gene. 42 (2), 169-173 (1986).
- Nandakumar, M. P., Marten, M. R. Comparison of lysis methods and preparation protocols for one- and two-dimensional electrophoresis of Aspergillus oryzae intracellular proteins. Electrophoresis. 23 (14), 2216-2222 (2002).
- Silva, G. A. D., Bernardi, T. L., Schaker, P. D. C., Menegotto, M., Valente, P. Rapid yeast DNA extraction by boiling and freeze-thawing without using chemical reagents and DNA purification. Brazilian Archives of Biology and Technology. 55, 319-327 (2012).
- Baldwin, C., Robinson, C. W. Disruption of Saccharomyces cerevisiae using enzymatic lysis combined with high-pressure homogenization. Biotechnology Techniques. 4 (5), 329-334 (1990).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hudspeth, M. E., Shumard, D. S., Tatti, K. M., Grossman, L. I. Rapid purification of yeast mitochondrial DNA in high yield. Biochimica et Biophysica Acta. 610 (2), 221-228 (1980).
- Szymanski, E. P., Kerscher, O. Budding yeast protein extraction and purification for the study of function, interactions, and post-translational modifications. Journal of Visualized Experiments. (80), e50921 (2013).
- Bzducha-Wróbel, A., et al. Evaluation of the efficiency of different disruption methods on yeast cell wall preparation for β-glucan isolation. Molecules. 19 (12), 20941-20961 (2014).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Smith, B. C., Fisher, D. L., Weedn, V. W., Warnock, G. R., Holland, M. M. A systematic approach to the sampling of dental DNA. Journal of Forensic Sciences. 38 (5), 1194-1209 (1993).
- Sweet, D., Hildebrand, D. Recovery of DNA from human teeth by cryogenic grinding. Journal of Forensic Sciences. 43 (6), 1199-1202 (1998).
- Lorenz, W. W., Yu, Y. S., Dean, J. F. An improved method of RNA isolation from loblolly pine (P. taeda L.) and other conifer species. Journal of Visualized Experiments. (36), e1751 (2010).
- Singh, M. R., Roy, S., Bellare, J. R. Influence of Cryogenic Grinding on Release of Protein and DNA from Saccharomyces cerevisiae. International Journal of Food Engineering. 5 (1), (2009).
- Singh, R. K., Kabbaj, M. H., Paik, J., Gunjan, A. Histone levels are regulated by phosphorylation and ubiquitylation-dependent proteolysis. Nature Cell Biology. 11 (8), 925-933 (2009).
- Liang, D., Burkhart, S. L., Singh, R. K., Kabbaj, M. H., Gunjan, A. Histone dosage regulates DNA damage sensitivity in a checkpoint-independent manner by the homologous recombination pathway. Nucleic Acids Research. 40 (19), 9604-9620 (2012).
- Singh, R. K., Gonzalez, M., Kabbaj, M. H., Gunjan, A. Novel E3 ubiquitin ligases that regulate histone protein levels in the budding yeast Saccharomyces cerevisiae. PLoS One. 7 (5), 36295 (2012).
- Gunjan, A., Verreault, A. A Rad53 kinase-dependent surveillance mechanism that regulates histone protein levels in S. cerevisiae. Cell. 115 (5), 537-549 (2003).
- Gill, P., et al. Identification of the remains of the Romanov family by DNA analysis. Nature Genetics. 6 (2), 130-135 (1994).
- Alain, K., et al. DNA extractions from deep subseafloor sediments: novel cryogenic-mill-based procedure and comparison to existing protocols. Journal of Microbiological Methods. 87 (3), 355-362 (2011).
- Mohammad, F., Buskirk, A. Protocol for Ribosome Profiling in Bacteria. Bio-Protocol. 9 (24), 3468 (2019).
- Liew, Y. J., et al. Identification of microRNAs in the coral Stylophora pistillata. PLoS One. 9 (3), 91101 (2014).
- Lopez de Heredia, M., Jansen, R. P. RNA integrity as a quality indicator during the first steps of RNP purifications: a comparison of yeast lysis methods. BMC Biochem. 5 (14), (2004).
- Grant, L. J., et al. Purified plant cell walls with adsorbed polyphenols alter porcine faecal bacterial communities during in vitro fermentation. Food & Function. 11 (1), 834-845 (2020).
- Lolo, M., et al. Cryogenic grinding pre-treatment improves extraction efficiency of fluoroquinolones for HPLC-MS/MS determination in animal tissue. Analytical and Bioanalytical Chemistry. 387 (5), 1933-1937 (2007).
- Santos, D., et al. Determination of Cd and Pb in food slurries by GFAAS using cryogenic grinding for sample preparation. Analytical and Bioanalytical Chemistry. 373 (3), 183-189 (2002).
- da Silva, E. G. P., et al. Fast method for the determination of copper, manganese and iron in seafood samples. Journal of Food Composition and Analysis. 21 (3), 259-263 (2008).
- Kamogawa, M. Y., Nogueira, A. R. A., Costa, L. M., Garcia, E. E., Nobrega, J. A. A new strategy for preparation of hair slurries using cryogenic grinding and water-soluble tertiary-amines medium. Spectrochimica Acta Part B-Atomic Spectroscopy. 56 (10), 1973-1980 (2001).
- Sillen, A., Hall, G., Richardson, S., Armstrong, R. Sr-87/Sr-86 ratios in modern and fossil food-webs of the Sterkfontein Valley: Implications for early hominid habitat preference. Geochimica Et Cosmochimica Acta. 62 (14), 2463-2473 (1998).
- Nielsen-Marsh, C. M., et al. Sequence preservation of osteocalcin protein and mitochondrial DNA in bison bones older than 55 ka. Geology. 30 (12), 1099-1102 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon