JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자동 냉동고 밀에서 냉동 분쇄에 의한 세포 추출물 준비
요약
우리는 단백질의 분해 및 분해를 최소화하는 극저온 냉동고 밀을 사용하여 효모 또는 다른 세포에서 온전세포 추출물의 제조를 위한 신뢰할 수 있는 방법을 설명합니다. 세포 추출물은 기능성 단백질 복합체의 정화, 프로테오믹 분석, 공동 면역 침전 연구 및 음순 단백질 수정의 검출에 적합합니다.
초록
유전자 조작의 용이성과 신진 효모 Saccharomyces cerevisiae에서 진핵 세포 기계의 강한 진화 적 보존은 저명한 유전 모델 유기체를 만들었습니다. 그러나 효율적인 단백질 절연은 세포의 최적의 중단에 달려 있기 때문에 세포 단백질의 생화학 적 분석을위한 효모의 사용은 효소적으로 소화하는 데 비용이 많이 드는 세포 벽 (lyticase 또는 zymolyase 사용)에 의해 방해되며, 기계적으로 중단하기 어렵고 (전통적인 비터, 프랑스 프레스 또는 커피 분쇄기를 사용하여) 시료의 가열을 유발하지 않고 단백질 분해를 유발합니다. 모르타르와 유봉을 사용하여 액체 질소 (LN2)에서효모 세포의 수동 연삭은 시료의 과열을 방지하지만, 작업자 사이의 세포 용해의 가변성에 따라 노동 집약적이며 변동이 적용됩니다. 수년 동안 우리는 자동화된 냉동고 공장에서 세포의 극저온 분쇄를 사용하여 고품질 효모 추출물을 성공적으로 준비해 왔습니다. LN2의 사용으로 달성된 -196°C의 온도는 프로테아제 및 뉴클레아제에 의한 분해로부터 생물학적 물질을 보호하여 그대로 단백질, 핵산 및 기타 거대 분자의 회수를 허용합니다. 여기서 우리는 "팝콘"으로 알려진 세포의 냉동 액적을 생성하기 위해 LN2에 드롭 와이즈 추가를 통해 처음으로 리시스 버퍼에서 세포의 현탁액을 동결 포함 신진 효모 세포를 위해 자세히이 기술을 설명합니다. 이 팝콘은 냉동고 밀에서 LN2 에서 분쇄되어 천천히 해동되고 원심분리에 의해 명확히 하여 불용성 이물질을 제거합니다. 결과 추출물은 단백질 또는 핵산 정제, 프로테오믹 분석 또는 공동 면역 침전 연구와 같은 다운스트림 응용 분야에 대한 준비가 되어 있습니다. 이 기술은 다양한 미생물, 식물 및 동물 조직, 산호를 포함한 해양 표본뿐만 아니라 법의학 및 퍼머 프로스트 화석 표본에서 DNA / RNA를 분리하는 세포 추출물 준비에 널리 적용됩니다.
서문
효모는 단백질 연구를 위한 인기 있는 모형 유기체입니다, 연구원을 위해 유효한 유전 및 생화확적인 공구의 풍부를 가진 간단한 진핵 생물이기 때문에1. 그들의 튼튼한 세포 벽 때문에, 연구원이 직면하는 한 가지 도전은 세포 내용을 손상시키지 않고 효율적으로 세포를 lysing에 있습니다. 다른 방법은 효소 용해 (zymolyase)2,3,화학 용해4,동결 해동5, 압력 기반 (프랑스 프레스)6,7,기계 (유리 구슬, 커피 분쇄기)8,9,초음파 기반10 및 cryogenic2,11을포함하는 효모 세포의 중단을 통해 단백질 추출물을 얻을 수 있습니다. 세포 용해및 단백질 수율의 효율은 채택된 기술에 따라 상당히 달라질 수 있으므로 용액에 대한 원하는 다운스트림 적용에 대한 최종 결과 또는 적합성에 영향을 미칩니다. 불안정한 단백질을 연구할 때, 번역 후 잠시 변형이 있거나 온도에 민감하며, 준비하는 동안 시료 손실이나 저하를 최소화하는 방법을 사용하는 것이 특히 중요합니다.
| 추출 준비 기술 | 세부 정보 | 장점 | 단점 | 다운스트림 분석 | 참조 |
| 프랑스 언론: Zymolyase를 사용하여 효소 전처리를 하는 고압 균질화제(일명 미세유체제) | Zymolyase-20T, 미세 유체화기 고압 균질화제. 파괴기는 공기 구동, 고압 펌프 (비율 1:250; 필요한 기압 0.6-l MPa)와 추가 역압 장치가있는 특수 중단 챔버로 구성됩니다. 처리하려면 최소 샘플 크기가 20mL입니다. | 결합 된 프로토콜을 사용하여 얻은 최종 총 중단은 Zymolyase없이 균질화를 사용하여 95 MPa에서 4 패스로 32 %의 중단과 비교하여 95 MPa의 압력에서 4 패스로 100 %에 접근했습니다. | 소규모 응용 프로그램에는 적합하지 않습니다. 효소는 대규모 준비를 위해 비싸지 않습니다. | 단백질 정제 | 6 |
| 비드 비터 : 빠른 준비 기기에서 유리 구슬로 lysed Zymolyase 처리 된 세포 | 대략 감기, 건조, 산 세척 0.5mm 유리 구슬의 동일한 볼륨은 용해 완충제에 있는 세포 펠릿의 주어진 부피에 추가되고 세포는 격렬한 수동 동요에 의해 중단됩니다. | 단백질 정화보다는 의도적으로 많은 다른 작은 효모 배양에서 추출하는 것이 특히 유용합니다. | 유리 비드 시술 동안 단백질은 단백질 성변으로 이어지는 광범위한 발포를 유발하는 가혹하게 치료됩니다. 세포 파손의 양은 다양하지만, 단백질의 프로테오분해뿐만 아니라 변형은 기계적 파손 시 4°C 이상의 추출물의 가열로 인해 발생할 수 있습니다. | 주로 DNA & RNA 분석, 하지만 또한 젤 전기 전화제를 데스팅 하 여 단백질 분석, 또는 서양 얼룩 없이. | 8 |
| 삼투성 충격과 두드러기 균질화의 조합을 사용하여 용해다음 Zymolyase 치료 | 세포벽의 효소 소화 후, 구엽세포는 Dounce 균질화에서 15~20스트로크의 타이트한 유봉(클리어런스 1~ 3 μm)으로 분해됩니다. | BJ926 또는 EJ101과 같은 프로테이즈 결핍 균주를 사용하는 것이 유리합니다. 이것은 효모 세포를 분해하는 가장 부드러운 방법이며 따라서 복잡한 효소 기능 (예를 들어, 번역, 전사, DNA 복제)을 수행 할 수있는 추출물을 준비하는 데 가장 적합하며 거시 분자 구조 (예 : 리보솜, 스플리솜)의 무결성을 유지해야합니다. 또한 크로마틴 연구(블룸 앤 카본, 1982) 또는 핵 단백질 추출물(Lue and Kornberg, 1987)에 사용할 수 있는 온전한 핵을 분리하는 데도 유용합니다. | 구형 세포 용해 절차의 주요 단점은 상대적으로 지루하고 비싸다는 것입니다, 특히 대규모 제제 (>10 리터), 긴 잠복기간은 proteolysis 또는 단백질 수정으로 이어질 수 있습니다. 크로마틴 제제의 경우, 차동 원심분리에 의해 생성된 품질보다 다양하거나 낮은 품질(뉴클레오터 래더 무결성기준)이 있는 것으로 보입니다. | 크로마틴 연구를 위한 손상되지 않은 핵 분리, 복잡한 효소 기능을 수행할 수 있는 추출물, 의 무결성을 요구하는 추출물 거대 분자 구조, 핵 단백질 추출물. | 2 |
| 박격포/유봉 또는 블렌더를 사용하여 액체 질소에서 분쇄하여 플래시 냉동 세포의 세포 중단 | 세포는 액체 질소에서 즉시 동결된 다음 유봉을 사용하여 모르타르에서 수동으로 연마하거나 액체 질소가 있는 동안 워링 블렌더를 사용하여 용액을 제거합니다. | 프로토콜은 빠르고 쉽습니다. 그것은 매우 큰 배양을 포함하여 효모 세포의 다양한 양을 수용할 수 있습니다. 그것의 주요 장점은 세포가 액체 질소로 적극적으로 성장하는 상태에서 즉시 취한다는 것입니다 (−196°C), 단백질을 수정하는 활동뿐만 아니라 프로테아제와 뉴클레아제와 같은 분해 효소 활동뿐만 아니라 단백질 (예를 들어, 인산염 및 키나아제). 그것은 대규모 단백질 정제를 위한 단 하나 효모 배양에서 전세포 추출물을 만들기에 특히 적합합니다. | 조금 지저분하고 부주의 한 수사관에게 잠재적으로 위험합니다. 작은 샘플(즉, 10-100ml 효모 배양)은 블렌더에서 효과적으로 골절할 수 있는 냉동 세포 덩어리의 질량이 충분하지 않기 때문에 쉽게 처리되지 않습니다. 개별 샘플을 처리하고 사용 사이의 장비를 청소하는 데 시간이 많이 걸립니다. | 대규모 단백질 정제를 위한 단일 효모 배양에서 온전세포 추출물. | 2 |
| 자동 분리, 비드 밀 | pH 5.0, 50°C, 24시간, 200rpm/Ø 0.5mm, 5× 3분/3분 | 특히 소규모 추출물 준비를 위한 빠르고 효율적인 용해 | 열 생성은 거대 분자의 분해 및 저하로 이어집니다. 비드 구타 장비가 필요합니다. | 소규모 분석. | 10 |
| 자동 변기, 초음파 처리 | pH 5.0, 50°C, 24시간, 200rpm, 4× 5분/2분, 펄스80%, 파워 80% | 초음파 처리 장비는 일반적으로 대부분의 기관에서 사용할 수 있습니다. | 열 생성은 거대 분자의 분해 및 저하로 이어집니다. 초음파 장치 필요. 느린 리시스는 24 시간 이상 걸릴 수 있습니다. | 효모 세포 벽 준비. | |
| 끓는 및 동결 해동 공정 | 표준 냉동고와 난방 블록 또는 온수 욕조 이외에는 특수 장비가 필요하지 않습니다. | 효율적이고, 재현 가능하며, 간단하고 저렴합니다. | 열 생성은 거대 분자의 분해 및 저하로 이어집니다. | PCR에 의한 DNA 분석. | 5 |
표 1: 효모 추출물의 제조에 사용할 수 있는 방법의 비교.
극저온 분쇄(일명 극저온 분쇄/극저온 밀링)는 일반적으로 정량적 또는 질적 분석을 위해 신뢰할 수 있는 방식으로 온도에 민감한 샘플에서 핵산, 단백질 또는 화학 물질을 회수하는 데 사용됩니다. 생명 공학, 독물학, 법의학12,13,환경 과학, 식물 생물학14 및 식품 과학을 포함한 다양한 분야에서 여러 응용 분야에 성공적으로 사용되었습니다. 손상되지 않은 생물학적 거대 분자의 격리는 일반적으로 온도에 매우 의존합니다. 극히 낮은 온도로 프로테아제와 뉴클레아제가 비활성 상태를 유지하여 후속 분석을 위해 손상되지 않은 단백질, 핵산 및 기타 거대 분자를 안정적으로 분리합니다. 실제로, 냉동고 공장은 전형적으로 -196°C(LN2의비등점)의 시료 온도를 유지하므로 DNA/RNA 또는 단백질 분해 및 분해를 최소화한다.
냉동고 공장은 스테인레스 스틸 엔드 플러그 사이에 분쇄될 시료를 포함하는 유리병 내에서 고체 금속 막대 또는 실린더를 앞뒤로 빠르게 이동하는 전자기 분쇄 챔버를 사용합니다. 계측기는 연삭 챔버 내에서 자기장을 생성하고 빠르게 반전시깁니다. 자기장이 앞뒤로 이동함에 따라 자석은 플러그에 대한 샘플을 분쇄하여 '냉동 분쇄'와 팝콘의 분쇄를 달성합니다. 냉동고 밀은 모르타르와 유봉을 대체하고 여러 샘플(또는 최대 4개의 작은 샘플)을 높은 재현성으로 순차적으로 처리할 수 있게 해주며 수동 연삭과 관련된 사용자 간 가변성을 방지합니다. 샘플이 처리되면 셀 추출물을 다양한 다운스트림 응용 프로그램에 사용할 수 있습니다.
프로토콜
1. 효모 팝콘 준비
- YPD 매체의 0.5 L에서 효모 세포를 1 x 107 세포/mL의 밀도로 성장시다. 쿨터 카운터 또는 다른 수단을 사용하여 셀을 계산합니다.
- 원심분리기 세포는 2,400g 및 4°C에서 10분 동안.
- 각 샘플을 얼음냉이 500mL로 1회 세척하여 18메가 옴 밀리-Q 수로 세척합니다.
- 얼음차가운 리시스 버퍼 15mL의 펠릿 재연 [20m HEPES-KOH pH 7.5, 110 mM KCl, 0.1% 트웬, 10% 글리세롤, 갓 첨가된 환원제 10m β-메르카포에탄올, 프로테아제 억제제 칵테일, 10 μM 프로테좀 억제제 MG-132, 1mM 디아실라제 억제제 나트륨 부티레이트 및 인산염 억제제(1m 나트륨 바나다테, 50m 나트륨+β). 자세한 내용은 재료 표를 참조하십시오. 샘플이 다음 단계에 대비할 때까지 다시 중단된 세포를 얼음 위에 보관하십시오.
참고: 다수의 비이온 세제를 포함하는 다양한 용해 완충제는 다운스트림 적용을 기반으로 샘플 및 특정 억제제와 함께 사용될 수 있다. 프로테아제와 프로테아소말 억제제의 포함은 단백질 분해를 방지하는 데 매우 중요하며, 특히 추출물이 해동되면 특히 중요합니다. - 미리 차가운 세로지컬 파이펫을 사용하여 한 번에 한 방울씩 천천히 셀 서스펜션을 추가하여 드라이 아이스에 보관되고 림 바로 아래까지 LN2로 채워진 스냅 냉동 효모 팝콘을 만듭니다. 급속한 증발로 인한 손실을 보상하기 위해 튜브에 액체 질소를 자주 보충합니다. 질소 질식과 관련된 위험을 피하기 위해 통풍이 잘 되는 지역에서 작업하십시오.
- 대신 50mL 튜브 대신, 여러 50mL 튜브를 함께 묶은 튜브(또는 극저온 온도를 견딜 수 있는 큰 플라스틱 원심분리기 병과 같은 큰 입이 있는 용기)를 팝콘제제(그림 1A)를사용합니다. 컨테이너와 개구부가 클수록 팝콘이 뭉쳐 큰 골재를 형성하는 것을 막기 때문에 팝콘 준비가 더 쉬워집니다. 팝콘용 0.3~0.5cm의 크기 범위는 냉동고밀(도 1B)을이용하여 적절한 분쇄/분쇄를 달성하는 데 이상적입니다.
- LN2가 -80°C로 저장하기 전에 팝콘을 함유한 튜브로부터 완전히 증발했는지 확인합니다. -80°C에서 유지될 때 몇 년 동안 안정되어 있기 때문에 효모 팝콘을 준비한 후에 멈출 수 있다.

그림 1: 효모 팝콘 준비. (A) 효모 "팝콘"은 LN2에서세포 현탁액의 드롭 와이즈 동결에 의해 만들어집니다. 고무 밴드와 함께 1~3mL 튜브를 사용하고 드라이 아이스로 채워진 얼음 양동이에 넣습니다. 튜브는 LN2로 채워져 있으며 모든 세포 현탁액이 팝콘(B)으로 만들어질 때까지 거의 가득 차도록 액체 질소를 자주 얹어 팝콘의 크기는 최적의 연삭 효율을 결정하는 중요한 결정요인입니다. 팝콘의 크기 범위는 직경이 0.3~0.5cm 사이여야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 극저온 분쇄
- 먼저 냉동고 공장을 식히고, 바이알을 갈고, 소모품을 갈고, 모든 시료에 대한 기계를 작동시킬 수 있는 충분한 LN2가 있는지 확인하십시오. 5개 미만의 샘플의 경우 LN2의 30-35 L이 충분합니다. 냉동고 밀 챔버를 LN2로 채우기 라인까지 채웁니다.
경고: LN2와 관련된 모든 단계는 통풍이 잘되는 지역에서 수행되어야하며 냉동실 자체는 질식의 위험을 피하기 위해 이러한 지역에 위치해야합니다. 적절한 신발, 실험실 코트, 안전 안경, 니트릴 장갑의 기본 레이어, 열 장갑, 또 다른 니트릴 장갑 을 포함한 개인 보호 장비를 착용하십시오. LN2를취급할 때는 주의하십시오. - 냉동고 밀 뚜껑을 천천히 닫고 LN2의 스플래시를 피하고 기계가 식을 수 있도록 몇 분 이내세요. 다음 단계로 진행하기 전에 증발로 인한 손실을 보상하기 위해 LN2로 챔버를 다시 채울 필요가 있을 수 있습니다.
참고: 채우기 라인까지만 필요에 따라 LN2를 리필합니다. 이 기계에 위험하고 해롭다 모두 될 수 있기 때문에 챔버를 초과 채우지 마십시오. 냉동고 공장에 연결된 저장 탱크에서 필요에 따라 증발LN2를 보충할 수 있는 냉동고 밀에 자동 리필 시스템을 사용할 수 있습니다. - LN2에서 덩크하여 큰 연삭 바이알과 자기 충격기 바를 미리 식히면 별도의 작은 드워드에 보관됩니다. LN2가 버블링을 멈출 때 모든 LN2를 decant. 그런 다음 시료/효모 팝콘을 연삭 바이알에 넣고 두 개의 스테인리스 스틸 엔드 플러그로 단단히 밀봉합니다.
- 연삭 효율을 줄일 수 있기 때문에 분쇄 유리알의 1/3 이상을 샘플로 채우지 마십시오. 대신, 더 큰 견본은 둘 이상의 유리병으로 분할하고 순차적으로 그(것)들을 분쇄하여 처리될 수 있습니다. 더 작은 연삭 바이알은 더 작은 샘플(최대 3mL)에 사용할 수 있습니다.
- 분쇄 유리알을 냉동실 챔버에 놓고 제자리에 고정하십시오. 뚜껑을 닫습니다.
- 신진 효모의 경우, 14의 분쇄 속도로 2 분 / 사이클 (사이클 간 냉각을위한 2 분 휴식)에 대한 총 3 사이클에 대한 샘플을 분쇄합니다. 기계가 사이클을 완료한 후 정지하면 냉동고 밀 뚜껑을 천천히 열고 분말냉동 셀 용액으로 유리병의 잠금을 해제하고 냉동고 공장에서 제거합니다. 여러 개의 작은 바이알을 사용하는 경우 신속하게 작동하여 한 번에 하나의 유리병을 제거하고 드라이 아이스에 넣습니다.
참고: 일반적으로 동일한 유형의 샘플로 다른 크기의 바이알을 사용할 때 연삭 매개변수를 조정할 필요가 없습니다. 그러나 사이클 수 및 연삭 속도와 같은 연삭 매개변수는 lyse가 용이성에 따라 다른 샘플 유형에 대해 경험적으로 결정되어야 합니다. 대부분의 포유류 세포와 연조직은 10의 분쇄 속도로 1-2 주기에서 lyse 것입니다. 박테리아, 효모, 플라이 애벌레 및 성인 과일 파리와 같은 샘플을 lyse하기 어렵게 하면 최대 속도로 3-6 사이클이 필요하며 뼈, 치아 등과 같은 단단한 조직은 최대 10 사이클이 필요할 수 있습니다. 해동된 시료의 작은 알리쿼트들은 연삭 전후현미경으로 볼 수 있으며, 이는 리스 효율을 결정하기 위해 온전하고 무연수세포의 수를 계산한다. 신진 효모에서 단백질과 DNA의 방출에 극저온 분쇄 파라미터의 영향에 대한 우수한 분석은 이전에15에발표되었다. - 시료가 해동되지 않도록 신속하게 작업하여 개구부 도구를 사용하여 최종 조각 중 하나를 조심스럽게 풀수 있습니다 (연삭 중에 다소 느슨해진 것으로 보이는 조각을 선택하십시오). 그런 다음 긴 집게(드라이 아이스가 있는 양동이에서 미리 냉각됨)를 사용하여 임펙터 바를 제거합니다. LN2로 미리 냉각되고 드라이 아이스를 유지하여 폴리스티렌 계량 접시에 분쇄 바이알을 반전시키고 눌러 분쇄 된 샘플을 수집합니다.
- 모든 분말 냉동 셀 용액이 연삭 유리병에서 회수되면, 50mL 튜브로 다시 계량 접시에서 분말 리세이트를 부어 최상의 결과를 위해 다음에 설명 된 느린 해동 단계로 즉시 진행합니다. 또는, 동결 된 분말 용액을 하룻밤 -80 °C에 저장하지만, 이것은 약간의 저하를 초래할 수 있지만.
- 얼음과 물의 50%의 슬러리가 있는 얼음 양동이를 준비하고 자기 교반기로 저어접시에 놓습니다. 시료를 보관하기 위해 와이어 랙 또는 얼음 슬러리에 다른 적합한 랙을 잠급합니다.
- 그런 다음, 자기 교반기를 사용하여 슬러리의 지속적인 동요와 얼음 슬러리 욕조에 샘플을 천천히 해동. 녹는 얼음을 대체하기 위해 얼음을 더 추가하십시오 (얼음 양동이가 넘쳐 나는 것을 방지하기 위해 일부 물을 버려야 할 수도 있습니다). 여러 억제제는 수성 완충제에서 짧은 반감기를 가지고 있기 때문에, 추가 프로테아제 억제제 칵테일을 추가 (재료의 표참조) 및 10 μM proteasome 억제제 MG-132 샘플이 해동 시작되면 (약 30 분 후) 용사에.
- 해동 과정을 촉진하기 위해 5 분마다 튜브 외부에 형성 된 얼음을 제거합니다. 실온 이상에서 시료를 빠르게 해동하면 상당한 저하가 발생할 수 있습니다.
- 시료가 완전히 해동된 후(시료의 양에 따라 1시간 이상 걸릴 수 있음), 4°C에서 냉장 탁상 원심분리기에서 20분 동안 lysate에서 lysate를 원심분리하여 용해물에서 세포 이물질의 대부분을 제거한다.
- 상체를 얼음에 미리 냉각된 50mL 폴리카보네이트 원심분리기 튜브로 옮기고 샘플을 4°C에서 20분 동안 16,000g에서 원심분리기로 옮긴다(재료표 참조).
- 흐린 지질층(도2)을방해하지 않고, 튜브내 액체 컬럼의 중심으로부터 명확한 전세포 추출물로 구성된 명확한 상체만 을 미리 차가운 세로지피펫을 사용하여 차가운 15mL 튜브로 옮춥니다. 지질과 파편의 이월을 방지하기 위해 원심 분리기 튜브의 모든 lysate를 제거하지 마십시오. 원심분리기 관내남은 남은 리자테는 각 스핀 후 소량의 추출물을 회수하기 위해 여러 번 원심분리될 수 있다.
참고: 어떤 변성 단백질과 함께 지질은 흐리고 액체/공기 인터페이스의 상단에 위치하며, 때때로 불용성 세포 파편으로 구성된 펠릿 자체 위에있습니다(그림 2).
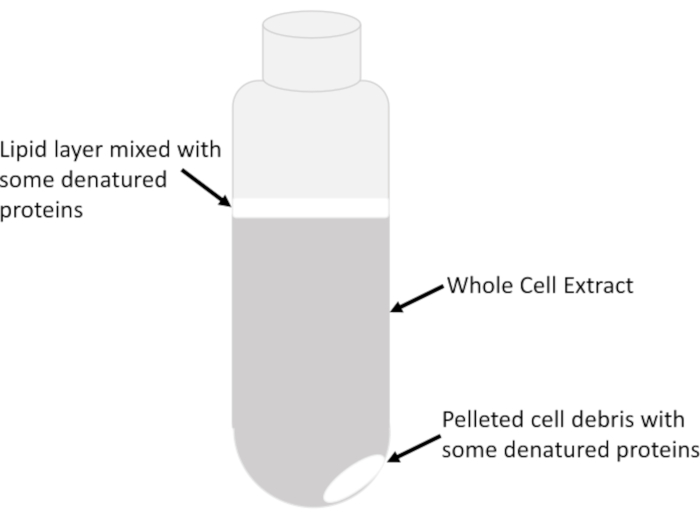
그림 2: 원심분리기 튜브에서 층을 추출합니다. 20 분 동안 16,000 g에서 원심 분리 다음 튜브에서 전체 세포 추출물의 주요 눈에 띄는 특징이 표시됩니다. 각 피처의 상대적 풍부도는 샘플 유형, 세포의 성장 단계(지수 대 고정), 세포를 재일시 중단하는 데 사용되는 용해 버퍼의 양 및 용액 효율에 따라 달라집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 원심분리기는 남은 용액을 5분 동안 분리하여 추출물을 더 많이 회수합니다. 가능한 한 명확한 추출물을 복구하는 데 필요한 경우 이 5분 원심 분리를 여러 번 반복하십시오. 펠릿 근처의 튜브 바닥 에 가까운 지질이 들어있는 흐린 리세테를 버리십시오.
- 단백질 복합 정제, 면역 침전 및 프로테오믹 분석과 같은 다운스트림 응용 분야에 이러한 추출물을 사용합니다.
결과
효모 세포 용해, 즉 유리 비드 밀링에 대한 두 가지 다른 방법, 즉 4°C에서 유리 비드 밀링 및 -196°C의 자동 냉동 분쇄 방법을 비교하여 두 가지 방법으로 제조된 세포 추출물의 상대적 회수 단백질을 평가하였다. 이 연구를 위해, 우리는 신진 효모 균주 YAG 1177 (MAT a lys2-810 leu2-3,-112 ura3-52 his3-Δ200 trp1-1[am] ubi1-Δ1::TRP1 ubi2-Δ2:ura3 ubi3-Δ2:ura3 ubi3-Δub-2.2 ubi4-Δ2::LEU2 [pUB221]) 16 [pUB221])...
토론
효모에서 토착 단백질을 연구하는 한계는 그들의 힘든 세포 벽 때문에 효모 세포의 비효율적인 lysis입니다. 여러 가지 방법이 개발되었지만, 우리 손에 가장 일관되고 효율적인 방법은 팝콘으로 얼어 붙은 효모 세포의 냉동 분쇄입니다. 이 방법은 다른 용해 방법에 비해 신진 효모에서 고품질 전세포 추출물의 신뢰할 수있는 준비를 할 수 있습니다. 대표적인 결과는 저온분쇄가 4°C(도
공개
저자는 공개 할 것이 없습니다.
감사의 말
군얀 연구소의 연구는 국립 보건 원, 국립 과학 재단 및 플로리다 보건부의 자금 지원을 받고 있습니다. 우리는 기술 지원을 학부 학생 존 파커 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 50 mL polycarbonate tubes with screw caps | Beckman | 357002 | Centrifuge tubes |
| BD Bacto Peptone | BD Biosiences | 211677 | Yeast YPD media component |
| BD Bacto Yeast Extract | BD Biosiences | 212750 | Yeast YPD media component |
| Beckman Avanti centrifuge | Beckman | B38624 | High speed centrifuge |
| Beckman JLA-9.1000 | Beckman | 366754 | Rotor |
| D-(+)-Dextrose Anhydrous | MP Biomedicals | 901521 | Yeast YPD media component |
| Eppendorf A-4-44 | Eppendorf | 22637461 | Swinging bucket rotor |
| Eppendorf refrigerated centrifuge 5810 R | Eppendorf | 22625101 | Refrigerated centrifuge |
| Glycerol | SIGMA-ALDRICH | G5150-1GA | Volume excluder and cryoprotectant |
| HEPES | FisherBiotech | BP310-100 | Buffer |
| HIS6 antibody | Novagen | 70796 | Antibody for HIS tag |
| KCl | SIGMA-ALDRICH | P9541-1KG | Salt for maintaining ionic strength |
| MG-132 | CALBIOCHEM | 474790 | Proteasome Inhibitor |
| Phosphatase inhibitor cocktail | ThermoFisher Scientific | A32957 | Phosphatase inhibitor cocktail |
| Ponceau S | SIGMA | P7170-1L | Protein Stain |
| Protease inhibitor cocktail | ThermoFisher Scientific | A32963 | Protease inhibitor cocktail |
| Rotor JLA 25.500 | Beckman | JLA 25.500 | Rotor |
| Sodium Butyrate | EM Science | BX2165-1 | Histone Deacetylase Inhibitor |
| Sodium Fluoride | Sigma-Aldrich | S6521 | Phosphatase Inhibitor |
| Sodium Vanadate | MP Biomedicals | 159664 | Phosphatase Inhibitor |
| Sodium β-glycerophosphate | Alfa Aesar | 13408-09-8 | Phosphatase Inhibitor |
| Spex Certiprep 6850 freezer mill | SPEX Sample Prep | 6850 | Freezer Mill |
| TALON Metal Affinity Resin | BD Biosiences | 635502 | For pulling down HIS tagged proteins |
| Tween 20 | VWR International | VW1521-07 | Non-ionic detergent |
| β-Mercaptoethanol | AMRESCO | M131-250ML | Reducing agent |
참고문헌
- Botstein, D., Chervitz, S. A., Cherry, J. M. Yeast as a model organism. Science. 277 (5330), 1259-1260 (1997).
- Dunn, B., Wobbe, C. R. Preparation of protein extracts from yeast. Current Protocols in Molecular Biology. , (2001).
- Holm, C., Meeks-Wagner, D. W., Fangman, W. L., Botstein, D. A rapid, efficient method for isolating DNA from yeast. Gene. 42 (2), 169-173 (1986).
- Nandakumar, M. P., Marten, M. R. Comparison of lysis methods and preparation protocols for one- and two-dimensional electrophoresis of Aspergillus oryzae intracellular proteins. Electrophoresis. 23 (14), 2216-2222 (2002).
- Silva, G. A. D., Bernardi, T. L., Schaker, P. D. C., Menegotto, M., Valente, P. Rapid yeast DNA extraction by boiling and freeze-thawing without using chemical reagents and DNA purification. Brazilian Archives of Biology and Technology. 55, 319-327 (2012).
- Baldwin, C., Robinson, C. W. Disruption of Saccharomyces cerevisiae using enzymatic lysis combined with high-pressure homogenization. Biotechnology Techniques. 4 (5), 329-334 (1990).
- Rigaut, G., et al. A generic protein purification method for protein complex characterization and proteome exploration. Nature Biotechnology. 17 (10), 1030-1032 (1999).
- Hudspeth, M. E., Shumard, D. S., Tatti, K. M., Grossman, L. I. Rapid purification of yeast mitochondrial DNA in high yield. Biochimica et Biophysica Acta. 610 (2), 221-228 (1980).
- Szymanski, E. P., Kerscher, O. Budding yeast protein extraction and purification for the study of function, interactions, and post-translational modifications. Journal of Visualized Experiments. (80), e50921 (2013).
- Bzducha-Wróbel, A., et al. Evaluation of the efficiency of different disruption methods on yeast cell wall preparation for β-glucan isolation. Molecules. 19 (12), 20941-20961 (2014).
- Umen, J. G., Guthrie, C. A novel role for a U5 snRNP protein in 3' splice site selection. Genes & Development. 9 (7), 855-868 (1995).
- Smith, B. C., Fisher, D. L., Weedn, V. W., Warnock, G. R., Holland, M. M. A systematic approach to the sampling of dental DNA. Journal of Forensic Sciences. 38 (5), 1194-1209 (1993).
- Sweet, D., Hildebrand, D. Recovery of DNA from human teeth by cryogenic grinding. Journal of Forensic Sciences. 43 (6), 1199-1202 (1998).
- Lorenz, W. W., Yu, Y. S., Dean, J. F. An improved method of RNA isolation from loblolly pine (P. taeda L.) and other conifer species. Journal of Visualized Experiments. (36), e1751 (2010).
- Singh, M. R., Roy, S., Bellare, J. R. Influence of Cryogenic Grinding on Release of Protein and DNA from Saccharomyces cerevisiae. International Journal of Food Engineering. 5 (1), (2009).
- Singh, R. K., Kabbaj, M. H., Paik, J., Gunjan, A. Histone levels are regulated by phosphorylation and ubiquitylation-dependent proteolysis. Nature Cell Biology. 11 (8), 925-933 (2009).
- Liang, D., Burkhart, S. L., Singh, R. K., Kabbaj, M. H., Gunjan, A. Histone dosage regulates DNA damage sensitivity in a checkpoint-independent manner by the homologous recombination pathway. Nucleic Acids Research. 40 (19), 9604-9620 (2012).
- Singh, R. K., Gonzalez, M., Kabbaj, M. H., Gunjan, A. Novel E3 ubiquitin ligases that regulate histone protein levels in the budding yeast Saccharomyces cerevisiae. PLoS One. 7 (5), 36295 (2012).
- Gunjan, A., Verreault, A. A Rad53 kinase-dependent surveillance mechanism that regulates histone protein levels in S. cerevisiae. Cell. 115 (5), 537-549 (2003).
- Gill, P., et al. Identification of the remains of the Romanov family by DNA analysis. Nature Genetics. 6 (2), 130-135 (1994).
- Alain, K., et al. DNA extractions from deep subseafloor sediments: novel cryogenic-mill-based procedure and comparison to existing protocols. Journal of Microbiological Methods. 87 (3), 355-362 (2011).
- Mohammad, F., Buskirk, A. Protocol for Ribosome Profiling in Bacteria. Bio-Protocol. 9 (24), 3468 (2019).
- Liew, Y. J., et al. Identification of microRNAs in the coral Stylophora pistillata. PLoS One. 9 (3), 91101 (2014).
- Lopez de Heredia, M., Jansen, R. P. RNA integrity as a quality indicator during the first steps of RNP purifications: a comparison of yeast lysis methods. BMC Biochem. 5 (14), (2004).
- Grant, L. J., et al. Purified plant cell walls with adsorbed polyphenols alter porcine faecal bacterial communities during in vitro fermentation. Food & Function. 11 (1), 834-845 (2020).
- Lolo, M., et al. Cryogenic grinding pre-treatment improves extraction efficiency of fluoroquinolones for HPLC-MS/MS determination in animal tissue. Analytical and Bioanalytical Chemistry. 387 (5), 1933-1937 (2007).
- Santos, D., et al. Determination of Cd and Pb in food slurries by GFAAS using cryogenic grinding for sample preparation. Analytical and Bioanalytical Chemistry. 373 (3), 183-189 (2002).
- da Silva, E. G. P., et al. Fast method for the determination of copper, manganese and iron in seafood samples. Journal of Food Composition and Analysis. 21 (3), 259-263 (2008).
- Kamogawa, M. Y., Nogueira, A. R. A., Costa, L. M., Garcia, E. E., Nobrega, J. A. A new strategy for preparation of hair slurries using cryogenic grinding and water-soluble tertiary-amines medium. Spectrochimica Acta Part B-Atomic Spectroscopy. 56 (10), 1973-1980 (2001).
- Sillen, A., Hall, G., Richardson, S., Armstrong, R. Sr-87/Sr-86 ratios in modern and fossil food-webs of the Sterkfontein Valley: Implications for early hominid habitat preference. Geochimica Et Cosmochimica Acta. 62 (14), 2463-2473 (1998).
- Nielsen-Marsh, C. M., et al. Sequence preservation of osteocalcin protein and mitochondrial DNA in bison bones older than 55 ka. Geology. 30 (12), 1099-1102 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유