Method Article
Совместное культивирование и трансдукция мышиных тимоцитов на дельта-подобных 4-экспрессирующих стромальных клетках для изучения онкогенов при Т-клеточном лейкозе
В этой статье
Резюме
Этот протокол описывает выделение двойных отрицательных тимоцитов из тимуса мыши с последующей ретровирусной трансдукцией и совместным культивированием в дельта-подобной 4-экспрессирующей системе совместного культивирования стромальных клеток костного мозга (OP9-DL4) для дальнейшего функционального анализа.
Аннотация
Трансдуцированные незрелые тимоциты мыши могут быть дифференцированы в Т-клетки in vitro с использованием дельта-подобной 4-экспрессирующей системы совместного культивирования линии стромальных клеток костного мозга (OP9-DL4). Поскольку ретровирусная трансдукция требует деления клеток для интеграции трансгенов, OP9-DL4 обеспечивает подходящую среду in vitro для культивирования гемопоэтических клеток-предшественников. Это особенно выгодно при изучении эффектов экспрессии определенного гена во время нормального развития Т-клеток и лейкемогенеза, поскольку позволяет исследователям обойти трудоемкий процесс создания трансгенных мышей. Для достижения успешных результатов необходимо тщательно выполнить ряд скоординированных шагов, включающих одновременное манипулирование различными типами клеток. Несмотря на то, что это очень хорошо зарекомендовавшие себя процедуры, отсутствие общего источника в литературе часто означает, что требуется ряд оптимизаций, которые могут занять много времени. Было показано, что этот протокол эффективен при трансдукции первичных тимоцитов с последующей дифференцировкой на клетках OP9-DL4. Здесь подробно описан протокол, который может служить быстрым и оптимизированным руководством для совместного культивирования ретровирусно трансдуцированных тимоцитов на стромальных клетках OP9-DL4.
Введение
Линия стромальных клеток костного мозга OP9 обеспечивает полезную систему in vitro для индукции лимфопоэза из нескольких источников предшественников1. Первые исследования, в которых использовались клетки OP9, продемонстрировали, что отсутствие экспрессии колониестимулирующего фактора макрофагов (MCSF) способствовало способности клеточной линии OP9 поддерживать кроветворение и дифференцировку В-клеток из гемопоэтических стволовых клеток (ГСК) костного мозга, что позже было показано и для эмбриональных стволовых клеток (ESCs)2,3,4,5 . В предыдущих исследованиях генерация дельта-подобных 1/4-экспрессирующих клеток OP9 (OP9-DL1/OP9-DL4) позволила индукировать приверженность линии Т-клеток6 и продемонстрировала способность успешно рекапитулировать созревание тимуса 7,8. Вкратце, развитие Т-клеток было описано последовательной экспрессией молекул CD4 и CD8. Незрелые тимоциты являются «двойноотрицательными» (DN, CD4-, CD8-) и могут быть дополнительно разделены в соответствии с поверхностной экспрессией CD44 и CD25. ДН-тимоциты дифференцируются через незрелую одноположительную (ISP) стадию, характеризующуюся экспрессией CD8 у мышей и CD4 у человека, за которой следует двойная положительная (DP) стадия, характеризующаяся совместной экспрессией CD4 и CD8, и, наконец, зрелая одноположительная стадия, характеризующаяся экспрессией CD4 или CD89. ГСК экспрессируют рецептор Notch1, который обычно взаимодействует с дельта-подобным 4 (DL4), экспрессируемым на эпителиальных клетках тимуса, индуцируя дифференцировку Т-линии10. Следовательно, интерес к модели OP9-DL1/4 постепенно возрастал, что привело к широкому использованию этого подхода в самых разных приложениях за последние два десятилетия 8,11,12,13. Хотя DL1 и DL4 способны поддерживать дифференцировку Т-клеток in vitro, они демонстрируют дифференциальные требования in vivo, и несколько исследований показали, что OP9_DL4 более эффективен, чем OP9_DL1, при повторении среды тимуса мыши 7,14.
Среди потенциальных применений системы OP9-DL1/4 особый интерес представляет комбинация этой системы с трансдукцией ДНК-клеток или ГСК ретровирусными векторами. Эта комбинация является эффективным способом манипулирования экспрессией генов во время нормального развития Т-клеток и лейкемогенеза и, как было показано, является эффективным методом индуцирования или ингибирования функции интересующего гена15,16,17. Эта модель была особенно успешно использована для изучения взаимодействия между онкогенами, управляющими лейкемией15, поскольку она является гибкой и позволяет изучать эффекты нескольких комбинаций генов в разумные сроки, в отличие от получения трансгенных мышей. Более того, подобные модели использовались ранее для оценки эффектов введения онкогенов в нормальные клетки15,16,17. Кроме того, ретровирусная трансдукция требует деления клеток для интеграции трансгена18, и хотя лентивирусная трансдукция преодолела бы это ограничение, устранив необходимость в делении клеток для интеграции трансгенов, мы не смогли добиться успешной трансдукции тимоцитов ДН с использованием лентивирусных векторов. Таким образом, OP9-DL1/DL4 является подходящим инструментом для выращивания гемопоэтических клеток-предшественников.
Стандартный протокол лимфопоэза трансдуцированных тимоцитов на OP9-DL4 включает в себя ряд скоординированных шагов, которые должны быть тщательно выполнены для достижения успешного результата. Несмотря на то, что эти методы хорошо служат обществу в течение многих лет, часто протоколы, доступные в литературе, фрагментированы. В результате каждая лаборатория вынуждена адаптировать и оптимизировать различные этапы процедуры, что может занять много времени. Здесь этот протокол описывает выделение тимоцитов ДНК из тимуса мыши с последующей ретровирусной трансдукцией и совместным культивированием на стромальных клетках OP9-DL4 для дальнейшего функционального анализа. Было показано, что этот установленный протокол эффективен и воспроизводим при трансдуцировании первичных тимоцитов с последующей дифференцировкой на клетках OP9-DL4 или индукцией Т-клеточного острого лимфобластного лейкоза15.
протокол
Все описанные эксперименты на животных были одобрены Институциональным комитетом по биобезопасности NIH (IBC) и Комитетом по уходу за животными и их использованию (ACUC). Подробную информацию обо всех реагентах и материалах, используемых в этом протоколе, см. в таблице материалов . Обратитесь к опубликованным рекомендациям19 для получения более подробной информации о культуре клеток ретровируса-продуцента и процедурах поддержания. Обзор протокола приведен на рисунке 1 .
1. Начало культивирования клеток OP9-DL4 (1-й день)
- Быстро разморозьте клетки OP9-DL4, держа флакон и осторожно встряхивая на водяной бане при температуре 37 °C. Немедленно перенесите клетки в центрифужную пробирку, содержащую 5 мл среды OP9 (среда MEM-альфа, 10% FBS, 50 ЕД/мл пенициллина/стрептомицина, 55 мкМ 2-меркаптоэтанола, 2 мМ L-глутамина) для удаления криопротекторов.
- Центрифугу при 300 × г в течение 5 мин при комнатной температуре. Выбросьте надосадочную жидкость и ресуспендируйте клетки в 1 мл среды OP9.
- Поместите 5 мл среды OP9 в колбу T25 и добавьте ресуспендированные клетки в эту колбу. Культура при 37 °C и 5% CO2.
- Через 2-3 дня субкультурируйте клетки, используя разделение 1:3 (проходите клетки каждый понедельник, среду и пятницу).
ПРИМЕЧАНИЕ: Разделите ячейки OP9-DL4 до того, как они достигнут слияния. Колба OP9-DL4 должна быть на 80–90% сливающейся на 6–7-й день и на 8–9+ день для совместного культивирования с тимоцитами. Следовательно, важно спланировать, сколько клеток OP9-DL4 потребуется в эти дни при разделении клеток OP9-DL4.- Вылейте средство из колбы и промойте монослой 1x PBS. Выбросьте PBS, добавьте 1 мл 0,25% трипсина и инкубируйте в течение 1–5 минут при 37 ° C или до тех пор, пока клетки не вытеснятся из колбы. Ударьте по колбе, чтобы выбить клетки.
ПРИМЕЧАНИЕ: (Необязательно) Ход диссоциации клеток можно проверить с помощью микроскопии. - Добавьте 5 мл среды OP9 для инактивации трипсина и ресуспендируйте клетки, промыв покрытую клетками поверхность колбы во время ресуспендирования.
- Центрифугируют клеточную суспензию при 300 × г в течение 5 мин при комнатной температуре и ресуспендируют в 3 мл среды OP9 (для разделения 1:3).
- Поместите 1 мл клеточной суспензии в колбу T25, которая уже содержит 5 мл свежей среды OP9. Заморозьте/выбросьте оставшиеся ячейки.
- Чтобы заморозить клетки OP9-DL4, ресуспендируйте клетки в 90% FBS / 10% DMSO в соотношении 1 мл замораживающей среды на один флакон клеток.
- Замораживание в криовиалах объемом 1 мл при температуре -80 °C или в жидком азоте, в зависимости от будущих требований. Хранить в жидком азоте для длительного хранения.
- Вылейте средство из колбы и промойте монослой 1x PBS. Выбросьте PBS, добавьте 1 мл 0,25% трипсина и инкубируйте в течение 1–5 минут при 37 ° C или до тех пор, пока клетки не вытеснятся из колбы. Ударьте по колбе, чтобы выбить клетки.
2. Начало культивирования клеточной линии ретровируса-продуцента (День 1)
- Быстро разморозьте клеточную линию, продуцирующую ретровирус, держа флакон и осторожно встряхивая на водяной бане при 37 ° C. Немедленно перенесите клетки в центрифужную пробирку, содержащую 5 мл клеточной среды, продуцирующей ретровирус (RPC: DMEM, 10% FBS), для удаления криопротектора.
- Центрифугу при 300 × г в течение 5 мин при комнатной температуре. Выбросьте надосадочную жидкость и ресуспендируйте клетки в 1 мл среды RPC.
- Поместите 5 мл среды RPC в колбу T25 и добавьте ресуспендированные клетки в эту колбу. Культура при 37 °C и 5% CO2.
- Проходите клетки каждые 2–3 дня с интервалом от 1:5 до 1:8.
- Ударьте по колбе, чтобы вытеснить клетки, и ресуспендируйте клетки, агрессивно пипетируя.
ПРИМЕЧАНИЕ: Эти клетки могут быть удалены с поверхности колбы путем агрессивного пипетирования без трипсина. В качестве альтернативы трипсинизируют (0,05% трипсина/0,53 мМ ЭДТА) до тех пор, пока клетки не отсоединятся и не смогут быть легко пипетированы в одноклеточную суспензию.
- Ударьте по колбе, чтобы вытеснить клетки, и ресуспендируйте клетки, агрессивно пипетируя.
- Центрифугируют клеточную суспензию при 300 × г в течение 5 мин и ресуспендируют в 5 мл среды RPC (для разделения 1:5).
- Поместите 1 мл клеточной суспензии в колбу T25, которая уже содержит 5 мл свежей среды RPC. Заморозьте/выбросьте оставшиеся ячейки. Заморозьте клетки-продуценты ретровируса таким же образом, как описано для клеток OP9-DL4 (этапы 1.4.4.1–1.4.4.2).
3. Начало культивирования клеток-продуцентов ретровируса в 6-луночных планшетах (4–5 дни)
- Засейте клетки-продуценты ретровируса за 18–24 ч до трансфекции при слиянии 70–90% в каждой лунке 6-луночной пластины для культивирования тканей в 2 мл среды RPC и инкубируйте при 37 ° C и 5% CO2.
ПРИМЕЧАНИЕ: Трансфицируйте две лунки клеток-продуцентов ретровируса на каждые 2–5 × 105 до 1 × 106 тимоцитов, которые будут трансдуцированы.
4. Трансфицировка клеток-продуцентов ретровируса для получения ретровируса, содержащего интересующие гены (дни 5–6)
- Замените среду свежей средой RPC за 1 ч до трансфекции.
- Приготовьте смеси для липофекции (для каждой лунки 6-луночной пластины - при необходимости увеличивайте масштаб): разведите 4 мкг ДНК (2 мкг вспомогательной плазмиды (pCL-Eco) и 2 мкг трансферной плазмиды (pMIG) в 250 мкл среды с восстановленной сывороткой. Аккуратно перемешайте.
- Смешайте 10 мкл реагента для трансфекции с 250 мкл среды с восстановленной сывороткой с этапа 4.2. Инкубировать 5 минут при комнатной температуре.
- После 5 мин инкубации соединить разбавленную ДНК с разбавленным реагентом для трансфекции (общий объем = 500 мкл). Аккуратно перемешайте и выдерживайте 20–25 минут при комнатной температуре.
- Аккуратно добавьте 500 мкл смеси реагентов ДНК/трансфекции в лунку, содержащую клетки-продуценты ретровируса, капая на клетки круговыми движениями. Аккуратно перемешайте, раскачивая тарелку вперед и назад, и инкубируйте тарелку в инкубаторе с температурой 37 °C в течение 16–24 часов.
ПРИМЕЧАНИЕ: Субконфлюентные клетки (80–90%) лучше всего подходят для трансфекции и потенциально генерируют самый высокий титр вируса. Поскольку клетки-продуценты ретровируса очень легко вытесняются из колбы, избегайте резких движений при работе с этими клетками.
5. Смена клеточной среды ретровируса-продуцента (6–7 день)
- Замените старую среду примерно через 16 ч после трансфекции 2 мл свежей среды RPC. Продолжайте инкубацию клеток при 37 °C в течение 20–24 ч.
- Оцените эффективность трансфекции под флуоресцентным микроскопом (опционально).
ПРИМЕЧАНИЕ: В этом протоколе GFP-положительные клетки представляют интерес (см. рис. 2). Этот шаг зависит от ретровирусного вектора, выбранного для использования в этом протоколе (присутствует ли репортерный ген в основной цепи).
6. Подготовка тимоцитов и истощение CD4+ и CD8+ клеток (6–7 день)
- Соберите тимус у 4–6-недельной мыши C57BL/6. Для получения более подробной информации о сборе тимуса см. Син и Хогквист20.
ПРИМЕЧАНИЕ: Мышей усыпляли ингаляцией CO2 с последующим вывихом шейки матки. - Приготовьте одноклеточную суспензию тимоцитов, поместив тимус в 5 мл PBS в чашку Петри. Используя стерильные стеклянные предметные стекла, поместите тимус между матовыми поверхностями предметных стекол и аккуратно потрите предметные стекла друг о друга, перекатывая тимус между двумя предметными стеклами. Промойте предметные стекла, чтобы собрать клетки, и выбросьте остатки стромальной ткани тимуса.
ПРИМЕЧАНИЕ: Предполагаемый выход из одного тимуса составляет 90 × 10 6–100 × 106 клеток, и примерно 1% клеток останется после истощения CD4 и CD8. Используйте ткань тимуса от более молодых мышей для лучшего выхода клеток, так как клеточность тимуса мыши в первые недели после рождения быстро увеличивается, достигает плато в возрасте 4-6 недель и постепенно инволюция впоследствии21. Подсчитайте клетки с помощью автоматического счетчика клеток крови или любого альтернативного метода. - Отфильтруйте суспензию тимуса через фильтр 30 мкм или 40 мкм, пипетируя 5 мл суспензии тимуса через клеточный фильтр. Центрифугируют клетки при концентрации 300 × г в течение 10 мин.
- Удалите надосадочную жидкость и лизируйте эритроциты буфером лизиса ACK, добавив (в зависимости от размера образца) 1 мл буфера на пробирку в течение 1 мин. Добавьте 5 мл буфера для истощения клеток (500 мл PBS [pH 7,2], 0,5% BSA, 2 мМ 0,5 М ЭДТА, pH 8,0) для дезактивации буфера лизиса ACK, центрифугу при 300 × г в течение 10 мин и ресуспендирование в 1–5 мл буфера истощения клеток для подсчета.
ПРИМЕЧАНИЕ: Отложите на лед следующее до истощения (до истощения): 70 мкл клеточной суспензии для подсчета (варьируйте это в зависимости от выбранного метода подсчета клеток) и 200 мкл клеточной суспензии для определения эффективности истощения путем окрашивания на CD4 и CD8 и анализа с помощью проточной цитометрии22,23. - Пересчитайте клетки и центрифугу при 300 × г в течение 10 мин. Ресуспендируют клетки при 1 × 107/80 мкл буфера истощения клеток. Добавьте по 10 мкл микрогранул CD4 и CD8 на 1 ×10-7 клеток. Хорошо перемешайте и выдержите 15 минут в темноте в холодильнике (2–8 °C).
- Подготовьте обедненную колонку, промыв ее 2 мл обедненного буфера и выбросив проточный.
- Промывают клетки с этапа 6.6, добавляя 1–2 мл обедненного буфера на 1 × 10-7 клеток, и центрифугу при 300 × г в течение 10 мин. Удалите и выбросьте надосадочную жидкость.
- Ресуспендировать до 1,25 × 10-8 клеток в 500 мкл обедненного буфера. Нанесите суспензию ячеек на колонку и соберите проточные (немеченые ячейки). Промойте колонку 2 раза 1 мл буфера и соберите проточный.
ПРИМЕЧАНИЕ: Добавляйте новый буфер только тогда, когда резервуар столбца пуст. Отложите на лед после истощения (контроль после истощения): 70 мкл клеточной суспензии для подсчета (варьируйте это в зависимости от выбранного метода подсчета клеток) и 1,000 мкл клеточной суспензии для определения эффективности истощения путем окрашивания на CD4 и CD8 и анализа с помощью проточной цитометрии22,23. - Окрашивайте контроль эффективности истощения, разделив 200 мкл клеток, собранных до истощения, на четыре пробирки FACS: неокрашенные, одноокрашенные CD4, одноокрашенные CD8 и дважды окрашенные CD4/CD8 (используйте неокрашенные и одноокрашенные образцы для настройки параметров проточной цитометрии). Используйте 1000 мкл клеток, собранных после истощения, для окрашивания на CD4 и CD8 и сравните с двойным окрашенным образцом, собранным до истощения (см. Типичные результаты истощения на рисунке 3).
ПРИМЕЧАНИЕ: Отрегулируйте объемы для окрашивания проточной цитометрией в соответствии с рекомендацией производителя антитела (например, 1 мкл анти-CD4-FITC + 0,5 мкл анти-CD8-PE на 1 x 106 клеток в 50 мкл буфера).
7. Культивирование тимоцитов на клетках OP9-DL4 (6–7 дни)
- Поместите 2–5 × 105 –1 × 10–6 тимоцитов после истощения в колбу T25 с 80–90% сливающимися клетками OP9-DL4 в среде OP9, содержащей цитокины (10 нг/мл рекомбинантного IL-7 и рекомбинантного hFLT-3). Культура при 37 °C и 5% CO2. Расти в течение примерно 24 ч на клетках OP9-DL4.
ПРИМЕЧАНИЕ: Эта продолжительность необходима для того, чтобы сделать Т-клетки трансдуцируемыми (см. типичный результат на рисунке 4). Зарезервируйте одну колбу T25 с кокультурой тимоцитов и клеток OP9-DL4 для использования в качестве контроля (нетрансдуцированной). Нетрансдуцированные тимоциты будут окрашены вместе с трансдуцированными тимоцитами (этап 9.1) в качестве отрицательного контроля для оценки эффективности трансдукции. Нетрансдуцированные тимоциты также могут быть использованы для измерения влияния экспрессии трансгена на дифференцировку клеток. Откажитесь от цитокинсодержащей среды через 1 месяц.
8. Забор ретровируса из надосадочной жидкости и использование его для трансдукции тимоцитов (дни 8–9)
- Соберите надосадочную жидкость, содержащую ретровирусы, из трансфицированных клеток, наклонив 6-луночную пластину и поместив шприц объемом 3–5 мл в нижнюю часть пластины, потянув за поршень для аспирации надосадочной жидкости. Замените среду 2 мл свежей среды RPC. Продолжайте инкубацию клеток при 37 ° C в течение 20–24 ч для второй трансдукции на шаге 8.9.
- Отфильтруйте надосадочную жидкость ретровируса через шприцевой фильтр 0,45 мкм и соберите фильтрат в пробирку объемом 50 мл.
ПРИМЕЧАНИЕ: Не замораживайте ретровирусную надосадочную жидкость. Используйте свежеприготовленный вирусный препарат для трансдукции. - Соберите тимоциты из культуры OP9-DL4 путем агрессивного пипетирования, чтобы удалить тимоциты и клетки OP9-DL4 с поверхности колбы. Отфильтруйте клеточную суспензию через клеточный сетчатый фильтр 40 мкм, чтобы удалить большую часть клеток OP9-DL4, и соберите фильтрат в пробирку объемом 50 мл.
ПРИМЕЧАНИЕ: Клетки OP9 очень адгезивы. Хотя агрессивное пипетирование может удалить некоторые клетки OP9-DL4 из колбы, разрушение монослоя OP9-DL4 во время этого процесса минимально, и клетки OP9-DL4, которые отрываются, будут отфильтровываться с помощью ситечка для клеток 40 мкм, поскольку клетки OP9-DL4 намного больше, чем первичные тимоциты. Если клетки OP9-DL4 все еще сливаются на 80–90%, удалите тимоциты и повторно поместите их в ту же колбу OP9-DL4. В качестве альтернативы необходимо подготовить новую колбу OP9-DL4. - Центрифугируют тимоциты в фильтрате с этапа 8.3 при 300 × г в течение 5 мин. Откажитесь от надосадочной жидкости.
- В пробирке объемом 50 мл ресуспендируют тимоциты в 0,5–1 мл среды OP9 + цитокины (см. этап 7.1). Добавьте 1–2 мл среды RPC, содержащей вирус (в два раза больше среды RPC, чем среды тимоцитов). Добавьте бромид гексаметрина (исходная концентрация 10 мкг/мкл), чтобы получить 8 мкг гексаметрина бромида/мл общей клеточной суспензии.
- Спинокулят центрифугированием клеток при 850 × г в течение 1 ч при комнатной температуре.
- Ресуспендируют клетки в 6 мл среды OP9 + цитокины на колбу (см. шаг 7.1) и добавляют суспензию обратно на монослой клеток OP9-DL4.
ПРИМЕЧАНИЕ: В качестве альтернативы подготовьте новые колбы OP9-DL4 для приема трансдуцированных тимоцитов. Если тимоциты должны быть помещены обратно в использованную колбу OP9-DL4, обязательно добавьте свежую среду OP9 в клетки OP9-DL4 в течение 1 часа спинокуляции тимоцитов, чтобы сохранить клетки здоровыми и обеспечить слияние 80–90%. - Инкубировать при температуре 37 °C в течение ночи.
- Повторите шаги 8.2–8.7, используя новую лунку надосадочной жидкости, содержащей ретровирус.
9. Поддержание трансдуцированных тимоцитов на культуре OP9-DL4 в течение 2–5 дней или замораживание по мере необходимости (день 9+)
- Оцените дифференцировку тимоцитов с помощью проточной цитометрии путем окрашивания тимоцитов на маркеры развития Т-клеток, такие как CD4, CD8, CD25 и CD4423. Типичные результаты дифференцировки тимоцитов см. на рисунке 5.
Результаты
Эффективность истощения можно оценить проточно-цитометрически, пометив магнитно немеченую клеточную фракцию для CD4 и CD8 после иммуномагнитного разделения клеток (MACS) и проанализировав ее на двумерной двумерной точечной диаграмме (рис. 3). Хороший выход двойных отрицательных (CD4-, CD8-) клеток составляет 95% или выше, как показано на рисунке 3. Двумя наиболее распространенными причинами снижения выхода являются неправильный расчет микрогранул на основе количества клеток и количества меченых клеток, превышающих емкость колонки. Рекомендуется выбирать правильное количество столбцов MACS в соответствии с количеством помеченных ячеек. При работе с тимоцитами количество меченых клеток (DP и SP клеток) практически равно количеству суммарных клеток (более 96%). Подсчет ячеек может производиться в автоматическом счетчике ячеек, камере Нойбауэра или любым альтернативным методом. В результате может потребоваться корректировка объемов, выделенных для подсчета ячеек, в зависимости от конкретной машины и выбранного метода подсчета.
Важно определить количество клеток, присутствующих до и после истощения. Эти подсчеты клеток необходимы для расчета количества необходимых столбцов истощения LD и равномерного распределения тимоцитов DN в соответствующее количество колб OP9-DL4. Контроль проточной цитометрии (немеченые клетки, клетки, меченные CD4, и клетки, меченные CD8), может быть выполнен с зарезервированным образцом до истощения, так как он содержит больше клеток. Однако, поскольку ожидается, что большая часть ячеек будет сохранена в столбце, образец после истощения, подлежащий маркировке, потребует большего объема. Следовательно, может потребоваться внести коррективы в соответствии с выбранным протоколом маркировки.
При использовании векторов, экспрессирующих скрининговые маркеры, таких как ген флуоресценции, трансфекцию и трансдукцию можно приблизительно и эмпирически оценить с помощью флуоресцентной микроскопии (рис. 2). Эффективность трансдукции может быть проанализирована путем сбора тимоцита из монослоя OP9-DL4, как описано на шаге 8.3, и изучения экспрессии гена флуоресценции с помощью проточной цитометрии. Эффективность трансдукции с использованием пустого ретровирусного вектора с GFP в качестве репортерного гена составила 84,2% (рис. 4).
Дифференцировка Т-клеток на клетках OP9-DL4 может наблюдаться через 4 дня после трансдукции. Проточную цитометрия обычно проводят для оценки дифференцировки клеток, индуцированной кокультурой на клетках OP9-DL4 и/или экспрессии трансгена, как показано на рисунке 5, где клетки были помечены для CD4, CD8, CD44 и CD25. Существует несколько возможных комбинаций маркировки молекул клеточной поверхности, которые, как было показано, полезны для исследования молекулярных и клеточных механизмов развития Т-клеток у мышей24,25,26,27. Следовательно, панели флуоресцентных антител могут варьироваться в зависимости от рассматриваемого вопроса. Трансдукция ДН-тимоцитов пустым ретровирусным вектором pMIG, показанная на панели B, представляла примерно те же пропорции одиночных положительных (CD4+ или CD8+), двойных положительных (CD4+/CD8+), двойных отрицательных (CD4-/CD8-) и ее подстадий, двойных отрицательных 1–4 (DN1–DN4), как и нетрансдуцированные тимоциты, показанные на панели А, что указывает на то, что процесс трансдукции не повлиял на развитие Т-клеток.
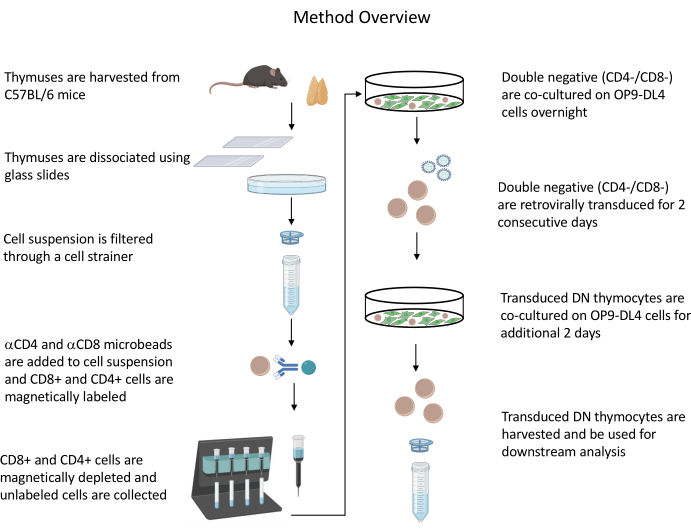
Рисунок 1: Схема этапов выделения, трансдукции и совместного культивирования тимоцитов. Аббревиатура: DN = двойное отрицание. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
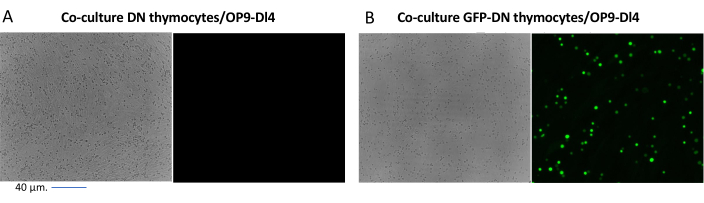
Рисунок 2: Флуоресцентная микроскопия кокультуральной тимоцитов, трансдуцированных GFP, или нетрансдуцированных тимоцитов и клеток OP9-DL4. (A) Нетрансдуцированные тимоциты и (B) стабильные GFP-экспрессирующие мышиные тимоциты на OP9-DL4 на 3-й день после второй трансдукции. Использовался флуоресцентный микроскоп Olympus-IX71 с 40-кратным объективом и фильтром 480/30, подходящим для детектирования GFP. Масштабная линейка = 40 мкм. Сокращения: GFP = зеленый флуоресцентный белок; DN = двойное отрицательное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
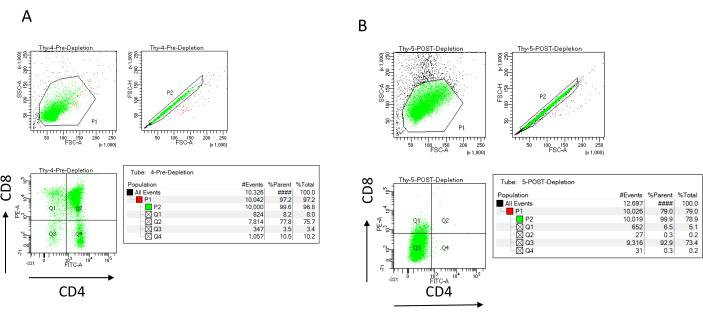
Рисунок 3: Проточная цитометрия истощения тимоцитов. Репрезентативные графики проточной цитометрии, анализирующие экспрессию CD4 и CD8 на тимоцитах, полученных от самок мышей C57BL/6J в возрасте 7-8 недель (A) до истощения и (B) после истощения CD4+ и CD8+ с использованием микрогранул и колонок LD в соответствии с инструкциями производителя. Точечные графики слева показывают ворота в зависимости от размера и сложности события (FCS-A и SSC-A соответственно). На средней панели показано сравнение FSC-H и FSC-A для затвора одиночных ячеек и исключения дублетов. На графиках справа клетки были определены как CD4 и CD8 от одноклеточного ворота. Сокращения: FSC-A = площадь пика прямого рассеяния; SSC-A = площадь пика бокового рассеяния; FSC-H = высота пика прямого рассеяния; FITC = изотиоцианат флуоресцеина; ПЭ = фикоэритрин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
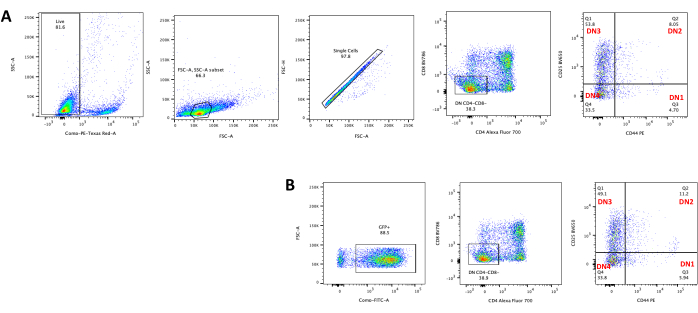
Рисунок 4: Проточная цитометрия эффективности ретровирусной трансдукции тимоцитов. (A) Нетрансдуцированные тимоциты, совместно культивируемые на OP9-DL4; (B) ретровирусно трансдуцированные тимоциты на OP9-DL4 на 3-й день после трансдукции. Сокращения: FSC-A = площадь пика прямого рассеяния; SSC-A = площадь пика бокового рассеяния; FSC-H = высота пика прямого рассеяния; FITC = изотиоцианат флуоресцеина; ПЭ = фикоэритрин; DN = двойное отрицательное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
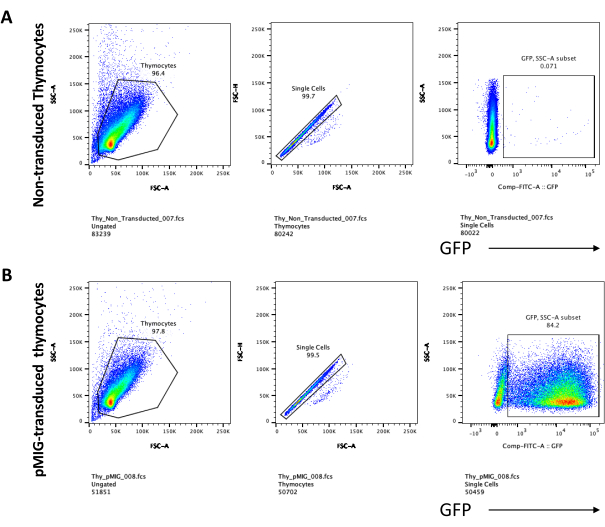
Рисунок 5: Проточная цитометрия трансдуцированных тимоцитов после 4 дней совместной культуры OP9-DL4. (A) Нетрансдуцированный и (B) трансдуцированный ретровирусом pMIG. Клетки сначала закрывали на живых клетках, а затем закрывали в зависимости от размера и сложности (FCS-A и SSC-A, соответственно), а затем строили график FSC-H по сравнению с FSC-A для затвора на одиночных клетках и исключения дублетов. Для нетрансдуцированных клеток мы использовали следующую стратегию ворот. Из одноклеточного затвора клетки были определены как одиночные положительные (CD4+ или CD8+), двойные положительные (CD4+/CD8+) и двойные отрицательные (CD4-/CD8-). Затем, с двойного отрицательного (CD4-/CD8-) затвора, клетки определяли как CD44+, CD25+, CD44+/CD25+ и CD44-/CD25−, как показано на панели A. Для трансдуцированных клеток pMIG, показанных на панели B, из одноклеточного ворота клетки сначала определялись как GFP+/GFP-, а затем из клеток GFP+ распределение популяции клеток на основные стадии развития Т-клеток, определяемое экспрессией CD4, CD8, CD44 и CD25, определяли с использованием той же стратегии ворот, что и для нетрансдуцированных клеток. Сокращения: FSC-A = площадь пика прямого рассеяния; SSC-A = площадь пика бокового рассеяния; FSC-H = высота пика прямого рассеяния; FITC = изотиоцианат флуоресцеина; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Описанный здесь протокол был разработан специально для исследований ДНК (CD4-/CD8-) Т-клеток, полученных из тимуса, с последующей ретровирусной трансфекцией с последующей моделью дифференцировки OP9-DL4. Однако вполне вероятно, что клетки-мишени, которые будут подвергнуты этому протоколу трансдукции с последующей дифференцировкой клеток, будут иметь более широкую междисциплинарную полезность. Таким образом, в дополнение к незрелым тимоцитам, гемопоэтические стволовые клетки, такие как клетки, полученные из печени плода или костного мозга, потенциально могут быть использованы в этом протоколе.
Система OP9-DL4 оказалась эффективной моделью для изучения функции генов в различных аспектах, включая дифференцировкуклеток 17 и онкогенез15. В то время как ретровирусная модификация гемопоэтических предшественников является хорошо зарекомендовавшим себя методом, который обеспечивает стабильную генетическую модификацию, сочетание индукции дифференцировки клеток в системе OP9-DL4 и ретровирусной трансдукции требует осторожности и навыков. Критическим аспектом для достижения успеха с этим протоколом является обеспечение хорошей координации всех шагов, поскольку протокол включает в себя использование трех различных типов клеток, которые необходимо поддерживать здоровыми и в идеальном слиянии, необходимом для каждого конкретного этапа. Имея это в виду, важно выполнить все анализы контрольных точек контроля качества после выполнения каждого шага, прежде чем переходить к следующему шагу. Это гарантирует, что все шаги работают. Таким образом, проверка эффективности истощения, трансфекции и трансдукции важна для успешного выполнения этого протокола (см. типичный результат эффективности трансдукции на рисунке 4). Хорошая эффективность первичной клеточной трансдукции связана с высоким титром вируса. Как правило, более крупные вставки приводят к более низким титрам вируса18. В учебных целях мы используем пустой вектор для представления результатов, которые могут быть получены с помощью этого протокола. По нашему опыту, эффективность трансдукции и трансфекции варьируется в зависимости от размера вставки, особенно с учетом репортерных генов, экспрессирующих вирусную магистраль, таких как GFP. Одна из стратегий, которая может быть использована при изучении взаимодействия более чем одного гена, заключается в клонировании каждого гена в другой вектор переноса с последующим производством отдельного вируса и, наконец, совместной трансдукцией клетки-мишени. В этом случае стадия отбора может быть применена для удаления одиночно трансдуцированных клеток и сохранения только котрансдуцированных клеток.
Стоит отметить, что большинство клеточных линий стромального фидерного слоя OP9-DL1/DL4 были генетически модифицированы для экспрессии GFP как части конструкций DL1 или DL47. В этом протоколе мы использовали ретровирусный вектор, который также экспрессирует GFP; однако он ярче, чем белок GFP, экспрессируемый клетками OP9-DL4, и не мешает трансдукционному контролю при визуализации кокультуры под флуоресцентным микроскопом.
Клетки OP9 дифференцируются в адипоциты после многих пассажей, длительных периодов в культуре или в условиях чрезмерного слияния19. Об этом свидетельствует развитие крупных вакуолей. Таким образом, ячейки OP9, обладающие этими характеристиками, не должны использоваться в этом протоколе. Трансфекция чрезмерно сливающихся клеток-продуцентов ретровируса приведет к низкому титру вируса. Действительно, субконфлюентная стадия - это когда клетки наиболее трансфицируемы. Кроме того, трансфекция клеток-продуцентов ретровируса с низким слиянием уменьшит клеточный стресс в процессе трансфекции и даст самый высокий титр вируса.
Хотя в этом протоколе мы не титруем надосадочную жидкость вируса, титрование надосадочной жидкости вируса необходимо учитывать в некоторых случаях, например, при отсутствии репортерного гена в ретровирусном векторе, что предотвратило бы косвенное определение продукции вируса, или в случаях, когда экспериментальный дизайн требует более точного количества копий трансгена, которые должны быть интегрированы в геном клетки-мишени. Однако важно отметить, что титр надосадочной жидкости ретровирусного вектора значительно снижается при хранении при -80 °C или 4 °C до получения результатов титрования. Таким образом, использование свежеприготовленного надосадочной жидкости вируса для трансдукции даст лучшую эффективность трансдукции.
Тимус содержит большое количество двойных положительных (DP) тимоцитов (более 85%) и около 10% одноположительных15 клеток (CD4 или CD8), которые являются тимоцитами пост-ДН-стадии. DP-клетки не могут выжить in vitro при ретровирусных манипуляциях, в то время как SP-клетки нетрансдумируемы. Таким образом, этот протокол может быть применен для генерации ретровирусного вектора, трансдуцируемого ДН-тимоцитов.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать
Благодарности
Эта работа была поддержана очной программой Национального института рака, проект ZIABC009287. OP9-DL4 был получен от доктора Хуана Карлоса Суньига-Пфлюкера (Центр медицинских наук Саннибрук, Торонто, Онтарио, Канада). Авторы благодарят Программу NCI-Frederick Laboratory Animal Sciences Program за их постоянную техническую помощь, экспериментальные советы и вклад, а также Джеффа Каррела, Меган Карван и Кимберли Кларманн за помощь в проточной цитометрии. Мы благодарны Говарду Янгу за критические советы и вклад.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma | M3148 | |
| ACK Lysis buffer | Lonza | 10-548E | |
| BSA | Cell Signaling Technology | 9998S | |
| CD4 Microbeads | Miltenyi | 130-049-201 | |
| CD8 Microbeads | Miltenyi | 130-049-401 | |
| Centrifuge 5910R | eppendorf | 5942IP802353 | |
| DMEM | Corning | 10-013-CV | |
| EDTA | Invitrogen | 15575-038 | |
| Fetal calf serum HyClone FBS | ThermoScientific | SH30910.03 | |
| LD columns | Miltenyi | 130-042-901 | |
| L-glutamine | Sigma | G7513 | Freeze glutamine in aliquots and use freshly-thawed glutamine |
| Lipofectamine 2000 | Invitrogen | P/N 52887 | |
| MEM-alpha Medium | Gibco | 12561-072 | |
| OPTI-MEM I Reducing Serum Medium | Invitrogen | 31985-062 | |
| PBS pH 7.2 | Corning | 21-040-CV | |
| pcL-Eco Plasmid | Addgene | 12371 | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| pMIG Plasmid | Addgene | 6492 | |
| Polybrene | Chemicon | TR-1003-G | |
| Pre-Separation Filters | Miltenyi | 130-041-407 | |
| recombinant hFLT-3L | PeproTech | 300-19 | |
| recombinant IL-7 | Peprotech | 217-17 | |
| Retrovial packaging cell line Phoenix-Eco | Orbigen | RVC-10002 | |
| Syringe filter (0.45 µm) | Millipore | SLHV033RS |
Ссылки
- Zuniga-Pflucker, J. C. T-cell development made simple. Nature Reviews Immunology. 4 (1), 67 (2004).
- Kodama, H., Nose, M., Niida, S., Nishikawa, S., Nishikawa, S. Involvement of the c-kit receptor in the adhesion of hematopoietic stem cells to stromal cells. Experimental Hematology. 22 (10), 979-984 (1994).
- Nakano, T., Kodama, H., Honjo, T. Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science. 265 (5175), 1098-1101 (1994).
- Nakano, T., Kodama, H., Honjo, T. In vitro development of primitive and definitive erythrocytes from different precursors. Science. 272 (5262), 722-724 (1996).
- Ueno, H., et al. A stromal cell-derived membrane protein that supports hematopoietic stem cells. Nature Immunology. 4 (5), 457-463 (2003).
- Jaleco, A. C., et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation. Journal of Experimental Medicine. 194 (7), 991-1002 (2001).
- Mohtashami, M., et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. Journal of Immunology. 185 (2), 867-876 (2010).
- Schmitt, T. M., Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity. 17 (6), 749-756 (2002).
- Mazzucchelli, R., Durum, S. K. Interleukin-7 receptor expression: Intelligent design. Nature Reviews Immunology. 7 (2), 144-154 (2007).
- Robey, E. A., Bluestone, J. A. Notch signaling in lymphocyte development and function. Current Opinion in Immunology. 16 (3), 360-366 (2004).
- Lavaert, M., et al. Integrated scRNA-Seq identifies human postnatal thymus seeding progenitors and regulatory dynamics of differentiating immature thymocytes. Immunity. 52 (6), 1088-1104 (2020).
- Roh, K. H., Roy, K. Engineering approaches for regeneration of T lymphopoiesis. Biomaterials Research. 20 (20), (2016).
- Zlotoff, D. A., et al. CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus. Blood. 115 (10), 1897-1905 (2010).
- Holmes, R., Zuniga-Pflucker, J. C. The OP9-DL1 system: Generation of T-lymphocytes from embryonic or hematopoietic stem cells in vitro. Cold Spring Harbor Protocols. 2009 (2), (2009).
- Cramer, S. D., et al. Mutant IL-7Ralpha and mutant NRas are sufficient to induce murine T cell acute lymphoblastic leukemia. Leukemia. 32 (8), 1795-1882 (2018).
- Treanor, L. M., et al. Interleukin-7 receptor mutants initiate early T cell precursor leukemia in murine thymocyte progenitors with multipotent potential. Journal of Experimental Medicine. 211 (4), 701-713 (2014).
- Yokoyama, K., et al. In vivo leukemogenic potential of an interleukin 7 receptor alpha chain mutant in hematopoietic stem and progenitor cells. Blood. 122 (26), 4259-4263 (2013).
- Simmons, A., Alberola-Ila, J. Retroviral transduction of T cells and T cell precursors. Methods in Molecular Biology. 1323, 99-108 (2016).
- . Retroviral systems Available from: https://web.stanford.edu/group/nolan/_OldWebsite/retroviral_systems/retsys.html (2022)
- Xing, Y., Hogquist, K. A. Isolation, identification, and purification of murine thymic epithelial cells. Journal of Visualized Experiments. (90), e51780 (2014).
- Gray, D. H., et al. Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood. 108 (12), 3777-3785 (2006).
- Godfrey, D. I., Kennedy, J., Suda, T., Zlotnik, A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3-CD4-CD8- triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. Journal of Immunology. 150 (10), 4244-4252 (1993).
- Wang, Y. B., Edinger, M., Mittar, D., McIntyre, C. Studying mouse thymocyte development using multiparametric flow cytometry: An efficient method to improve an 8-color panel on the BD FACSVerse™ system. BD Biosciences–Application Note. , (2012).
- Sakaguchi, N., et al. Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature. 426 (6965), 454-460 (2003).
- He, X., Park, K., Kappes, D. J. The role of ThPOK in control of CD4/CD8 lineage commitment. Annual Review of Immunology. 28, 295-320 (2010).
- Wang, Y., et al. A conserved CXXC motif in CD3epsilon is critical for T cell development and TCR signaling. PLoS Biology. 7 (12), e1000253 (2009).
- Aliahmad, P., Kadavallore, A., de la Torre, B., Kappes, D., Kaye, J. TOX is required for development of the CD4 T cell lineage gene program. Journal of Immunology. 187 (11), 5931-5940 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены