Method Article
Лапароскопическая передняя правая гепатэктомия: одноцентровый опыт
В этой статье
Резюме
Здесь мы представляем пошаговый протокол проведения лапароскопической передней правой гепатэктомии и сравниваем ее клинические эффекты и послеоперационные результаты с таковыми при обычной гепатэктомии. Анализ данных 82 пациентов с гепатоцеллюлярной карциномой показал, что лапароскопическая передняя правая гепатэктомия имела лучшие клинические исходы и выживаемость, чем обычная гепатэктомия.
Аннотация
Лапароскопическая передняя правая гепатэктомия (LARH) используется в некоторых больницах. Однако данные о целесообразности и безопасности этой процедуры все еще ограничены из-за жестких технических требований. Основной целью данного исследования было сравнение клинических исходов ЛАРГ с таковыми при лапароскопической традиционной гепатэктомии правой стороны (ЛКРГ) у пациентов с большой гепатоцеллюлярной карциномой правой руки, а также подтверждение безопасности и целесообразности применения ЛАРГ. Кроме того, в статье представлено пошаговое описание хирургических процедур при ЛАРГ, которые помогут выполнить эту операцию в клинике. Принцип LARH заключается в том, чтобы сначала отдавать приоритет отделению входного протока печени, а затем отделять правую печеночную перипепатическую связку после пересечения печени. С декабря 2015 г. по июнь 2022 г. в исследование было набрано 82 пациента с большой гепатоцеллюлярной карциномой правой руки (максимальный диаметр опухоли ≥ 5 см). В этой когорте 54 и 28 пациентов прошли ЛАРГ и ЛКРЗ соответственно. Сравнивали периоперационные клинические данные и выживаемость в двух группах. По сравнению с LCRH, LARH продемонстрировал преимущества меньшего контакта и экструзии, что привело к достижению превосходных результатов. Таким образом, мы предполагаем, что ЛАРГ является оптимальным выбором для пациентов с большой гепатоцеллюлярной карциномой правой руки.
Введение
Хирургическое вмешательство считается наиболее эффективным методом улучшения прогноза у пациентов с гепатоцеллюлярной карциномой. Тем не менее, правая гепатэктомия является сложной процедурой. По сравнению с традиционным подходом для правой гепатэктомии (CA-RH), передний доступ для правой гепатэктомии (AA-RH) может достичь лучших краткосрочных и долгосрочных эффектов. Lo et al. сообщили, что АА-РГ включает обширную резекцию (p < 0,001) и пришли к выводу, что передний доступ позволяет лучше мобилизовать и легче удалять крупные опухоли после диссекции печени1. Beppu et al. сообщили, что АА-РЗ с маневром подвешивания приводит к лучшим показателям общей выживаемости (ОВ), чем СА-РЗ (p = 0,021), из-за снижения интраоперационной кровопотери (p < 0,001), что приводит к низкой частоте трансфузии (p < 0,001)2. В своем последнем мета-анализе Jiang et al. проанализировали 2297 пациентов, включенных в 16 исследований, и подтвердили, что AA-RH приводит к более быстрому послеоперационному восстановлению и лучшим исходам выживаемости, чем CA-RH3.
В 1996 году Lai et al. были первыми, кто продемонстрировал эффективность и безопасность АА-РГ с помощью проспективного анализа и сравнил интраоперационные и послеоперационные исходы между АА-РГ и СА-РГ4. Правая гепатэктомия включает в себя полное рассечение входящих и выходных сосудов правой печени, а также рассечение паренхимы печени. Время мобилизации правой доли печени варьируется в зависимости от подхода. Belghiti et al. были первыми, кто предложил висячий маневр для АА-РГ, где используются анатомические характеристики заднего и нижнего печеночных пространств5. Печеночная повязка, используемая в маневре подвешивания, представляла собой зажатую ленту, которая проходит позади печени и вокруг печеночной паренхимы, поднимая печень от передней поверхности нижней полой вены (НПВ). В 2012 году Troisi et al. исследовали лапароскопическую АА-РГ с помощью специального устройства под названием «диссектор Голдфингера» и предположили, что оно может заменить роль печеночного слинга воткрытой хирургии. В 2016 году Cai et al. применили технику «диссектора Голдфингера» через ретро-печеночный туннель7. С тех пор эта процедура постепенно стала приниматься в Китае.
В последнее время развитие лапароскопической хирургии способствовало развитию лапароскопической передней правой гепатэктомии (LARH), хирургической техники, включающей комбинацию АА-РГ и лапароскопии. А LCRH включает в себя комбинацию CA-RH и лапароскопии. В предыдущем исследовании Liu et al. использовали сопоставление показателей склонности, чтобы показать, что интраоперационная кровопотеря (p = 0,049) и общая частота осложнений (p = 0,028) были ниже при LARH, чем при LCRH8. Передний доступ основан на принципах «бесконтактного и неэкструзионного доступа» в соответствии с принципом «без опухоли» для повышения выживаемости пациентов3. Принцип «бесконтактности и неэкструзии» направлен на то, чтобы избежать длительной ротации и смещения печеночных долей, избежать нарушения афферентной и эфферентной циркуляции. Кроме того, применение этого принципа может снизить вероятность разрыва опухоли, улучшая прогноз выживаемости пациентов и снижая риск нарушения функции печени, вызванного мобилизацией печени.
При ЛАРГ сначала рассекается входной проток печени, а после рассечения печени – правая печеночная перипепатическая связка. Кроме того, благодаря ретикулярному пространству между печенью и веной, маневр висения может быть удобно выполнен для правильного направления траектории резекции. Эта процедура может еще больше снизить трудности в мобилизации правой печени и значительно увеличить частоту резекции большой гепатоцеллюлярной карциномы правой печени. Тем не менее, LARH имеет длительное время работы и высокие технические требования, а число зарегистрированных случаев в настоящее время невелико- 6,7. Здесь мы провели ретроспективное исследование для оценки целесообразности и безопасности LARH, и наши результаты подтвердили эффективность этой процедуры. Кроме того, мы сравнили клинические исходы двух подходов в рамках лапароскопической техники, чтобы лучше поддерживать исходный баланс и исключить искажающие факторы. Поэтому мы рекомендуем эту процедуру пациентам с раком правой печени (максимальный диаметр опухоли ≥ 5 см) для увеличения частоты резекции и улучшения клинических эффектов.
Для демонстрации пошаговой процедуры мы приводим случай 44-летней женщины со случайно обнаруженным печеночным образованием во время УЗИ брюшной полости. Физикальное обследование не выявило существенных отклонений. Результаты лабораторных исследований, включая рутинные анализы крови, коагулограммы и функциональные пробы печени, были в норме. При поступлении на расширенной компьютерной томографии (КТ) верхней части брюшной полости было выявлено гипоинтенсивное образование размером 9,5 см х 9,0 см х 7,0 см, занимающее правую печень (рис. 1), которое было диагностировано как первичная опухоль правой печени. После прохождения соответствующих обследований была проведена LARH. Мы выбрали этот случай, чтобы продемонстрировать, как операция была проведена в когорте из 82 пациентов.
протокол
Это исследование было одобрено Комитетом больницы Чжуцзян Южного медицинского университета (Этическое одобрение No: 2021-KY-081-01) 25 августа 2021 года. Настоящий протокол хирургии человека был одобрен и выполнен в соответствии с этическими принципами Чжуцзянской больницы Южного медицинского университета (Гуанчжоу, Китай). Кроме того, от пациента было получено информированное согласие на разглашение информации и данных, связанных с его лечением.
1. Критерии включения и исключения
- Включите пациентов со следующими клиническими обследованиями.
- Предоперационная оценка КТ-изображения, указывающая на гепатоцеллюлярную карциному.
- Предоперационное визуализирующее обследование, показывающее, что максимальный диаметр опухолей печени составляет >5 см.
- Все предоперационные оценки по шкале Чайлд-Пью как A или B9.
- Пациенты с остаточными объемами >30% нормальной и >40% склеротической печени.
- Пациенты без серьезных поражений жизненно важных органов.
- Исключить пациентов со следующей клинической оценкой.
- Предоперационные КТ-изображения, указывающие на опухолевую инвазию в НПВ, левую печеночную ножку или левую печеночную вену.
- Предоперационные КТ-снимки, указывающие на опухолевую инвазию в левую печень и отдаленные метастазы.
- Предоперационные КТ-снимки, указывающие на разрыв опухоли.
- Предоперационные КТ-снимки, показывающие наличие опухоли рядом с НПВ.
2. Предоперационная подготовка
- Запретить пациенту есть и пить перед операцией.
- Используйте интубацию трахеи под общим наркозом10.
- Простерилизуйте кожу 0,5% скрабом на основе йода. Положите стерильные полотенца на межсосковое соединение, лобковый симфиз, правую подмышечную и левую среднеключичную линии.
ПРИМЕЧАНИЕ: Продезинфицируйте операционную область йодофором три раза.
3. Хирургическая техника LARH
- Положите пациента в положение лежа на спине, изголовье кровати приподнято, ножки кровати опущены, а правая сторона тела пациента наклонена под углом 15°.
- Сделайте пять разных изогнутых надрезов. Используйте иглу для пневмоперитонеума, чтобы получить доступ к брюшной полости, введя ее через разрез пупка. Подсоедините иглу пневмоперитонеума к пневмоперитонеумному аппарату через соединительную трубку пневмоперитонеума и введитеСО2 в брюшную полость (Таблица материалов). Установите давление пневмоперитонеума на 13 мм рт.ст. на пневмоперитонеуме.
- Рассматривайте изогнутый разрез на пупке в качестве лапароскопического отверстия (A), два изогнутых разреза по 1 см (B и E) в качестве основных операционных отверстий и два 5-миллиметровых изогнутых разреза (C и D) в качестве вспомогательных операционных отверстий (рисунок 2).
- Расположите троакар размером 5, 10, 10, 5 и 5 мм в области пупка (рис. 2, точка А), ниже мечевидного отростка (точка В), среднеключичной линии (точка Е), передней подмышечной линии под правым реберным краем (точка С) и между операционными разрезами А и В (точка D) (рис. 2).
- Выполните исследование брюшной полости, проникнув в брюшную полость. Локализовать опухоль и проверить наличие значительных внепеченочных метастазов путем визуального осмотра.
- Рассекают углубление6 между корнем средней печеночной вены (MHV) и правой печеночной веной (RHV) с помощью ультразвукового ножа и аспиратора (рисунок 3).
- Отделите треугольник желчного пузыря ультразвуковым ножом, чтобы обнажить проток желчного пузыря и артерию. Срежьте их и удалите желчный пузырь.
- Убедитесь, что ассистент оказывает помощь в подъеме печени, а оператор отделяет правую печеночную артерию (RHA) и правую ветвь воротной вены (RPV) с помощью ультразвукового ножа и аспиратора. Затем используйте шовный материал (4#), чтобы перевязать RPV, но не пересекайте его сначала. Используйте home-o-lock, чтобы зажать RHA.
- Обведите IVC снизу вверх, чтобы найти раны коротких печеночных вен (SHV) и перевязать их (рис. 4A). Затем зажмите их ультразвуковым ножом, чтобы получить доступ к аваскулярной области за печенью (рис. 4B).
- Ввести диссектор Голдфингера через заднюю часть печени и выйти через углубление печеночной вены.
- Зафиксируйте диссектор Голдфингера мочевым катетером (Таблица материалов) и шунтируйте печень для создания ретро-печеночного туннеля (Рисунок 5).
- Используйте катетер, чтобы приподнять печень и помочь обнажить плоскость резекции печени во время диссекции печени.
- Разрезают паренхиму печени ультразвуковым ножом по линии ишемии печени. Следите за тем, чтобы не возникало значительного кровотечения до тех пор, пока опухоль не будет удалена вместе с правой печенью.
- Вскрыть нижнюю гепатодуоденальную связку ультразвуковым ножом и использовать стерильный браслет для обхода гепатодуоденальной связки в качестве преблокирующей бандажа для выполнения первой прикорневой окклюзии и уменьшения кровотечения, если это необходимо.
- По возможности используйте ультразвуковой нож для пересечения паренхимы печени вдоль MHV и во время процесса. Более толстые трубы, которые встречаются, могут быть отрезаны путем перевязки швов и клипсирования home-o-lock (Рисунок 6).
- Освободите правый передний и задний глиссоны, а затем пересеките их с помощью эндоскопического инструмента для сшивания и одноразового нагрузочного устройства (например, Endo-GIA).
- Полностью отрезав печеночную паренхиму, осмотрите наличие сосудов снизу вверх и отделите их по одному.
- Отделите правую печеночную коронарную и треугольную связки с помощью ультразвукового ножа с помощью ассистента, который может помочь с правильным воздействием.
- Поместите образец в мешок для образцов и сделайте поперечный разрез на пересечении правой среднеключичной линии и пупочной линии (красная линия), чтобы полностью удалить образец (Рисунок 2).
ПРИМЕЧАНИЕ: Обратите внимание, что MHV виден во время разреза печени и IVC под печенью после завершения резекции печени (Рисунок 7). - Установите лапароскопическую дренажную трубку (табл. материалов) в место резекции печени и выйдите из правой нижней части живота после подтверждения отсутствия активного кровотечения в брюшной полости.
- Зашить все 5-мм и 10-мм разрезы троакара слой за слоем.
4. Послеоперационный уход
- Внимательно следите за жизненно важными показателями пациента в первые послеоперационные 24 часа с помощью непрерывной электрокардиографии в режиме реального времени.
- Вводите антибиотик внутривенно в течение 24 часов после операции, чтобы предотвратить инфекцию.
- Удалить катетер и дренажную трубку через 24 ч и через 48-72 ч после операции соответственно.
- На 3-е сутки после операции провести расширенное КТ-исследование.
ПРИМЕЧАНИЕ: Расширенная КТ показала изменения после резекции гепатоцеллюлярной карциномы правой руки с углублением, соответствующим наружной дренажной трубке в зоне операции (рис. 8).
Результаты
Соответствующие результаты LARH представлены в таблице 1. Пациент, показанный на видео, хорошо восстановился после операции и был отправлен обратно в палату. Операция длилась 180 мин, интраоперационная кровопотеря составила около 150 мл, что не потребовало переливания крови. Интраоперационный диурез составил 800 мл. Время установления ретро-печеночного канала и рассечения паренхимы печени составляет 15 мин и 35 мин соответственно. Маневр Прингла был выполнен дважды. Пациентка выздоровела хорошо, без послеоперационных осложнений и была выписана на 8-е сутки после операции. Предоперационная КТ показала умеренно низкодифференцированную гепатоцеллюлярную карциному размером 9,5 см х 9,0 см х 7,0 см (рис. 1). Послеоперационная КТ выявила полную резекцию опухоли правой печени, подтверждающую резекцию R0, без значительного выпота в правом отделе печени (рис. 8). Послеоперационные патологоанатомические результаты подтвердили гепатоцеллюлярную карциному (рис. 9). Безрецидивная выживаемость (DFS) пациента составляет 17 месяцев, а общая выживаемость (OS) – 32 месяца.
Приведенный выше случай был выбран для демонстрации того, как была проведена операция у 82 пациентов. С декабря 2015 г. по июнь 2022 г. для исследования было набрано 82 пациента с диагнозом большая гепатоцеллюлярная карцинома правой руки (максимальный диаметр опухоли ≥5 см). В общей сложности 54 и 28 пациентов прошли ЛАРГ и ЛКРЗ соответственно. LARH выполняли, как описано выше, а LCRH выполняли, какописано ранее 3 (см. Дополнительный файл 1).
Сравнивали периоперационные клинические данные и выживаемость в двух группах. Характеристики всех 82 пациентов сведены в таблицу 2.Статистически значимой разницы между группами ЛАРГ и ЛКРЗ по клиническим характеристикам не выявлено (р >0,05). Результаты хирургического вмешательства сведены в таблицу 3. По результатам можно определить интраоперационную кровопотерю, продолжительность методики, время рассечения паренхимы печени и частоту осложнений в обеих группах. Приведенные выше показатели периоперационного наблюдения демонстрируют эффективность и безопасность ЛАРГ. Интраоперационная кровопотеря у пациентов в группе ЛАРГ была меньше, чем у пациентов в группе ЛКРЗ (200 против 300 мл, р < 0,05). Ретро-печеночный туннель был успешно установлен у пациентов, перенесших ЛАРГ без массивного кровотечения, и катетер был использован для завершения маневра подвешивания. Медиана времени установления запеченочного канала у пациентов группы ЛАРГ составила 15 мин. Время рассечения паренхимы печени у пациентов группы ЛАРГ было меньше (р = 0,011). Кроме того, пациенты в группе ЛАРГ имели более короткие сроки послеоперационного пребывания в стационаре (8,5 против 11 дней, p <0,05). Частота осложнений (III и IV степени) по классификации Clavien-Dindo11 в группе LARH была лучше, чем в группе LCRH (9,3% против 32,1%, p = 0,009). Обе группы пациентов успешно завершили операцию, и выживаемость составила 100% сразу после операции.
Четверо из 82 пациентов не явились на контрольные визиты, а 78 пациентов были включены в анализ выживаемости в течение 8-69 месяцев, при этом медиана наблюдения составила 32 месяца. В группе LARH показатели 1-й, 3- и 5-летней безрецидивной выживаемости (DFS) были лучше, чем в группе LCRH (88,5% против 76,9%, 65,5% против 42,0%, 48,9% против 29,4% соответственно; p = 0,043) (рис. 10). Показатели ОВ в течение 1, 3 и 5 лет были схожи в группе LARH (95,5% против 96,2%, 70,8% против 64,2%, 84,5% против 64,2% соответственно; p = 0,35) по сравнению с таковыми в группе LCRH (рис. 11). Прогностические факторы для ОС и СФС приведены в таблице 4. Многофакторный анализ показал, что ЛАРГ (отношение рисков [ОР]=0,518, 95% ДИ 0,268-1,000, p=0,049) и отсутствие тромба сосудистой опухоли (отношение рисков [ОР]=0,110, 95% ДИ 0,151-0,240, p<0,001) и кровопотеря < 250 мл (отношение рисков [ОР]=2,067, 95% ДИ 1,027-4,163, p<0,042) были связаны с более длительным СДС. Кроме того, отсутствие сосудистого опухолевого тромба (отношение рисков [ОР]=0,229, 95% ДИ 0,106-0,493, p<0,001) не ассоциировалось с более длительным ОВ.
Таблица 1: Релевантные результаты LARH. классификация Clavien-Dindo класс III/IV Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Характеристика пациентов. HBsAg, поверхностный антиген гепатита В; АФП, альфа-фетопротеин. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Результаты хирургического вмешательства. классификация Clavien-Dindo класс III/IV Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Прогностический факторный анализ ДФС и ОС. ОР: коэффициент риска; ОС: общая выживаемость; DFS: безрецидивная выживаемость; АФП: уровень α-фетопротеина в сыворотке крови. Данные в скобках представляют собой 95% доверительные интервалы. Использовалась модель пропорциональной регрессии опасности Кокса для DFS и OS. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
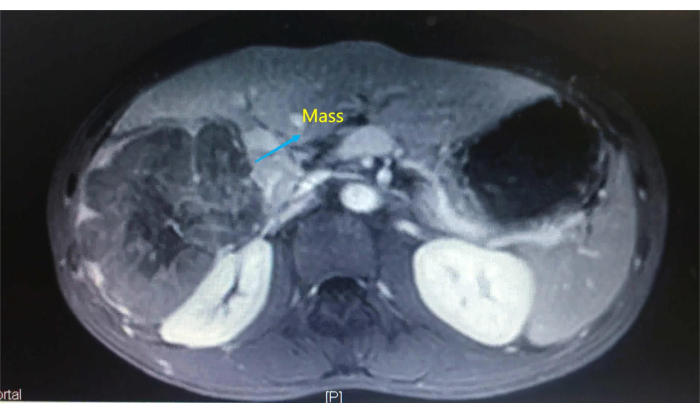
Рисунок 1: Усиленная компьютерная томография подтвердила гипоинтенсивное образование, занимающее правую печень. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
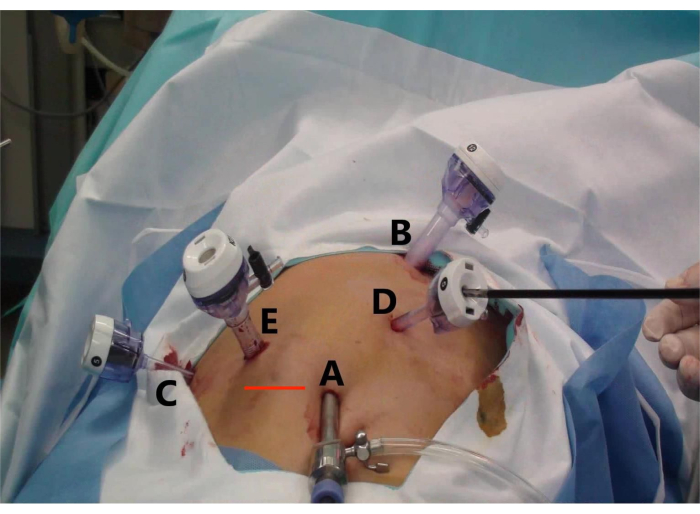
Рисунок 2: Установка троакара и разрез для извлечения образца для лапароскопической передней правой гепатэктомии (LARH). На рисунке показано (A) смотровое отверстие, (B) основное рабочее отверстие для ассистента, (C) вспомогательное рабочее отверстие для оператора, (D) вспомогательное рабочее отверстие для ассистента, (E) основное рабочее отверстие для оператора, а также (красная линия) поперечный разрез для извлечения образца. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
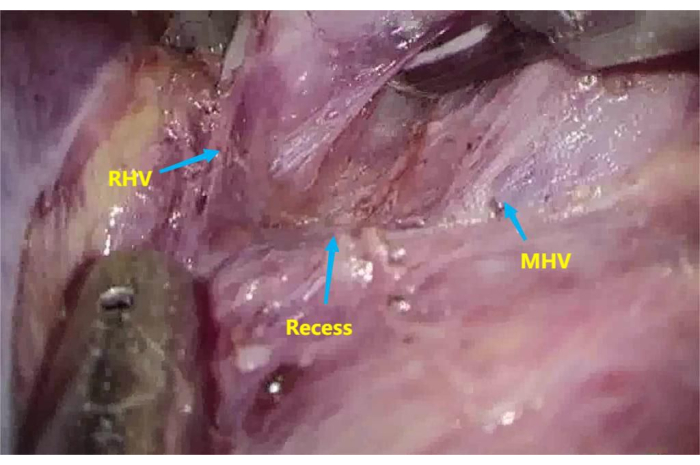
Рисунок 3: Углубление между корнем средней печеночной вены (MHV) и правой печеночной веной (RHV). Рассечь углубление между корнем MHV и RHV. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
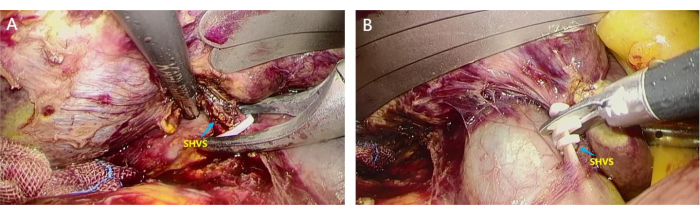
Рисунок 4: Рассечение коротких печеночных вен (SHV). SHV разделяли и перевязывали для доступа к аваскулярной области позади печени. (А) Ассистент поднимает печень, а хирург использует home-o-lock для зажима более толстых SHVS; (Б) SHV отсоединяли с помощью ножниц для доступа к аваскулярной области позади печени. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
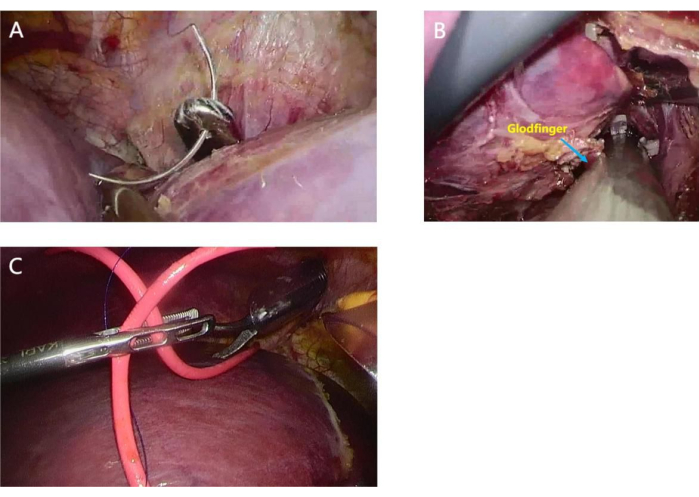
Рисунок 5: Использование диссектора Голдфингера и мочевого катетера для подтяжки печени. На диссекторе Голдфингера был установлен мочевой катетер диаметром 8 мм, а печень шунтировали для создания ретро-печеночного туннеля. (А) Диссектор Голдфингера в обход печени; (B) Введение мочевого катетера с наложением шва после того, как диссектор Голдфингера вышел из углубления между корнем средней печеночной вены (MHV) и правой печеночной веной (RHV); (с) Мочевой катетер поднимает печень после ее прохождения через запеченочный туннель. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
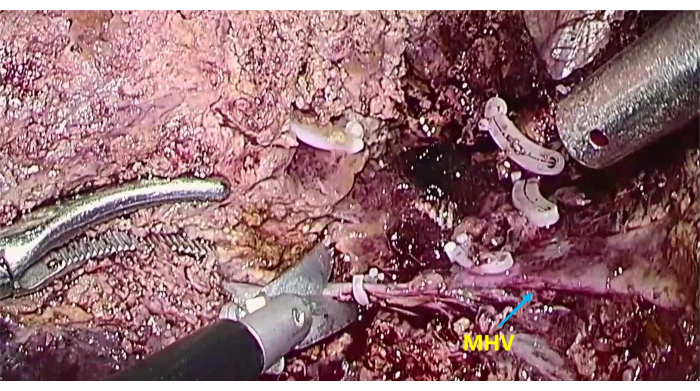
Рисунок 6: Обнажение средней печеночной вены (МНВ) Для пересечения паренхимы печени вдоль МГВ. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
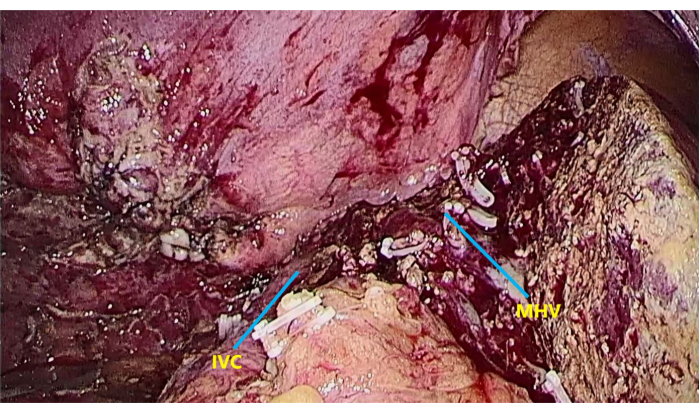
Рисунок 7: Обнажение средней печеночной вены (MHV) и нижней полой вены (IVC). Для экспонирования MHV и IVC после завершения резекции печени. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
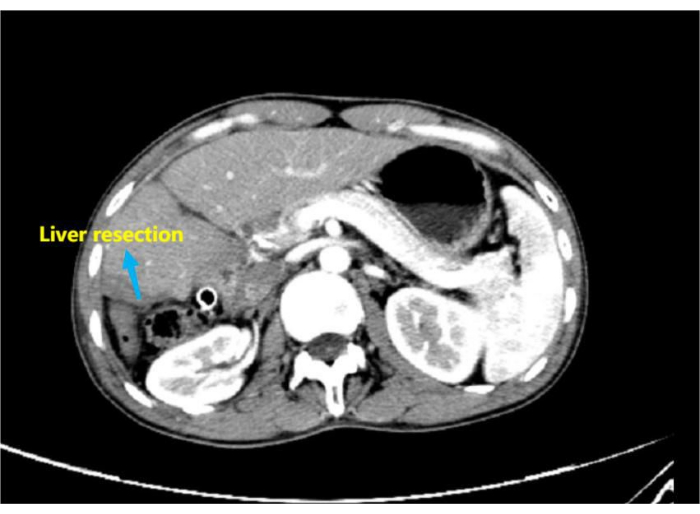
Рисунок 8: Послеоперационная усиленная компьютерная томография, показывающая изменения после резекции правой гепатоцеллюлярной карциномы, что позволяет предположить, что резецированная правая печень с вдавливанием наружной дренажной трубки в операционной области отличается от той, которая наблюдалась во время предоперационной визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
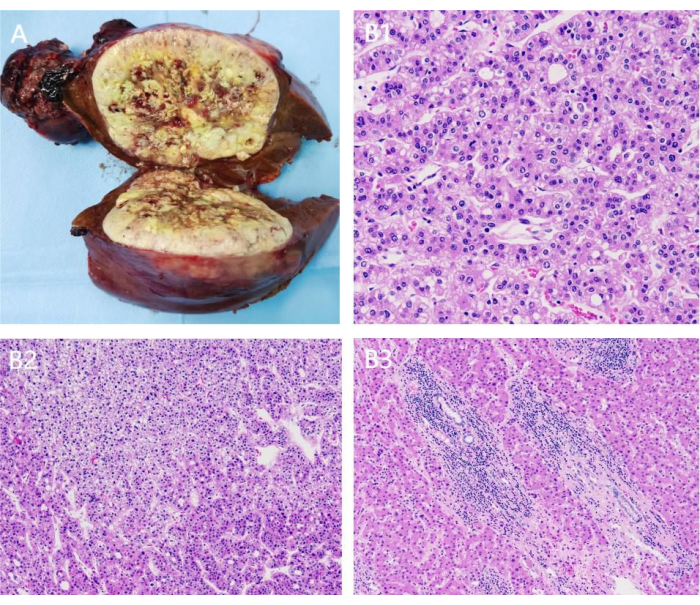
Рисунок 9: Послеоперационный патологоанатомический результат. А) резецированная опухоль правой печени; (В1-3) ОН-красители опухоли подтверждают гепатоцеллюлярную карциному. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
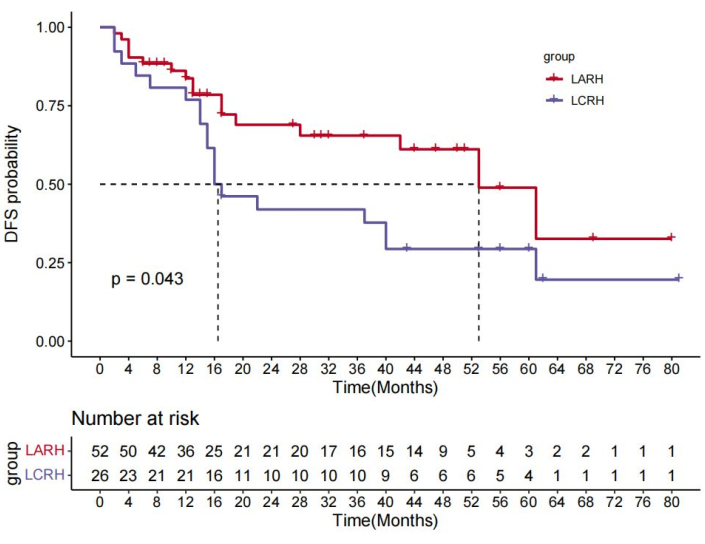
Рисунок 10: Безрецидивная выживаемость (DFS) была лучше в группе LARH по сравнению с группой LCRH, P = 0,043 (логарифмический ранговый критерий). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
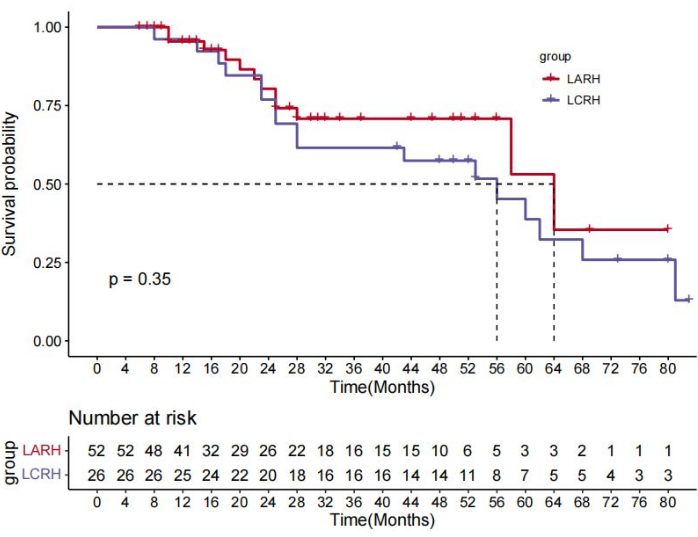
Рисунок 11: Общая выживаемость (ОВ) была одинаковой в группе LARH по сравнению с группой LCRH, P = 0,35 (логарифмический ранговый критерий). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Кратко о шагах LCRH. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Благодаря разработке новых хирургических инструментов и развитию анатомической теории 12,13,14, АА-РГ в настоящее время широко применяется в нескольких медицинских центрах по всему миру. Было показано, что прогноз пациентов, перенесших АА-РГ, лучше, чем у тех, кто проходит традиционную процедуру. Тем не менее, исследования показали, что размер опухоли (максимальный диаметр опухоли ≥5 см) может быть важным клиническим фактором, определяющим успех АА-РГ15. Метод АА-РГ был первоначально разработан путем оптимизации хирургического подхода СА-РГ, и с тех пор его многочисленные преимущества были доказаны. LARH и LCRH — это процедуры, которые сочетают в себе методы AA-RH и CA-RH с лапароскопией соответственно. В этом исследовании мы обнаружили, что LARH превосходит LCRH в отношении клинических эффектов и выживаемости.
Маневр подвешивания, используемый в LARH, облегчает обнажение сосудистой структуры, позволяя оптимально направлять путь резекции 13,16. Чтобы внедрить эту технику во время наших хирургических процедур, мы установили ретропеченочный туннель в ретропеченочном пространстве, области, впервые описанной Куино как рыхлое ретикулярное пространство с небольшим количеством кровеносных сосудов между печенью и веной17. При создании этого туннеля важно определить промежутки между печеночными венами и перевязать SHV. Для подъема печени можно использовать несколько материалов, в том числе резинку, хлопчатобумажный слинг или самодельную подтяжку 18,19,20. В нашем центре мы выбрали мочевой катетер из-за его удобства. Техника маневра виса была использована для направления плоскости разреза печени и увеличения скорости иссечения при большой лапароскопической гепатэктомии. Однако этот метод не может быть использован для опухолей, которые плотно прилегают или вторгаются в НПВ, так как эти особенности приводят к недостаточности установленного ретро-печеночного туннеля. В нашем случае у пациентов в группе ЛАРГ наблюдалось достоверное снижение кровопотери, а время, необходимое для пересечения паренхимы печени, также было меньше, чем в группе ЛКРГ, что свидетельствует о безопасности и целесообразности данной методики. Кроме того, время, необходимое для создания ретро-печеночного туннеля, находилось в приемлемом диапазоне, а время Прингла было одинаковым в обеих группах, что подтверждает эффективность этого метода. Кроме того, создание ретро-печеночного туннеля с использованием переднего доступа было успешным во всех случаях, так как мы исключили пациентов, у которых опухоль плотно прилегала к НПВ.
Использование переднего доступа при расслоении печеночной паренхимы предотвращает остаточные поражения, сохраняя при этом как можно большую часть нормальной печени 2,15. Наиболее частыми послеоперационными осложнениями у всех пациентов были инфекция и печеночная недостаточность. Наши результаты показывают, что традиционный хирургический подход ассоциировался с чрезмерной интраоперационной кровопотерей и возможным повышением риска послеоперационной инфекции в группе LCRH. Кроме того, традиционный подход увеличивал компрессию нормальной печени, что приводило к увеличению печеночной недостаточности в группе LCRH по сравнению с группой LARH. Наконец, продолжительность пребывания в стационаре была короче в группе LARH, что указывает на то, что этот метод способствует более быстрому послеоперационному восстановлению после операции. Несколько исследований подтвердили, что частоту серьезных осложнений можно снизить, применяя этот метод вместо традиционного подхода21,22.
Перипеченочная мобилизация может вызывать ятрогенную экструзию и разрыв опухоли, способствуя распространению раковых клеток в системный кровоток и тем самым значительно увеличивая риск диссеминации и рецидива опухоли 22,23,24. И наоборот, LARH является бесконтактным и неэкструзионным методом, при котором печеночный кровоток контролируется перед отделением печени, чтобы избежать распространения опухоли и эффективно снизить частоту послеоперационных рецидивов опухолей 24,25,26. Тем не менее, послеоперационный рецидив гепатоцеллюлярной карциномы остается важным фактором для гепатобилиарных хирургов. Кроме того, частота развития гепатоцеллюлярной карциномы после операции является важным фактором, влияющим на прогноз пациентов. Таким образом, оценка частоты DFS и OS имеет важное значение при оценке эффективности хирургического вмешательства. Наш анализ выявил схожие показатели ОВ между группами LARH и LCRH; тем не менее, группа LARH имела более высокий уровень DFS, что, возможно, было вызвано небольшим размером выборки в нашем исследовании. Многофакторный анализ модели пропорционального регрессионного риска Кокса показал, что лечение LARH, отсутствие тромба сосудистой опухоли и кровопотеря < 250 мл были связаны с более длительным DFS. Наши результаты подтверждают превосходный прогноз ЛАРГ по сравнению с ЛКРГ, что согласуется с результатами большинства современных исследований. Таким образом, выбор ЛАРГ в соответствующих случаях важен для улучшения прогноза пациента. Однако диаметр опухоли и уровень АФП не были признаны факторами риска развития СДС, что может быть связано с небольшим размером выборки.
Это исследование имело некоторые ограничения, в том числе крутую кривую обучения, длительный период обучения и систематическую ошибку отбора, связанную с ретроспективными исследованиями. Крутая кривая обучения может быть связана с пониманием автором преимуществ переднего подхода, что облегчает выбор этого подхода на более поздних этапах исследования. Кроме того, традиционный подход был выбран преимущественно на ранней стадии исследования, в то время как передний подход чаще выбирался во второй половине. Эти факторы могли повлиять на выбор хирургических методов и сравнение клинических эффектов. Кроме того, размер выборки был небольшим. Необходимы будущие исследования с большим размером выборки, чтобы полностью раскрыть значимость и эффективность LARH.
Основываясь на полученных результатах, мы пришли к выводу, что ЛАРГ может эффективно уменьшать кровопотерю, ускорять операции в печени и уменьшать рецидив опухоли по сравнению с ЛКРЗ. LARH предполагает меньший контакт и экструзию, что согласуется с «безопухолевым принципом». Таким образом, мы предполагаем, что LARH может быть полезной стратегией лечения большой гепатоцеллюлярной карциномы правой руки.
Раскрытие информации
Авторы заявляют, что им нечего раскрывать.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая (No 82072627).
Материалы
| Name | Company | Catalog Number | Comments |
| Pneumoperitoneum needle | Unimicro Medical Systems Co.,Ltd | 150mm | |
| Disposable single-cavity rubber catheter | Yangzhou Huayue Technology Development Co, Ltd | 3.5mm (10Fr) | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | |
| Disposable trocar | Kangji Medical | 10010, 10012 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4020B | |
| Endoscopic Stapling Instrument & Single Use Loading Unit (Endo-GIA) | Covidien | 1650 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| Non-absorbable polymer ligation clips (Home-o-lok) | Teleflex Medical | 545330 | |
| Ultrasound knife | Johnson | GEN11 | |
| Video system | Lenovo | GK309 |
Ссылки
- She, W. H., et al. Anterior approach to major resection for colorectal liver metastasis. J Gastrointest Surg. 11, 1928-1938 (2018).
- Beppu, T., et al. Anterior approach for right hepatectomy with hanging maneuver for hepatocellular carcinoma: a multi-institutional propensity score-matching study. J Hepatobiliary Pancreat Sci. 3, 127-136 (2017).
- Tang, J. X., Li, J. J., Weng, R. H., Liang, Z. M., Jiang, N. Anterior vs conventional approach right hepatic resection for large hepatocellular carcinoma: A systematic review and meta-analysis. World J Gastroenterol. 44, 7917-7929 (2017).
- Peng, Y., et al. Is the anterior approach suitable for laparoscopic right hemihepatectomy in patients with large hcc (5-10 cm)? A propensity score analysis. Surg Endosc. 8, 6024-6034 (2022).
- Lai, E. C., Fan, S. T., Lo, C. M., Chu, K. M., Liu, C. L. Anterior approach for difficult major right hepatectomy. World J Surg. 3, 314-317 (1996).
- Belghiti, J., Guevara, O. A., Noun, R., Saldinger, P. F., Kianmanesh, R. Liver hanging maneuver: a safe approach to right hepatectomy without liver mobilization. J Am Coll Surg. 1, 109-111 (2001).
- Troisi, R. I., Montalti, R. Modified hanging maneuver using the Goldfinger dissector in laparoscopic right and left hepatectomy. Dig Surg. 6, 463-467 (2012).
- Cai, L. X., Wei, F. Q., Yu, Y. C., Cai, X. J. Can retrohepatic tunnel be quickly and easily established for laparoscopic liver hanging maneuver by Goldfinger dissector in laparoscopic right hepatectomy. J Zhejiang Univ Sci B. 9, 712-721 (2016).
- . EASL Clinical practice guidelines: Management of hepatocellular carcinoma. J Hepatol. 69, 182-236 (2018).
- Costi, R., et al. Partial splenectomy: who, when and how, a systematic review of the 2130 published cases. J Pediatr Surg. 54, 1527-1538 (2019).
- Dindo, D., Demartines, N., Clavien, P. A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2, 205-213 (2004).
- Yoh, T., et al. Laparoscopic right hepatectomy using the caudal approach is superior to open right hepatectomy with anterior approach and liver hanging maneuver: A comparison of short-term outcomes. Surg Endosc. 2, 636-645 (2020).
- Hasegawa, Y., et al. Anterior approach for pure laparoscopic donor right hepatectomy. Surg Endosc. 10, 4677-4678 (2020).
- Chu, H., et al. Laparoscopic liver hanging maneuver through the retrohepatic tunnel on the right side of the inferior vena cava combined with a simple vascular occlusion technique for laparoscopic right hemihepatectomy. Surg Endosc. 6, 2932-2938 (2018).
- Chen, H. W., et al. Laparoscopic right hepatectomy via an anterior approach for hepatocellular carcinoma. JSLS. 1, e2017.00084 (2018).
- Araki, K., et al. Left lobe mobilization strategy of right-sided major hepatectomy for treatment of a tumor causing severe inferior vena cava compression: a novel strategy using the modified liver-hanging maneuver. Ann Surg Oncol. 5, 1150-1151 (2018).
- Couinaud, C. Exposure of the left hepatic duct through the hilum or in the umbilical of the liver: Anatomic limitations. Surgery. 1, 21-27 (1989).
- Nanashima, A., Nagayasu, T. Development and clinical usefulness of the liver hanging maneuver in various anatomical hepatectomy procedures. Surg Today. 4, 398-404 (2016).
- Ariizumi, S. I., Nanashima, A., Yamamoto, M. Anterior approach in right hepatectomy. J Hepatobiliary Pancreat Sci. 7, 351-352 (2018).
- Sugimachi, K., Iguchi, T., Nakanoko, T., Mano, Y. Inferior right hepatic vein-preserving hepatectomy for large liver tumors: anterior approach using the two-stage modified hanging maneuver (with video). J Gastrointest Surg. 6, 1444-1447 (2020).
- Llado, L., et al. The anterior hanging-approach improves postoperative course after right hepatectomy in patients with colorectal liver metastases. results of a prospective study with propensity-score matching comparison. Eur J Surg Oncol. 2, 176-183 (2016).
- Zheng, J., et al. Outcomes of anterior approach major hepatectomy with diaphragmatic resection for single huge right lobe HCC with diaphragmatic invasion. Medicine (Baltimore). 36, e12194 (2018).
- Zhang, Y., et al. Long-term survival after anterior approach right hepatectomy combined with inferior vena cava thrombectomy using trans-diaphragmatic intrapericardial inferior vena cava occlusion: a case report and review of the literature. BMC Surg. 1, 122 (2019).
- Ratti, F., Cipriani, F., Catena, M., Paganelli, M., Aldrighetti, L. Approach to hepatocaval confluence during laparoscopic right hepatectomy: three variations on a theme. Surg Endosc. 2, 949 (2017).
- Jackson, N. R., et al. The safety and efficacy of approaches to liver resection: a meta-analysis. JSLS. 1, e2014-e2186 (2015).
- Chen, H. W., et al. Anterior approach for right hepatectomy using the 5-steps stapling technique: a preliminary study. Int J Surg. 32, 19-23 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены