Method Article
Выделение мононуклеарных клеток периферической крови человека из охристых оболочек с помощью высокопроизводительного иммуномагнитного разделения шариков
В этой статье
Резюме
В этом протоколе подробно описывается высокопроизводительный, совместимый с автоматизацией метод выделения мононуклеарных клеток периферической крови человека для биобанкинга и других целей.
Аннотация
Мононуклеарные клетки периферической крови (ПМЦ) представляют собой гетерогенную популяцию моноцитов и лимфоцитов. Криоконсервированные PBMC обладают стабильной жизнеспособностью при длительном хранении, что делает их идеальным типом клеток для многих последующих исследовательских целей, включая проточную цитометрию, иммунологические анализы и секвенирование генома. Как правило, PBMC изолируются с помощью центрифугирования с градиентом плотности, однако это рабочий процесс с низкой пропускной способностью, который сложно и дорого масштабировать. В этой статье представлен высокопроизводительный рабочий процесс с использованием быстро реализуемого метода изоляции PBMC на основе магнитных шариков. Сравнивали общую концентрацию клеток, жизнеспособность и популяционное распределение с PBMC, полученными с помощью изоляции градиента плотности, а жизнеспособность клеток и долю типов клеток были сопоставимы для обоих методов. Изолированные ПМЦ продемонстрировали жизнеспособность более 70% в течение 9 дней после забора крови, хотя выход снизился вдвое через 5 дней по сравнению с ПМЦ, обработанными в течение 24 ч после забора. Подводя итог, можно сказать, что в этой статье описывается протокол PBMC, который использует подход на основе валиков для адаптации к высокопроизводительному рабочему процессу и демонстрирует, что как ручные, так и автоматизированные методы на основе валиков могут увеличить производительность обработки и обеспечить гибкость для различных бюджетов.
Введение
Выделение мононуклеарных клеток периферической крови (PBMC) — это метод, который отделяет и изолирует лимфоциты и моноциты от других компонентов цельной крови. PBMC представляют собой универсальный тип клеток, используемый для многочисленных применений, включая, помимо прочего, иммунотерапию, разработку вакцин, идентификацию мишеней или биомаркеров, а также разработку антител/низкомолекулярных лекарств 1,2. Эти клетки могут быть выделены из здоровых или больных людей и могут быть немедленно использованы в последующих процессах или криоконсервированы длябудущих исследований. В некоторых случаях конечная цель известна, в то время как в других, как это принято в биобанкинге, PBMC выделяются и хранятся длябудущих неопределенных применений.
Центрифугирование с градиентом плотности является традиционным методом выделения PBMCs 5,6,7 из цельной крови с использованием дифференциального разделения составляющих типов клеток на основе плотности клеток во время центрифугирования. Хотя в этом методе могут быть некоторые вариации, цельную кровь обычно разбавляют фосфатно-солевым буфером (PBS), наслаивают на среду с градиентом плотности в специализированной или стандартной центрифужной пробирке, а затем вращают. В результате получаются четыре отдельных слоя: верхний слой плазмы обогащен тромбоцитами, тонкий слой PBMC находится выше градиентной среды плотности, и, наконец, нижний слой состоит из эритроцитов (эритроцитов) и гранулоцитов. Несмотря на то, что этот метод ранее называли «золотым стандартом»8, существуют ограничения для масштабирования, такие как длительное время обработки, производительность центрифуги, сложность в аликвотировании других продуктов крови (например, плазмы и эритроцитов) и трудоемкость автоматизации. Несмотря на то, что автоматизация возможна для этого метода9, она требует всестороннего программирования манипулятора жидкости (с полностью автоматизированным модулем центрифугирования) и остается длительным процессом.
В дальнейшем представлен альтернативный рабочий процесс, в котором используется иммуномагнитное разделение шариков с помощью магнита с восемью держателями для ручной обработки или инструмента для полностью автоматизированной обработки. В этом методе используется коктейль антител, который добавляется к клеткам и связывает нежелательные клеточные популяции, в данном случае тромбоциты, гранулоциты и эритроциты. Эти нежелательные популяции впоследствии удаляются путем магнитной сепарации, в результате чего популяции моноцитов и лимфоцитов остаются в отрицательной фракции, готовой к последующей обработке10. Этот метод отрицательного отбора является более быстрым, чем методы положительного отбора, которые требуют дополнительных этапов для удаления антител и комплекса магнитных шариков из PBMCs. Отрицательный отбор является дополнительным преимуществом, поскольку он был описан как способ сохранения функциональности клетки.
протокол
Образцы крови для контроля качества и собственные данные (такие как количество клеток, жизнеспособность и возраст образца на момент обработки) были получены в результате согласованных научных исследований в биобанке штата Новый Южный Уэльс, Королевской больнице принца Альфреда (одобрение HREC: 2019/ETH06776). Обработанные (т.е. обедненная плазма), непроверенные и обезличенные образцы крови взрослого человека были собраны в пробирках ЭДТА. Эти образцы крови для контроля качества были обработаны менее чем через 72 ч после сбора и использовались для экспериментов по выделению PBMC, сравнивая градиент плотности и методы на основе гранул. Метод разделения по градиенту плотности, использованный в репрезентативных результатах, см. в процедуре, приведенной в дополнительном файле 1. Подробная информация о реагентах и оборудовании, использованном для этого исследования, приведена в Таблице материалов.
1. Заготовка цельной крови
- Аккуратно переверните 10 мл пробирок с цельной кровью (покрытой этилендиаминтетрауксусной кислотой [ЭДТА], цитрат-цитрат-декстрозой [АКД] или гепарином лития) 10 раз при комнатной температуре.
- Дополнительно: Если необходимо хранить цельную кровь, аликвот в криопробирки для хранения при температуре -80 °C.
- Центрифугируйте пробирки с помощью ротора с качающимся ковшом при давлении 800 x g в течение 10 мин при 22 °C при включенном тормозе (9 ускорений/9 замедлений).
2. Коллекция пальто «Баффи»
- После центрифугирования поместите образцы в шкаф биологической безопасности и проверьте наличие трех отдельных слоев (как показано на рисунке 1).
ПРИМЕЧАНИЕ: Эритроциты находятся в нижнем темно-красном слое центрифужной пробирки. Белый непрозрачный слой, содержащий лейкоциты и тромбоциты, расположен над слоем эритроцитов, известным как охристая шерсть. Верхний желтый слой содержит плазму. - Дополнительно: Если плазма будет храниться, поместите плазму в криопробирки для хранения при температуре -80 °C.
- Пипетку пипетку 1 мл охристого покрытия (исходного материала) из пробирки с кровью объемом 10 мл и переложите в пробирку, указанную и промаркированную на шаге 3.1 и шаге 4.1 для ручного и автоматизированного методов соответственно. Взболтайте охристую шерсть (белый непрозрачный слой) с помощью наконечника пипетки и соберите охристую шерсть путем аспирации.
ПРИМЕЧАНИЕ: Менее 100 мкл плазмы и эритроцитов допустимо во время аспирации. Если для одного участника собрано несколько пробирок с кровью, можно объединить охристые шерсти; Однако это может повлиять на концентрацию тромбоцитов13. - Для ручной обработки перейдите к разделу 3. Для автоматизированной обработки перейдите к разделу 4.
- Дополнительно: Если эритроциты должны быть сохранены, апикируйте эритроциты в криопробирки для хранения при температуре -80 °C.
3. Очистка PBMC - ручным методом
ПРИМЕЧАНИЕ: Одним оператором может быть обработано до 8 образцов на один держатель магнита.
- Этикетка 3 x 5 мл полистирольных туб с буквами A-C.
ПРИМЕЧАНИЕ: Используйте последовательную нумерацию при выполнении более одного образца, т.е. 1A, 1B, 1C, 2A, 2B, 2C. - Добавьте 60 мкл 0,1 М ЭДТА (для конечной концентрации ЭДТА 6 мМ, pH 8,0 см. Дополнительный файл 2 для рецепта) в пробирку А, содержащую охристую оболочку, перенесенную на этапе 2.3.
- Добавьте 50 μL пробирки для коктейльной смеси (см. Таблицу материалов) в пробирку А, перемешайте пипетированием вверх и вниз не менее 3 раз и инкубируйте в течение 5 минут при комнатной температуре.
- Добавьте 890 мкл PBS в пробирку А и перемешайте пипетированием вверх и вниз не менее 3 раз.
- Вихревая трубка магнитного шарика (см. Таблицу материалов) в течение 30 с.
- Добавьте 50 мкл магнитных шариков в пробирку А и перемешайте, пипетируя вверх и вниз не менее 3 раз.
- Немедленно поместите пробирку А в подставку для магнитов и выдерживайте в течение 5 минут при комнатной температуре.
- Осторожно пипетируйте обогащенную клеточную суспензию в пробирку В, собирая прозрачную фракцию с отсутствующими/минимальными (<100 мкл) эритроцитами для оптимального восстановления PBMC.
ПРИМЕЧАНИЕ: Не тревожьте бусины, привязанные к магниту. Рекомендуется использовать переводную пипетку. - Снимите трубку А с магнитной подставки и утилизируйте.
- Добавьте 50 мкл магнитных шариков в клеточную суспензию в пробирке B и перемешайте пипетированием вверх и вниз не менее 3 раз.
- Немедленно поместите пробирку B в подставку для магнитов и инкубируйте в течение 5 минут при комнатной температуре.
- Осторожно пипетируйте обогащенную клеточную суспензию в пробирку С, собирая только прозрачную фракцию.
ПРИМЕЧАНИЕ: Не тревожьте бусины, привязанные к магниту. Рекомендуется использовать переводную пипетку. - Снимите трубку B с магнитной подставки и утилизируйте.
- Немедленно поместите пробирку C в подставку для магнитов и выдерживайте в течение 5 минут при комнатной температуре.
- Осторожно дозируйте обогащенную клеточную суспензию в пробирку с маркировкой для центрифуги и долейте до 2 мл PBS.
- Перенесите 50 мкл клеточной суспензии в чашку для образца автоматического счетчика клеток. Для подсчета ячеек разведения 1:10 добавьте 450 мкл PBS. Перейдите к разделу 5, чтобы перейти к шагам подсчета ячеек.
4. Очистка PBMC - автоматизированный метод
ПРИМЕЧАНИЕ: Одним автоматизированным прибором PBMC может быть обработано до 4 образцов. Несколько приборов могут работать параллельно одним оператором.
- Наклейте этикетку на 2 пробирки объемом 14 мл с буквами A и B, 1 пробирку для центрифуги объемом 50 мл с буквой C и 1 пробирку для центрифуги объемом 50 мл с надписью «waste».
ПРИМЕЧАНИЕ: Для каждого прогона автоматизированного прибора PBMC требуется только один контейнер для отходов. Используйте последовательную нумерацию при выполнении более одной выборки, т.е. 1A, 1B, 1C, 2A, 2B, 2C. - Добавьте 60 мкл 0,1 М ЭДТА (для конечной концентрации ЭДТА 6 мМ) в пробирку А, содержащую охристую оболочку, перенесенную на этапе 2.3.
- Сделайте вихревую трубку магнитного шарика (см. Таблицу материалов) в течение 30 с.
- Включите автоматический прибор PBMC, включив питание на передней панели прибора.
- На главном экране автоматизированного прибора PBMC выберите профиль и выберите нужный протокол.
ПРИМЕЧАНИЕ: EasySep Direct Human PBMC isolation 19654 - buffy coat был выбран профиль протокола для этой изоляции PBMC. Ознакомьтесь со стандартной процедурой производителя для этого профиля в протокольном отчете14. - Введите начальный объем (количество охристого слоя, отсасываемого в пробирку А), и повторите для каждого образца.
- Выберите все квадранты, в которых будет использоваться один и тот же набор реагентов.
ПРИМЕЧАНИЕ: Если один и тот же протокол используется для более чем одного квадранта, автоматизированный прибор PBMC предложит использовать один и тот же набор реагентов для всех квадрантов14. - Загрузите в карусель прибора промаркированные расходные материалы, наконечники для фильтров и буферный контейнер. Набор реагентов, содержащий магнитную трубку для шариков и пробирку для коктейльной смеси, должен быть загружен в квадрант 1.
ПРИМЕЧАНИЕ: Прибор спросит, хочет ли пользователь использовать 1 набор реагентов для всех квадрантов. Выберите «Да» и выделите все квадранты с помощью набора реагентов. - После завершения загрузки снимите крышки с расходных материалов и реагентов и выберите «Запустить» на экране прибора.
- Когда прогон будет завершен, выберите выгрузку и извлечение образцов (содержащих суспензию PBMC, помеченную в пробирке C) из карусели прибора. Храните магнитную трубку с шариками, пробирку для коктейльной смеси и буферный контейнер при температуре 4 °C. Выбросьте пробирки с маркировкой A, B и отходы (см. шаг 4.1) и наконечники фильтра.
ПРИМЕЧАНИЕ: Для автоматизированного метода долива PBS не требуется, так как суспензия PBMC производит конечный объем 7 мл. - Перенесите 500 мкл клеток в чашку для образца для подсчета клеток без разбавления. Перейдите к разделу 5 для подсчета ячеек.
5. Подсчет ячеек
- Проводите подсчет клеток и определение жизнеспособности с использованием метода исключения трипанового синего красителя в соответствии с инструкциями производителя15.
ПРИМЕЧАНИЕ: Для внутренних процессов автора анализ клеток выполняется с использованием автоматического счетчика клеток со следующими настройками для получения PBMC.
Коэффициент разведения = 10 (для ручного протокола, если клеточная суспензия находится в малом объеме) или 1 (для автоматизированного протокола)
Тип ячейки: PBMC
Диапазон концентраций = 5 x 104 до 1 x 107 кл/мл
Диапазон размеров (диаметр) = от 8 μм до 50 μм
Количество изображений = 50
6. Подготовка к криоконсервации
- Центрифугируйте (с помощью качающегося ротора ведра) пробирки с образцами при давлении 300 x g в течение 8 мин при температуре 22 °C при включенном тормозе (9 ускорений/9 замедлений).
- После центрифугирования поместите образцы обратно в шкаф биологической безопасности.
- С помощью пипетки осторожно удалите надосадочную жидкость. Небольшое количество надосадочной жидкости можно оставить вместе с гранулой PBMC, чтобы она не была нарушена.
- Суспендируйте гранулу в 3 мл холодной криоконсервационной среды. Медленно и аккуратно перемешайте суспензию вверх и вниз до однородности.
ПРИМЕЧАНИЕ: Объем среды для цироконсервации может быть отрегулирован в зависимости от желаемой конечной концентрации PBMC. - Налейте 1 мл ресуспендированного PBMC в предварительно назначенную криопробирку и поместите ее в контейнер для замораживания с контрольной скоростью минимум на 4 часа при -80 °C.
ПРИМЕЧАНИЕ: Объем PBMC, аликвотируемых на каждую криопробирку, может быть отрегулирован в зависимости от предпочтений исследователя. - После хранения криопробирок при температуре -80 °C в течение минимум 4 часов переведите криопробирки в резервуар с жидкой азотной фазой для длительного хранения.
7. Статистический анализ данных
- Репрезентативные данные результатов были проанализированы с использованием статистического и графического программного обеспечения, как указано в Дополнительном файле 3.
Результаты
Пропорции лимфоцитов, моноцитов, нейтрофилов, эозинофилов и базофилов до (т.е. в цельной крови) и после выделения PBMC измеряли при выделении PBMC с использованием метода разделения на основе гранул или градиента плотности. Пропорции лимфоцитов и моноцитов были значительно обогащены обоими методами (рис. 2A, B). Кроме того, доли нейтрофилов, эозинофилов и базофилов (т.е. гранулоцитов) были значительно снижены в PBMC, выделенных методом на основе гранул (рисунок 2C-F). Не было выявлено существенных различий в пропорциях лимфоцитов, моноцитов, нейтрофилов, эозинофилов, базофилов и гранулоцитов между методами градиента плотности и методами на основе гранул (рис. 2). Процент восстановления был дополнительно рассчитан для перечисленных выше типов клеток (см. дополнительный рисунок 1). Средняя жизнеспособность клеток составила более 95% для обоих методов и существенно не различалась (рисунок 3A). PBMC также подсчитывали с использованием диапазона размеров (диаметра) от 8 мкм до 50 мкм, где метод разделения по градиенту плотности дал примерно в два раза большее общее количество клеток (рис. 3B).
Затем был проведен сравнений автоматизированного метода на основе бусин с ручным методом. Не было выявлено существенных различий в отношении жизнеспособности клеток (рисунок 4A) или общего количества клеток (рисунок 4B) при использовании ручного или автоматизированного метода. Время обработки этих 8 образцов было сравнено, включая время без вмешательства человека. Общее время обработки 8 образцов составило 43 мин против 43 мин. 57 мин для ручного сравнению. автоматизированный метод. Автоматизированный метод включал в себя 35 минут обработки без вмешательства (рис. 4C).
В течение 9 месяцев был опробован процесс выделения PBMC с использованием гранул (с аликвотированием цельной крови и плазмы), в ходе которого 1410 образцов PBMC были выделены из непроверенной человеческой крови с использованием ручной платформы для первых 820 участников, а затем с использованием автоматизированного метода для следующих 590 участников. Обработка проводилась либо в тот же день, либо в течение 10 дней после сбора в соответствии с критериями приемлемости исследования, с задержками в обработке, в основном из-за времени транспортировки образцов. При использовании ручного или автоматизированного метода PBMC, обработанные в течение 24 ч после сбора, имели наивысшую жизнеспособность и восстановление (рис. 5). Средняя жизнеспособность клеток составила >90% для PBMC, обработанных в течение 5 дней, и >70% для PBMC, обработанных в течение 10 дней (рисунок 5A). Средний выход PBMC снизился на 50% через 5 дней по сравнению с образцами, обработанными в течение 24 ч (рис. 5B).
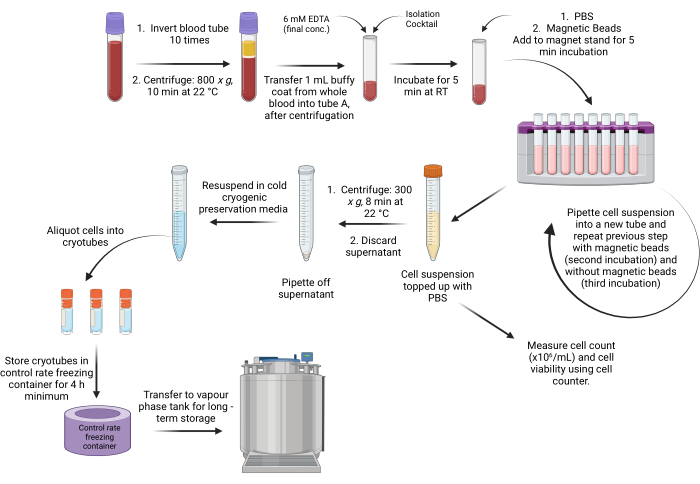
Рисунок 1: Схематический рабочий процесс протокола выделения PBMC на основе бусин из buffy coat. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
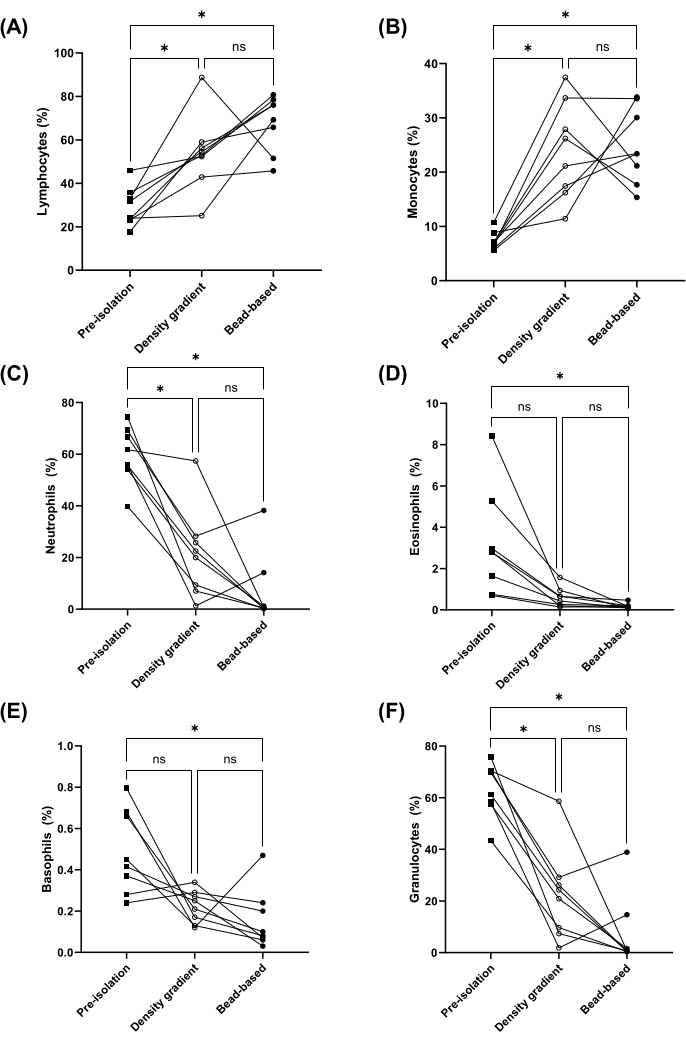
Рисунок 2: Пропорции лимфоцитов, моноцитов, нейтрофилов, эозинофилов, базофилов и гранулоцитов в цельной крови до и после выделения PBMC методами градиента плотности и на основе гранул. Процентное содержание лимфоцитов (А), моноцитов (В), нейтрофилов (С), эозинофилов (D), базофилов (Е) и гранулоцитов (F) в согласованной цельной крови до выделения PBMC (квадраты) и в PBMC после выделения с помощью градиента плотности (разомкнутые круги) или метода на основе гранул (замкнутые круги) (n = 8). ns = не значимо, а *p < 0,05 по данным однофакторного ANOVA (A и B) или теста Фридмана (C- Е). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
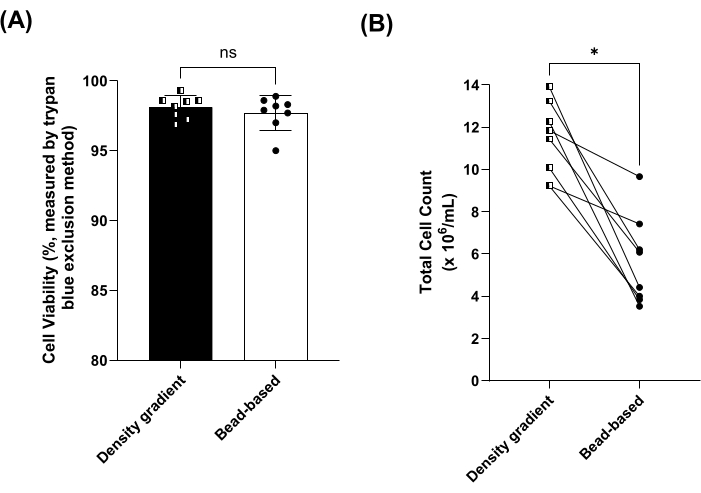
Рисунок 3: Жизнеспособность и общее количество клеток PBMC, выделенных методом градиента плотности и методами на основе гранул. (A) Средняя (± SD) жизнеспособность клеток для образцов, обработанных с использованием градиента плотности (квадраты, темная полоса) по сравнению с Методы на основе бусин (круги, открытая полоса) для 8 парных образцов. ns = не значимо по парному t-критерию. (B) Общее количество клеток для образцов, обработанных с использованием градиента плотности (квадраты, темная полоса) по сравнению с Методы на основе бусин (круги, открытая полоса) для 8 парных образцов. *p < 0,05 определяется с помощью парного t-критерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
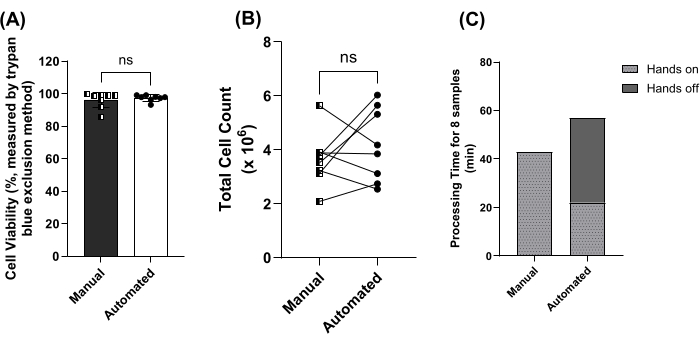
Рисунок 4: Сравнение ручных и автоматизированных методов, основанных на гранулах. (A) Средняя (± SD) жизнеспособность клеток для образцов, обработанных вручную (квадраты, темная полоса) по сравнению с Автоматизированные (круги, открытая панель) методы на основе бусин для 8 парных образцов. ns = не значимо по критерию Манна-Уитни. (B) Общее количество клеток для образцов, обработанных вручную (квадраты) по сравнению с Автоматизированные (круги) методы на основе бусин для 8 парных образцов. ns = не значимо по парному t-критерию. (C) Время обработки 8 образцов, обработанных вручную по сравнению с ручным способом. автоматизированные методы, включая периоды практической работы (светлая полоса) и временные периоды без помощи (темная полоса). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
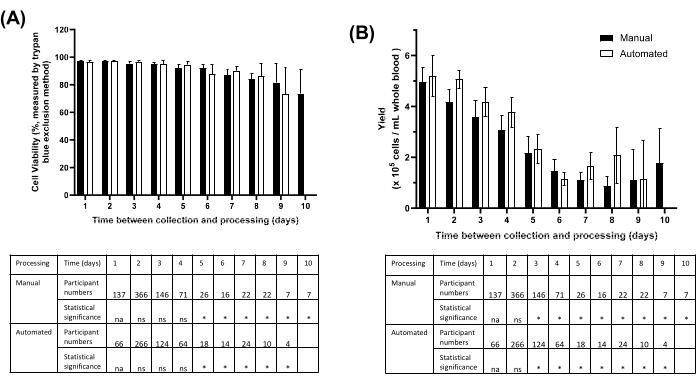
Рисунок 5: Жизнеспособность и выход PBMC, выделенных методом на основе гранул вручную или с помощью автоматизации, в зависимости от времени между сбором образца и хранением PBMC. (A) Средняя (± 95% ДИ) жизнеспособность клеток для образцов участников, обработанных вручную (темная полоса) по сравнению с Автоматизированные (открытые барные) методы на основе бисера. Таблица с подробным описанием количества участников. ns = не значимый. na = не применяется. *p < 0,05 по тесту множественного сравнения Тьюки. (B) Общее количество клеток для образцов участников, обработанных вручную (темная полоса) по сравнению с Автоматизированные (открытые барные) методы на основе бисера. Таблица с подробным описанием количества участников. ns = не значимый. na = не применяется. *p < 0,05 по тесту множественного сравнения Тьюки. Значение для Automated Day 10 отсутствует из-за того, что число репликации меньше 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Рисунок дифференциального процентного восстановления ячеек с помощью методов градиента плотности и на основе гранул. Процент рассчитывали с использованием абсолютного количества клеток до изоляции в цельной крови и постизолированной суспензии клеток методом градиента плотности (квадраты, темная полоса) и методом на основе бусин (круги, открытая полоса) (n = 8). ns = не значимо, а *p < 0,05 по непарному t-критерию. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Протокол градиента плотности. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Получение 0,1 М ЭДТА, pH 8,0 в PBS. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Подробные процедуры, выполненные для получения репрезентативных данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
PBMC человека — это универсальные типы клеток, используемые для многочисленных анализов; Тем не менее, пропускная способность изоляции часто является ограничением во многих лабораториях, включая биобанки16. Ранее биобанк штата Новый Южный Уэльс изолировал PBMC с помощью метода градиента плотности. Для увеличения производительности были исследованы возможности автоматизации метода разделения по градиенту плотности, но были выявлены препятствия на пути внедрения, в том числе (i) стоимость установки для обработки жидкостей с полностью автоматизированной установкой центрифугирования, а также дополнительное требование к установке HEPA для производства стерильного продукта, (ii) обученный персонал для программирования и (iii) время, необходимое для тестирования протокола. Таким образом, в этом исследовании были изучены альтернативные методы и идентифицирован коммерчески приобретенный набор Human PBMC, который может быть использован для ручной и автоматизированной обработки. Стерильность обеспечивается за счет того, что оборудование, необходимое для обработки, помещается в стандартный (длина 1,2 м) шкаф биологической безопасности. В этом документе подробно описаны изменения, внесенные в рекомендованный производителем протокол14 для повышения эффективности и снижения затрат на реагенты без ущерба для качества. Кроме того, протокол производителя был расширен для детализации этапов биобанка образцов для будущих исследований, включая аликвотирование цельной крови (шаг 1.2), плазмы (шаг 2.2) и эритроцитов (шаг 2.5) из исходной пробирки с кровью, а также подсчет клеток и криоконсервацию.
В этом исследовании сравнивались три протокола изоляции PBMC: разделение градиента плотности, ручное выделение и автоматизированное выделение на основе гранул. Были внесены изменения в протокол производителя на основе бусин, в том числе удаление разбавления охристой оболочки перед выделением PBMC и устранение требования о прерывании OFF для центрифугирования, что позволило исследователям следовать адаптируемому, экономически эффективному и высокопроизводительному протоколу выделения PBMC. Во-первых, восемь совпадающих образцов цельной крови были использованы для выделения PBMC для сравнения разделения градиента плотности и ручной техники на основе гранул. Важно отметить, что распределение клеточной популяции, жизнеспособность клеток и восстановление PBMC существенно не различались между двумя сравниваемыми методами, как показано на рисунках 2A-F, 3A и дополнительных рисунках 1 соответственно. В репрезентативных данных количество клеток было выше при методе разделения градиента плотности с использованием метода исключения трипанового синего, но не при использовании гематологического клеточного анализатора. Настройки типа клеток PBMC на счетчике клеток использовали диапазон диаметров клеток от 8 до 50 мкм, и, следовательно, подсчет будет включать PBMC, а также гранулоциты (примерно 12-15 мкм в диаметре) при использовании метода исключения трипанового синего17. В то время как счетчик гематологических клеток показал более высокую специфичность, чем метод исключения трипанового синего, некоторые расчеты восстановления были выше 100%, что отражает погрешность прибора (см. дополнительный рисунок 1). В связи с этим исследователям рекомендуется применять комбинацию методов подсчета клеток при сравнении выходов из протоколов выделения PBMC, поскольку большинство методов не предлагают одновременно специфического и высокочувствительного дифференциального подсчета клеток. Кроме того, анализы не проводились для сравнения функциональной активности PBMC, полученных с помощью любого из методов, что является ограничением нашего анализа.
Затем были сравнены ручные и автоматизированные методы на основе гранул, и не было выявлено существенных различий между выходом и жизнеспособностью PBMC из 8 совпадающих образцов (рис. 4A, B). Клеточные популяции не сравнивались по отдельности, так как для обоих методов использовался один и тот же коктейль из изоляции антител. Важно отметить, что время ручной обработки 8 образцов было сокращено с 43 минут до 22 минут с использованием автоматизированного протокола (Рисунок 4C). При этом пропускная способность, предотвращение выгорания техников и стабильность обработки образцов обеспечиваются за счет автоматизации, стоимость реагентов и расходных материалов значительно выше и в 3-4 раза выше, чем при ручном методе с использованием валиков. Это происходит после внесения изменений в протокол производителя для использования 1 мл охристого волоса (из объема цельной крови 10 мл) вместо рекомендуемого диапазона в 2-5 мл (из объема цельной крови 10 мл и/или более). Если бюджет ограничен, выбор ручного метода может сократить время обработки на ~25% при сохранении затрат на реагенты и расходные материалы, сопоставимых с затратами при использовании метода разделения по плотности. Рекомендуется обрабатывать не более 8 образцов за один раз на одного техника, чтобы обеспечить адекватное ступенчатое распределение образцов (~30 с/образец) в течение 5-минутного инкубационного периода (шаги 3.7, 3.11 и 3.14).
Как при ручном, так и при автоматизированном методе с использованием бусин удаление охристой шерсти является критически важным этапом для обеспечения оптимальной изоляции PBMC. Важно отметить, что в этом протоколе используется охристая шерсть, а не цельная кровь, так как объем реагентов основан на исходном материале10 объемов. Эффективное удаление всего объема охристой шерсти может быть технически сложной задачей. Первоначально этот метод детализировал удаление 0,5 мл охристого покрова, однако он был увеличен до 1 мл для улучшения восстановления. Чтобы обеспечить адекватное и последовательное восстановление охристого покрова, важно подробно описать этот процесс в протокольной документации и обучении. Рекомендуется вращать наконечник пипетки во время аспирации охристой шерсти, стараясь при этом не отсасывать слишком много эритроцитов из слоя ниже (шаг 2.3). Важно не насыщать коктейль антител, который связывает нежелательные клетки (т.е. гранулоциты и эритроциты), что может повлиять на урожайность и чистоту10. Чтобы свести к минимуму количество эритроцитов, собранных во время экстракции охристого покрова, кончик пипетки должен находиться между плазмой и слоем охристого покрытия. Объем охристой шерсти может быть увеличен от 1 мл; Тем не менее, необходимо соблюдать осторожность, как описано выше, чтобы гарантировать, что не более 10% собранного объема содержит эритроциты. В качестве альтернативы можно использовать автоматизированный манипулятор для сбора охристых слоев18. Тем не менее, часы, необходимые для калибровки и устранения неисправностей протоколов работы с приборами для работы с жидкостями, особенно с учетом стоимости, могут оказаться нецелесообразными для большинства лабораторий.
Переход и применение протокола на основе бусин были необходимы, учитывая, что биобанк штата Новый Южный Уэльс поставил перед собой цель обработать 23 000 PBMC в течение следующих 3 лет. Здесь было продемонстрировано, что PBMC могут быть выделены из пробирок ACD в течение 9 дней после сбора со средней жизнеспособностью >70%. Несмотря на то, что выход был оптимальным через 24 часа после сбора, обработка в течение этого периода времени не всегда возможна, поскольку может потребоваться транспортировка образцов. Было показано, что PBMC, выделенные ручным или автоматизированным методом на основе гранул, могут иметь выход >3 x 105 клеток/мл цельной крови при выделении в течение 4 дней после сбора и >1 x 105 клеток/мл цельной крови при выделении в течение 10 дней после сбора. Низкие значения для образцов в течение 5 дней отмечаются как ограничение этого анализа. Кроме того, данные не были разделены на основе возраста, пола участников и истории болезни, поскольку эта информация не была доступна. Несмотря на необходимость сравнительного анализа для изучения влияния задержек во времени обработки для обоих методов, ранее сообщалось, что задержки в выделении PBMC с использованием метода градиента плотности снижают качество клеток и значительно увеличивают загрязнение эритроцитов19,20. Кроме того, доли гранулоцитов увеличиваются при задержке обработки, и, следовательно, образцы с одинаковым «возрастом» должны быть сгруппированы для последующих анализов 20,21,22. Следует отметить, что этот эксперимент проводился с использованием антикоагулянтов крови с кислой лимонной декстрозой (т.е. цитратом тринатрия, лимонной кислотой и декстрозой); однако выход и/или доля типов клеток могут варьироваться при использовании других антикоагулянтов; поэтому исследователям рекомендуется выбирать подходящий антикоагулянт на основе предполагаемых анализов PBMC на последующих этапах.
Таким образом, протокол выделения PBMC с использованием магнитных шариков, который может быть адаптирован к рабочим процессам с высокой пропускной способностью, подробно описан для выполнения требований к масштабированию без ущерба для жизнеспособности клеток. Как ручные, так и автоматизированные методы могут быть оптимизированы для получения определенных концентраций клеток путем изменения начального объема и объема ресуспендирования. Биобанк штата Новый Южный Уэльс перешел от извлечения ~60 PBMC в месяц с использованием традиционного метода разделения градиента плотности к ~300 PBMC в месяц с использованием этого метода, совместимого с автоматизацией. Следующей целью авторов является использование автоматизированной платформы для обработки до 1200 PBMC в месяц и дальнейшее сравнение PBMC, выделенных как методами на основе магнитных шариков (ручным и автоматизированным), так и методом градиента плотности, чтобы направить внедрение этого метода в другие лаборатории с особым акцентом на биобанки.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Биобанк штата Новый Южный Уэльс выражает благодарность за поддержку со стороны Службы патологии здравоохранения Нового Южного Уэльса, Управления здравоохранения и медицинских исследований Нового Южного Уэльса и Местного округа здравоохранения Сиднея. Кроме того, авторы выражают благодарность Omico и другим научным исследованиям, поддерживаемым Биобанком здравоохранения штата Новый Южный Уэльс, за предоставление разрешения на публикацию собственных данных и использование неиспользованных образцов в исследовательских целях. Авторы благодарят профессора Дженнифер Брайн (Департамент патологии здоровья Нового Южного Уэльса, Университет Сиднея) за критическое руководство и дискуссии. Рисунок 1 был создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell cryopreservation media CS10, 100 mL (CRYOSTOR) | StemCellTM Technologies | 07930 | |
| Class II Biological Safety Cabinet | Thermo ScientififcTM | 51033311 | |
| CoolCell 1 mL FX | BioTools | BCS-407P | This is the control rate freezing container used. |
| Distilled Water | Bacto Laboratories | 561832 | |
| DxH 500 Hematology Analyzer | Beckman Coulter Life Sciences | B40601 | Referred to as external automated cell counter. |
| EasyEightsTM EasySepTM Magnet | StemCellTM Technologies | 18103 | |
| EasySepTM Direct Human PBMC Isolation Kit | StemCellTM Technologies | 19654 | Kit includes the magnetic bead tube and the cocktail mix tube |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich Pty Ltd | E6758-500G | Instructions to make 0.1M EDTA solution from EDTA salt is located in supplemental file 2. |
| LymphoprepTM Density Gradient Medium | StemCellTM Technologies | 7851 | |
| Megafuge ST4 Plus Centrifuge | Thermo ScientififcTM | THR75009903 | |
| Orion Star A211 pH meter electrode | Thermo ScientififcTM | STARA2110 | |
| Orion™ ROSS Ultra™ Glass Triode™ pH/ATC Combination Electrodes | Thermo ScientififcTM | 8302BNURCA | |
| Phosphate buffered saline (PBS), solution, 1X, 500ml | Life Technologies Australia Pty Ltd | 10010023 | |
| Prism | GraphPad | ||
| RoboSepTM Buffer 1X | StemCellTM Technologies | 20104 | Software used for statistical analysis. |
| RoboSepTM-S | StemCellTM Technologies | 21000 | Fully automated cell separator instrument. |
| RoboSep™ Filter Tips | StemCellTM Technologies | 20125 | |
| SepMateTM-50 (IVD) tubes | StemCellTM Technologies | 85460 | IVD - In vitro diagnostics. Also known as SepMateTM-50 tubes |
| Vi-CELL XR Cell Anlayzer | Beckman Coulter Life Sciences | Internal automated cell counter. Instrument obsolete and no longer available for purchase (as of December 31, 2022). Alternative instrument is the ViCell BLU Cell Viability Analyzer (Product no. C19196). | |
| Vi-CELL XR Quad Pack Reagent Kit | Beckman Coulter Life Sciences | 383722 |
Ссылки
- Alexovic, M., et al. Human peripheral blood mononuclear cells: A review of recent proteomic applications. Proteomics. 22 (15-16), e2200026 (2022).
- Zhang, M., Huang, B. The multi-differentiation potential of peripheral blood mononuclear cells. Stem Cell Res Ther. 3 (6), 48 (2012).
- Arimilli, S., Damratoski, B. E., Chen, P., Jones, B. A., Prasad, G. L. Rapid isolation of leukocyte subsets from fresh and cryopreserved peripheral blood mononuclear cells in clinical research. Cryo Lett. 33 (5), 376-384 (2012).
- Kleeberger, C. A., et al. Viability and recovery of peripheral blood mononuclear cells cryopreserved for up to 12 years in a multicenter study. Clin Diagn Lab Immunol. 6 (1), 14-19 (1999).
- Ulmer, A. J., Scholz, W., Ernst, M., Brandt, E., Flad, H. D. Isolation and subfractionation of human peripheral blood mononuclear cells (PBMC) by density gradient centrifugation on percoll. Immunobiology. 166 (3), 238-250 (1984).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Curr Protoc Immunol. 7, 711-718 (2009).
- Gautam, A., et al. Investigating gene expression profiles of whole blood and peripheral blood mononuclear cells using multiple collection and processing methods. PLoS One. 14 (12), e0225137 (2019).
- Hamot, G., Ammerlaan, W., Mathay, C., Kofanova, O., Betsou, F. Method validation for automated isolation of viable peripheral blood mononuclear cells. Biopreserv Biobank. 13 (3), 152-163 (2015).
- Coppola, L., et al. Purification of viable peripheral blood mononuclear cells for biobanking using a robotized liquid handling workstation. J Transl Med. 17 (1), 371 (2019).
- Stemcell Technologies. Vol. 27156. STEMCELL TECHNOLOGIES. , 1-4 (2020).
- Hornschuh, M., et al. Negative magnetic sorting preserves the functionality of ex vivo cultivated non-adherent human monocytes. Biology (Basel). 11 (11), 1583 (2022).
- Bhattacharjee, J., Das, B., Mishra, A., Sahay, P., Upadhyay, P. Monocytes isolated by positive and negative magnetic sorting techniques show different molecular characteristics and immunophenotypic behaviour. F1000Res. 6, 2045 (2017).
- Ohlsson, S., Diedrich, B., Uhlin, M., Sandgren, P. Optimized processing for pathogen inactivation of double-dose buffy-coat platelet concentrates: Maintained in vitro quality over 7-day storage. Vox Sang. 113 (7), 611-621 (2018).
- Easysep direct human PBMC isolation kit for processing 100 mL buffy coat. Stemcell Technologies Available from: https://www.stemcell.com/products/brands/easysep-cell-separation.html (2022)
- Vi-cell XR cell viability analyzer instructions for use. Beckman Coulter Available from: https://mbcbiolabs.com/wp-content/uploads/2022/08/Beckman-Coulter-ViCell-Manual.pdf (2017)
- Fuchs, Y. F., et al. Next-generation biobanking: Employing a robotic system for automated mononuclear cell isolation. Biopreserv Biobank. 21 (1), 106-110 (2023).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls Publishing. , (2024).
- Mathay, C., Ammerlaan, W., Betsou, F. Automatic buffy coat extract on: Methodology, feasibility, optimization, and validation study. Biopreserv Biobank. 10 (6), 543-547 (2012).
- Golke, T., et al. Delays during PBMC isolation have a moderate effect on yield, but severly compromise cell viability. Clin Chem Lab Med. 60 (5), 701-706 (2022).
- Yi, P. C., et al. Impact of delayed PBMC processing on functional and genomic assays. J Immunol Methods. 519, 113514 (2023).
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t-cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive t-cell responses: Position statement of the t-cell workshop committee of the immunology of diabetes society. Clin Exp Immunol. 163 (1), 33-49 (2011).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7 (2), 17-27 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены